ZOMETA 4MG FR/AMP. 100ML na Nova Medicamentos
Zometa - 4Mg 1 Frasco-Ampola 100Ml

ZOMETA 4MG FR/AMP. 100ML na Nova Medicamentos
Não encontramos este produto para a Nova Medicamentos no Cliquefarma.
Confira os menores preços para Zometa - 4Mg 1 Frasco-Ampola 100Ml

Zometa - 4Mg 1 Frasco-Ampola 100Ml
25.34%
R$ 815,00
Agille Medicamentos
17.20%
R$ 903,89
Justmed Medicamentos Especiais
11.60%
R$ 965,00
OncoExpresso Medicamentos
10.41%
R$ 978,00
Facilita Medicamentos
1.25%
R$ 1.078,02
Para que serve
Zometa é usado para tratar metástases ósseas e para reduzir a quantidade de cálcio no sangue de pacientes com hipercalcemia induzida por tumor (HIT).
Este medicamento também é usado para prevenir complicações relacionadas ao esqueleto (como por exemplo, fraturas patológicas) em pacientes com tumor maligno avançado com metástases ósseas.
Zometa também é indicado para prevenção da perda óssea decorrente do tratamento antineoplásico a base de hormônios em pacientes com câncer de próstata ou câncer de mama.
Como o Zometa funciona?
O princípio ativo do Zometa é o ácido zoledrônico. Ele pertence a um grupo de medicamentos denominado bisfosfonatos, altamente potentes que atuam especificamente no osso. É um dos mais potentes inibidores da reabsorção óssea osteoclástica conhecido até o momento.
A ação seletiva dos bisfosfonatos no osso é baseada na sua elevada afinidade por osso mineralizado, mas o mecanismo molecular preciso que conduz à inibição da atividade osteoclástica é ainda desconhecido. Nos estudos de longo prazo em animais, o ácido zoledrônico inibe a reabsorção óssea sem afetar adversamente a formação, mineralização ou propriedades mecânicas do osso.
Zometa é fornecido como solução concentrada para infusão. Zometa é administrado como uma infusão na veia.
O ácido zoledrônico age ligando-se ao osso e diminuindo a taxa de reabsorção óssea. É usado para reduzir a quantidade de cálcio no sangue nos casos em que esta quantidade é muito alta devido à presença de um tumor. Os tumores podem acelerar a reabsorção óssea normal de modo que a liberação de cálcio do osso fique aumentada. Esta condição é conhecida como hipercalcemia induzida por tumor (HIT).
Pergunte ao seu médico se você tiver qualquer dúvida sobre porque este medicamento está sendo prescrito para você.
Contraindicação
Você não deve utilizar Zometa nos seguintes casos:
- Se você for alérgico (hipersensível) ao ácido zoledrônico ou a outro bisfosfonato (o grupo de substâncias ao qual Zometa pertence), ou quaisquer outros ingredientes de Zometa listados no início dessa bula;
- Se você estiver grávida;
- Se você estiver amamentando.
Este medicamento é contraindicado para uso por gestantes.
Este medicamento é contraindicado para uso por lactantes.
Converse com o seu médico se tiver qualquer outra dúvida.
Como usar
Zometa só deve ser administrado por profissionais da área da saúde treinados em administrar bisfosfonatos intravenosamente, ou seja, por uma veia. Siga cuidadosamente todas as instruções dadas a você pelo seu médico, enfermeira ou farmacêutico.
Como usar Zometa?
Zometa apenas pode ser utilizado por médicos com experiência na administração de bisfosfonatos intravenosos.
Zometa deve ser preparado por um profissional da saúde (enfermeiro ou farmacêutico) e deve ser administrado em ambiente hospitalar ou clínicas com infraestrutura adequada.
Solução para infusão 4 mg/100 mL
A apresentação da solução para infusão de Zometa 4 mg/100 mL é “pronta para o uso” e não deve ser diluída ou misturada com outras soluções para infusão. A solução para infusão deve ser utilizada imediatamente após aberta.
Zometa 4 mg/100 mL deve ser administrado via infusão intravenosa com duração de pelo menos 15 minutos e deve ser administrado como uma solução única em um cateter separado de todas as outras drogas. Zometa solução para infusão “pronta para o uso” não devem ser misturados com soluções de infusão contendo cálcio ou outro cátion bivalente, como solução de Ringer lactato.
A duração do tratamento é conforme orientação médica.
Quanto é administrado?
A dose normal de Zometa em adultos é de 4 mg. Se você tem problema nos rins, seu médico deve diminuir a dose, dependendo da gravidade de seu problema nos rins.
Por quanto tempo usar Zometa?
Se você estiver sendo tratado para prevenção de complicações relacionadas ao esqueleto, você deverá receber uma infusão de Zometa a cada 3 a 4 semanas.
Se você estiver sendo tratado para hipercalcemia induzida por tumor (HIT), receberá, normalmente, apenas uma infusão de Zometa.
Se você estiver sendo tratado para prevenção da perda de densidade óssea decorrente de tratamento antineoplásico a base de hormônios por câncer de próstata, você deverá receber uma infusão de Zometa a cada 3 meses.
Se você estiver sendo tratado para prevenção da perda de densidade óssea decorrente de tratamento antineoplásico a base de hormônios por câncer de mama, você deverá receber uma infusão de Zometa a cada 6 meses.
Seu médico irá decidir com que frequência você deve receber as infusões.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Zometa?
Zometa apenas pode ser utilizado por médicos com experiência na administração de bisfosfonatos intravenosos.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Siga cuidadosamente as instruções do seu médico. Elas podem diferir da informação geral contida nesta bula.
Tome cuidado especial com Zometa:
- Se você tem problemas de fígado;
- Se você teve ou tem problemas nos rins;
- Se você teve ou tem problemas no coração;
- Se você tem asma e também se for alérgico ao ácido acetilsalicílico;
- Se você teve ou tem dor, tumefação ou entorpecimento de mandíbula, sensação de mandíbula pesada, perda de um dente, ou qualquer outro sintoma oral;
- Se você estiver sob tratamento odontológico ou será submetido a uma cirurgia dental, avise seu dentista que você está sendo tratado com Zometa.
- Se você teve ou tem rigidez articular, dores e dificuldade de movimentos (especialmente no quadril ou coxa) ou dor ao redor do canal auditivo externo, informe o seu médico, pois pode ser sinal de um problema ósseo chamado osteonecrose (danos ao tecido ósseo devido à perda do fornecimento de sangue ao osso).
É aconselhável que você seja avaliado por um dentista antes do tratamento com Zometa e procedimentos odontológicos invasivos devem ser evitados durante o tratamento. Você deve estar ciente da importância de uma boa higiene oral, dos cuidados odontológicos de rotina e avaliações dentárias regulares.
Comunique imediatamente quaisquer sintomas orais, tais como perda de um dente, dor, inchaço, feridas que não cicatrizam ou exsudação durante o período do tratamento com Zometa.
Seu médico irá avaliar sua resposta ao tratamento em intervalos regulares. Antes de iniciar seu tratamento com Zometa, seu médico deve realizar exames de sangue.
Antes das infusões certifique-se de que você ingeriu líquido suficiente, de acordo com instruções médicas para ajudar a prevenir desidratação.
Se você está sendo tratado com Aclasta, um medicamento que contém a mesma substância ativa do Zometa, ou com qualquer outro bisfosfonato (mesma classe de medicamento) você não deve ser tratado com Zometa concomitantemente.
Se alguma destas situações se aplicar a você, informe o seu médico antes de fazer uso de Zometa.
Níveis reduzidos de cálcio no sangue (hipocalcemia) às vezes levando a câimbras musculares, pele seca, sensação de queimação, têm sido reportados em pacientes tratados com Zometa. Batimentos irregulares do coração (arritmia cardíaca), convulsões, espasmos e contrações (tetania) têm sido relatados como secundários a hipocalcemia grave. Em alguns casos a hipocalcemia pode ser fatal.
Se você possui hipocalcemia pré-existente, esta deve ser corrigida antes de iniciar a primeira dose de Zometa. Você deverá receber suplementação de cálcio e vitamina D.
Se alguma dessas situações se aplicar a você, informe ao seu médico imediatamente.
Reações Adversas
Como todos os medicamentos, alguns eventos adversos podem ocorrer durante o tratamento com Zometa, embora nem todas as pessoas os apresentem. Os mais comuns são normalmente leves e provavelmente desaparecerão após um curto período de tempo. Os seguintes eventos adversos foram relatados:
Se qualquer um dos eventos adversos se tornar grave, avise seu médico, enfermeiro ou farmacêutico.
Muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
- Nível baixo de fosfato no sangue.
Comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Formigamento ou dormência das mãos ou dos pés (parestesia);
- Pressão arterial elevada (hipertensão);
- Inchaço das mãos, tornozelos ou pés (edema periférico);
- Distúrbios do sono;
- Dor de cabeça e sintomas de gripe como febre, fadiga, fraqueza, sonolência, calafrios e dores ósseas, musculares e nas juntas;
- Reações gastrintestinais tais como náuseas, vômitos, constipação e perda de apetite;
- Nível baixo de células vermelhas (anemia);
- Nível baixo de cálcio no sangue;
- Dores ósseas, musculares, nas juntas e generalizadas;
- Rigidez das articulações;
- Exames sanguíneos indicando alterações na função renal (níveis mais altos de creatinina);
- Conjuntivite, como relatado com outros bisfosfonatos (o grupo de substâncias ao qual o Zometa pertence);
- Sudorese excessiva (hiperhidrose)
Incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Dor na boca, nos dentes e na mandíbula, feridas que cicatrizam ou não na boca ou exsudação, inchaço, boca seca, dormência ou “sensação de mandíbula pesada” ou perda de dente. Estes podem ser sinais de dano ósseo da mandíbula (osteonecrose). Se você sentir qualquer um destes sintomas, avise seu médico ou dentista imediatamente;
- Alterações na função renal incluindo insuficiência renal grave. Tais alterações também são conhecidas por ocorrer com outros medicamentos deste tipo. Adicionalmente, casos de doença renal foram reportados;
- Reações de hipersensibilidade;
- Pressão arterial baixa;
- Dor no peito;
- Reações cutâneas (vermelhidão e inchaço) no local da injeção, erupção cutânea (rash), coceira;
- Dificuldade de respirar;
- Tontura;
- Diarreia;
- Contagem baixa de células brancas e de plaquetas;
- Nível baixo de magnésio e de potássio no sangue. Seu médico irá monitorá-lo e tomar as medidas necessárias;
- Alterações do paladar;
- Tremor;
- Ansiedade;
- Visão turva;
- Dores abdominais;
- Desconforto estomacal após refeições;
- Aumento de peso.
Raras (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Inchaço principalmente na face e garganta;
- Nível alto de potássio e sódio no sangue;
- Batimento cardíaco lento;
- Confusão;
- Sintomas como gripe incluindo artrite e inchaço nas articulações;
- Doença pulmonar (doença pulmonar intersticial);
- Olhos vermelhos, doloridos e/ou inchados (uveite);
- Distúrbio da função renal chamada de síndrome de Fanconi.
Casos muito raros (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento):
- Desmaio devido a pressão arterial baixa;
- Dores graves e ocasionalmente incapacitantes nos ossos, juntas e músculos;
- Sonolência;
- Batimento irregular do coração (arritmia cardíaca);
- Convulsões. Avise seu médico imediatamente se você tiver esses sintomas;
- Dormência (hipoestesia);
- Espasmos e contração muscular (tetania) Avise seu médico imediatamente se você tiver esses sintomas;
- Dificuldade de respirar com chiado ou tosse;
- Reação alérgica grave;
- Erupção cutânea (rash) com coceira.
Também foi observado ritmo cardíaco irregular (fibrilação atrial) em pacientes recebendo ácido zoledrônico para osteoporose na pós-menopausa. Atualmente não está claro se o ácido zoledrônico causa este ritmo cardíaco irregular, mas você deve informar seu médico se sentir tais sintomas após ter recebido ácido zoledrônico.
Outros bisfosfonatos podem causar dificuldades de respiração em pacientes com asma que são alérgicos à aspirina.
Entretanto, nenhum destes casos foi relatado com o uso de Zometa.
Pode ocorrer fratura irregular do fêmur particularmente em pacientes em tratamento prolongado para a osteoporose.
Contate o seu médico se sentir dor, fraqueza ou desconforto no quadril, coxa ou na virilha, pois isso pode ser um sinal precoce de uma possível fratura do fêmur.
Atenção:
Este produto é um medicamento que possui nova concentração no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu medico.
População Especial
Uso em idosos (65 anos ou mais):
Zometa pode ser usado em pacientes idosos. Não há evidências de necessidade de quaisquer precauções adicionais.
Uso em crianças:
O uso de Zometa em crianças e adolescentes não foi estudado e, portanto não é recomendado.
Gravidez e lactação:
Avise seu médico se você está ou pensa que possa estar grávida. Você não deve utilizar Zometa durante a gravidez.
Converse com seu médico se você estiver amamentando. Não é conhecido se o ácido zoledrônico, a substância ativa de Zometa, passa para o leite materno. Você não deve amamentar durante o tratamento com Zometa.
Efeitos sobre a habilidade de dirigir veículos e/ou utilizar máquinas:
Os efeitos de Zometa para atividades que necessitam de sua atenção não foram estudados. Portanto, recomenda-se cautela para dirigir veículos e/ou operar máquinas.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Composição
Cada frasco de Zometa 4 mg/100 mL contém 4 mg de ácido zoledrônico (anidro), correspondente a 4,264 mg de ácido zoledrônico monoidratado.
Excipientes:
Manitol, citrato de sódio e água para injetáveis.
Superdosagem
Você pode desenvolver anomalias eletrolíticas séricas e mudanças na função renal, incluindo insuficiência renal grave.
Se você recebeu doses mais altas do que a recomendada, você deve ser cuidadosamente monitorado por um médico.
Pode ser necessária uma infusão de suplemento de cálcio.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações previstas a serem consideradas
Recomenda-se precaução quando os bisfosfonatos como o Ácido Zoledrônico (substância ativa) são administrados com aminoglicosídeos, calcitonina ou diuréticos de alça, uma vez que estes agentes podem ter um efeito aditivo, resultando num nível sérico de cálcio mais baixo durante períodos mais prolongados do que o requerido.
Recomenda-se precaução quando o Ácido Zoledrônico (substância ativa) é usado com outros fármacos potencialmente nefrotóxicos.
Outras interações a serem consideradas
Recomenda-se precaução quando o Ácido Zoledrônico (substância ativa) é administrado com medicamentos antiangiogênicos uma vez que um aumento na incidência de osteonecrose da mandíbula foi observado em pacientes tratados concomitantemente com esses medicamentos.
Ausência de interações
Nos estudos clínicos, o Ácido Zoledrônico (substância ativa) foi administrado concomitantemente com agentes anticancerígenos, diuréticos (exceto para diuréticos de alça, ver seção anterior), antibióticos e analgésicos, sem ocorrência de interações clinicamente aparentes.
Nenhum ajuste da dose de Ácido Zoledrônico (substância ativa) foi necessário quando coadministrado com a talidomida, exceto em pacientes com insuficiência renal leve a moderada no início do estudo.
A coadministração de talidomida (100 ou 200mg uma vez ao dia) com o Ácido Zoledrônico (substância ativa) (4mg administrado como uma infusão de 15 minutos) não alterou significativamente a farmacocinética do Ácido Zoledrônico (substância ativa) e o clearance (depuração) de creatinina de pacientes com mieloma múltiplo.
Ação da Substância
Resultados de eficácia
Resultados dos estudos clínicos na prevenção de eventos relacionados ao esqueleto em pacientes com câncer metastático no osso:
O Ácido Zoledrônico (substância ativa) foi comparado ao placebo na prevenção de eventos relacionados ao esqueleto (ERE) em pacientes adultos com câncer de próstata, 214 homens recebendo Ácido Zoledrônico (substância ativa) 4mg versus 208 homens recebendo placebo. Após o tratamento inicial de 15 meses, 186 pacientes continuaram por até 9 meses adicionais, totalizando 24 meses de terapia duplo-cega. O Ácido Zoledrônico (substância ativa) 4mg demonstrou vantagem significativa sobre o placebo na proporção de pacientes apresentando no mínimo um evento relacionado ao esqueleto (ERE) (38% para Ácido Zoledrônico (substância ativa) 4mg versus 49% para placebo, p = 0,028), prolongando a mediana do tempo até o primeiro ERE (488 dias para Ácido Zoledrônico (substância ativa) 4mg versus 321 dias para placebo, p = 0,009), e reduzindo a incidência anual de eventos por paciente – taxa de morbidade esquelética (0,77 para Ácido Zoledrônico (substância ativa) 4mg versus 1,47 para placebo, p = 0,005).
A análise de múltiplos eventos mostrou uma redução de 36% no risco de desenvolvimento de eventos relacionados ao esqueleto no grupo recebendo Ácido Zoledrônico (substância ativa) comparado ao grupo recebendo placebo (p = 0,002). A dor foi medida no início e periodicamente durante o estudo. Os pacientes recebendo Ácido Zoledrônico (substância ativa) relataram menor aumento da dor do que aqueles recebendo placebo, e as diferenças atingiram significância nos meses 3, 9, 21 e 24. Pacientes que receberam Ácido Zoledrônico (substância ativa) apresentaram menos fraturas patológicas. Os resultados do tratamento foram menos acentuados em pacientes com lesões blásticas. Os resultados de eficácia são fornecidos na Tabela 1.
Tabela 1. Resultados de eficácia (pacientes com câncer da próstata tratados com terapêutica hormonal)
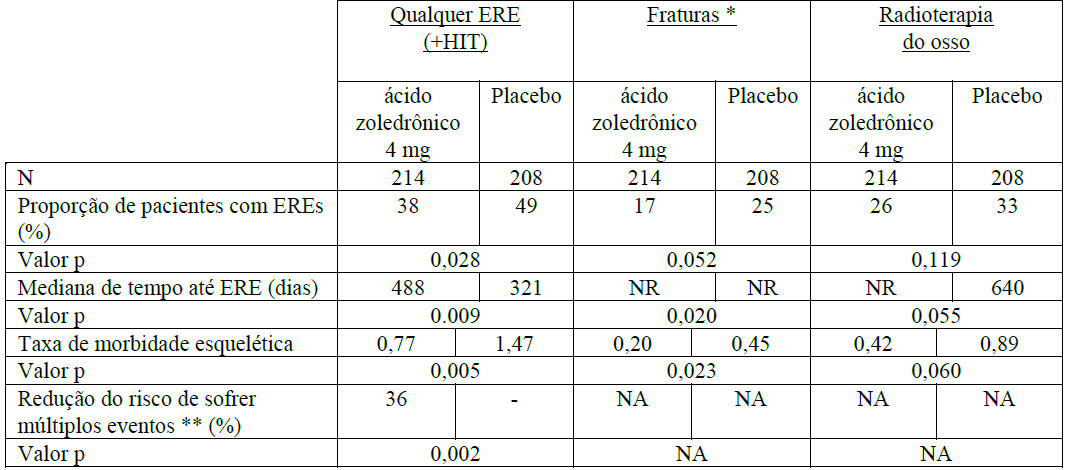 * Inclui fraturas vertebrais e não vertebrais.
* Inclui fraturas vertebrais e não vertebrais.
** Representa todos os eventos relacionados ao esqueleto, o número total bem como o tempo até cada evento durante o estudo clínico.
NR = Não Alcançado.
NA = Não Aplicável.
Num segundo estudo, o Ácido Zoledrônico (substância ativa) reduziu o número de EREs e prolongou em mais de dois meses a mediana de tempo até um ERE na população de pacientes adultos com outros tumores sólidos envolvendo os ossos, cuja mediana de sobrevida era de apenas seis meses [134 pacientes com câncer de pulmão de células não pequenas (CPNPC), 123 com outros tumores sólidos tratados com o Ácido Zoledrônico (substância ativa) versus 130 pacientes com CPNPC, 120 com outros tumores sólidos tratados com placebo]. Após um tratamento inicial de 9 meses, 101 pacientes foram admitidos na extensão de 12 meses do estudo, e 26 completaram o total de 21 meses. O Ácido Zoledrônico (substância ativa) 4mg reduziu a proporção de pacientes com EREs (39% para o Ácido Zoledrônico (substância ativa) 4mg versus 48% para placebo, p = 0,039), prolongou a mediana de tempo até o primeiro ERE (236 dias para o Ácido Zoledrônico (substância ativa) 4mg versus 155 dias para placebo, p = 0,009), e reduziu a incidência anual de eventos por paciente – taxa de morbidade esquelética (1,74 para o Ácido Zoledrônico (substância ativa) 4mg versus 2,71 para placebo, p = 0,012). A análise de múltiplos eventos mostrou uma redução de 30,7% no risco de desenvolvimento de eventos relacionados ao esqueleto no grupo recebendo Ácido Zoledrônico (substância ativa) comparado ao grupo recebendo placebo (p= 0,003). O efeito do tratamento em pacientes com câncer de pulmão de células não pequenas pareceu ser menor do que nos pacientes com outros tumores sólidos. Os resultados de eficácia são fornecidos na Tabela 2.
Tabela 2. Resultados de eficácia (pacientes com CPNPC e outros tumores sólidos, exceto câncer de mama e de próstata)
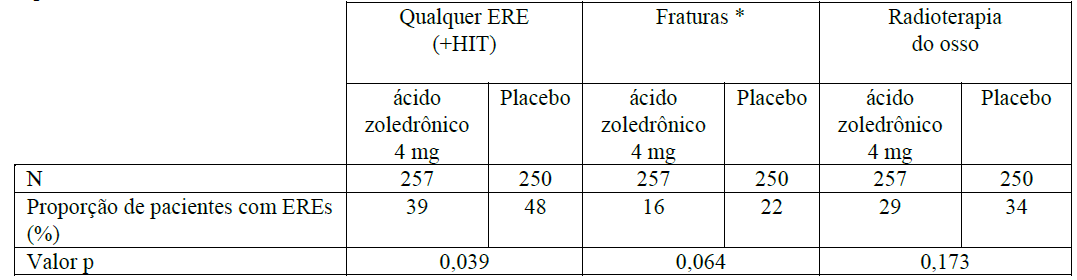
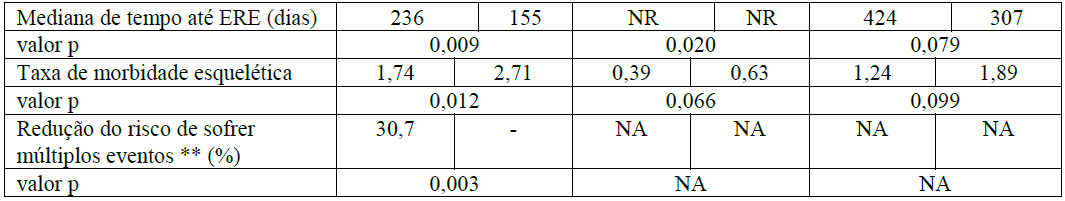 * Inclui fraturas vertebrais e não vertebrais.
* Inclui fraturas vertebrais e não vertebrais.
** Representa todos os eventos relacionados ao esqueleto, o número total bem como o tempo até cada evento durante o estudo clínico.
NR = Não Alcançado.
NA = Não Aplicável.
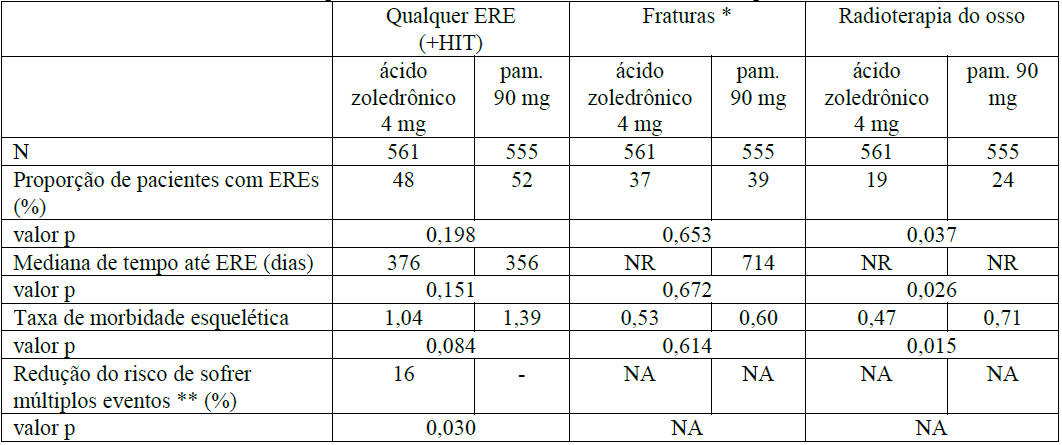
Em um terceiro estudo de fase III, randomizado, duplo-cego, comparando o Ácido Zoledrônico (substância ativa) 4mg a pamidronato 90mg, 1122 pacientes adultos (564 recebendo o Ácido Zoledrônico (substância ativa) 4mg e 558 recebendo pamidronato 90mg) com mieloma múltiplo ou câncer de mama, e com pelo menos uma lesão óssea, foram tratados com Ácido Zoledrônico (substância ativa) 4mg ou pamidronato 90mg a cada 3 a 4 semanas. Oito pacientes foram excluídos da análise de eficácia devido a não adesão às boas práticas clínicas. Seiscentos e seis pacientes foram admitidos na fase de extensão duplo-cega de 12 meses. A terapia total teve duração de 24 meses.
Os resultados demonstraram que o Ácido Zoledrônico (substância ativa) 4mg mostrou eficácia comparável ao pamidronato 90mg na prevenção de eventos relacionados ao esqueleto. As análises de múltiplos eventos revelaram uma redução de risco significativa de 16% (p = 0,030) em pacientes tratados com o Ácido Zoledrônico (substância ativa) 4mg. Os resultados de eficácia são fornecidos na Tabela 3.
Tabela 3. Resultados de eficácia (pacientes com câncer da mama e mieloma múltiplo)
 * Inclui fraturas vertebrais e não vertebrais.
* Inclui fraturas vertebrais e não vertebrais.
** Representa todos os eventos relacionados ao esqueleto, o número total bem como o tempo até cada evento durante o estudo clínico.
NR = Não Alcançado.
NA = Não Aplicável.
Nos estudos clínicos realizados em pacientes adultos com metástases ósseas ou lesões osteolíticas, o perfil de segurança global entre todos os grupos tratados (Ácido Zoledrônico (substância ativa) 4mg, e pamidronato 90mg e placebo) foi semelhante no tipo e gravidade.
O Ácido Zoledrônico (substância ativa) também foi estudado em um ensaio clínico placebo-controlado, randomizado, duplo-cego, em 228 pacientes adultos com metástases ósseas decorrentes de câncer de mama visando avaliar o efeito de o Ácido Zoledrônico (substância ativa) na razão da taxa de eventos relacionados ao esqueleto (ERE), calculado através do número total de eventos relacionados ao esqueleto (excluindo hipercalcemia e ajustado para fratura pré-existente), dividido pelo período total de risco. Os pacientes receberam tanto o Ácido Zoledrônico (substância ativa) 4mg ou placebo a cada 4 semanas por um ano e foram distribuídos entre grupo tratado com o Ácido Zoledrônico (substância ativa) e grupo placebo.
A razão da taxa de eventos relacionados ao esqueleto em um ano foi de 0,61, indicando que o tratamento com o Ácido Zoledrônico (substância ativa) reduziu a taxa de ocorrência de eventos relacionados ao esqueleto em 39% comparado com o grupo placebo (p = 0,027).
A proporção de pacientes com pelo menos um evento relacionado ao esqueleto (excluindo hipercalcemia) foi de 29,8% no grupo tratado com o Ácido Zoledrônico (substância ativa) versus 49,6% no grupo placebo (p = 0,003). O tempo mediano para detecção do primeiro evento relacionado ao esqueleto no braço em uso de o Ácido Zoledrônico (substância ativa) ao final do estudo não foi alcançado e foi significativamente prolongado quando comparado ao grupo placebo (p = 0,007). O Ácido Zoledrônico (substância ativa) reduziu o risco de eventos relacionados ao esqueleto em 41% em análises de evento múltiplo (razão de risco = 0,59, p = 0,019) quando comparado ao grupo placebo.
No grupo tratado com o Ácido Zoledrônico (substância ativa), ocorreu redução dos escores de dor comparado ao nível basal (usando o BPI “Brief Pain Inventory”) a partir da quarta semana de tratamento e a cada subsequente avaliação durante o estudo, enquanto que o escore de dor no grupo placebo não alterou ou aumentou a partir do nível basal (Figura 1). O Ácido Zoledrônico (substância ativa) inibiu a piora do escore analgésico mais que o grupo placebo. Adicionalmente, 71,8% dos pacientes tratados com o Ácido Zoledrônico (substância ativa) versus 63,1% dos pacientes do grupo placebo demonstraram melhora ou nenhuma alteração no índice de desempenho segundo ECOG (“Easter Cooperative Oncology Group”) na observação final.
Figura 1: Alteração média nos escores de dor a partir dos níveis basais segundo BPI (“Brief Pain Inventory”) do grupo tratado em função do tempo de estudo
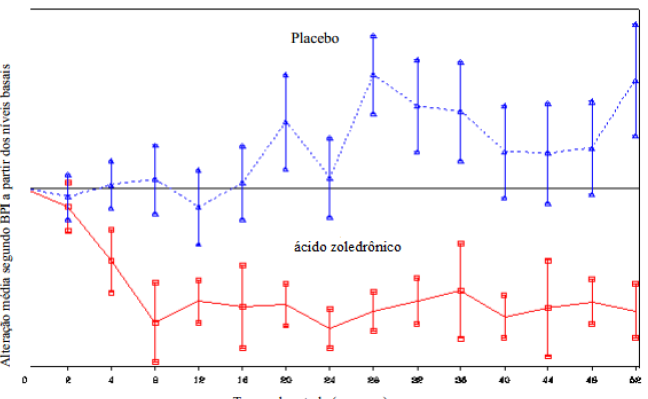
Resultados de estudo clínico no tratamento da HIT (hipercalcemia induzida por tumor)
Estudos clínicos na hipercalcemia induzida por tumor demonstraram que o efeito do Ácido Zoledrônico (substância ativa) se caracteriza pela diminuição do cálcio sérico e da excreção urinária de cálcio.
Para avaliar os efeitos do Ácido Zoledrônico (substância ativa) versus pamidronato 90mg, combinaram-se os resultados de dois estudos pivotais multicêntricos em pacientes adultos com hipercalcemia induzida por tumor (HIT) numa análise pré-planejada. Os resultados mostraram que o Ácido Zoledrônico (substância ativa) 4mg e 8mg foram estatisticamente superiores ao pamidronato 90mg para a proporção de pacientes que respondem completamente, no 7º dia e 10° dia. Verificou-se uma normalização mais rápida do cálcio sérico corrigido no 4° dia para 8mg de Ácido Zoledrônico (substância ativa) e no 7° dia para 4mg e 8mg de Ácido Zoledrônico (substância ativa). Foram observadas as seguintes taxas de resposta: vide Tabela 4.
Tabela 4. Proporção de respostas completas por dia nos estudos HIT combinados


O tempo médio para atingir a normocalcemia foi de 4 dias. No 10° dia, a taxa de resposta foi de 87 a 88% para os grupos em tratamento com o Ácido Zoledrônico (substância ativa) versus 70% para pamidronato 90mg. O tempo médio para recidivas (retorno dos níveis do cálcio sérico corrigido pela albumina ? 2,9mmol/L) foi de 30 a 40 dias para pacientes tratados com o Ácido Zoledrônico (substância ativa) versus 17 dias para aqueles tratados com pamidronato 90mg.
Os resultados mostraram que o tempo para recaída em ambas as doses de Ácido Zoledrônico (substância ativa) foi estatisticamente superior ao do pamidronato 90mg. Não houve diferenças estatisticamente significativas entre as duas doses de Ácido Zoledrônico (substância ativa).
Nos estudos clínicos realizados em pacientes com hipercalcemia induzida por tumor, o perfil de segurança global entre todos os grupos tratados (Ácido Zoledrônico (substância ativa) 4 e 8mg e pamidronato 90mg) foi semelhante no tipo e gravidade.
Características farmacológicas
Grupo farmacoterapêutico: bisfosfonato.
Código ATC: M05 BA08.
Farmacodinâmica
O Ácido Zoledrônico (substância ativa) é um fármaco altamente potente pertencente a classe de medicamentos bisfosfonatos que atuam especificamente no osso. É um dos mais potentes inibidores da reabsorção óssea osteoclástica conhecida até o momento.
A ação seletiva dos bisfosfonatos no osso é baseada na sua elevada afinidade por osso mineralizado, mas o mecanismo molecular preciso que conduz à inibição da atividade osteoclástica é ainda desconhecido. Nos estudos de longo prazo em animais, o Ácido Zoledrônico (substância ativa) inibe a reabsorção óssea sem afetar adversamente a formação, mineralização ou propriedades mecânicas do osso.
Além de ser um inibidor muito potente da reabsorção óssea, o Ácido Zoledrônico (substância ativa) também tem várias propriedades antitumorais que poderiam contribuir para a sua eficácia global no tratamento da doença óssea metastática. As seguintes propriedades foram demonstradas nos estudos pré-clínicos:
- - In vivo: inibição da reabsorção óssea osteoclástica, alterando o microambiente da medula óssea, tornando-a menos propícia ao crescimento das células tumorais, atividade antiangiogênica e atividade antinociceptiva.
- - In vitro: inibição da proliferação dos osteoblastos, atividade citostática e pró-apoptótica direta sobre as células tumorais, efeito citostático sinérgico com outros fármacos antineoplásicos e atividade antiadesão/invasão.
Farmacocinética
Infusões únicas e múltiplas de 2, 4, 8 e 16mg de Ácido Zoledrônico (substância ativa), com a duração de 5 e 15 minutos, em 64 pacientes com metástases ósseas, originaram os seguintes dados farmacocinéticos.
Não há dados disponíveis de farmacocinética para o Ácido Zoledrônico (substância ativa) em pacientes com hipercalcemia.
Após início da infusão de Ácido Zoledrônico (substância ativa), as concentrações plasmáticas de fármaco aumentaram rapidamente, atingindo o máximo no final do período de infusão, seguidas por uma rápida diminuição para < 10% do valor máximo após 4 horas e < 1% do valor máximo após 24 horas, com um período subsequente prolongado de concentrações muito baixas, não excedendo 0,1% do valor máximo previamente à segunda infusão do fármaco no 28° dia.
Distribuição:
O Ácido Zoledrônico (substância ativa) demonstra baixa afinidade para os componentes celulares do sangue humano, com concentração média plasmática de 0,59 numa faixa de concentração de 30 ng/mL a 5000 ng/mL. A ligação às proteínas plasmáticas é baixa, com a fração não ligada que varia de 60% em 2 ng/mL até 77% em 2000 ng/mL de Ácido Zoledrônico (substância ativa).
Biotransformação / metabolismo:
O Ácido Zoledrônico (substância ativa) não é metabolizado e é excretado inalterado por via renal. O Ácido Zoledrônico (substância ativa) não inibe as enzimas do P450 humano in vitro.
Eliminação:
O Ácido Zoledrônico (substância ativa) administrado intravenosamente é eliminado em três fases: desaparecimento bifásico rápido da circulação sistêmica, com meia-vida t1/2 alfa de 0,24 horas e t1/2 beta de 1,87 horas, seguido de uma longa fase de eliminação, com meia-vida de eliminação terminal t1/2 gama de 146 horas. Não ocorreu acúmulo de fármaco no plasma após administração de doses múltiplas do fármaco a cada 28 dias. Durante as primeiras 24 horas, 39 ± 16% da dose administrada é recuperada na urina, enquanto a restante se encontra ligada principalmente ao tecido ósseo. Do tecido ósseo é liberado novamente para a circulação sistêmica, muito lentamente, e eliminado por via renal. O clearance (depuração) corpóreo total é de 5,04 ± 2,5 L/h, independentemente da dose.
Linearidade / não-linearidade:
A farmacocinética do Ácido Zoledrônico (substância ativa) é independente da dose. O aumento do tempo de infusão de 5 para 15 minutos provocou uma diminuição de 30% na concentração de Ácido Zoledrônico (substância ativa) no final da infusão, no entanto não demonstrou alteração na área sob a curva, da concentração plasmática versus tempo.
Populações Especiais
Insuficiência hepática:
Não estão disponíveis dados de farmacocinética para o Ácido Zoledrônico (substância ativa) em pacientes com insuficiência hepática. O Ácido Zoledrônico (substância ativa) não inibe as enzimas do P450 humano in vitro, não demonstrou biotransformação, e em estudos em animais, menos de 3% da dose administrada foi recuperada nas fezes, sugerindo a não existência de um papel relevante da função hepática na farmacocinética do Ácido Zoledrônico (substância ativa).
Insuficiência renal:
O clearance (depuração) renal do Ácido Zoledrônico (substância ativa) foi correlacionado com o clearance (depuração) da creatinina, em que o clearance (depuração) renal representa 75 ± 33% do clearance (depuração) da creatinina, a qual mostrou valores médios de 84 ± 29mL/min (média de 22 a 143mL/min) nos64 pacientes com câncer estudados. A análise populacional mostrou que para um paciente com clearance (depuração) da creatinina de 50mL/min (insuficiência moderada), estima-se um clearance (depuração) correspondente para o Ácido Zoledrônico (substância ativa) de 72%, daquele de um paciente com clearance (depuração) da creatinina de 84mL/min. Os dados farmacocinéticos disponíveis em pacientes com insuficiência renal grave são limitados [clearance (depuração) da creatinina < 30mL/min]. O uso de Ácido Zoledrônico (substância ativa) não é recomendado em pacientes com insuficiência renal grave.
Efeito por sexo, idade e raça:
Os três estudos de farmacocinética realizados em pacientes com câncer com metástase óssea não revelaram qualquer efeito, por sexo, raça, idade (faixa de 38-84 anos), e peso corporal no clearance (depuração) do Ácido Zoledrônico (substância ativa) total.
Dados de Segurança pré-clínicos
Estudos de toxicidade:
Em estudos parenterais em bolus, o Ácido Zoledrônico (substância ativa) foi bem tolerado quando administrado por via subcutânea em ratos e por via intravenosa em cães em doses diárias de até 0,02mg/kg, durante 4 semanas. A administração por até 52 semanas, de 0,001mg/kg/dia por via subcutânea em ratos e 0,005mg/kg/ por via intravenosa uma vez a cada 2 a 3 dias em cães foi igualmente bem tolerada.
Em estudos de infusão intravenosa, tolerabilidade renal foi observada em ratos em doses de até 0,6mg/kg e em cães de até 0,5mg/kg, mas com intervalos de dosagem diferentes.
O achado mais frequente nos estudos de repetição de doses consistiu no aumento primário na metáfise esponjosa dos ossos longos em animais em crescimento em quase todas as doses, uma descoberta que reflete a atividade anti-reabsorção farmacológica do composto.
O rim foi identificado como um principal órgão-alvo de toxicidade, em estudos parenterais com Ácido Zoledrônico (substância ativa). Nos estudos de infusão venosa, a tolerabilidade renal foi observada em ratos que receberam infusões com doses de até seis infusões de 0,6mg/kg em intervalos de 3 dias, enquanto que cinco infusões de 0,25mg/kg administradas em intervalos de 2 a 3 semanas foram bem toleradas em cães.
Toxicidade na reprodução:
Estudos de teratogenicidade foram realizados em duas espécies, ambas com administração subcutânea de Ácido Zoledrônico (substância ativa). A teratogenicidade foi observada em ratos em doses ? 0,2mg/kg/dia e manifestada por malformações externas, viscerais e esqueléticas. No teste em ratos, foi observada distócia com menor dose (0,01mg/kg/dia).
Não foram observados efeitos teratogênicos ou embrio/fetal em coelhos, apesar da toxicidade materna marcada em 0,1mg/kg/dia. Efeitos adversos maternos foram associados com, e podem ter sido causados por, hipocalcemia induzida por medicação.
Mutagenicidade:
O Ácido Zoledrônico (substância ativa) não foi mutagênico nos testes in vitro e in vivo de mutagenicidade realizados.
Carcinogenicidade:
Em estudo oral de carcinogenicidade em roedores, o Ácido Zoledrônico (substância ativa) revelou não ter potencial carcinogênico.
Cuidados de Armazenamento
O produto deve ser mantido em temperatura ambiente (entre 15 e 30°C).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
A solução 4 mg/100 mL é uma solução “pronta para o uso” que não deve ser diluída ou misturada com outras soluções para infusão e deve ser utilizada imediatamente após aberta.
Aspecto físico:
A solução de Zometa “pronta para o uso” é fornecida em frascos plásticos. Solução límpida incolor.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Mensagens de Alerta
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Venda sob prescrição médica.
Dizeres Legais
MS – 1.0068.0154
Farm. Resp.:
Flavia Regina Pegorer – CRF-SP 18.150
Importado por:
Novartis Biociências S.A.
Av. Prof. Vicente Rao, 90 - São Paulo - SP
CNPJ: 56.994.502/0001-30
Indústria Brasileira
Fabricado por:
Novartis Pharma Stein AG, Stein, Suíça ou Fresenius Kabi Austria GmbH, Graz, Áustria.