- Medicamentos
- Medicamentos Especiais
- Copaxone 20Mg Ml Injetável Copaxone 20Mg Ml Injetável 28 Seringas De 1Ml
Comparamos o preço de copaxone 20mg ml injetável copaxone 20mg ml injetável 28 seringas de 1ml, veja o menor preço
Copaxone 20Mg Ml Injetável Copaxone 20Mg Ml Injetável 28 Seringas De 1Ml

Menor Preço
R$ 6.670,00
- CATEGORIA: Medicamentos Especiais
- PRINCÍPIO ATIVO: Acetato De Glatirâmer
- FABRICANTE: TEVA
PARA QUE SERVE?
Para que serve Copaxone (acetato de glatirâmer) está indicado na redução da frequência de recidivas (surtos) nos pacientes com esclerose múltipla remissiva recidivante* (EMRR). Os pacientes tratados com este medicamento tiveram poucas reincidências Copaxone também é indicado no tratamento de pacientes que tiveram um primeiro episódio clínico bem definido e que apresentem alto risco de desenvolver a esclerose múltipla clinicamente definida (EMCD). O termo remissiva recidivante é equivalente ao termo remitente-recorrente.
N
Novo
2
ofertasMelhores preços a partir de R$ 6.670,00 até R$ 6.670,00
Menor preço
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
Menor preço
Para que serve
Copaxone (acetato de glatirâmer) está indicado na redução da frequência de recidivas (surtos) nos pacientes com esclerose múltipla remissiva recidivante* (EMRR). Os pacientes tratados com este medicamento tiveram poucas reincidências Copaxone também é indicado no tratamento de pacientes que tiveram um primeiro episódio clínico bem definido e que apresentem alto risco de desenvolver a esclerose múltipla clinicamente definida (EMCD).
O termo remissiva recidivante é equivalente ao termo remitente-recorrente.
Contraindicação
Copaxone (acetato de glatirâmer) é contraindicado para pacientes com hipersensibilidade (alergia) conhecida ao acetato de glatirâmer ou ao manitol.
Como usar
A solução injetável subcutânea de Copaxone (acetato de glatirâmer) é límpida, incolor a levemente amarelada e deve estar livre de partículas. A dose recomendada para adultos é de 20 mg ao dia, injetada via subcutânea [uma seringa preenchida Copaxone.
A dose e a frequência de administração devem ser indicadas pelo médico. A seringa preenchida de Copaxone solução injetável deve ser usada somente uma única vez Copaxone deve ser aplicado à mesma hora, todos os dias. Os locais indicados para a autoinjeção são os braços, abdômen, quadris e coxas. Deve-se usar um local diferente para injeção a cada dia, sugerindo-se seguir o sentido horário ou anti-horário. O rodízio nos locais de injeção tem como objetivo reduzir a propensão a irritações locais ou dor resultante da injeção.
Instruções de uso:
Antes de utilizar Copaxone solução injetável leia cuidadosamente todas as instruções da bula. Remova somente um blister, contendo a seringa preenchida com a solução injetável, da embalagem e guarde todas as seringas não utilizadas novamente sob refrigeração (entre 2°C e 8°C). Aguarde, no mínimo 20 minutos, para que a seringa preenchida com solução atinja a temperatura ambiente.
Lave suas mãos com água e sabão, para prevenir infecções, e não toque em seu cabelo ou pele após a lavagem.
Remova a seringa preenchida do blister retirando a película protetora. Antes do uso, observe o líquido da seringa. Se o líquido estiver turvo ou apresentar alguma partícula, não utilize a seringa e ligue para o atendimento ao consumidor. Se o líquido estiver límpido, coloque a seringa em uma superfície limpa.
Se você observar pequenas bolhas de ar dentro da seringa, não tente expulsá-las antes de injetar o medicamento para evitar perdas de medicamento.
Escolha o local da injeção, utilizando a figura.
Existem 7 áreas possíveis para injeção em seu corpo: braços, coxas, quadris e abdômen.
Alterne o local de injeção todos os dias, isto reduz as chances de irritação ou dor no local da injeção Não aplique na mesma área mais que uma vez durante a semana.
Existem alguns locais em seu corpo que dificultam a autoaplicação (como a parte de trás do braço), por isso você pode necessitar de ajuda.
Limpe a área escolhida para a injeção com um algodão umedecido com álcool isopropílico 70% e deixe o local secar.
Segure a seringa como se fosse uma caneta. Remova a proteção da agulha. Com a outra mão, pince suavemente uma porção de aproximadamente 5 centímetros de sua pele entre o dedo indicador e o polegar.
Insira a agulha, sob um ângulo de 90º, dentro de pele.
Injete o medicamento empurrando o êmbolo constantemente para baixo até a seringa se esvaziar.
Puxe a seringa e a agulha até sair totalmente da pele.
Pressione um chumaço de algodão seco no local da injeção por alguns segundos. Não massageie o local da injeção.
Descarte a seringa no recipiente de descarte apropriado. Descarte do material usado. Descarte a seringa preenchida com a agulha num recipiente resistente a perfurações e seguro.
Posologia: A dose recomendada para adultos de Copaxone para o tratamento de esclerose múltipla remissiva recidivante é de 20 mg/dia, injetada subcutaneamente. Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico. O uso inadequado do medicamento pode mascarar ou agravar sintomas. Consulte um clínico regularmente Ele avaliará corretamente a evolução do tratamento. Siga corretamente suas orientações.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO Se você se esquecer de aplicar uma dose, aplique assim que você se lembrar Não dobre a dose para compensar a dose esquecida Aplique a próxima dose somente após 24 horas Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista 8
POSOLOGIA E MODO DE USAR
Precauções
Advertências e Precauções: A administração deve ser feita exclusivamente por via subcutânea (injeção no tecido imediatamente abaixo da pele) Copaxone (acetato de glatirâmer) não deve ser administrado por via intravenosa (injeção lenta na veia) ou via intramuscular (injeção aplicada no interior de um músculo). Siga exatamente as instruções para autoaplicação, de acordo com as instruções de uso, para garantir a segurança de administração. Baseado em dados atuais, não é necessária nenhuma precaução especial para pacientes envolvidos em atividades que necessitem de atenção, como dirigir veículos ou operar máquinas.
- Uso em idosos, crianças e outros grupos de risco Uso em Idosos: Copaxone não foi estudado especificamente em pacientes idosos.
- Uso Pediátrico: A segurança e eficácia de Copaxone em crianças abaixo de 18 anos ainda não foram estabelecidas. Não foram realizados estudos clínicos em crianças ou adolescentes. Não existem informações suficientes sobre o uso de Copaxone em crianças com menos de 12 anos de idade que permita a recomendação deste uso. Assim sendo, Copaxone não deve ser utilizado nesta população Interação com outros medicamentos. As interações entre Copaxone e os demais fármacos ainda não foram integralmente avaliadas.
Não se conhece, até o momento, alguma interação possível de Copaxone com alimentos ou com exames laboratoriais. Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Gravidez e Lactação: Informe seu médico sobre a ocorrência de gravidez na vigência do tratamento ou após o seu término. Copaxone não é recomendado para uso durante a gravidez. Informe ao médico se está amamentando.
Não há informações sobre a passagem de Copaxone para o leite materno. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Efeitos sobre a capacidade de dirigir e operar máquinas: Baseado nos dados atuais, não é necessária nenhuma precaução especial para pacientes envolvidos em atividades que requerem alerta mental, como dirigir veículos ou operar máquinas.
Interrupção do Tratamento: Não interromper o tratamento sem o conhecimento do seu médico. Foi observado em estudo clínico que alguns pacientes abandonaram o tratamento devido a alguma reação adversa, sendo as mais comuns: reações no local da injeção, dispneia (falta de ar), urticária (reação alérgica manifestada por alterações na pele), vasodilatação (dilatação dos vasos sanguíneos), hipersensibilidade, gravidez não programada, depressão, taquicardia (aceleração dos batimentos cardíacos), vertigem (tontura) e tremor.
Reações Adversas
Como todos os medicamentos, Copaxone (acetato de glatirâmer) pode causar reações adversas, embora nem todas as pessoas as apresentem. Se você apresentar algum dos sintomas descritos abaixo, comunique seu médico imediatamente. Avise seu médico de qualquer evento adverso que você tenha enquanto estiver fazendo uso de Copaxone. As reações adversas mais frequentemente observadas nos estudos clínicos conduzidos com Copaxone foram reações no local da injeção, tendo sido relatadas pela maioria dos pacientes em tratamento com Copaxone. Nos estudos clínicos controlados, a proporção de pacientes que relataram estas reações adversas, ao menos uma vez, após tratamento com Copaxone (70%) foi superior quando comparado com os pacientes que receberam placebo (37%).
As reações no local da injeção mais comumente relatadas nos estudos clínicos e no período pós-comercialização foram: eritema (rubor), algia (dor), nódulo, prurido, edema, inflamação, hipersensibilidade (alergia) e raras ocorrências de lipoatrofia (atrofia localizada do tecido gorduroso abaixo da pele) e necrose de pele (lesão grave com morte de células da pele)
Lipoatrofia e necrose de pele: Nos locais de injeção, lipoatrofia localizada e, raramente, necrose de pele foram relatadas após o período de comercialização. A lipoatrofia pode ocorrer no início do tratamento (algumas vezes após vários meses) e é considerada como sendo permanente. Não existe tratamento conhecido para lipoatrofia. Para auxiliar na possível diminuição destes eventos, o paciente deve ser orientado a seguir adequadamente as técnicas de injeção e fazer rodízio dos locais de injeção diariamente.
Composição
COMPOSIÇÃO Cada seringa preenchida de 1,0 mL de Copaxone (acetato de glatirâmer) contém: acetato de glatirâmer* 20 mg Excipientes: manitol, água para injetáveis * Acetato de glatirâmer, a substância ativa de Copaxone, também conhecido como copolímero-1, é o sal acetato de polipeptídeos sintéticos, contendo 4 aminoácidos de ocorrência natural: ácido L-glutâmico, L-alanina, L-tirosina e L-lisina, em fração molar média de 0,141; 0,427; 0,095 e 0,338, respectivamente.
O peso molecular médio do acetato de glatirâmer está entre 5 000 e 9 000 daltons Cada 20 mg de acetato de glatirâmer equivalem a 18 mg de glatirâmer. O pH da solução injetável é de aproximadamente 5,5 a 7,0.
Superdosagem
Se utilizar uma grande quantidade deste medicamento de uma só vez, comunique seu médico imediatamente.
Interação Medicamentosa
Interações entre Acetato de Glatirâmer (substância ativa) e outros fármacos não foram formalmente avaliadas. Os resultados dos ensaios clínicos existentes não sugerem quaisquer interações significativas entre Acetato de Glatirâmer (substância ativa) e as terapias normalmente utilizadas para pacientes com esclerose múltipla (EM), incluindo o uso concomitante de corticosteróides por até de 28 dias.
Acetato de Glatirâmer (substância ativa) não chegou a ser formalmente avaliado em combinação com interferon beta. No entanto, dez pacientes que passaram da terapia com interferon beta para Acetato de Glatirâmer (substância ativa) não relataram eventos adversos inesperados que pudessem ser relacionados ao tratamento.
Incompatibilidades
Acetato de Glatirâmer (substância ativa) não deve ser misturado ou administrado concomitantemente com outros medicamentos.
Interação com exames laboratoriais
Não se conhece, até o momento, alguma interação possível de Acetato de Glatirâmer (substância ativa) com exames laboratoriais.
Interação Alimentícia
Não se conhece, até o momento, alguma interação possível de Acetato de Glatirâmer (substância ativa) com alimento.
Ação da Substância
Resultados de eficácia
As evidências clínicas que suportam a eficácia do Acetato de Glatirâmer (substância ativa) na redução da frequência de surtos em pacientes com esclerose múltipla remissiva recidivante (EMRR) estão fundamentadas em dois estudos clínicos pivotais controlados por placebo, ambos usando dosagens de Acetato de Glatirâmer (substância ativa) equivalentes a 20 mg/dia (nenhuma outra dosagem foi estudada em estudos clínicos controlados por placebo em esclerose múltipla remissiva recidivante), além de outros estudos complementares:
Estudo 1
Estudo clínico realizado em centro único, que incluiu 50 pacientes (Acetato de Glatirâmer (substância ativa) n=25; placebo n=25) randomizados para receber doses diárias de 20 mg de Acetato de Glatirâmer (substância ativa) por via subcutânea ou placebo. Os pacientes foram diagnosticados, pelos critérios correntes, como portadores de EMRR e tinham sido acometidos por, pelo menos, duas exacerbações nos últimos dois anos que precederam à seleção para o estudo. Os pacientes podiam se movimentar, conforme evidenciado pela graduação não superior a 6 da Escala Expandida de Incapacitação de Kurtzke (EDSS), uma escala padrão variando de 0 = normal a 10 = morte, válida para esclerose múltipla (EM). Graduação 6 significa que o paciente pode movimentar-se com assistência; graduação 7 significa que o paciente necessita de cadeira de rodas.
Os pacientes foram vistos a cada 3 meses, por um período de 2 anos, assim como em todas as vezes que foram acometidos por uma suposta exacerbação. Para que tivesse havido confirmação de uma exacerbação, um neurologista não informado sobre o estudo clínico deveria documentar sinais neurológicos objetivos, bem como documentar a existência de outros critérios (por exemplo, a persistência de sinais neurológicos por, pelo menos, 48 horas).
O resultado inicial para avaliação, especificado no protocolo, era a proporção de pacientes em cada grupo de tratamento que tivesse permanecido livre de exacerbações durante os dois anos de estudo, mas outros dois resultados também foram especificados como objetivos: 1) a frequência das exacerbações durante o estudo; e 2) a mudança do número de exacerbações, em comparação com a frequência de exacerbações nos dois anos anteriores.
A tabela abaixo mostra o resultado das análises dos três resultados acima descritos, bem como diversas outras avaliações secundárias especificadas no protocolo. Tais análises estão baseadas na população passível de tratamento (isto é, pacientes que tenham recebido ao menos uma dose de tratamento e que tenham tido, pelo menos, uma avaliação de tratamento).
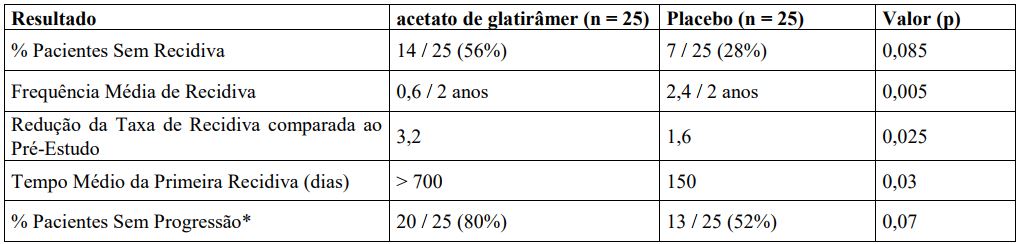
*Progressão definida como aumento de, pelo menos, um ponto na EDSS, que persiste por, pelo menos, 3 meses consecutivos.
Estudo 2
O segundo estudo foi estudo clínico multicêntrico de projeto similar ao primeiro, desenvolvido em 11 centros norte- americanos. Um total de 251 pacientes (Acetato de Glatirâmer (substância ativa) n=125; placebo n=126) participaram do estudo. O resultado inicial era a taxa média de recidiva em dois anos. A tabela abaixo apresenta os resultados da análise desses resultados dessa população passível de tratamento, bem como, outras avaliações secundárias.
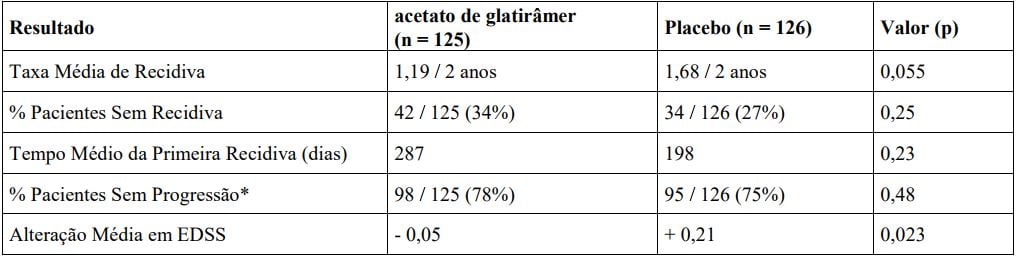
Em ambos os estudos, o Acetato de Glatirâmer (substância ativa) demonstrou efeito benéfico claro na taxa de recidivas; com base nestas evidências, demonstra-se a eficácia do Acetato de Glatirâmer (substância ativa).
Estudo 3
Um terceiro estudo foi um estudo multinacional , no qual parâmetros de ressonância magnética foram utilizados como parâmetros primários e secundários. Um total de 239 pacientes com EMRR (Acetato de Glatirâmer (substância ativa) n=119; Placebo n=120) foram randomizados para tratamento. O critério adotado foi similar ao do segundo estudo, incluindo apenas um critério adicional em que o paciente teria que ter pelo menos uma lesão Gd realçada na ressonância magnética inicial. Os pacientes foram tratados através de modo duplo-cego por 9 meses; durante o tratamento eram submetidos mensalmente a uma ressonância magnética. O parâmetro primário para a fase duplo-cega do estudo foi o número total cumulativo de lesões T1 realçadas por Gd durante os nove meses. A tabela abaixo apresenta os resultados do parâmetro primário, obtidos durante a monitoração da coorte de intenção de tratamento (ITT).

Estudo 4
Um estudo controlado com placebo incluindo 481 pacientes (Acetato de Glatirâmer (substância ativa) n=243, placebo n=238) foi realizado em pacientes com episódio único bem definido de manifestação neurológica unifocal e com achados de ressonância nuclear magnética (RNM) sugestivos de esclerose múltipla (pelo menos duas lesões cerebrais com mais de 6 mm de diâmetro na imagem da RNM em T2). Qualquer outra doença que não fosse esclerose múltipla e que pudesse melhor explicar os sinais e sintomas daquele paciente foram excluídas.
Durante o período controlado com placebo de até três anos, o Acetato de Glatirâmer (substância ativa) retardou a progressão do primeiro evento clínico para esclerose múltipla clinicamente definida (EMCD) de acordo com os critérios de Poser de uma forma estatisticamente significativa e clinicamente importante, correspondendo a uma redução de risco de 45% (Razão de risco = 0,55; 95% CI [0,40; 0,77], valor de p = 0,0005). A proporção de pacientes que converteu para EMCD foi 43% no grupo placebo e 25% no grupo Acetato de Glatirâmer (substância ativa). O efeito favorável do tratamento com Acetato de Glatirâmer (substância ativa) sobre o placebo também foi demonstrado em dois desfechos na RNM, isto é, no número de novas lesões em T2 e no volume das lesões de T2.
As análises dos subgrupos post-hoc foram realizadas em pacientes com várias características no momento da inclusão para identificar uma população de maior risco de desenvolvimento de um segundo surto. Para aqueles indivíduos com RNM de base apresentando pelo menos uma lesão Gd realçada e 9 ou mais lesões em T2, a conversão para EMCD foi evidente em 50% dos pacientes no grupo placebo vs. 28% dos pacientes no grupo Acetato de Glatirâmer (substância ativa) em 2,4 anos. Para aqueles indivíduos com 9 ou mais lesões em T2 de base, a conversão para EMCD foi evidente em 45% dos pacientes no grupo placebo vs. 26% nos pacientes com Acetato de Glatirâmer (substância ativa) em 2,4 anos. No entanto, o impacto do tratamento precoce com Acetato de Glatirâmer (substância ativa) na evolução em longo prazo não é conhecido mesmo nestes grupos de alto risco, porque o estudo foi basicamente idealizado para avaliar o período de tempo até um segundo evento. De qualquer forma, o tratamento somente deve ser considerado para pacientes classificados como sendo de alto risco.
Características farmacológicas
Grupo Farmacoterapêutico: Outras Citocinas e Imunomoduladores.
Código ATC: L03AX13.
O Acetato de Glatirâmer (substância ativa) é considerado um agente imunomodulador que altera as respostas autoimunes específicas da esclerose múltipla.
A atividade biológica do Acetato de Glatirâmer (substância ativa) não é totalmente conhecida, mas tem a habilidade de bloquear a indução de EAE (encefalomielite alérgica) em ratos.
Características Químicas
Acetato de Glatirâmer (substância ativa), a substância ativa de Acetato de Glatirâmer (substância ativa), também conhecido como copolímero-1, é o sal acetato de polipeptídeos sintéticos, contendo 4 aminoácidos de ocorrência natural: ácido L-glutâmico, L-alanina, L-tirosina e L-lisina, em fração molar média de 0,141; 0,427; 0,095 e 0,338, respectivamente. O peso molecular médio do Acetato de Glatirâmer (substância ativa) está entre 5.000 e 9.000 daltons.
O Acetato de Glatirâmer (substância ativa) é designado polímero do ácido L-glutâmico com acetato (sal) de L-alanina, L-lisina e L-tirosina. Sua fórmula estrutural é
(Glu,Ala,Lys,Tyr)x•x CH 3COOH
(C5H9NO4 • C3H7NO2•C6H14N2O2 • C9H11NO3) x • x C2H4O2.
CAS -147245-92-9.
Propriedades Farmacodinâmicas
Resultados pré-clínicos sugerem um mecanismo de ação específico. O Acetato de Glatirâmer (substância ativa) reage de forma cruzada com a proteína básica da mielina (PBM) nos níveis humoral e celular. Além disso, o Acetato de Glatirâmer (substância ativa) liga-se com grande afinidade às proteínas do MHC (Complexo de Histocompatibilidade) de Classe II na superfície das células apresentadoras de antígenos.
Estudos in vitro demonstram que a afinidade do Acetato de Glatirâmer (substância ativa) é suficiente para competir e, até mesmo, deslocar a proteína básica de mielina (PBM), a glicoproteína oligodendrócito mielínica (GOM) e a proteína proteolipídica (PPL) da ligação ao MHC II.
A patogênese da Esclerose Múltipla é melhorada por dois efeitos específicos das ligações do Acetato de Glatirâmer (substância ativa) ao MHC de Classe II sobre as células apresentadoras de antígeno
- Ativação das células-T supressoras (antígeno-específicas) que irão mediar mecanismos de supressão da doença;
- Competição direta ou mesmo deslocamento da PBM e outros componentes encefalitogênicos associados à mielina para ligar-se ao MHC de classe II, com subsequente inibição das etapas de indução da resposta celular antígeno-específicas, como proliferação de células, secreção de linfocinas e citotoxicidade.
Ambos os efeitos, imagina-se, são iniciados pelas células linfoides próximas ao local da injeção. Não há evidências de que o Acetato de Glatirâmer (substância ativa) cause imunossupressão geral.
Sabendo-se que o Acetato de Glatirâmer (substância ativa) pode alterar funções imunológicas, há preocupações sobre seu potencial para alterar as respostas imunológicas de ocorrência natural. Os resultados de uma bateria limitada de testes projetados para avaliar o risco não chegaram a produzir resultados preocupantes nesse sentido; todavia, não há como excluir definitivamente tal possibilidade.
O Acetato de Glatirâmer (substância ativa) é identificado por anticorpos específicos.
Efeitos Farmacodinâmicos
O fármaco demonstrou ser eficaz e não tóxico tanto curando, suprimindo, prevenindo ou reduzindo a gravidade da encefalomielite alérgica (EAE) aguda ou crônica recidivante experimental, induzidas por substância branca cerebral completa ou por diversas proteínas mielínicas (PMB, PPL) com adjuvante de Freund, nas seguintes espécies de animais:
- Camundongos;
- Ratos;
- Preás (adultos e jovens);
- Coelhos;
- Primatas (macacos rhesus e babuínos).
Propriedades Farmacocinéticas
Os resultados obtidos nos estudos farmacocinéticos, realizados em humanos (voluntários saudáveis) e animais, suportam a hipótese de que uma fração substancial da dose terapêutica administrada aos pacientes via subcutânea é hidrolisada localmente. Contudo, fragmentos grandes de Acetato de Glatirâmer (substância ativa) podem ser reconhecidos pelos anticorpos reativos ao Acetato de Glatirâmer (substância ativa). Alguma fração do material injetado, intacto ou parcialmente hidrolisado, é supostamente distribuída na circulação linfática, possibilitando o alcance de linfonodos na região, e alguns podem entrar intactos na circulação sistêmica.
Os efeitos terapêuticos são, então, mediados pela distribuição sistêmica das células-T ativadas no local. Portanto, mesmo se forem detectados os níveis sanguíneos do Acetato de Glatirâmer (substância ativa) ou de seus metabólitos, não se espera que sejam capazes de prover o efeito terapêutico.
Foram realizadas tentativas de caracterizar a biodisponibilidade através da administração subcutânea do 125I-Acetato de Glatirâmer (substância ativa) em animais. Os estudos demonstraram que o Acetato de Glatirâmer (substância ativa) é absorvido rapidamente no local da injeção subcutânea.
Amostras de soro foram analisadas qualitativamente por Cromatografia Liquida de Alta Eficiência (HPLC) para estimar a proporção de Acetato de Glatirâmer (substância ativa) intacto e de fragmentos peptídicos relacionados ao Acetato de Glatirâmer (substância ativa) ao longo do tempo. O padrão de eluição do HPLC foi compatível com o do Acetato de Glatirâmer (substância ativa), três minutos após a injeção. Aos 15 minutos, o padrão de eluição desviou-se para duas espécies menores, distintas e para iodeto livre. Não chegou a ficar claro se as duas espécies menores representavam metabólitos do 125I-Acetato de Glatirâmer (substância ativa) ou outras espécies iodetadas não relacionadas, como resultado da troca de iodeto. Tais estudos não foram repetidos em humanos.
Cuidados de Armazenamento
Copaxone (acetato de glatirâmer) apresenta prazo de validade de 24 meses a partir da data de fabricação, devendo ser conservado sob refrigeração (entre 2°C e 8°C), protegido da luz. Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. O tempo e a condição de armazenamento, antes do uso, são responsabilidades do paciente. As seringas preenchidas devem ser mantidas sob refrigeração (entre 2ºC e 8ºC) e protegidas da luz. Não congelar o medicamento. Se o medicamento for congelado, ele deve ser descartado. Se o medicamento não puder ser armazenado sob refrigeração, ele pode ser armazenado em temperatura ambiente (entre 15ºC e 30ºC) por até um mês. O medicamento não deve ser mantido nesta temperatura por mais de um mês. Após este período de um mês, se o medicamento não for utilizado e estiver em sua embalagem original, ele deve ser armazenado novamente sob refrigeração (entre 2ºC e 8ºC).
Dizeres Legais
DIZERES LEGAIS MS nº: 1 5573 0001 Farm Resp : Mônica Riyoko Nekozuka - CRF-SP nº: 16 970 Fabricado por: Teva Pharmaceutical Industries Ltd Kfar Saba - Israel ou Ivax Pharmaceuticals UK Limited Aston Lane North, Whitehouse Vale Industrial Estate Runcorn - Reino Unido Importado e distribuído por: Teva Farmacêutica Ltda Av Guido Caloi, 1935 - Prédio B - 1ºAndar São Paulo - SP CNPJ nº 05 333 542/0001-08 ? Marca registrada de Teva Pharmaceutical Industries Ltd Atendimento ao Consumidor Teva Farmacêutica: 0800-772-2660 E-mail: paco@tevabrasil com br
VENDA SOB PRESCRIÇÃO MÉDICA VENDA PROIBIDA AO COMÉRCIO Esta bula foi aprovada pela Anvisa em 03/11/2014 TEVA FARMACÊUTICA LTDA - BRASIL Anexo B Histórico de Alteração para a Bula Dados da submissão eletrônica Dados da petição / notificação que altera bula Dados das alterações de bulas Data do expediente N° expediente Assunto Data do expediente N° expediente Assunto Data da aprovação Itens de bula
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso