- Home
- Medicamentos
- Medicamentos Especiais
- Genotropin 12Mg 36Ui C 1Un
- Bula de Genotropin 12Mg 36Ui C 1Un
para o que é indicado e para que serve?
Para que serve Genotropin é indicado no tratamento de longo prazo de crianças com distúrbios de crescimento devido às seguintes condições: secreção insuficiente do hormônio de crescimento, síndrome de Turner (doença genética que só acomete mulheres), crianças nascidas pequenas para a idade gestacional que não recuperaram a altura nos primeiros quatro anos de vida e síndrome de Prader-Willi (doença genética que acomete ambos os sexos).Continue lendo...
ofertas de Genotropin 12Mg 36Ui C 1Un

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Genotropin é indicado no tratamento de longo prazo de crianças com distúrbios de crescimento devido às seguintes condições: secreção insuficiente do hormônio de crescimento, síndrome de Turner (doença genética que só acomete mulheres), crianças nascidas pequenas para a idade gestacional que não recuperaram a altura nos primeiros quatro anos de vida e síndrome de Prader-Willi (doença genética que acomete ambos os sexos).
Genotropin é indicado no tratamento de baixa estatura idiopática (sem causa identificada).
Genotropin é indicado na terapia de reposição em adultos com deficiência de hormônio de crescimento.
Como o Genotropin funciona?
Genotropin é um hormônio que age no metabolismo de lípides (gorduras do sangue), carboidratos e proteínas.
Genotropin estimula o crescimento e aumenta a velocidade de crescimento em crianças que têm deficiência de hormônio de crescimento (GH) endógeno (produzido pelo organismo). Em adultos, assim como em crianças, o Genotropin mantém a composição corpórea normal através do estímulo do crescimento dos músculos e ossos e distribuição da gordura corpórea. A gordura dos órgãos é bastante responsiva ao GH. Além do aumento da quebra das gorduras, o Genotropin diminui os estoques de gordura corporal.
Contraindicação
Genotropin é contraindicado a pacientes que apresentam hipersensibilidade (reação alérgica) à somatropina ou a qualquer componente da fórmula. Também é contraindicado a pacientes que possuam evidência de atividade neoplásica (câncer), pacientes com crescimento não controlado de tumores intracranianos (dentro do crânio) benignos, pacientes aguda e criticamente doentes por complicações após a cirurgia cardíaca (do coração), cirurgia abdominal, trauma acidental múltiplo ou insuficiência respiratória aguda (diminuição aguda da respiração).
Genotropin não deve ser usado para promover o crescimento em crianças com epífises (áreas de crescimento dos ossos) fechadas.
Genotropin é contraindicado a pacientes com retinopatia diabética (doença da retina causada por diabetes) proliferativa ativa ou não proliferativa grave.
Como usar
Se você estiver utilizando as apresentações de Genotropin em que os frascos-ampola que contêm o medicamento são adquiridos separadamente da caneta injetora, a solução deve ser preparada utilizando a caneta injetora Genotropin Pen.
Se você estiver utilizando Genotropin Caneta Preenchida, não é necessário adquirir separadamente a caneta injetora Genotropin Pen, porque Genotropin Caneta Preenchida é uma caneta injetora preenchida, que contém em seu interior o frasco-ampola de Genotropin.
Tanto nas apresentações de Genotropin que requerem a caneta injetora Genotropin Pen, como nas apresentações que já fornecem as canetas preenchidas (Genotropin Caneta Preenchida), a solução é preparada de modo que o diluente seja misturado automaticamente com a substância ativa, no próprio frasco-ampola de duplo compartimento.
Dissolver o pó através de movimentos giratórios lentos e suaves.
A solução não deve ser agitada vigorosamente, pois poderá haver desnaturação (perda do efeito) da substância ativa.
Quando se utilizar Genotropin Pen e Genotropin Caneta Preenchida, a agulha deve ser colocada antes da reconstituição (mistura do pó com o diluente). Utilize uma nova agulha antes de cada injeção. As agulhas não devem ser reutilizadas.
Leia atentamente as Instruções de Uso de Genotropin Pen ou de Genotropin Caneta Preenchida.
A dose e o esquema de administração devem ser individualizados e estabelecidos somente pelo médico. A dose semanal de Genotropin deve ser dividida em 6-7 injeções subcutâneas devendo-se variar o local de aplicação para evitar a ocorrência de lipoatrofia (diminuição da gordura corporal localizada).
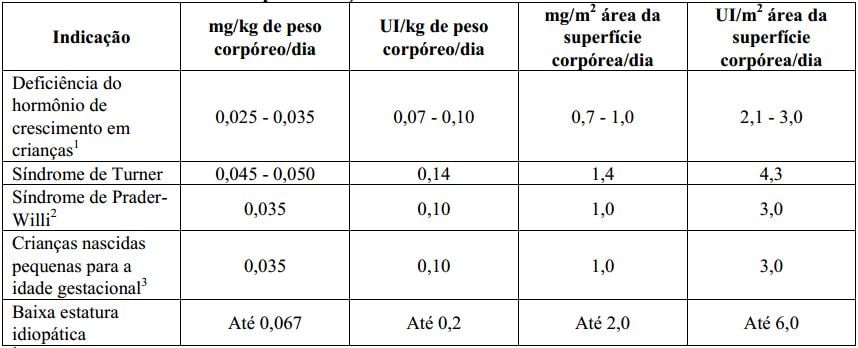
Tabela 1. Doses recomendadas para crianças
1Doses maiores podem ser utilizadas.
2A dose diária não deve ultrapassar 2,7mg. O tratamento não deve ser utilizado em crianças com velocidade de crescimento menor que 1cm por ano e próximo ao fechamento das epífises (área de crescimento dos ossos). Em pacientes com distúrbio de crescimento, o tratamento pode ser realizado até que a altura final seja atingida. O tempo de tratamento para melhora da composição corpórea deve ser avaliado pelo médico responsável pelo tratamento.
3Esta dose geralmente é recomendada até se atingir a altura final. O tratamento deve ser descontinuado se a velocidade de crescimento for <2cm/ ano e, se a idade óssea for >14 anos (meninas) ou >16 anos (meninos), correspondendo ao fechamento das placas de crescimento epifisário.
Baixa estatura idiopática (sem causa identificada): iniciar o tratamento com 0,15UI/kg/dia, ajustando a dose de acordo com a resposta clínica e com as concentrações de IGF-1 no sangue. A dosagem periódica do IGF-1 no sangue, durante o tratamento com Genotropin, é útil na avaliação da eficácia, segurança e da aderência à medicação, auxiliando no ajuste da melhor dose para cada paciente.
Tabela 2. Doses recomendadas para pacientes adultos
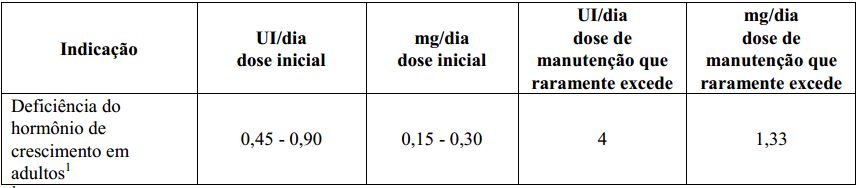
1 A dose deve ser aumentada gradualmente de acordo com as necessidades individuais do paciente, conforme determinado pela concentração de IGF-I (substância produzida por estímulo do GH - hormônio do crescimento). O objetivo do tratamento deve ser atingir concentrações de IGF-I dentro de 2 DP (desvios padrão) a partir da média corrigida pela idade. Pacientes com concentrações normais de IGF-I no início do tratamento devem receber Genotropin até atingir, no máximo, um nível normal de IGF-I, não excedendo 2 DP. A resposta clínica e os efeitos colaterais podem ser utilizados como parâmetros de determinação da dose. A dose diária de manutenção raramente excede 1,0mg ao dia. Mulheres podem necessitar de doses maiores que os homens, sendo que os homens têm demonstrado aumento da sensibilidade ao IGF-I no decorrer do tempo. Isto significa que existe um risco de que mulheres, especialmente aquelas em tratamento oral de reposição de estrógeno (hormônio sexual feminino), sejam subtratadas enquanto que há o risco dos homens serem supertratados. A exatidão da dose de Genotropin deve ser controlada, portanto, a cada 6 meses. As doses podem ser reduzidas visto que a produção fisiológica normal do hormônio de crescimento diminui com a idade. Deve ser utilizada a menor dose efetiva.
Uso em pacientes idosos
A segurança e eficácia de Genotropin em pacientes com 60 anos ou mais não foram avaliadas em estudos clínicos.
Pacientes idosos podem ser mais sensíveis à ação de Genotropin e ser mais propensos a desenvolver reações adversas.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Genotropin?
Se você esquecer de aplicar Genotropin no horário estabelecido, deve fazê-lo assim que lembrar. Entretanto, se já estiver perto do horário de administrar a próxima dose, você deve desconsiderar a dose esquecida e utilizar a próxima.
Neste caso, você não deve utilizar a dose duplicada para compensar doses esquecidas. O esquecimento de dose pode comprometer a eficácia do tratamento.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Genotropin pode causar dor no local da injeção. Em raros casos, quando ocorre dor muscular e/ou dor desproporcional àquela do local da aplicação, deve-se considerar o diagnóstico de miosite (inflamação muscular). Esta reação pode ser devido ao metacresol, o conservante utilizado no Genotropin. Para continuar o tratamento após esta reação, recomenda-se o uso de outro hormônio de crescimento sem metacresol.
Genotropin pode induzir resistência à insulina e hiperglicemia (aumento da glicose no sangue) em alguns pacientes.
Raramente, pode ocorrer diabetes. Nos pacientes diabéticos em tratamento com Genotropin pode ser necessário ajustar a dose dos hipoglicemiantes (medicamentos que reduzem a glicose no sangue).
Genotropin também pode interferir nos níveis sanguíneos dos hormônios da tireoide. É recomendado dosar estes hormônios no sangue antes do início e toda vez que ajustar a dose do Genotropin.
Em pacientes com deficiência do hormônio de crescimento devido a tratamento de doenças malignas, é recomendado monitorar a recorrência dos sintomas durante o uso de Genotropin.
Se a criança apresentar dificuldade para andar durante o tratamento com Genotropin, ela deve ser avaliada.
Pacientes que apresentarem dor de cabeça grave ou frequente, alterações visuais, náuseas e/ou vômitos, devem fazer exame de fundo de olho. Em caso de alteração neste exame, o diagnóstico de hipertensão intracraniana (aumento da pressão do cérebro) benigna deve ser considerado. A experiência clínica mostra que pacientes que já apresentaram hipertensão craniana benigna podem ser tratados novamente com Genotropin e não apresentam recorrência desta doença; os sintomas devem ser monitorados cuidadosamente. A experiência com Genotropin em pacientes acima de 60 anos é limitada.
Em crianças com síndrome de Prader-Willi, o tratamento com Genotropin deve ser acompanhado de dieta com restrição calórica. Ocorrendo piora da escoliose (curvatura lateral da coluna vertebral) durante o uso de Genotropin, o médico deverá ser consultado.
A experiência com tratamentos prolongados em pacientes adultos ou com síndrome de Prader-Willi é limitada.
Antes de iniciar o tratamento com Genotropin para crianças nascidas pequenas para a idade gestacional (PIG), outras razões que possam explicar o distúrbio do crescimento devem ser descartadas. Não é recomendado o início do tratamento com Genotropin em crianças nascidas PIG em idade próxima ao início da puberdade. Se o tratamento com Genotropin for interrompido antes de a criança atingir a altura final, o ganho em altura pode ficar prejudicado.
Não há informação sobre a segurança do tratamento de reposição de hormônio de crescimento em pacientes criticamente doentes.
Quando não ocorre aumento da velocidade de crescimento, particularmente no 1° ano de tratamento, em pacientes pediátricos com baixa estatura idiopática, é necessário avaliar a adesão ao tratamento e outras causas de falha de crescimento, como hipotireoidismo, subnutrição, idade óssea avançada e anticorpos contra o rhGH.
Reações Adversas
Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
Adultos:
Artralgia (dor nas articulações) e edema periférico (inchaço nas extremidades do corpo).
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento)
Crianças:
Artralgia (dor nas articulações) e reação no local da injeção.
Adultos:
Parestesia (dormência e formigamento), mialgia (dor muscular) e rigidez muscular.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
Crianças:
Parestesia (dormência e formigamento) e edema periférico (inchaço nas extremidades do corpo).
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
Crianças:
Leucemia, hipertensão intracraniana benigna (aumento da pressão dentro do crânio) e mialgia (dor muscular).
Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento)
Não conhecido.
Frequência desconhecida (não foi possível estimar com os dados disponíveis)
Crianças:
Rigidez muscular, diabetes tipo 2 e diminuição do cortisol no sangue.
Adultos:
Hipertensão intracraniana benigna (aumento da pressão dentro do crânio), diabetes tipo 2, reação no local da injeção e diminuição do cortisol no sangue.
Na experiência pós-comercialização, casos raros de morte súbita foram relatados em pacientes portadores de síndrome de Prader-Willi tratados com Genotropin, embora nenhuma relação causal tenha sido demonstrada.
Foram relatadas ocorrências de deslizamento da epífise femoral proximal e de síndrome de Legg-Calvé-Perthes em crianças tratadas com hormônio de crescimento. Nenhuma relação casual foi demonstrada com o Genotropin.
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
População Especial
Lactação
Não se sabe se Genotropin é excretado no leite materno, mas a absorção do hormônio pelo estômago e intestino do lactente (bebê em fase de amamentação) é extremamente improvável.
Informe ao seu médico se estiver amamentando.
Obstrução das vias aéreas superiores
Caso ocorra obstrução das vias aéreas superiores (nariz e garganta) incluindo início ou aumento de ronco durante o tratamento com Genotropin, consulte o médico.
Habilidade de dirigir veículos ou operar máquinas
Não foi observado efeito na habilidade de dirigir veículos ou operar máquinas com o uso de Genotropin.
Atenção: Este medicamento contém Açúcar, portanto, deve ser usado com cautela em portadores de Diabetes.
Este medicamento pode causar doping.
Informe ao seu médico a ocorrência de gravidez na vigência do tratamento ou após o seu término.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
Cada frasco-ampola de duplo compartimento de Genotropin contém:
Somatropina recombinante (correspondente à somatotrofina humana) no compartimento I e diluente no compartimento II. Três unidades internacionais (3,0UI) correspondem a 1,0mg de somatropina. Após reconstituição, cada mL contém 5,3mg (16UI) ou 12mg (36UI) de somatropina.
Excipientes: glicina, manitol, fosfato de sódio dibásico anidro, fosfato de sódio monobásico anidro, metacresol, água para injetáveis.
Superdosagem
A superdosagem aguda poderia resultar inicialmente em hipoglicemia (diminuição da glicose no sangue) e, subsequentemente, em hiperglicemia (aumento da glicose no sangue). A superdosagem em longo prazo poderia resultar em sinais e sintomas compatíveis com efeitos conhecidos de excesso de hormônio de crescimento.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
O tratamento concomitante com glicocorticoides pode inibir os efeitos de promoção do crescimento de produtos contendo Somatropina (substância ativa deste medicamento). Assim, os pacientes tratados com glicocorticoides deve ter seu crescimento cuidadosamente monitorizados para avaliar o impacto potencial do mesmo sobre o crescimento.
Os dados obtidos de um estudo de interação realizado em adultos com deficiência de hormônio de crescimento sugerem que a administração de Somatropina (substância ativa deste medicamento) pode aumentar a depuração de substâncias que sofrem metabolização pelo citocromo P4503A4 (ex.: esteroides sexuais, corticosteroides, anticonvulsivantes e ciclosporina).
A significância clínica desse resultado é desconhecida.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados de eficácia
Somatropina (substância ativa deste medicamento), é um hormônio que atua no metabolismo.
Somatropina (substância ativa deste medicamento) é o hormônio do crescimento humano que é produzido através de tecnologia de DNA recombinante utilizando como vetor bacteriano a E. coli. A estrutura é idêntica ao hormônio do crescimento humano.
Em crianças com quantidades inadequadas de hormônio do crescimento, Somatropina (substância ativa deste medicamento) estimula o crescimento no tratamento a longo prazo. Em adultos, assim como em crianças, Somatropina (substância ativa deste medicamento) mantém a composição corporal normal, aumentando a retenção de nitrogênio e estimulando o crescimento do músculo esquelético, e também mobilizando a gordura corporal. O tecido adiposo visceral é particularmente responsivo à Somatropina (substância ativa deste medicamento). Adicionalmente à lipólise aumentada, Somatropina (substância ativa deste medicamento) diminui a recaptação dos triglicérides nos depósitos de gordura do corpo.
A Somatropina (substância ativa deste medicamento) humana aumenta a síntese de proteínas celulares com consequente retenção de nitrogênio, e estimula o crescimento das áreas cartilaginosas dos ossos longos. Possui um efeito diabetogênico atribuído ao aumento da resistência periférica à insulina, com a consequente hiperinsulinemia. A administração inicial resulta em uma mobilização de gorduras, com aumento de ácidos graxos circulantes.
Somatropina (substância ativa deste medicamento) estimula o crescimento linear e aumenta a velocidade de crescimento em crianças que têm deficiência do GH endógeno.
Diversos estudos demonstraram sucesso do tratamento com GH de crianças com DGH, de forma que os consensos sobre o assunto recomendam o tratamento destes pacientes com GH.
Burns e cols. Avaliaram 60 crianças com DGH idiopática, as quais foram tratadas com GH até que a estatura final fosse alcançada (tempo de tratamento, 2 a 15 anos; média, 5,4 anos). A estatura final destes pacientes ficou com Z-score de -2,3 DP em relação à população geral (-2,0 DP em relação aos pais), o que representa um ganho de aproximadamente 4,0 DP, uma vez que os dados da literatura indicam que o Z-score da estatura final de pacientes com DGH não tratada é, em média, de -6,0 DP. A perda de 2 DP neste estudo dos anos 1980 deve ter se relacionado ao atraso do início do tratamento (média, 11 anos de idade), uma vez que estudos posteriores mostraram recuperação total da estatura.
Hokken-Koelega e cols. Avaliaram 20 crianças com idade entre 4 e 16 anos que apresentavam baixa estatura e insuficiência renal crônica (IRC), e que foram tratadas com doses subcutâneas de GH (1,3 mg/m2/dia) ou placebo em um estudo duplo-cego cruzado. Os tratamentos com GH ou placebo duraram 6 meses cada, e foram instituídos de forma randomizada. Dezesseis crianças completaram o seguimento.
Observou-se aumento significante da velocidade de crescimento após o tratamento com GH (P <0,0001) e também com o placebo (P =0,04), embora o GH tenha promovido crescimento 2,9 cm maior que o placebo após 6 meses. O GH causou uma significante elevação do IGF-1 e uma moderada elevação do IGF-2. Frutosamina, perfil lipídico e PTH não se alteraram com o tratamento com GH.
Um estudo paralelo duplo-cego envolvendo 125 crianças com IRC chegou a resultados parecidos: no grupo de 82 crianças tratadas com GH durante 2 anos, o Z-score da estatura aumentou de -2,94 DP para -1,55 DP, enquanto que no grupo placebo, o Z-score diminuiu de -2,82 DP para -2,91 DP (P <0,00005). Pacientes tratados com GH que completaram 2 anos de tratamento tiveram crescimento médio no 1o ano de 10,7 ±3,1 cm/ano e no 2o ano de 7,8 ±2,1 cm/ano. Estes números foram significantemente superiores ao observado no grupo placebo (6,5 ±2,6 cm/ano no 1o ano e 5,5 ±1,9 cm/ano no 2o ano).
A insulinemia basal e pós-prandial foi superior nos pacientes tratados com GH no primeiro mas não no segundo ano de tratamento. A glicemia basal e pós-prandial não se alterou com o tratamento com GH em nenhum momento. Nenhum evento adversos significante se associou ao tratamento com GH.
Carrel e cols. Avaliaram 54 crianças com síndrome de Prader-Willi durante 12 meses. As crianças foram randomizadas para tratamento com GH (1 mg/m2/d) ou placebo. Após 1 ano, observou-se nos pacientes tratados com GH aumento do Z-score da velocidade de crescimento aumentou (de 1,0 ±1,7 DP para 4,6 ±2,9 DP; P <0,001). Também se observou redução da massa gordurosa (46,3 ±8,4% para 38,3 ±10,7%) e melhora da função respiratória, força física e agilidade.
A International Society of Pediatric Endocrinology juntamente com a Growth Hormone Research Society publicaram em 2007 um consenso para o tratamento de crianças e adolescentes com baixa estatura nascidos pequenos para idade gestacional. Este documento recomenda que as crianças com baixa estatura importante (Z-score <2,5 DP) sejam tratadas com GH, na dose de 0,035-0,070 mg/kg/d).
Cento e cinquenta e quatro meninas com síndrome de Turner (idade 7-13 anos) foram randomizadas para tratamento com GH (0,30 mg/kg/semana, administrado em 6 doses semanais) ou placebo, em associação a reposição estrogênica após a idade cronológica de 13 anos. O protocolo de tratamento consistia em administrar o GH até que a velocidade de crescimento caísse abaixo de 2 cm/ano e a idade óssea fosse superior a 14 anos.
As pacientes foram então re-avaliadas 1 ano após o fim do tratamento, para que se tivesse um registro da estatura final. Ao final do tratamento, a estatura média das pacientes tratadas com GH foi significantemente superior ao grupo placebo (147,5 ±6,1 cm vs. 141,0 ±5,4 cm; P <0,001). Considerando as pacientes com dados de estatura final (>1 ano após o término do tratamento), o grupo tratado com GH manteve maior estatura (149,0 ±6,4 cm vs. 142,2 ±6,6 cm; P <0,001).
O ganho médio de altura final promovido pelo tratamento com GH foi de +7,3 cm.
Baixa estatura idiopática é definida como estatura abaixo de 2 DP da média para idade, sexo e grupo populacional, sem evidência de anormalidades sistêmicas, endócrinas, nutricionais ou cromossômicas.
Especificamente, as crianças com baixa estatura idiopática têm comprimento normal ao nascimento e secreção de GH normal. O grupo de crianças com baixa estatura idiopática inclui aquelas com baixa estatura familiar e as portadoras de atraso constitucional do crescimento e puberdade.
Segundo o Consenso de Diagnóstico e Tratamento da Baixa Estatura Idiopática, o ganho médio de estatura final é de 3,5-7,5 cm versus controles históricos, após um tempo médio de 4 a 7 anos de tratamento.
Estudos pré-clínicos de segurança
Em estudos com Somatropina (substância ativa deste medicamento) relativos a toxicidade subaguda e tolerabilidade local, nenhum efeito clinicamente relevante foi observado.
Em outros estudos com Somatropina (substância ativa deste medicamento) relativos a toxicidade geral, tolerabilidade local e toxicidade reprodutiva, nenhum efeito clínico relevante foi observado.
Os estudos de genotoxicidade in vitro e in vivo de indução de aberrações cromossômicas e mutações genéticas foram negativos com a somatotropina.
Características farmacológicas
Propriedades Farmacodinâmicas
A Somatropina (substância ativa deste medicamento) é um potente hormônio metabólico importante para o metabolismo de lípides, carboidratos e proteínas. Em crianças com níveis inadequados de hormônio do crescimento, a Somatropina (substância ativa deste medicamento) estimula o crescimento linear e aumenta as taxas de crescimento.
Em adultos, assim como em crianças, a Somatropina (substância ativa deste medicamento) mantém uma composição corporal normal, aumentando a retenção de nitrogênio, o estímulo de crescimento do músculo esquelético e a mobilização da gordura corporal. A gordura visceral é particularmente responsiva à Somatropina (substância ativa deste medicamento). Além da lipólise aumentada, a Somatropina (substância ativa deste medicamento) diminui a retomada de triglicérides nos depósitos de gordura.
As concentrações plasmáticas de IGF-1 (fator de crescimento insulina-símile 1) e IGFBP3 (proteína ligadora 3 do fator de crescimento insulina-símile) são aumentados pela Somatropina (substância ativa deste medicamento). Adicionalmente, as seguintes ações tem sido demonstradas:
Metabolismo lipídico
A Somatropina (substância ativa deste medicamento) induz os receptores hepáticos de colesterol LDL e afeta o perfil dos lípideos plasmáticos e lipoproteínas. De modo geral, a administração de Somatropina (substância ativa deste medicamento) a pacientes com deficiência de hormônio do crescimento resulta em redução das concentrações plasmáticas de LDL e apolipoproteína B. A redução no colesterol total também pode ser observada.
Metabolismo de carboidratos
A Somatropina (substância ativa deste medicamento) aumenta a insulina, mas a glicemia de jejum, em geral, permanece inalterada. Crianças com hipopituitarismo podem apresentar hipoglicemia de jejum. Esta condição é revertida pela Somatropina (substância ativa deste medicamento).
Metabolismo hídrico e mineral
A deficiência de hormônio do crescimento está associada ao volume extracelular e plasmático diminuídos. Ambos são rapidamente aumentados após o tratamento com Somatropina (substância ativa deste medicamento). A Somatropina (substância ativa deste medicamento) induz a retenção de sódio, potássio e fósforo.
Metabolismo ósseo
A Somatropina (substância ativa deste medicamento) estimula o metabolismo do esqueleto ósseo. A administração a longo prazo de Somatropina (substância ativa deste medicamento) a pacientes com deficiência de hormônio do crescimento que apresentam osteopenia resulta em aumento do conteúdo mineral ósseo e densidade (DMO).
Capacidade física
A força muscular e a capacidade de exercício físico aumentam após o tratamento a longo prazo com Somatropina (substância ativa deste medicamento). A Somatropina (substância ativa deste medicamento) também aumenta o débito cardíaco, mas o mecanismo precisa ainda ser esclarecido. Uma diminuição da resistência vascular periférica pode contribuir para este efeito.
Em estudos clínicos envolvendo crianças e adolescentes nascidos pequenos para a idade gestacional (PIG), doses de 0,033 e 0,067 mg de Somatropina (substância ativa deste medicamento)/kg de peso ao dia foram administradas para tratamento até que a altura final fosse alcançada. Em 56 pacientes que foram tratados continuamente e alcançaram a altura final, a alteração média de altura do início do tratamento foi +1,9 DP e +2,19 DP respectivamente.
Dados da literatura sobre pacientes nascidos pequenos para idade gestacional não tratados sugerem um crescimento tardio de 0,5 DP. Dados de perfil de segurança a longo prazo ainda são limitados.
Propriedades farmacocinéticas
Absorção
A biodisponibilidade da Somatropina (substância ativa deste medicamento) administrada por via subcutânea é de aproximadamente 80% em indivíduos saudáveis e em pacientes com deficiência de hormônio do crescimento. Uma dose subcutânea de 5 mg de Somatropina (substância ativa deste medicamento) em adultos saudáveis resulta em valores de Cmax e Tmax de 71 ±24 ?g/L (média ±DP) e 4 horas (mediana), respectivamente.
Eliminação
A meia-vida média terminal da Somatropina (substância ativa deste medicamento) após a administração intravenosa em pacientes adultos com deficiência de hormônio de crescimento é de aproximadamente 0,4 h. Todavia, após administração subcutânea de Somatropina (substância ativa deste medicamento) 6,7 mg/mL e Somatropina (substância ativa deste medicamento) 10 mg/1,5mL solução para injeção, uma meia-vida de 3 horas é alcançada.
A diferença observada pode ser atribuída à absorção mais lenta do local de injeção seguida da administração subcutânea.
Subpopulações
A biodisponibilidade absoluta de Somatropina (substância ativa deste medicamento) parece ser similar em homens e mulheres após a administração subcutânea.
Faltam informações sobre a farmacocinética da Somatropina (substância ativa deste medicamento) em populações geriátricas e pediátricas, em diferentes raças e em pacientes com insuficiência renal, hepática ou insuficiência cardíaca.
Cuidados de Armazenamento
Genotropin deve ser conservado sob refrigeração (entre 2 e 8ºC), protegido da luz. Não congelar.
Após preparada, a solução de Genotropin deve ser mantida sob refrigeração, protegida da luz e pode ser utilizada por até 4 semanas.
Características do produto
Antes da reconstituição:
Pó liófilo de aparência homogênea branca + solução diluente praticamente livre de material particulado.
Após reconstituição:
Solução praticamente livre de material particulado e sem formação significativa de bolhas.
Se você utilizar Genotropin Caneta Preenchida e estiver utilizando o dispositivo para proteção da agulha, guarde sua caneta com o protetor da agulha e com a tampa preta devidamente colocada. Se você não estiver utilizando o dispositivo para proteção da agulha, guarde sua caneta com a tampa branca devidamente colocada. Veja as Instruções de Uso (folheto explicativo) para mais detalhes. Estas medidas ajudarão a proteger Genotropin da luz.
As canetas preenchidas de Genotropin Caneta Preenchida devem ser descartadas após todo o conteúdo ter sido utilizado.
O volume da solução reconstituída pode sofrer variação, o que não afeta o volume de aplicação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS – 1.0216.0201
Farmacêutica Responsável:
Carolina C. S. Rizoli -
CRF-SP Nº 27071
Registrado e Importado por:
Laboratórios Pfizer Ltda.
Rodovia Presidente Castelo Branco, Km 32,5
CEP 06696-000 – Itapevi – SP
CNPJ nº 46.070.868/0036-99
Fabricado por:
Vetter Pharma-Fertigung GmbH & Co. KG
Langenargen – Alemanha
Embalado por:
Pfizer Manufacturing Belgium N.V.
Puurs – Bélgica
Fabricado e Embalado por:
Pfizer Manufacturing Belgium NV
Puurs – Bélgica
Venda sob prescrição médica.
Só pode ser vendido com retenção de receita.
informações complementares
| Fabricante |
| WYETH |
| Princípio ativo |
| somatropina |
| Categoria do medicamento |
| Medicamentos Especiais |
GENOTROPIN 12MG 36UI C 1UN É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.