- Home
- Medicamentos
- Medicamentos Especiais
- Granulokine - 30 Mu 300 Mcg So...
- Bula de Granulokine - 30 Mu 300 Mcg So...
para o que é indicado e para que serve?
Para que serve Granulokine é indicado para redução da duração da neutropenia (diminuição do número de glóbulos brancos neutrófilos) e da incidência da neutropenia febril em pacientes com neoplasias (tumores) não originadas da medula óssea, tratados com quimioterapia citotóxica estabelecida (medicamentos que atacam as células).Continue lendo...
ofertas de Granulokine - 30 Mu 300 Mcg Solução Injetável 1 Seringa Pree...

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Granulokine é indicado para redução da duração da neutropenia (diminuição do número de glóbulos brancos neutrófilos) e da incidência da neutropenia febril em pacientes com neoplasias (tumores) não originadas da medula óssea, tratados com quimioterapia citotóxica estabelecida (medicamentos que atacam as células).
Granulokine também é indicado para redução da duração da neutropenia e suas sequelas clínicas em pacientes submetidos à terapia mieloablativa (que destrói a medula óssea) seguida de transplante de medula óssea.
Peça ao médico mais esclarecimentos sobre a sua doença se necessário.
Como Granulokine funciona?
Granulokine é uma proteína altamente purificada produzida em laboratório que age estimulando especificamente a produção de neutrófilos (um dos tipos de glóbulos brancos que também são chamados de granulócitos), que ajudam o organismo a se defender contra infecções, principalmente bacterianas.
Em 24 horas após administração, ocorre aumento evidente dessas células.
A redução do número de granulócitos, que são produzidos na medula óssea, pode ocorrer nas seguintes situações:
Com o uso de quimioterapias tóxicas para a medula óssea, em infecções graves ou em outras situações.
Contraindicação
Granulokine não deverá ser administrado caso você tenha alergia ao filgrastim ou aos demais componentes.
Granulokine não deve ser administrado para aumentar a dose de quimioterapia contra câncer acima dos esquemas de administração e doses já estabelecidos pelo seu médico.
Você não deve receber Granulokine se for portador de neutropenia congênita severa (Síndrome de Kostmann) com constituição genética anormal.
Como usar
Uma ou duas doses de Granulokine por dia devem ser aplicadas por via subcutânea ou intravenosa. A aplicação de Granulokine deve ser feita ou supervisionada por um médico com experiência no uso desse tipo de medicamento.
Quimioterapia citotóxica estabelecida
A dose recomendada de Granulokine é de 0,5 MU/kg/dia (5 mcg/kg/dia). O conteúdo de uma seringa ou um único frasco de Granulokine com 30 milhões de unidades fornece, portanto, a dose diária necessária para um paciente com 60 kg. A primeira dose de Granulokine não deve ser administrada em menos de 24 horas após a quimioterapia citotóxica.
Espera-se que a duração necessária do tratamento para que o número dos neutrófilos retorne aos valores normais seja de até 14 dias, dependendo do tipo, da dose e do esquema quimioterápico citotóxico utilizado.
Em pacientes sob quimioterapia citotóxica, uma elevação transitória do número de neutrófilos é tipicamente observada 1 a 2 dias após iniciado o tratamento com Granulokine. Contudo, é recomendado manter a aplicação diária até que você recupere os valores normais do número de neutrófilos.
Pacientes tratados com terapia mieloablativa seguida de transplante da medula óssea
A dose inicial recomendada de Granulokine é de 1,0 MU/kg/dia (1 milhão de unidades por quilo de peso por dia) (10 mcg/kg/dia) (10 microgramas por quilo de peso por dia) administrado em 30 minutos ou 24 horas por infusão intravenosa (na veia), ou 1,0 MU/kg/dia (10 mcg/kg/dia) (mesma dose) administrado em 24 horas, de maneira contínua, por via subcutânea (abaixo da pele).
Granulokine deve ser diluído em 20 mL de solução glicosada a 5% (soro glicosado 5%).
A primeira dose de Granulokine não deve ser administrada nas 24 horas seguintes à quimioterapia citotóxica, mas sim dentro das 24 horas após a infusão da medula óssea. A eficácia e a segurança da administração de Granulokine por mais 28 dias neste contexto ainda não foram estabelecidas.
Granulokine tem demonstrado eficácia e boa tolerabilidade neste contexto em doses até 70 mcg/kg/dia.
Uso em idosos
Estudos clínicos com Granulokine incluíram pequeno número de pacientes idosos. Estudos especiais não foram realizados nesse grupo e, portanto, recomendações específicas de dosagem não podem ser feitas.
Insuficiência renal ou hepática
Não foram realizados estudos com Granulokine em pacientes com prejuízo severo das funções hepática e renal.
Portanto, seu uso nestes pacientes não pode ser recomendado.
O profissional da saúde saberá como preparar o medicamento.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que fazer quando eu me esquecer de usar Granulokine?
Seu médico saberá quando deverá ser aplicada a próxima dose de Granulokine.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Geral
Em pacientes tratados com filgrastim, foi reportada alergia, incluindo reações anafiláticas (um tipo de reação alérgica grave), que ocorrem no início ou durante o tratamento.
Os pacientes com alergia clinicamente significativa devem parar permanentemente o tratamento com filgrastim.
Os pacientes com histórico de alergia ao filgrastim ou ao pegfilgrastim não devem utilizá-lo.
Existem trabalhos publicados na literatura médica relatando que um número elevado de glóbulos brancos no sangue pode piorar a evolução de pacientes com anemia falciforme. Se você é portador de anemia falciforme, precisa informar ao seu médico, pois serão necessários exames clínicos e laboratoriais adicionais.
É possível que o Granulokine provoque aumento das crises de falcização.
A contagem de plaquetas deve ser cuidadosamente monitorada, pois trombocitopenia (redução do número de plaquetas no sangue) foi frequentemente relatada em pacientes em tratamento com Granulokine.
Se você é portador de osteoporose ou osteopenia, poderá haver necessidade de acompanhamento com exames periódicos de densitometria se você for tratado com Granulokine durante mais do que 6 meses.
Se você já foi submetido a radio e/ou quimioterapia extensas ou apresenta infiltração da medula óssea pelo tumor, pode ser que já exista diminuição das células da medula responsáveis pela produção de neutrófilos, os progenitores mieloides.
Se isso ocorrer, o aumento de neutrófilos com o uso do Granulokine poderá não ser o esperado.
O volume do baço deve ser avaliado regularmente por meio de palpação abdominal ou ultrassom para detecção de aumentos anormais.
Granulokine contém sorbitol como excipiente numa concentração de 50 mg/mL. É improvável que o tratamento apenas com Granulokine resulte em toxicidade clinicamente relevante para indivíduos sensíveis.
No entanto, em casos de intolerância hereditária à frutose, aconselha-se cautela.
Ainda não se conhece o efeito de Granulokine sobre a doença do enxerto versus hospedeiro (GvHD).
Início de febre ou sinais pulmonares (como tosse, falta de ar) em associação a sinais radiológicos de infiltrados pulmonares e piora da função pulmonar, pode corresponder a sinais preliminares da síndrome da angústia respiratória aguda (SARA), um quadro pulmonar grave. Em tais circunstâncias, seu médico deverá recomendar que você pare de usar Granulokine, e o tratamento apropriado para essa síndrome deve ser iniciado.
Glomerulonefrite (inflamação nos rins) tem sido relatada em pacientes que receberam tratamento com filgrastim e pegfilgrastim.
Geralmente, eventos de glomerulonefrite são resolvidos após redução da dose ou descontinuação do uso de filgrastim e pegfilgrastim. O monitoramento através de exames de urina deve ser feito conforme orientação médica.
Efeitos sobre a capacidade de dirigir e operar máquinas
Não foram relatados efeitos sobre a capacidade de dirigir e operar máquinas.
Até o momento, não há informações de que Granulokine (filgrastim) possa causar doping. Em caso de dúvidas, consulte o seu médico.
Gravidez e amamentação
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
A segurança do Granulokine não foi estabelecida em mulheres grávidas. Existem trabalhos na literatura médica demonstrando que pode haver passagem de filgrastim da gestante para o feto através da placenta.
Estudos em animais de laboratório mostraram que pode haver toxicidade para a reprodução.
Durante a gestação, seu médico deverá avaliar o possível risco do uso de Granulokine para o feto, com relação aos benefícios terapêuticos esperados.
Não se sabe se o Granulokine passa para o leite materno. Granulokine não é recomendado para mulheres que estejam amamentando.
Não foram estabelecidas a segurança e a eficácia de Granulokine em crianças.
Testes laboratoriais
É recomendado o monitoramento do hemograma completo durante o tratamento com filgrastim.
Interações medicamentosas
A segurança e a eficácia do Granulokine administrado no mesmo dia da quimioterapia tóxica para a medula óssea não foram estabelecidas.
O uso de Granulokine não é recomendado no período de 24 horas antes até 24 horas após quimioterapia.
Evidências preliminares em um número pequeno de pacientes tratados concomitantemente com Granulokine e 5-fluorouracil indicam que a gravidade da neutropenia pode ser exacerbada.
Embora a interação com lítio, que também promove a liberação de neutrófilos, não tenha sido formalmente investigada, não há evidências de que seja prejudicial.
Possíveis interações com outros fatores de crescimento hematopoiéticos e citocinas ainda não foram investigadas.
Imagem óssea
A atividade aumentada da medula óssea para produção de células sanguíneas em resposta à terapia com fator de crescimento tem sido associada a alterações temporárias de imagens ósseas, o que deve ser considerado na interpretação dos resultados de exames de imagem.
Pode ocorrer alteração temporária de imagens ósseas em exames de imagem associada ao uso de Granulokine.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Em pacientes com câncer
Experiência pós-comercialização
Composição
Cada frasco-ampola de 1 mL ou seringa preenchida de 0,5 mL contém:
Filgrastim - 30 milhões de unidades (MU) – 300 mcg.
Excipientes: Hidróxido de sódio, ácido acético glacial, sorbitol, polissorbato 80 e água para injeção.
Filgrastim é produzida em cepa de laboratório de Escherichia coli manipulada geneticamente mediante inclusão de um gene para o fator estimulador de colônias de granulócitos.
Superdosagem
Não foram estabelecidos os efeitos de Granulokine em caso de superdosagem. Doses de até 138 mcg/kg/dia foram administradas sem efeitos tóxicos. A descontinuação da terapia com Granulokine,em geral, resulta na diminuição de 50% dos neutrófilos circulantes dentro de um a dois dias, com retorno aos níveis normais em um a sete dias.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Não foram ainda estabelecidas a segurança e a eficácia de Filgrastim (substância ativa) quando administrado no mesmo dia que a quimioterapia citotóxica mielossupressora. Tendo em vista a sensibilidade da rapidez da divisão das células mieloides à quimioterapia citotóxica mielossupressora, a utilização de Filgrastim (substância ativa) não é recomendada no período que decorre entre as 24 horas anteriores e às 24 horas posteriores à quimioterapia. Evidências preliminares obtidas a partir de um grupo pequeno de pacientes tratados concomitantemente com Filgrastim (substância ativa) e 5-fluoruracila indicam que a gravidade da neutropenia pode ser exacerbada.
Nos estudos clínicos conduzidos não foram investigadas as possíveis interações do Filgrastim (substância ativa) com outros fatores de crescimento hematopoiéticos e com citocinas.
Considerando que o lítio promove a liberação de neutrófilos, é provável que possa potencializar o efeito de Filgrastim (substância ativa). No entanto, esta interação não foi formalmente investigada e não existe qualquer evidência de que tal interação possa ser prejudicial.
Ação da Substância
Resultados de eficácia
A eficácia e segurança clínica do Filgrastim (substância ativa) foram avaliadas em três estudos clínicos fase III.
Câncer de mama
Estudo clínico fase III, multinacional, multicêntrico, randomizado e controlado de comparação entre Filgrastim (substância ativa) vs. comparador vs. placebo, conduzido em 348 pacientes com câncer de mama tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 4 ciclos de docetaxel 75mg/m2 IV e doxorrubicina 60mg/m2 IV no 1° dia.
Câncer de pulmão
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em 240 pacientes com câncer de pulmão tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 6 ciclos com derivados de platina. O regime de terapia mais comum utilizado foi cisplatina + etoposídeo ou gencitabina em 49% e 15% dos pacientes, respectivamente. Outros regimes incluíram cisplatina + vinorelbina e combinações de carboplatina + vinorelbina, etoposídeo, gencitabina ou paclitaxel.
Linfomas Não-Hodgkin
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em pacientes com linfoma não-Hodgkin. Durante o estudo, os pacientes estavam sob tratamento quimioterápico, de no máximo 6 ciclos, com ciclofosfamida, doxorrubicina, vincristina e prednisona (CHOP). Tratamento adicional com rituximabe (anticorpo monoclonal anti-CD20) foi utilizado a critério de médico.
Os resultados de eficácia basearam-se nas seguintes determinações:
Característias Farmacológicas
Grupo Farmacoterapêutico:
Imunoestimuladores, Fatores Estimuladores de Colônias.
Código ATC: L03AA02.
Propriedades farmacodinâmicas
Filgrastim (substância ativa), é uma glicoproteína que regula a produção e a liberação de neutrófilos funcionais da medula óssea. O Filgrastim (substância ativa) provoca, em um período de 24 horas, um aumento significativo da contagem de neutrófilos no sangue periférico, com pequenos aumentos de monócitos. Em alguns pacientes com neutropenia crônica grave, o Filgrastim (substância ativa) pode também induzir um pequeno aumento do número de eosinófilos e basófilos circulantes em relação aos valores basais; alguns destes pacientes podem apresentar eosinofilia ou basofilia antes do tratamento. Elevações nas contagens de neutrófilos são dosedependentes nas doses recomendadas. Os neutrófilos produzidos em resposta ao Filgrastim (substância ativa) apresentam função normal ou aumentada, conforme demonstrado em testes de funções fagocítica e quimiostática. Após o término do tratamento com Filgrastim (substância ativa), a contagem de neutrófilos circulantes diminui em 50% dentro de 1 a 2 dias, e para níveis normais dentro de 1 a 7 dias.
O uso de Filgrastim (substância ativa) em pacientes submetidos à quimioterapia citotóxica leva a reduções significativas na incidência, gravidade e duração da neutropenia e da neutropenia febril. O tratamento com Filgrastim (substância ativa) reduz significativamente a duração da neutropenia febril, a utilização de antibióticos e o tempo de hospitalização após quimioterapia de indução para leucemia mieloide aguda ou terapia mieloablativa seguida de transplante de medula óssea. A incidência de relatos de febre e infecções não foi reduzida em nenhum destes quadros clínicos. A duração da febre não diminuiu nos pacientes que receberam terapia mieloablativa seguida de transplante de medula óssea.
A utilização de Filgrastim (substância ativa), isoladamente ou após quimioterapia, mobiliza as células progenitoras hematopoiéticas para o sangue periférico. Estas células progenitoras do sangue periférico (CPSP) autólogas podem ser coletadas e infundidas após terapia citotóxica de dose elevada, em substituição ou em adição ao transplante de medula óssea. A infusão de CPSP acelera a recuperação hematopoiética, reduzindo a duração do risco de complicações hemorrágicas e a necessidade de transfusões de plaquetas.
Os receptores de CPSP alogênicas mobilizadas com Filgrastim (substância ativa) tiveram uma recuperação hematológica significativamente mais rápida, levando a uma diminuição significativa do tempo de recuperação de plaquetas quando comparado com o transplante alogênico de medula óssea.
Um estudo Europeu retrospectivo que avaliou o uso de fator estimulador de colônias de granulócitos (G-CSF) após transplante alogênico de medula óssea em pacientes com leucemia aguda sugeriu risco aumentado de doença do enxerto contra hospedeiro (graft-versus-host disease - GVHD), mortalidade relacionada ao tratamento (TRM) e mortalidade quando o G-CSF foi administrado. Outro estudo retrospectivo internacional, conduzido em pacientes com leucemias mieloides aguda e crônica, não foi observado risco de GVHD, TRM e mortalidade. Uma metanálise de estudos de transplantes alogênicos, incluindo resultados de nove estudos randomizados prospectivos, 8 estudos retrospectivos e 1 estudo de caso-controle, não detectou efeito sobre o risco de GVHD aguda, GVHD crônica ou mortalidade relacionada ao tratamento.
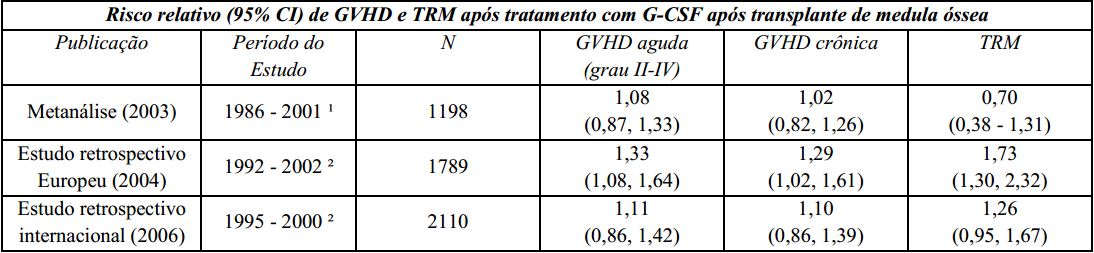 GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
TRM: mortalidade relacionada ao tratamento;
G-CSF: fator estimulador de colônias de granulócitos;
¹ A análise incluiu estudos envolvendo transplante de medula óssea durante este período; alguns estudos utilizaram GM-CSF (fator estimulador de colônias de macrófagos e granulócitos);
² A análise incluiu pacientes recebendo transplante de medula óssea durante este período.
Previamente ao transplante de CPSP alogênicas, a utilização de Filgrastim (substância ativa) para a mobilização de CPSP em doadores saudáveis permite um cultivo de 4 x 106 células CD34+ /kg de peso corporal do receptor na maioria dos doadores, após duas leucaféreses. Para estes doadores saudáveis é dada uma dose de 10 mcg/kg/dia, administrada por via subcutânea durante 4 a 5 dias consecutivos.
O uso de Filgrastim (substância ativa) em pacientes com neutropenia crônica grave (neutropenia congênita grave, neutropenia cíclica e neutropenia idiopática), induz um aumento sustentado das contagens absolutas de neutrófilos no sangue periférico e uma redução das infecções e eventos relacionados.
O Filgrastim (substância ativa), assim como com outros fatores de crescimento hematopoiéticos, demonstrou in vitro propriedades estimuladoras sobre as células endoteliais humanas.
Propriedades Farmacocinéticas
A depuração de Filgrastim (substância ativa), tanto após administração subcutânea como intravenosa, demonstrou seguir uma farmacocinética de primeira ordem. A meia-vida de eliminação sérica do Filgrastim (substância ativa) é de aproximadamente 3,5 horas, com uma taxa de depuração de aproximadamente 0,6mL/min/kg. A infusão contínua com Filgrastim (substância ativa) durante um período de até 28 dias, em pacientes em recuperação de transplante autólogo de medula óssea, não apresentou evidência de acumulação do fármaco e de meias-vidas comparáveis. Há uma correlação linear positiva entre a dose e a concentração sérica de Filgrastim (substância ativa), se administrado por via intravenosa ou por via subcutânea. Após administração subcutânea das doses recomendadas, as concentrações séricas mantiveramse acima dos 10 ng/mL, durante 8 a 16 horas. O volume de distribuição no sangue é aproximadamente de 150mL/kg.
Em pacientes com câncer, o perfil farmacocinético do Filgrastim (substância ativa) e do medicamento comparador foi comparável após administração única e após administrações múltiplas por via subcutânea.
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram risco especial para humanos com base em estudos convencionais de segurança farmacológica, genotoxicidade e tolerância local.
Os dados pré-clínicos de estudos convencionais de toxicidade de doses múltiplas demonstraram os efeitos farmacológicos esperados, incluindo aumento da contagem leucocitária, hiperplasia mieloide da medula óssea, hematopoiese extramedular e dilatação esplênica.
Não foram observados efeitos sobre a fertilidade de ratos do sexo masculino e feminino, assim como sobre a gestação em ratos. Não existe evidência a partir dos estudos conduzidos em ratos e coelhos de que o Filgrastim (substância ativa) seja teratogênico. Foi observada incidência aumentada de perda embrionária em coelhos, porém não foi observada má formação.
Cuidados de Armazenamento
Granulokine deve ser armazenado sob refrigeração, entre (2°C e 8°C).
A exposição acidental a temperaturas congelantes não afeta desfavoravelmente a estabilidade do produto.
O profissional da saúde saberá como armazenar o medicamento depois de aberto.
Número de lote e datas de fabricação e validade: Vide embalagem.
Após preparo, manter sob refrigeração de (2°C a 8°C) por até 24 horas.
Soluções diluídas de Granulokine não devem ser preparadas mais de 24 horas antes da administração.
Para sua segurança, mantenha o medicamento na embalagem original.
Característica física
A solução de Granulokine é límpida e incolor.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartadosbno esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS-1.0244.0006
Farm. Resp.:
Monica Carolina Dantas Pedrazzi CRF-SP 30.103
Importado por:
Amgen Biotecnologia do Brasil Ltda.
Rua Patrícia Lúcia de Souza, 146
Taboão da Serra – SP
CNPJ: 18.774.815/0001-93
Fabricado por:
F. Hoffmann-La Roche Ltd, Kaiseraugst, Suíça
Embalado por:
Amgen Europe B.V., Breda, Holanda
Sac: 0800 264 0800
Uso restrito a hospitais.
Venda sob prescrição médica.
informações complementares
| Fabricante |
| AMGEN |
| Princípio ativo |
| Filgrastim |
| Categoria do medicamento |
| Medicamentos Especiais |
GRANULOKINE - 30 MU 300 MCG SOLUÇÃO INJETÁVEL 1 SERINGA PREENCHIDA 0,5 ML É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
