- Home
- Medicamentos
- Medicamentos Especiais
- Mimpara 30Mg Frasco 30 Comprim...
- Bula de Mimpara 30Mg Frasco 30 Comprim...
para o que é indicado e para que serve?
Para que serve Mimpara é utilizado para o tratamento do hiperparatiroidismo secundário em pacientes com doença grave no rim, que precisam de diálise para limpar seu sangue de produtos que são normalmente excretados pelos rins.Continue lendo...
ofertas de Mimpara 30Mg Frasco 30 Comprimidos Revestidos

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Mimpara é utilizado para o tratamento do hiperparatiroidismo secundário em pacientes com doença grave no rim, que precisam de diálise para limpar seu sangue de produtos que são normalmente excretados pelos rins.
Utilizado para o tratamento do hiperparatiroidismo secundário em pacientes com doença grave no rim, que precisam de diálise para limpar seu sangue de produtos que são normalmente excretados pelos rins.
Contraindicação
Não utilize Mimpara se você é alérgico (hipersensível) ao cinacalcete ou a qualquer um dos componentes da fórmula do produto. Este medicamento é contraindicado para menores de 18 anos devido à insuficiência de dados de segurança e eficácia.
Não utilize se você é alérgico (hipersensível) ao cinacalcete ou a qualquer um dos componentes da fórmula do produto. Este medicamento é contraindicado para menores de 18 anos devido à insuficiência de dados de segurança e eficácia.
Como usar
Tome Mimpara sempre de acordo com as instruções do seu médico. Ele dirá qual a quantidade de Mimpara que você deverá tomar.
Hiperparatiroidismo secundário
A dose inicial usual de Mimpara é de 30 mg (um comprimido revestido) uma vez ao dia. O seu médico irá colher amostras de sangue regularmente para verificar como você está respondendo ao tratamento com Mimpara e, se necessário, ajustará sua dose a fim de controlar seus níveis de hormônio paratiroideano, cálcio e fosfato. Uma vez que sua condição estiver sob controle, seu médico continuará a checar regularmente o seu sangue e, posteriormente, sua dose poderá ser ajustada a fim de manter o controle dos níveis de hormônio paratiroideano, cálcio e fosfato em longo prazo.
Como usar
Mimpara deve ser tomado por via oral, com alimento ou logo após as refeições. Os comprimidos devem ser tomados inteiros e não devem ser divididos.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico. Este medicamento não pode ser partido, aberto ou mastigado.
Precauções
Efeitos na habilidade de dirigir e operar máquinas
Não foram conduzidos estudos sobre os efeitos de MIMPARA nas habilidades de dirigir e de operar máquinas. Foram relatadas tontura e crises epilépticas em pacientes que tomaram MIMPARA. Caso isto aconteça com você, suas habilidades de dirigir e operar máquinas poderão ser afetadas.
Informação importante sobre alguns ingredientes de MIMPARA Se você possui intolerância a algum açúcar (como a lactose, por exemplo), contate seu médico antes de tomar este medicamento.
Reações Adversas
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR Junto com os efeitos necessários para seu tratamento, os medicamentos podem causar efeitos não desejados Apesar de nem todos estes efeitos colaterais ocorrerem, você deve procurar atendimento médico caso algum deles ocorra Se você começar a sentir dormência ou formigamento ao redor da boca, dor muscular ou câimbras e convulsão, você deve comunicar ao seu médico imediatamente Estes podem ser sinais que seus níveis de cálcio estão muito baixos (hipocalcemia) Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): ? náusea e vômito, estas reações adversas são normalmente muito suaves e passageiras Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): ? tontura ? parestesia (sensação de dormência ou formigamento) ? anorexia (perda ou diminuição de apetite) ? mialgia (dor muscular) ? astenia (fraqueza) ? erupção cutânea ? redução dos níveis de testosterona ? nível elevado de potássio no sangue (hipercalemia) ? reações alérgicas (hipersensibilidade) ? dor de cabeça ? crises epilépticas (convulsão ou ataque) ? pressão sanguínea baixa (hipotensão) ? infecção respiratória superior ? dificuldades em respirar (dispnéia) ? tosse ? indigestão (dispepsia) ? diarréia ? dor abdominal, dor abdominal – superior ? constipação ? espasmo muscular ? nível baixo de cálcio no sangue (hipocalcemia) Frequência não conhecida: ? urticária (coceira); ? inchaço no rosto, lábios, boca, língua ou garganta que pode causar dificuldade na deglutição ou respiração (angioedema); e ? Batimentos incomuns do coração, rápidos ou palpitações, que possam estar associados com níveis baixos de cálcio no sangue (prolongamento do QT e arritimia ventricular secundária à hipocalcemia) MIMPARA diminui os seus níveis de cálcio Se os níveis de cálcio se tornarem muito baixos, você pode ficar com hipocalcemia Os sinais de hipocalcemia incluem: dormência ou formigamento ao redor da boca, dores musculares ou câimbras e convulsão Se tiver qualquer um destes sintomas, você deve procurar seu médico imediatamente Após tomar MIMPARA, um número muito pequeno de pacientes com insuficiência cardíaca apresentou piora de sua condição e/ou redução da pressão sanguínea (hipotensão) Crianças e adolescentes - O uso de MIMPARA em crianças e adolescentes não foi estabelecido Um desfecho fatal foi relatado em um estudo clínico com adolescente, um paciente com nível muito baixo de cálcio no sangue (hipocalcemia) 5Se algum desses efeitos não desejados se tornarem sérios ou se você notar algum efeito não listado nesta bula, por favor, contate seu médico ou farmacêutico Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos Nesse caso, informe ao seu médico Informe também a empresa através da Central de Atendimento ao Consumidor 9
População Especial
Uso Durante a Gravidez e Amamentação
Se você está grávida, amamentando ou pretende engravidar, converse com o seu médico ou farmacêutico antes de tomar qualquer medicamento.
MIMPARA não foi testado em mulheres grávidas. Em caso de gravidez, seu médico decidirá se irá modificar seu tratamento, pois MIMPARA poderá prejudicar o feto.
Não é sabido se MIMPARA é excretado no leite humano. O seu médico irá decidir pela interrupção da amamentação ou do tratamento com MIMPARA.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Uso em Crianças
A segurança e eficácia não foram estabelecidas em pacientes com menos de 18 anos. MIMPARA é indicado para utilização em adultos com mais de 18 anos.
Uso em Idosos
Não existem diferenças clinicamente relevantes na farmacocinética do cinacalcete devido à idade.
Riscos
Se você é alérgico (hipersensível) ao cinacalcete ou a qualquer um dos componentes de MIMPARA (veja “Composição”).
Este medicamento é contraindicado para menores de 18 anos devido à insuficiência de dados de segurança e eficácia.
Composição
COMPOSIÇÃO Cada comprimido revestido de 30 mg contém: cloridrato de cinacalcete 33,06 mg (equivalente a 30 mg de cinacalcete) Excipientes: amido, celulose microcristalina, povidona, crospovidona, dióxido de silício, estearato de magnésio, cera de carnaúba e corantes (contém lactose) Cada comprimido revestido de 60 mg contém: cloridrato de cinacalcete 66,12 mg (equivalente a 60 mg de cinacalcete) Excipientes: amido, celulose microcristalina, povidona, crospovidona, dióxido de silício, estearato de magnésio, cera de carnaúba e corantes (contém lactose) Se você tiver qualquer dúvida relacionada ao uso deste medicamento, questione seu médico ou farmacêutico Mantenha esta bula com o medicamento Você pode precisar lê-la novamente INFORMAÇÕES AO PACIENTE 1
“COMPOSIÇÃO”) 2Este medicamento é contra-indicado para menores de 18 anos devido à insuficiência de dados de segurança e eficácia 4
Superdosagem
Este medicamento deve ser usado somente na dose recomendada.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Sintomas
A superdosagem de MIMPARA pode conduzir à hipocalcemia. Os sinais de hipocalcemia incluem dormência ou formigamento ao redor da boca, dores musculares ou câimbras e crise epiléptica.
Interação Medicamentosa
Efeito de outros medicamentos sobre Cloridrato de Cinacalcete (substância ativa)
O Cloridrato de Cinacalcete (substância ativa) é metabolizado em parte pela enzima CYP3A4. A administração concomitante de 200mg de cetoconazol, um potente inibidor da CYP3A4, duas vezes ao dia, causou um aumento aproximado de 2 vezes nos níveis de Cloridrato de Cinacalcete (substância ativa). Pode ser necessário um ajuste da dose do medicamento, se o paciente iniciar ou suspender tratamento com um potente inibidor (ex.: cetoconazol, itraconazol, telitromicina, voriconazol, ritonavir) ou indutor (ex.: rifampicina) desta enzima.
Dados in vitro indicam que Cloridrato de Cinacalcete (substância ativa) é, em parte, metabolizado pela CYP1A2. O cigarro induz a CYP1A2; foi observado que a depuração de Cloridrato de Cinacalcete (substância ativa) é 36-38% superior em fumantes que em não fumantes. O efeito de inibidores da CYP1A2 (ex.: fluvoxamina, ciprofloxacina) nos valores plasmáticos de Cloridrato de Cinacalcete (substância ativa) não foi estudado. O ajuste de dose pode ser necessário em pacientes que iniciam ou deixam de fumar ou quando se inicia ou se interrompe um tratamento concomitante com potentes inibidores da CYP1A2.
Efeito de Cloridrato de Cinacalcete (substância ativa) em outros medicamentos
Ação da Substância
Resultados de eficácia
Hiperparatiroidismo (HPT) secundário
Foram conduzidos três ensaios clínicos, controlados por placebo, duplo-cegos, com duração de 6 meses, em pacientes com ESRD, com HPT secundário não controlado, submetidos a procedimento de diálise (n=1.136). As características demográficas basais foram representativas da população de pacientes submetidos à diálise com HPT secundário. As concentrações de PTH intacto (PTHi) basais médias, nos três estudos, foram 733 e 683 pg/ml (77,8 e 72,4 pmol/l) para os grupos de Cloridrato de Cinacalcete (substância ativa) e placebo, respectivamente. Sessenta e seis por cento (66%) dos pacientes recebiam análogos de vitamina D, no início do estudo, e > 90% recebiam quelantes de fósforo. Foram observadas reduções significativas no PTHi, no produto cálcio-fósforo séricos (Ca x P), no cálcio e no fósforo, nos pacientes tratados com Cloridrato de Cinacalcete (substância ativa), comparado com os tratados com placebo, recebendo terapia padrão, e os resultados foram consistentes nos três estudos. Em cada um dos estudos, os desfechos primários (proporção de pacientes com um PTHi ? 250 pg/ml (? 26,5 pmol/l)) foram alcançados por 41%, 46 % e 35% dos pacientes que receberam Cloridrato de Cinacalcete (substância ativa), comparados com 4%, 7% e 6% dos que receberam placebo. Aproximadamente 60% dos pacientes tratados com Cloridrato de Cinacalcete (substância ativa) atingiram uma redução ? 30% nos níveis de PTHi e este efeito foi consistente em todo o espectro de níveis basais de PTHi. As reduções médias no produto Ca x P, cálcio e fósforo foram, respectivamente, de 14%, 7% e 8%.
Foram mantidas reduções no PTHi e Ca x P, até os 12 meses de tratamento. O Cloridrato de Cinacalcete (substância ativa) diminuiu os níveis de PTHi , Ca x P, do cálcio e fósforo, independentemente dos níveis basais de PTHi ou Ca x P, da modalidade de diálise (diálise peritoneal versus hemodiálise), da duração da diálise e da administração ou não de análogos de vitamina D.
As reduções do PTH foram associadas a reduções não significativas dos marcadores do metabolismo ósseo (fosfatase alcalina óssea, N-telopeptídeo, turnover ósseo e fibrose óssea). Na análise post-hoc de dados conjuntos dos ensaios clínicos com duração de 6 e 12 meses, as estimativas de Kaplan-Meier de fratura óssea e paratiroidectomia foram significativamente mais baixas no grupo Cloridrato de Cinacalcete (substância ativa) comparadas com o grupo controle.
Estudos investigativos em pacientes com doença renal crônica (DRC) e HPT secundário não inseridos em programa de diálise indicaram que Cloridrato de Cinacalcete (substância ativa) reduz os níveis de PTH para valores semelhantes aos dos pacientes em programa de diálise com ESRD e HPT secundário. No entanto, a eficácia, segurança, dose ótima e objetivos do tratamento não foram estabelecidos para o tratamento de pacientes com insuficiência renal, em fase pré-dialítica. Esses estudos demonstraram que os pacientes com DRC, não submetidos à diálise, tratados com Cloridrato de Cinacalcete (substância ativa) têm um risco aumentado para desenvolver hipocalcemia comparado com os pacientes tratados com Cloridrato de Cinacalcete (substância ativa) com ESRD, o que pode ser devido a níveis basais de cálcio mais baixos e/ou a presença de função renal residual.
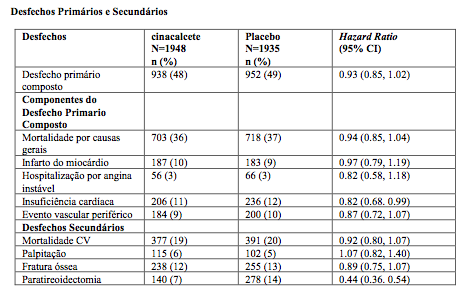
EVOLVE (EValuation Of Cinacalcet HCl Therapy to Lower CardioVascular Events) foi um estudo clínico randomizado, duplo-cego avaliando cloridrato de Cloridrato de Cinacalcete (substância ativa) versus placebo para a redução do risco de mortalidade por causas gerais e eventos cardiovasculares em 3.883 pacientes com HPT secundário e DRC recebendo diálise. O estudo não alcançou os objetivos primários de demonstrar uma redução no risco de morte por causas gerais ou eventos cardiovasculares incluindo infarto do miocárdio, hospitalização por angina instável, insuficiência cardíaca ou evento vascular periférico (HR 0,93; 95% CI 0,85, 1,02; p = 0,112). Após ajuste para as características basais, numa análise secundária, o HR do desfecho do composto primário foi 0,88; 95% CI: 0,79, 0,97.
Características farmacológicas
Farmacodinâmica
Grupo farmacoterapêutico - Homeostase cálcica , agentes antiparatiróide.
Mecanismo de ação
O receptor sensível ao cálcio da superfície celular da glândula paratiróide é o mais importante regulador da secreção de PTH. O Cloridrato de Cinacalcete (substância ativa) é um agente calcimimético que reduz diretamente os níveis de PTH por aumentar a sensibilidade do receptor ao cálcio extracelular. A redução do PTH está associada a uma diminuição concomitante dos níveis séricos de cálcio.
As reduções dos níveis de PTH correlacionam-se com as concentrações de Cloridrato de Cinacalcete (substância ativa). Logo após a ingestão, o PTH começa a diminuir até ao valor mais baixo, aproximadamente 2 a 6 horas após a administração, correspondendo à concentração plasmática máxima (Cmax) de Cloridrato de Cinacalcete (substância ativa). Daí em diante, como os níveis de Cloridrato de Cinacalcete (substância ativa) começam a diminuir, os níveis de PTH aumentam até 12 horas após a administração e, a partir desse ponto, a supressão do PTH mantém-se aproximadamente constante até ao fim do intervalo da dose diária. Os níveis de PTH, nos ensaios clínicos com cloridrato de Cloridrato de Cinacalcete (substância ativa), foram medidos no final do intervalo entre administrações.
Após ser atingido o estado estacionário, as concentrações séricas de cálcio mantêm-se constantes ao longo do intervalo entre as administrações.
Farmacocinética
Após a administração oral do medicamento, a concentração plasmática máxima de Cloridrato de Cinacalcete (substância ativa) é atingida em aproximadamente 2 a 6 horas.
Baseada na comparação de estudos, a biodisponibilidade absoluta de Cloridrato de Cinacalcete (substância ativa), em pacientes em jejum, foi estimada em 20-25%. A administração de cloridrato de Cloridrato de Cinacalcete (substância ativa) com alimentos resulta em um aumento aproximado de 50-80% na biodisponibilidade do Cloridrato de Cinacalcete (substância ativa). Os aumentos na concentração plasmática de Cloridrato de Cinacalcete (substância ativa) são semelhantes independentemente do teor de gordura da refeição.
Depois da absorção, as concentrações de Cloridrato de Cinacalcete (substância ativa) diminuem de um modo bifásico com uma meia-vida inicial de aproximadamente 6 horas e uma meia-vida final de 30 a 40 horas. Os níveis do fármaco, no estado estacionário, são alcançados no prazo de 7 dias com uma acumulação mínima. A AUC e a Cmax de Cloridrato de Cinacalcete (substância ativa) aumentam de forma aproximadamente linear dentro da variação de dose entre 30 a 180 mg uma vez por dia. Para doses superiores a 200 mg, a absorção foi saturada, provavelmente devido a uma solubilidade pobre. A farmacocinética do Cloridrato de Cinacalcete (substância ativa) não se altera ao longo do tempo. O volume de distribuição é elevado (aproximadamente 1.000 litros), indicando uma distribuição extensa. O Cloridrato de Cinacalcete (substância ativa) liga-se às proteínas plasmáticas em aproximadamente 97% e distribui-se de forma mínima nos glóbulos vermelhos.
O Cloridrato de Cinacalcete (substância ativa) é metabolizado por várias enzimas, predominantemente CYP3A4 e CYP1A2 (a contribuição da CYP1A2 não foi clinicamente caracterizada). Os metabólitos circulantes mais importantes são inativos.
Baseado em dados in vitro, Cloridrato de Cinacalcete (substância ativa) é um forte inibidor da CYP2D6, mas não é um inibidor de outras enzimas CYP em concentrações alcançadas clinicamente, incluindo CYP1A2, CYP2C8, CYP2C9, CYP2C19 e CYP3A4 e nem é um indutor das CYP1A2, CYP2C19 e CYP3A4.
Após a administração de uma dose radiomarcada de 75 mg em voluntários saudáveis, Cloridrato de Cinacalcete (substância ativa) foi rápida e extensamente metabolizado por oxidação seguida de conjugação. A excreção renal de metabólitos foi a via prevalente de eliminação de radioatividade. Aproximadamente 80% da dose foi recuperada na urina e 15% nas fezes.
Populações especiais
Mensagens de Alerta
Converse com seu médico, farmacêutico ou enfermeiro antes de utilizar Mimpara.
Antes de iniciar a utilização de MIMPARA, informe ao seu médico se você tem ou já teve qualquer doença, incluindo:
- crises epilépticas (às vezes chamada de ataque ou convulsão): o risco de ter crise epiléptica é maior em pessoas que tiveram epilepsia anteriormente. Diminuir demasiadamente o nível de cálcio também pode aumentar o risco de crise. Se você tiver uma crise, deve comunicar ao seu médico imediatamente;
- problemas no fígado;
- insuficiência cardíaca.
Níveis baixos de cálcio podem afetar seu ritmo cardíaco. Enquanto fizer uso de Mimpara, informe seu médico se você sentir batimentos incomuns no coração, rápidos ou palpitações, se você tem problemas no ritmo cardíaco, ou se você faz uso de medicamentos que conhecidamente possam causar problemas no ritmo cardíaco.
Durante o tratamento com MIMPARA, informe ao seu médico se você começar ou parar de fumar enquanto toma MIMPARA, pois este fato pode afetar o modo de atuação de MIMPARA.
Dizeres Legais
Geisa Acetto Cavalari CRF-SP nº 33.509.
informações complementares
| Fabricante |
| AMGEN |
| Princípio ativo |
| Cloridrato De Cinacalcete |
| Categoria do medicamento |
| Medicamentos Especiais |
MIMPARA 30MG FRASCO 30 COMPRIMIDOS REVESTIDOS É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
