- Home
- Medicamentos
- Medicamentos Especiais
- Ofev - 100 Mg 60 Cápsulas Mole...
- Bula de Ofev - 100 Mg 60 Cápsulas Mole...
para o que é indicado e para que serve?
Para que serve Ofev é indicado para o tratamento e retardo da progressão da fibrose pulmonar idiopática.Continue lendo...
ofertas de Ofev - 100 Mg 60 Cápsulas Mole

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Ofev é indicado para o tratamento e retardo da progressão da fibrose pulmonar idiopática.
Como o Ofev funciona?
O nintedanibe atua inibindo a proliferação, migração e transformação de fibroblastos, que são células envolvidas no desenvolvimento da fibrose pulmonar idiopática. Desta forma, atua tratando e diminuindo a progressão da doença.
Contraindicação
Você não deve usar Ofev se tiver alergia conhecida ao nintedanibe, amendoim, soja ou a qualquer excipiente do produto e/ou durante a gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Como usar
O tratamento com Ofev deve ser iniciado por médicos com experiência no diagnóstico e tratamento da fibrose pulmonar idiopática (FPI).
A cápsula de Ofev deve ser ingerida com água e, preferencialmente, junto com alimentos.
Este medicamento não deve ser partido, aberto ou mastigado.
A dose recomendada é de 150 mg duas vezes ao dia, administrados em intervalos de 12 horas.
Ajustes de dose
Além do tratamento sintomático, se for o caso, o manejo dos eventos adversos de Ofev pode incluir a redução da dose ou a interrupção temporária de Ofev. O tratamento com Ofev pode ser reiniciado com a dose completa (150 mg duas vezes ao dia) ou com uma dose reduzida (100 mg duas vezes ao dia). Nesses casos, seu médico saberá conduzir o manejo de Ofev.
População pediátrica
Não há dados nos estudos clínicos que autorizem o uso de Ofev em pacientes pediátricos.
Idosos (65 anos ou mais)
Não foram observadas diferenças gerais na segurança e na eficácia em pacientes idosos em comparação aos pacientes com idade abaixo de 65 anos, não sendo necessário ajuste da dose inicial com base na idade do paciente.
Raça
Nenhum ajuste de dose de Ofev é necessário, com base em sua raça.
Peso corporal
Nenhum ajuste de dose de Ofev é necessário, com base em seu peso corporal.
Insuficiência renal (mau funcionamento dos rins)
Menos de 1% da dose única de nintedanibe é excretada via renal. Não é necessário ajuste da dose inicial em pacientes com insuficiência renal leve a moderada. Todavia, não há dados que suportem o uso de Ofev em pacientes com insuficiência renal grave (< 30 mL/min de CrCL).
Insuficiência hepática (mau funcionamento do fígado):
O nintedanibe é predominantemente eliminado por excreção biliar/fezes (> 90%). A exposição aumentou em pacientes com insuficiência hepática (leve e moderada). Não é necessário ajuste da dose inicial em pacientes com insuficiência hepática leve. Uma vez que não existem dados em pacientes com insuficiência hepática moderada e grave, Ofev não é recomendado para estes pacientes.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e duração do tratamento.
Não interrompa o tratamento sem conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar este medicamento?
Você deve tomar a dose recomendada no próximo horário programado (habitual). Não duplique a dose e nunca exceda a dose máxima recomendada diária de 300 mg.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Diarreia
Ofev pode causar diarreia no início do tratamento; seu médico poderá receitar medicamentos para a diarreia ou interromper o tratamento com Ofev temporariamente. Seu médico poderá reiniciar o tratamento com uma dose reduzida ou com uma dose completa. Nos casos de persistência de sintomas severos, o tratamento com Ofev será descontinuado definitivamente.
Náuseas e vômitos
Ofev pode causar náuseas e vômitos; seu médico poderá receitar medicamentos sintomáticos, reduzir a dose ou interromper o tratamento com Ofev temporariamente. Seu médico poderá reiniciar o tratamento com uma dose reduzida ou com uma dose completa. Nos casos de persistência de sintomas severos, o tratamento com Ofev será descontinuado definitivamente.
Doenças do fígado
O tratamento com Ofev não é recomendado se você tiver doença moderada a grave do fígado. O risco de eventos adversos pode ser maior em pacientes com doença leve do fígado. Antes de iniciar o tratamento, seu médico deve realizar exames para testar os níveis de enzimas do fígado e a concentração de bilirrubina; durante o tratamento pode ocorrer aumento destas substâncias, portanto, seu médico deverá solicitar a realização de exames periodicamente. Dependendo dos resultados e dos sintomas, poderá reduzir a dose ou interromper o tratamento temporária ou definitivamente. Assim que os resultados dos exames voltarem a níveis normais, seu médico poderá reiniciar o tratamento com uma dose reduzida ou com uma dose completa.
Sangramentos e tromboembolismo venoso
O modo de ação de Ofev pode aumentar o risco de sangramentos e tromboembolismo venoso. Seu médico deve avaliar este risco.
Infarto do miocárdio (músculo do coração) e derrame
Pacientes com histórico recente não foram estudados. Seu médico deverá ter cautela se você tiver maior risco de doenças cardiovasculares e poderá interromper o tratamento se você apresentar sinais ou sintomas de infarto do miocárdio.
Perfuração gastrointestinal (abertura da parede do estômago ou intestino)
O modo de ação de Ofev pode aumentar o risco de perfurações gastrointestinais, entretanto, não foi observado o aumento deste risco durante os estudos com Ofev. No caso de perfuração gastrointestinal, seu médico deverá interromper o tratamento. Seu médico também deverá ter cautela se você já passou por cirurgia abdominal e deverá esperar pelo menos 4 semanas após uma cirurgia maior, incluindo-se cirurgias abdominais, para iniciar o tratamento com Ofev.
Cicatrização de feridas
O modo de ação de Ofev pode afetar o processo de cicatrização de feridas e seu médico deverá avaliar seu caso.
Excipiente lecitina de soja
As cápsulas de Ofev contém lecitina de soja.
Não use medicamento sem conhecimento do seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
Os eventos adversos mais frequentemente relatados associados com o uso de nintedanibe incluem diarreia, náuseas (enjoo) e vômitos, dor abdominal (dor na barriga), diminuição do apetite, perda de peso e aumento das enzimas do fígado.
Reações muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
Diarreia, náuseas (enjoo), dor abdominal (dor de barriga) e aumento de enzimas hepáticas (enzimas do fígado).
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Vômitos, aumento de enzimas do fígado: alanina aminotransferase (ALT), aspartato aminotransferase (AST) e gama glutamiltransferase (GGT); diminuição do apetite e perda de peso.
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
Aumento de fosfatase alcalina (FA) sanguínea, hiperbilirrubinemia (aumento de produção de bilirrubina, um dos pigmentos da bile que é secretada pelo fígado e acumulada na vesícula biliar) e hipertensão (pressão alta).
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
População Especial
Efeitos sobre capacidade de dirigir e operar máquinas
Não foram realizados estudos sobre o efeito na capacidade de dirigir e operar máquinas. Você deverá tomar cuidado quando for conduzir ou utilizar máquinas durante o tratamento com Ofev.
Fertilidade, Gravidez e Amamentação
Estudos em ratos não indicaram efeitos na fertilidade de machos, porém mostraram redução da fertilidade das fêmeas de ratos em níveis de exposição aproximadamente 3 vezes a máxima dose humana recomendada (MDHR).
Mulheres com possibilidade de engravidar devem fazer o teste de gravidez antes de iniciar o tratamento com Ofev e também evitar a gravidez durante o tratamento, pois estudos com Ofev em ratos e coelhos identificaram óbitos e danos na formação fetal.
Mulheres em tratamento com Ofev devem usar métodos contraceptivos adequados durante e pelo menos 3 meses após a última dose de Ofev.
Avise seu médico ou farmacêutico se você engravidar. A interrupção do seu tratamento com Ofev deve ser considerada.
Como precaução, a amamentação deve ser interrompida durante o tratamento com Ofev.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Informe imediatamente seu médico em caso de suspeita de gravidez.
Composição
Ofev 100 mg:
Ofev 150 mg:
Superdosagem
Não há um antídoto específico ou tratamento para a superdose de Ofev. Em caso de superdose, pode ocorrer aumento de enzimas hepáticas e sintomas gastrointestinais; o tratamento deve ser interrompido e as medidas de suporte geral devem ser iniciadas conforme apropriado.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
O nintedanibe é um substrato da glicoproteína-P (P-gp). O nintedanibe demonstrou não ser um substrato ou inibidor de OATP-1B1, OATP-1B3, OATP-2B1, OCT-2 ou MRP-2 in vitro. O nintedanibe também não foi um substrato de BCRP. Foi considerado apenas um fraco inibidor potencial de OCT-1, BCRP e P-gp, através de observações in vitro, o que é considerado de baixa relevância clínica. O mesmo se aplica para nintedanibe sendo um substrato de OCT-1.
Inibidores da P-gp
Inibidores potentes da P-gp (por exemplo, cetoconazol ou eritromicina) podem aumentar a exposição ao nintedanibe. Nesses casos, os pacientes devem ser cuidadosamente monitorizados quanto à tolerabilidade de nintedanibe. O manejo de eventos adversos pode requerer interrupção, redução da dose ou descontinuação da terapia com Esilato de Nintedanibe (substância ativa). Em um estudo dedicado de interação medicamentosa, a coadministração com cetoconazol aumentou a exposição ao nintedanibe em 1,61 vezes com base na ASC e em 1,83 vezes com base na Cmáx.
Indutores da P-gp
Indutores potentes da P-gp (por exemplo, rifampicina, carbamazepina, fenitoína e hipérico (erva-de-são-joão)) podem diminuir a exposição ao nintedanibe. Deve-se considerar a seleção de uma medicação concomitante alternativa sem ou com mínimo potencial de indução da P-gp. Em um estudo de interação medicamentosa com rifampicina, a exposição ao nintedanibe diminuiu em 50,3% com base na ASC e em 60,3% com base na Cmáx.
Enzimas do citocromo (CYP)
Apenas uma extensão menor da biotransformação de nintedanibe consistiu em vias de CYP. O nintedanibe e seus metabólitos, a porção de ácido livre BIBF 1202 e seu glicuronídeo BIBF 1202 não inibiram ou induziram as enzimas CYP em estudos pré-clínicos. Portanto, considera-se baixa a probabilidade de interações medicamentosas com nintedanibe com base no metabolismo de CYP.
Tratamento concomitante com pirfenidona
O tratamento concomitante de nintedanibe com pirfenidona foi investigado em um estudo com desenho de grupo paralelo em pacientes japoneses com FPI. Vinte e quatro pacientes foram tratados durante 28 dias com 150 mg de nintedanibe duas vezes ao dia. Em 13 pacientes, nintedanibe foi adicionado ao tratamento crônico com doses padrão de pirfenidona.
Onze pacientes receberam monoterapia de nintedanibe. A exposição ao nintedanibe tendeu a ser menor quando o nintedanibe foi administrado com pirfenidona em seu topo, comparado à administração de nintedanibe em monoterapia. O nintedanibe não exerceu nenhum efeito sobre a farmacocinética de pirfenidona. Devido à curta duração da exposição concomitante e ao baixo número de pacientes, nenhuma conclusão sobre a segurança e eficácia da combinação pode ser tirada.
Outros medicamentos
O potencial de interações de nintedanibe com contraceptivos hormonais não foi explorado.
Interação Alimentícia
Recomenda-se que Esilato de Nintedanibe (substância ativa) seja tomado com alimentos.
Ação da Substância
Resultados de eficácia
A eficácia clínica de nintedanibe foi estudada em pacientes com FPI em dois estudos de fase 3, randomizados, duplo-cegos e controlados com placebo com desenho idêntico (INPULSIS-1 e INPULSIS-2). Os pacientes foram randomizados em uma proporção de 3:2 para tratamento com Esilato de Nintedanibe 150 mg ou placebo duas vezes ao dia durante 52 semanas.
O desfecho primário foi a taxa anual de declínio na Capacidade Vital Forçada (CVF). Os desfechos secundários principais de avaliação foram a alteração na pontuação total no Questionário Respiratório de Saint George (QRSG) a partir do período basal até 52 semanas e o tempo para a primeira exacerbação aguda de FPI.
Taxa anual de declínio da CVF
A taxa anual de declínio da CVF (em mL) foi significativamente reduzida em pacientes que receberam nintedanibe em comparação com pacientes que receberam placebo. O efeito do tratamento foi consistente em ambos os estudos. Veja na Tabela 1 os resultados individuais e agrupados dos estudos.
Tabela 1: Taxa anual de declínio da CVF (mL) nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados - conjunto tratado:
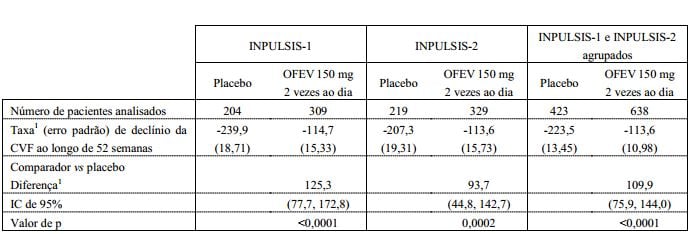
1Estimada com base em um modelo de regressão de coeficiente aleatório.
A robustez do efeito de nintedanibe na redução da taxa anual de declínio da CVF foi confirmada em todas as análises de sensibilidade pré-especificadas. Além disso, foram observados efeitos semelhantes em outros parâmetros de avaliação da função pulmonar, por exemplo, alteração na CVF a partir do período basal até a semana 52 e análise de pacientes que obtiveram resposta na CVF, provendo respaldo adicional para os efeitos de nintedanibe no retardo da progressão da doença. A Figura 1 mostra a evolução da alteração na CVF a partir do período basal ao longo do tempo em ambos os grupos de tratamento, com base na análise agrupada dos estudos INPULSIS-1 e INPULSIS-2.
Figura 1: Alteração média na CVF observada (erro padrão da média) a partir do período basal (mL) ao longo do tempo, nos estudos INPULSIS-1 e INPULSIS-2 agrupados:
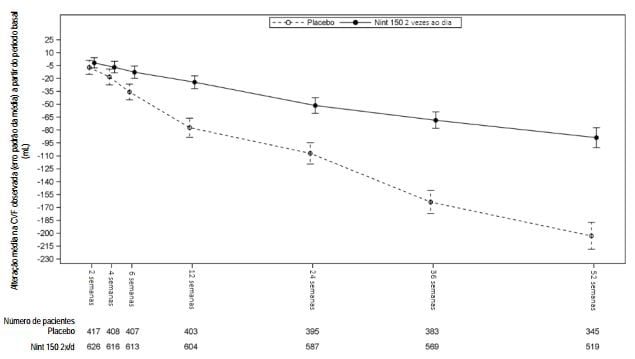
Análise de pacientes que obtiveram resposta na CVF
Em ambos os estudos INPULSIS, a proporção de pacientes que obtiveram resposta na CVF, definidos como pacientes com um declínio absoluto na porcentagem da CVF prevista não superior a 5% (um limiar indicativo do aumento no risco de mortalidade em FPI), foi significativamente maior no grupo de nintedanibe em comparação ao grupo placebo. Resultados semelhantes foram observados em análises usando um limiar mais conservador de 10%. Veja a Tabela 2 para os resultados individuais e agrupados dos estudos.
Tabela 2: Proporção de pacientes que obtiveram resposta na CVF em 52 semanas nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados - conjunto tratado:
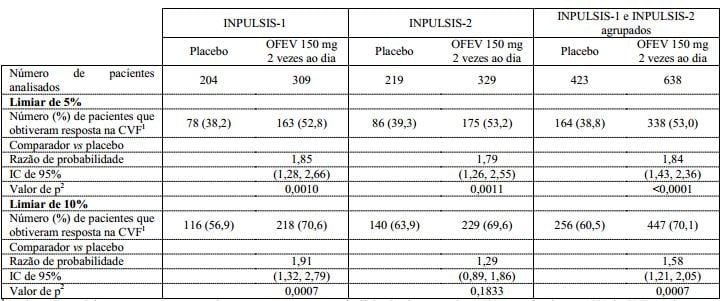
1 Pacientes que obtiveram resposta são aqueles que não apresentaram declínio absoluto superior a 5% ou maior do que 10% da CVF prevista em 52 semanas.
2 Com base em uma análise de regressão logística.
Tempo para progressão (? 10% de declínio absoluto da CVF prevista ou morte)
Em ambos os estudos INPULSIS, o risco de progressão foi estatisticamente e significativamente reduzido nos pacientes tratados com nintedanibe em comparação com o placebo. Na análise agrupada, a RR foi de 0,60, indicando uma redução de 40% no risco de progressão para os pacientes tratados com nintedanibe em comparação com placebo, veja a Tabela 3.
Tabela 3: Frequência de pacientes com ? 10% de declínio absoluto da CVF prevista ou morte ao longo de 52 semanas e tempo de progressão nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados – conjunto tratado:
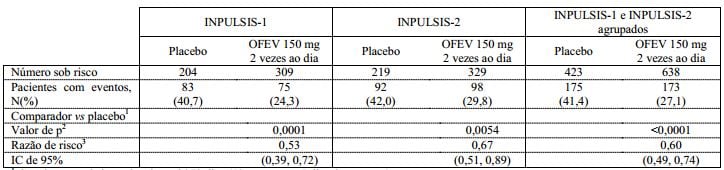
1 Com base em dados coletados até 372 dias (52 semanas + 7 dias de margem).
2 Com base no teste de Log-rank.
3 Com base em um modelo de regressão de Cox.
Alteração na pontuação total do QRSG na semana 52 a partir do período basal
A pontuação total do Questionário Respiratório St. George (QRSG), que avaliou a qualidade de vida relacionada à saúde (QVRS), foi analisada em 52 semanas. No INPULSIS-2, os pacientes que receberam placebo tiveram um aumento maior na pontuação total de QVRS a partir do basal em comparação com pacientes que receberam 150mg de nintedanibe duas vezes ao dia. A deterioração da QVRS foi menor no grupo nintedanibe; a diferença entre os grupos de tratamento foi estatisticamente significativa (-2,69, IC de 95%: -4,95, -0,43, p = 0,0197).
No INPULSIS-1, o aumento na pontuação total do QRSG na semana 52 a partir do período basal foi comparável entre nintedanibe e placebo (diferença entre os grupos de tratamento: -0,05, IC de 95%: -2,50, 2,40, p = 0,9657). Na análise agrupada dos estudos INPULSIS, a alteração média estimada desde o período basal até a semana 52 na pontuação total do QRSG foi menor no grupo nintedanibe (3,53) do que no grupo placebo (4,96), com uma diferença entre os grupos de tratamento de -1,43 (IC de 95%: -3,09, 0,23, p = 0,0923). No geral, o efeito de nintedanibe na qualidade de vida relacionada à saúde, medida pela pontuação total do QRSG, foi modesto, indicando uma menor deterioração em comparação com placebo.
Tempo para a primeira exacerbação aguda de FPI
No estudo INPULSIS-2, o risco de ocorrência da primeira exacerbação aguda de FPI ao longo de 52 semanas foi significativamente reduzido nos pacientes que receberam nintedanibe em comparação com o placebo; no estudo INPULSIS-1, não houve diferença entre os grupos de tratamento. Na análise agrupada dos estudos INPULSIS, um risco numericamente inferior da ocorrência da primeira exacerbação aguda foi observado em pacientes que receberam nintedanibe em comparação aos pacientes que receberam placebo. A Tabela 3 mostra os resultados individuais e agrupados dos estudos.
Tabela 4: Tempo para a primeira exacerbação aguda ao longo de 52 semanas com base em eventos notificados pelo investigador nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados – conjunto tratado:
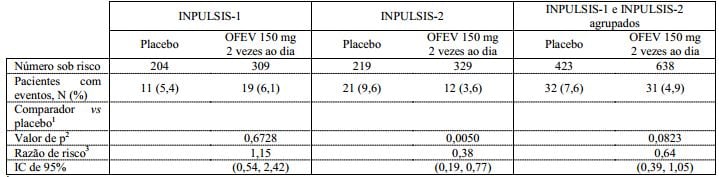
1 Com base em dados coletados até 372 dias (52 semanas + 7 dias de margem).
2 Com base no teste de Log-rank.
3 Com base em um modelo de regressão de Cox.
Todos os eventos adversos de exacerbação aguda de FPI relatados pelos pesquisadores foram avaliados por um comitê cego de avaliação. Uma análise de sensibilidade pré-especificada do tempo até a primeira “suspeita” de exacerbação aguda de FPI foi realizada nos dados agrupados. A frequência de pacientes com pelo menos uma exacerbação avaliada ocorrida dentro de 52 semanas foi menor no grupo nintedanibe (1,9% dos pacientes) do que no grupo placebo (5,7% dos pacientes). A análise do tempo até a ocorrência do evento de exacerbação (avaliada utilizando dados agrupados dos estudos ) produziu uma razão de risco (HR) de 0,32 ( IC de 95% 0,16, 0,65, p = 0,0010). Isto indica que o risco de ter uma primeira exacerbação aguda de FPI foi significativamente menor no grupo nintedanibe do que no grupo placebo em qualquer ponto analítico, com significância estatística.
Análise de sobrevida
Na análise agrupada pré-especificada de dados de sobrevida dos estudos INPULSIS, a mortalidade total ao longo de 52 semanas foi menor no grupo nintedanibe (5,5%) em comparação com o grupo placebo (7,8%). A análise do tempo até a morte resultou em uma HR de 0,70 (IC de 95% 0,43, 1,12, p = 0,1399). Os resultados de todos os desfechos de sobrevida (como a mortalidade durante o tratamento e mortalidade por causas respiratórias) mostraram uma diferença numérica consistente a favor de nintedanibe.
Tabela 5: Todas as causas de mortalidade ao longo de 52 semanas nos estudos INPULSIS-1, INPULSIS-2 e seus dados agrupados – conjunto tratado:
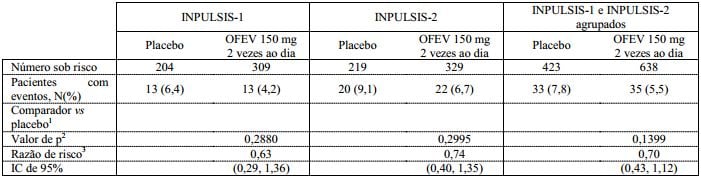
1 Com base em dados coletados até 372 dias (52 semanas + 7 dias de margem).
2 Com base no teste de Log-rank.
3 Com base em um modelo de regressão de Cox.
Efeito no intervalo QT
As medições de QT/QTc foram registradas e analisadas a partir de um estudo dedicado realizado em pacientes com carcinoma de células renais comparando a monoterapia de nintedanibe versus a monoterapia de sunitinibe.3 Neste estudo de doses orais únicas de 200 mg de nintedanibe, bem como de doses orais múltiplas de 200 mg duas vezes ao dia de nintedanibe administradas durante 15 dias, não prolongaram o intervalo QTcF.
Estudos pediátricos
Não foram conduzidos estudos clínicos em crianças e adolescentes.
Características Farmacológicas
Farmacodinâmica
Farmacocinética
A farmacocinética de nintedanibe pode ser considerada linear em relação ao tempo (isto é, os dados de dose única podem ser extrapolados para os dados de doses múltiplas). O acúmulo em múltiplas administrações foi de 1,04 vezes para Cmáx e 1,38 vezes para AUC?. As concentrações mínimas de nintedanibe permaneceram estáveis por mais de um ano.
Fatores intrínsecos e extrínsecos; populações especiais
As propriedades farmacocinéticas de nintedanibe foram semelhantes em voluntários saudáveis, pacientes com FPI e pacientes com câncer. Com base nos resultados de uma análise farmacocinética populacional (PopPK) em pacientes com FPI e carcinoma de pulmão de células não pequenas (CPCNP) (N = 1191) e investigações descritivas, a exposição ao nintedanibe não foi influenciada pelo sexo (corrigido pelo peso corporal), insuficiência renal leve e moderada (estimada pela depuração da creatinina), consumo de álcool ou genótipo de glicoproteína-P (P-gp).
A análise PopPK indicou efeitos moderados na exposição ao nintedanibe com relação a idade, peso corporal e raça, que são descritos a seguir. Com base na variabilidade interindividual elevada de exposição observada, efeitos moderados são considerados não clinicamente relevantes.
Cuidados de Armazenamento
Conservar sob refrigeração (temperatura entre 2 °C e 8 °C) e proteger da umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Apresentação
As cápsulas moles de Ofev100 mg são de cor pêssego e as de 150 mg são de cor marrom. Ambas são opacas, oblongas (ovais), contendo uma suspensão viscosa amarelo brilhante. São marcadas com o símbolo da empresa Boehringer Ingelheim em preto e identificadas quanto à concentração.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Venda sob prescrição médica.
MS 1.0367.0173
Farm. Resp.:
Dímitra Apostolopoulou – CRF-SP 08828
Importado por:
Boehringer Ingelheim do Brasil Quím. e Farm. Ltda.
Rod. Régis Bittencourt, km 286
Itapecerica da Serra – SP
CNPJ 60.831.658/0021-10
SAC 0800-7016633
Fabricado por:
Catalent Germany Eberbach GmbH Eberbach - Alemanha
Embalado por:
Boehringer Ingelheim Pharma GmbH & Co. KG
Ingelheim am Rhein - Alemanha
informações complementares
| Fabricante |
| BOEHRINGER |
| Princípio ativo |
| Esilato De Nintedanibe |
| Categoria do medicamento |
| Medicamentos Especiais |
OFEV - 100 MG 60 CÁPSULAS MOLE É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
