- Home
- Medicamentos
- Medicamentos Especiais
- Ontax - 6 Mg/Ml Solução Injetá...
- Bula de Ontax - 6 Mg/Ml Solução Injetá...
para o que é indicado e para que serve?
Para que serve Ontax tem as seguintes indicações Carcinoma (tumor maligno) de ovário Ontax é indicado como primeira e segunda linha de tratamento do carcinoma avançado de ovário; quando indicado como primeira linha de tratamento, Ontax é utilizado em combinação com outro medicamento com composto de platina.Continue lendo...
ofertas de Ontax - 6 Mg/Ml Solução Injetável Frasco-Ampola 16,7 Ml

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Ontax tem as seguintes indicações
Como Ontax funciona?
Ontax contém paclitaxel, substância que possui atividade antitumoral.
O paclitaxel é um agente que promove as reorganizações de funções que são essenciais para formação celular e também induz a formação anormal de estruturas durante o ciclo celular exercendo assim a atividade antitumoral.
Contraindicação
Caso você apresente histórico de reações graves de hipersensibilidade ao paclitaxel ou ao óleo de rícino polioxietilado você não deve utilizar Ontax.
Ontax não deve ser administrado em pacientes com tumores sólidos que apresentem as seguintes alterações nos exames laboratoriais:
- Contagem de neutrófilos basal < 1.500 células/mm³;
- Pacientes com sarcoma de Kaposi relacionado à AIDS com contagem de neutrófilos basal ou subsequente < 1.000 células/mm³.
Como usar
Risco de uso por via não recomendada
Para segurança e eficácia desta apresentação, Ontax não deve ser administrado por vias não recomendadas.
A administração deve ser somente pela via intravenosa.
Pelo fato deste produto ser de uso restrito em ambiente hospitalar ou em ambulatório especializado, com indicação específica e manipulação apenas por pessoal treinado, o item “Como usar o Ontax” não consta nesta bula, uma vez que as informações serão fornecidas pelo médico, conforme necessário.
Antes da administração de Ontax, você será pré-medicado para diminuir o risco da ocorrência de reações graves de hipersensibilidade.
Posologia
Carcinoma de ovário
Câncer de mama
Câncer de não-pequenas células do pulmão
Populações especiais
O que devo fazer quando eu me esquecer de usar Ontax?
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico.
Precauções
Ontax deve ser administrado sob a supervisão de um médico com experiência na utilização de agentes quimioterápicos.
Anafilaxia (reações alérgicas) e reações graves de hipersensibilidade
Você poderá apresentar anafilaxia e reações graves de hipersensibilidade que são caracterizadas por falta de ar, hipotensão (diminuição da pressão arterial), angioedema ou urticária generalizada.
Raras reações fatais ocorreram em alguns pacientes, apesar do pré-tratamento.
Como pré-tratamento, o seu médico poderá indicar difenidramina, medicamentos corticosteroides e da classe dos antagonistas H2.
Em caso de reação de hipersensibilidade grave, a infusão de Ontax deve ser descontinuada imediatamente e o paciente não deve receber novo tratamento com Ontax.
Mielodepressão (diminuição da atividade da medula óssea)
A principal toxicidade dependente da dose e do esquema posológico durante tratamento com Ontax é a diminuição da atividade da medula óssea, principalmente a neutropenia, que é diminuição das células brancas do sangue.
Seu médico poderá solicitar a monitorização frequente do hemograma (exame sanguíneo) durante o tratamento com Ontax.
Cardiovascular
Você poderá apresentar diminuição da pressão arterial, aumento da pressão arterial e diminuição dos batimentos cardíacos durante a administração de Ontax.
Os pacientes geralmente permanecem sem sintomas e não requerem tratamento.
Já em casos graves, pode ser necessária a interrupção ou a descontinuação das infusões de Ontax de acordo com a avaliação do seu médico.
Sistema nervoso
Você poderá apresentar neuropatia periférica, que é uma doença do sistema nervoso, e normalmente não é grave.
Seu médico poderá recomendar redução da dose de Ontax nos ciclos subsequentes.
Ontax contém álcool etílico em sua formulação.
Devem ser considerados os possíveis efeitos do álcool no sistema nervoso central (SNC) e seus outros efeitos, em todos os pacientes.
Crianças podem ser mais sensíveis aos efeitos do álcool que os adultos.
Reação no local da injeção
Seu médico deverá monitorar de perto o local da infusão quanto a uma possível infiltração durante a administração da droga.
Insuficiência hepática
Pacientes com insuficiência no fígado podem apresentar maior risco de toxicidade.
O ajuste de dose poderá ser recomendado e seu médico poderá recomendar monitoração quanto ao desenvolvimento de supressão profunda da medula óssea.
Vacinas
Como o sistema imune, responsável pelas defesas do organismo, pode estar com sua ação diminuída por Ontax, a vacinação com vírus vivos de pacientes em tratamento com Ontax pode resultar em infecção grave.
A resposta dos anticorpos a vacinas pode estar diminuída.
O uso de vacinas vivas deve ser evitado e o conselho de um especialista deve ser considerado.
Há um risco aumentado de doença sistêmica que leve ao óbito com o uso combinado de Ontax com vacinas vivas.
Vacinas vivas não são recomendadas em pacientes imunodeprimidos (com comprometimento do sistema imune).
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use o medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
A frequência e a gravidade dos eventos adversos são geralmente similares entre os pacientes que receberam paclitaxel para o tratamento do câncer de ovário, mama, carcinoma pulmonar de células não pequenas ou sarcoma de Kaposi.
Entretanto, pacientes com sarcoma de Kaposi relacionado à AIDS podem sofrer com maior frequência e gravidade toxicidade hematológica, infecções (incluindo infecções oportunistas) e neutropenia febril (diminuição da contagem de neutrófilos acompanhada por febre).
Estes pacientes necessitam de menor intensidade de dose e de cuidados de suporte.
Nos estudos clínicos, pacientes tratados com paclitaxel apresentaram reações de hipersensibilidade, alterações cardiovasculares (como, diminuição da frequência cardíaca, diminuição da pressão arterial e alterações no eletrocardiograma), neuropatia (doença do sistema nervoso), sintomas gastrintestinais (como náuseas, vômitos, diarreia e mucosite), dores musculares, dores articulares, queda de cabelo, alterações no fígado, reações no local da injeção e reações adversas relacionadas à medula óssea, como alterações das células brancas do sangue, trombocitopenia (diminuição da contagem de plaquetas), anemia, infecções e hemorragia.
Como resultado da reação de hipersensibilidade, você poderá apresentar alterações transitórias na pele e ou edema (inchaço), e em uma menor frequência poderá apresentar alterações nas unhas.
Raramente, você poderá apresentar reações pulmonares e anormalidades cutâneas, como erupção, prurido e síndrome de Stevens-Johnson (síndrome de reação alérgica grave com acometimento da pele e mucosas).
A frequência dos eventos adversos listada abaixo é definida usando o seguinte:
- Muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento);
- Comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento);
- Incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento);
- Rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento);
- Muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento);
- Não conhecido (não pode ser estimado com base nos dados disponíveis).
Infecções e infestações
Desordens do sangue e do sistema linfático
Desordens do sistema imunológico
Desordens no metabolismo e nutrição
Desordens psiquiátricas
Desordens do sistema nervoso
Desordens nos olhos
Desordens no ouvido e labirinto
Desordens respiratórias, torácicas e do mediastino
Desordens cardíacas
Desordens vasculares
Desordens gastrintestinais
Desordens hepatobiliares
Desordens do tecido subcutâneo e da pele
Desordens musculoesqueléticas, nos ossos e tecidos de conexão
Desordens gerais e condições do local da administração
Investigações
População Especial
Uso em crianças
A segurança e a eficácia de paclitaxel em pacientes pediátricos não foram estabelecidas.
Em um estudo clínico conduzido com crianças, ocorreram casos de toxicidade do sistema nervoso central (SNC).
Uso em idosos
Pacientes idosos podem apresentar com maior frequência eventos cardíacos, neuropatia e diminuição da função da medula óssea.
Gravidez
Ontax poderá causar danos ao feto quando administrado durante a gestação.
Mulheres em idade reprodutiva devem evitar a gravidez durante a terapia com o paclitaxel.
Se o paclitaxel for utilizado durante a gestação ou se a paciente ficar grávida enquanto em tratamento com a droga, a paciente deverá ser informada sobre os perigos potenciais.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Informe imediatamente seu médico em caso de suspeita de gravidez.
Lactação
Mulheres que estejam amamentando, recomenda-se a interrupção da amamentação enquanto durar a terapia com Ontax.
Fertilidade
O Ontax pode ter um efeito mutagênico, portanto pacientes homens e mulheres tratados com Ontax devem utilizar métodos contraceptivos efetivos para não terem filhos durante ou em até 6 meses após o tratamento.
Como Ontax pode diminuir a fertilidade masculina, seu médico deve considerar a preservação do esperma para posterior paternidade.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use o medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Composição
Cada mL de solução contém:
6,0 mg de paclitaxel.
Veículos: óleo de rícino (etoxilato), ácido cítrico e álcool etílico.
Superdosagem
Não existe antídoto conhecido que possa ser utilizado em caso de superdose.
As complicações principais de uma superdose consistem em depressão da medula óssea, toxicidade neurológica e inflamação da mucosa.
A superdosagem em pacientes pediátricos pode estar associada com a toxicidade aguda ao etanol.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Cisplatina
Em estudos clínicos combinados, a mielossupressão foi mais acentuada e o clearance do paclitaxel (substância ativa) foi reduzido em cerca de 20% quando se administrou paclitaxel (substância ativa) após a cisplatina, comparativamente a paclitaxel (substância ativa) administrado antes da cisplatina.
Substratos, Indutores, Inibidores do Citocromo P450 2C8 e 3A4
O metabolismo de paclitaxel (substância ativa) é catalisado pelo citocromo P450, isoenzimas CYP2C8 e CYP3A4. Deve-se ter cuidado quando da administração de paclitaxel (substância ativa) concomitantemente com conhecidos substratos, indutores (ex. rifampicina, carbamazepina, fenitoína, enfavirenz, nevirapina) ou inibidores (ex. eritromicina, fluxetina, genfibrozil) do citocromo P450, isoenzimas CYP2C8 e CYP3A4.
Doxorrubicina
Efeitos relacionados a administração sequencial, caracterizados por episódios mais acentuados de neutropenia e estomatite foram observados com o uso combinado de paclitaxel (substância ativa) e doxorrubicina quando se administrou paclitaxel (substância ativa) antes da doxorrubicina e por períodos de infusão mais longos do que os recomendados. Os níveis plasmáticos de doxorrubicina (e de seu metabólito ativo doxorrubicinol) podem aumentar quando paclitaxel (substância ativa) e doxorrubicina são utilizados em combinação. Entretanto, dados de um estudo utilizando doxorrubicina in bolus e infusão de paclitaxel (substância ativa) por 3 horas não mostraram efeitos sequenciais nos padrões de toxicidade.
Outras interações
Há um risco aumentado de doença sistêmica fatal por vacina com o uso concomitante com vacinas vivas. Vacinas vivas não são recomendadas em pacientes imunodeprimidos.
Ação da Substância
Resultados da eficácia
Carcinoma de ovário
Câncer de mama
Câncer de Não-pequenas Células do Pulmão (CNPCP)
Em estudo Fase III, aberto, randomizado e conduzido pelo ECOG, 599 pacientes foram randomizados com paclitaxel (T) na dosagem de 135 mg/m2 com infusão de 24 horas em combinação com cisplatina (c) 75 mg/m2, com paclitaxel (T) na dosagem de 250 mg/m2 com infusão de 24 horas em combinação com cisplatina (c) 75 mg/m2 com suporte G-CSF, ou cisplatina (c) 75 mg/m2 no dia 1, seguido por etoposídeo (VP) 100 mg/m2 nos dias 1, 2, e 3 (controle).
As taxas de resposta, o tempo mediano para progressão, a sobrevida mediana e as taxas de 1 ano de sobrevida estão descritos na tabela a seguir. Os valores de p fornecidos não foram ajustados para múltiplas comparações. Houve diferenças estatisticamente significativas a favor de cada um dos braços de paclitaxel + cisplatina, para a taxa de resposta e tempo de progressão da doença.
Não houve diferenças estatisticamente significativas na sobrevida entre o braço paclitaxel + cisplatina e o braço cisplatina + etoposídeo.
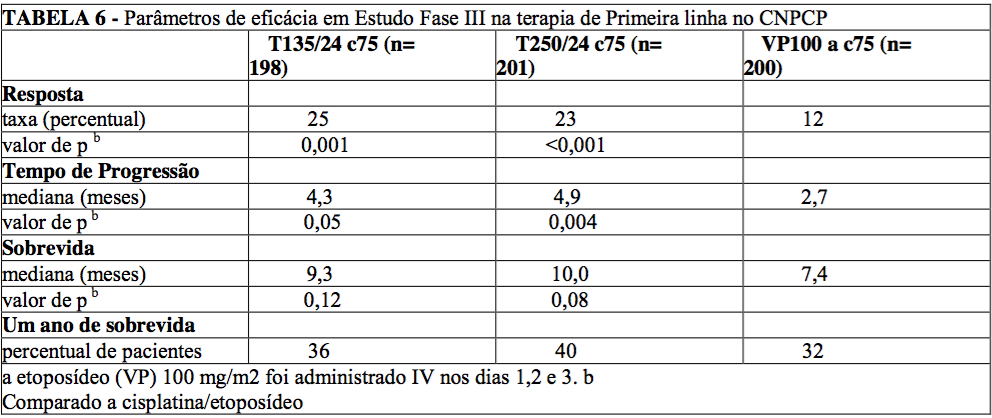
No estudo ECOG, o questionário da Avaliação Funcional da Terapia de Câncer do Pulmão (FACT-L) teve sete sub- escalas que mediram a avaliação subjetiva do tratamento. Das sete, a sub-escala dos sintomas específicos do câncer de pulmão favoreceu o braço paclitaxel 135 mg/m2 (24 horas) + cisplatina, comparado ao braço cisplatina + etoposídeo. Para todos os outros fatores, não houve diferença entre os grupos de tratamento.
O perfil dos eventos adversos dos pacientes que receberam paclitaxel em combinação com cisplatina no estudo em geral foi consistente com o perfil observado na análise de dados dos 812 pacientes tratados apenas com paclitaxel, em 10 estudos clínicos realizados.
Sarcoma de Kaposi Relacionado à AIDS
Dados de dois estudos abertos FASE II suportam o uso de paclitaxel como segunda linha de tratamento em pacientes com sarcoma de Kaposi Relacionado à AIDS. Cinquenta e nove dos 85 pacientes envolvidos nestes estudos receberam previamente terapia sistêmica, incluindo Interferon Alfa (32%), DaunoXome (31%), DOXIL(2%) e quimioterapia com doxorrubicina ( 42%), sendo que 64 % haviam recebido medicamentos da classe das antraciclinas. Oitenta e cinco por cento dos pacientes pré-tratados progrediram ou não toleraram a terapia sistêmica prévia.
No estudo CA 139-174, os pacientes receberam paclitaxel 135 mg/m2 com infusão de 3 horas a cada 3 semanas (intensidade da dose pretendida 45 mg/m /semana). Os pacientes receberam 155 mg/m2 e 175 mg/m2 em ciclos subsequentes, caso nenhuma toxicidade dose limitante fosse observada.
Fatores de crescimento hematopoiético não foram utilizados inicialmente. No estudo CA 139-281 os pacientes receberam paclitaxel 100 mg/m2 com infusão de 3 horas a cada 2 semanas (intensidade da dose pretendida 50 mg/m /semana). Neste estudo os pacientes poderiam receber suporte hematopoiético antes de iniciar a terapia com paclitaxel, ou este suporte poderia ser iniciado como indicado; a dose de paclitaxel não foi aumentada. A intensidade da dose de paclitaxel utilizado nesta população foi menor do que a intensidade da dose recomendada para outros tumores sólidos.
Todos os pacientes apresentavam doenças disseminadas e de baixo risco. Aplicando os critérios da escala (ACTG) para os pacientes submetidos à terapia sistêmica prévia, 93 % eram de baixo risco em relação à extensão da doença (T1), 88 % com a contagem de CD4 <200 células/mm3 (I1) e considerando respectivas doenças sistêmicas 97 % apresentavam baixo risco (S1).
Todos os pacientes no estudo CA 139-174 apresentavam um status do desempenho Karnofsky de 80 ou 90 no valor basal; no estudo CA 139-281, havia 26 (46%) pacientes com um status do desempenho Karnofsky de 70 ou pior no valor basal.
| TABELA 7 - Extensão da Doença no Início do Estudo -Percentual de Pacientes | |
| Visceral ±edema ± oral ± cutâneo | Terapia Sistêmica Prévia (n= 59) 42 |
| Edema ou linfonodo ± oral ± cutâneo | 41 |
| Oral ± cutâneo | 10 |
| Somente Cutâneo | 7 |
Embora a intensidade da dose planejada em dois estudos tenha sido ligeiramente diferente (45 mg/m2/semana no estudo CA 139-174 e 50 mg/m2/semana no estudo CA 139-281), a intensidade da dose administrada foi de 38-39 mg/m2/ semana em ambos estudos, com uma variação similar (20-24 a 51-61).
Benefícios Clínicos Adicionais
A maioria dos dados dos pacientes beneficiados foi avaliada retrospectivamente (planos para esta análise não foram incluídos nos protocolos dos estudos). No entanto, as descrições clínicas e fotográficas indicaram benefícios claros em alguns pacientes, incluindo melhora da função pulmonar em pacientes com comprometimento pulmonar, melhora na deambulação, resolução de úlceras e diminuição de necessidade de analgésicos em pacientes com Sarcoma de Kaposi nos pés e melhora de lesões faciais e edema em pacientes com SK na face, extremidades e genitália.
Segurança
O perfil dos eventos adversos apresentados pelos pacientes com AIDS avançada ou de baixo risco de Sarcoma de Kaposi relacionado à AIDS que receberam paclitaxel foi, em geral, semelhante ao observado na análise de dados dos 812 pacientes com tumores sólidos.
Nos pacientes imunossuprimidos, entretanto, é recomendada uma menor intensidade de dose de paclitaxel e terapia de apoio, incluindo fatores de crescimento hematopoiético em pacientes com neutropenia grave. Pacientes com Sarcoma de Kaposi relacionado à AIDS podem apresentar toxicidade hematológica mais severa do que em pacientes com tumores sólidos.
Características Farmacológicas
O paclitaxel possui atividade antitumoral.
Mecanismo de ação
O paclitaxel é um novo agente antimicrotúbulo que promove a agregação dos microtúbulos a partir dos dímeros de tubulina. Ele estabiliza os microtúbulos prevenindo a despolimerização, resultando na inibição da dinâmica normal de reorganização da rede de microtúbulos essencial para as funções celulares. O paclitaxel também induz a formação anormal ou feixe de microtúbulos durante o ciclo celular e múltiplos ásteres de microtúbulos durante a mitose.
Farmacocinética
A farmacocinética do paclitaxel foi avaliada em uma série de doses, até 300 mg/m2, e esquemas de infusão, variando de 3 a 24 horas e demonstrou ser não-linear e saturável com um aumento desproporcionalmente grande dos valores de concentração máxima (Cmáx) e área sob a curva (AUC) com o aumento da dose, acompanhado por uma diminuição aparente, relacionada à dose, do clearance corpóreo total.
Após a administração intravenosa, o paclitaxel mostra um declínio bifásico das concentrações plasmáticas. O declínio rápido inicial representa a distribuição para os compartimentos periféricos e a eliminação da droga. A última fase deve-se, em parte, a um efluxo relativamente lento do paclitaxel do compartimento periférico. Em pacientes tratados com doses de 135 e 175 mg/m2 administrados por infusões de 3 e 24 horas, a meia-vida final média variou de 13,1 a 52,7 horas e o clearance corpóreo total variou de 12,2 a 23,8 L/h/m . O volume médio de distribuição no estado de equilíbrio variou de 198 a 688 L/m , indicando uma distribuição extravascular extensa e/ou ligação do paclitaxel aos tecidos.
A variabilidade na exposição sistêmica do paclitaxel, avaliada pela AUC(o-oo) para ciclos de tratamento sucessivos é mínima; não há evidências de acúmulo do paclitaxel quando administrado em múltiplos ciclos de tratamento.
Distribuição
Em média, 89% da droga encontra-se ligada às proteínas séricas; a presença de cimetidina, ranitidina, dexametasona ou difenidramina não altera a taxa de ligação protéica do paclitaxel.
Metabolismo
Estudos in vitro com microssomos hepáticos humanos e pedaços de tecidos demonstraram que o paclitaxel é metabolizado fundamentalmente ao 6?-hidroxipaclitaxel pelo citocromo P450 isoenzima CYP2C8; e a dois metabólitos menores, o 3-p-hidroxipaclitaxel e o 6?,3'-p-diidroxipaclitaxel pelo CYP3A4. In vitro, o metabolismo do paclitaxel a 6?-hidroxipaclitaxel foi inibido por vários agentes. O efeito da disfunção renal sobre a disposição do paclitaxel não foi estudado.
Excreção
Após administração intravenosa de doses de 15 a 275 mg/m2 de paclitaxel por 1, 6 ou 24 horas de infusão, os valores médios de recuperação urinária cumulativa da droga inalterada variaram de 1,3% a 12,6% da dose. Isto indica um clearance não-renal extenso de paclitaxel. Em 5 pacientes que receberam doses radio marcadas de 225 ou 250 mg/m2 de paclitaxel por infusão de 3 horas, 14% da radioatividade foi recuperada na urina e 71% foi excretada nas fezes em 120 horas. A recuperação total da radioatividade variou de 56% a 101% da dose. O paclitaxel representou uma média de 5% da radioatividade recuperada nas fezes, enquanto que os metabólitos, principalmente o 6?-hidroxipaclitaxel, responderam pelo restante.
Insuficiência Hepática
A disposição e toxicidade da infusão de 3 horas de paclitaxel foi avaliada em 35 pacientes com variados graus de função hepática. Em comparação com os pacientes com bilirrubina normal, a exposição plasmática ao paclitaxel em pacientes com nível de bilirrubina sérica anormal menor ou igual a 2 vezes o limite superior da normalidade (LSN), que receberam 175 mg/m2, foi aumentada, mas não com aumento aparente na frequência ou severidade da toxicidade.
Em cinco pacientes com nível de bilirrubina sérica total maior que 2 vezes LSN, houve uma incidência maior estatisticamente não significativa de mielossupressão grave, mesmo com dose reduzida (110 mg/m2), mas não foi observado aumento na exposição plasmática.
Cuidados de Armazenamento
Este medicamento deve ser conservado em sua embalagem original, em temperatura ambiente (entre 15ºC e 30ºC) e protegido da luz.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Todo medicamento deve ser mantido fora do alcance das crianças.
Os frascos ampola de Ontax quando utilizados como multidose mantêm sua estabilidade física e química por até 28 dias (após sua primeira utilização) se armazenados em temperatura ambiente até 25°C e protegidos da luz até o final do prazo de validade do produto.
As soluções diluídas, se preparadas como recomendado são química e fisicamente estáveis por até 27 horas em temperatura ambiente (entre 15ºC e 30ºC) e em condições de iluminação ambiente.
As soluções diluídas não devem ser refrigeradas.
Depois de preparado (em temperatura ambiente entre 15°C e 30ºC), este medicamento pode ser utilizado em 27 horas.
Características físicas
Ontax é uma solução límpida, transparente, ligeiramente amarelada e isenta de partículas visíveis.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais
MS nº: 1.0033.0115.
Farmacêutica responsável:
Cintia Delphino de Andrade
CRF-SP nº: 25.125.
Registrado por:
Libbs Farmacêutica LTDA.
Rua Josef Kryss, 250
São Paulo – SP
CNPJ 61.230.314/0001-75.
Fabricado por:
Libbs Farmacêutica LTDA.
Rua Alberto Correia Francfort, 88
Embu – SP
Indústria brasileira.
Venda sob prescrição médica.?
Uso restrito a hospitais.
informações complementares
| Fabricante |
| LIBBS |
| Princípio ativo |
| Paclitaxel |
| Categoria do medicamento |
| Medicamentos Especiais |
ONTAX - 6 MG/ML SOLUÇÃO INJETÁVEL FRASCO-AMPOLA 16,7 ML É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
