- Medicamentos
- Medicamentos Especiais
- Valcyte 450Mg 60 Comprimidos
Comparamos o preço de valcyte 450mg 60 comprimidos, veja o menor preço
Valcyte 450Mg 60 Comprimidos

Menor Preço
R$ 13.698,70
- CATEGORIA: Medicamentos Especiais
- PRINCÍPIO ATIVO: Valganciclovir
- FABRICANTE: ROCHE
PARA QUE SERVE?
Para que serve Valcyte é indicado para o tratamento de retinite (inflamação da retina) por citomegalovírus (CMV) em pacientes adultos com síndrome da imunodeficiência adquirida (AIDS). Valcyte é indicado como profilaxia da doença por CMV em pacientes adultos e pediátricos receptores de transplante de órgãos sólidos (TOS) de risco alto a risco moderado.
R
Referência
13
ofertasMelhores preços a partir de R$ 13.698,70 até R$ 17.301,75
Menor preço
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Menor preço
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Preço Válido para compra em Boleto
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Onco Express Medicamentos Especiais e Oncológicos
economize
1.80%
R$ 16.990,00
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria!
Para que serve
Valcyte é indicado para o tratamento de retinite (inflamação da retina) por citomegalovírus (CMV) em pacientes adultos com síndrome da imunodeficiência adquirida (AIDS). Valcyte é indicado como profilaxia da doença por CMV em pacientes adultos e pediátricos receptores de transplante de órgãos sólidos (TOS) de risco alto a risco moderado.
Como Valcyte funciona?
O citomegalovírus (CMV) é um vírus da família herpesvírus, e cerca de 50% a 75% dos adultos já foram infectados por ele. Nos indivíduos com o sistema de defesa íntegro, o CMV permanece em estado dormente. Em indivíduos com o sistema de defesa enfraquecido, como os doentes com AIDS, ou em pacientes que receberam transplante de órgão e fazem uso de medicação contra rejeição, o CMV torna-se ativo e causa doença. Em pacientes com AIDS, a retinite (inflamação da retina) é a manifestação mais frequente do CMV. Em pacientes que receberam transplante de órgãos, a doença pelo CMV pode causar várias complicações, entre elas a perda do órgão transplantado.
Valcyte é um antiviral que contém o ingrediente ativo valganciclovir. Depois de ingerido, é rapidamente convertido para ganciclovir e age interrompendo a reprodução do CMV. Em um estudo clínico com pacientes com AIDS e retinite por CMV em que Valcyte foi comparado ao ganciclovir, observou-se um tempo médio para progressão da retinite de 226 dias (mediana de 160 dias) no grupo que usou Valcyte, nos períodos de indução e de manutenção.
Contraindicação
Valcyte é contraindicado a pacientes com hipersensibilidade conhecida ao valganciclovir, ao ganciclovir ou a qualquer componente da fórmula.
Como usar
Este medicamento não deve ser partido, aberto ou mastigado.
Tendo em vista que Valcyte tem potencial para causar danos ao feto e câncer em humanos, devem ser adotadas precauções no manuseio de comprimidos quebrados. O contato direto dos comprimidos quebrados ou esmagados com a pele ou com as mucosas deve ser evitado. Caso ocorra contato, lave minuciosamente a pele com água e sabão e enxague os olhos abundantemente com estéril ou água corrente, caso água estéril não esteja disponível.
Você deve tomar Valcyte por via oral e junto com alimentos.
Tratamento de indução (dose de ataque) para retinite por CMV em pacientes adultos
Para pacientes com retinite ativa por CMV, a dose recomendada é de 900 mg (dois comprimidos de 450 mg), duas vezes ao dia, durante 21 dias. O tratamento de indução prolongado pode aumentar o risco de toxicidade na medula óssea.
Tratamento de manutenção para retinite por CMV em pacientes adultos
Em seguida ao tratamento de indução, ou em pacientes com retinite inativa por CMV, a dose recomendada é de 900 mg (dois comprimidos de 450 mg), uma vez ao dia. Os pacientes com piora da retinite podem repetir o tratamento de indução.
Prevenção da doença provocada por CMV no transplante de órgãos em pacientes adultos e pediátricos
Os pacientes pediátricos devem ser avaliados quanto à capacidade de engolir os comprimidos inteiros.
Em pacientes pediátricos receptores de transplante de órgão sólido a partir de quatro meses até 16 anos de idade, com risco de desenvolvimento da doença causada pelo CMV, a dose recomendada deverá ser calculada pelo médico com base na sua área de superfície corporal e depuração de creatinina (taxa de remoção da creatinina, uma proteína resultante do metabolismo muscular).
Para pacientes maiores que 16 anos, a dose recomendada é 900 mg (dois comprimidos de 450 mg) uma vez ao dia, igual à dose recomendada para pacientes adultos receptores de transplante
de órgão sólido.
Em pacientes adultos ou pediátricos receptores de transplante renal, o tratamento com a dose única diária recomendada deve ser iniciado até o 10º dia após o transplante e mantido até o 200º dia pós-transplante.
Em pacientes adultos ou pediátricos receptores de transplante de órgão sólido que não seja o rim, o tratamento com a dose única diária recomendada deve ser iniciado até o 10º dia após o transplante e mantido até o 100º dia póstransplante.
Para pacientes pediátricos, seu médico poderá recomendar a administração de Valcyte comprimidos revestidos, caso a dose calculada esteja dentro do limite de 10% a mais ou a menos da dose dos comprimidos e desde que você consiga engolir os comprimidos. Por exemplo, se a dose calculada estiver entre 405 mg e 495 mg, deve-se administrar um comprimido.
Recomenda-se que o médico realize o monitoramento regular dos níveis da creatinina sérica, a avaliação de alterações no peso e altura e o ajuste de dose apropriado durante o período de prevenção em pacientes pediátricos.
Instruções de dose em populações especiais
Para pacientes adultos com insuficiência renal, o médico deverá ajustar a dose de acordo com a depuração de creatinina, conforme tabela a seguir:
Tabela 1 – Dose de Valcyte comprimidos para pacientes com insuficiência renal
|
Depuração de creatinina (mL/min) |
Dose de indução |
Dose de manutenção |
|
> 60 |
900 mg, duas vezes ao dia |
900 mg, uma vez ao dia |
|
40 – 59 |
450 mg, duas vezes ao dia |
450 mg, uma vez ao dia |
|
25 – 39 |
450 mg, uma vez ao dia |
450 mg, a cada dois dias |
|
10 – 24 |
450 mg, a cada dois dias |
450 mg, duas vezes por semana |
|
< 10 |
não recomendado |
não recomendado |
Não há dados disponíveis do uso de Valcyte em pacientes com insuficiência hepática.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Valcyte?
Se você esquecer de tomar uma dose de Valcyte, tome-a assim que se lembrar e retorne ao esquema de tratamento habitual. Entretanto, se estiver quase no horário da próxima dose, pule a dose que você esqueceu e tome a próxima dose no horário habitual.
Não tome dose dobrada para compensar a que você esqueceu.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Você deve utilizar Valcyte conforme prescrito pelo seu médico.
Hipersensibilidade cruzada
Se você desenvolveu alergia a aciclovir, valaciclovir, penciclovir ou famciclovir, avise seu médico, pois você pode apresentar reação alérgica a Valcyte.
Genotoxicidade, toxicidade reprodutiva, carcinogenicidade, fertilidade e contracepção
Em animais, foi verificado que o ganciclovir é mutagênico (pode causar dano à molécula de DNA), teratogênico (pode causar malformação), carcinogênico (pode causar câncer) e pode alterar a produção de espermatozoides e comprometer a fertilidade. Portanto, Valcyte pode causar defeitos de nascimento, câncer e inibição temporária ou permanente da espermatogênese (formação de espermatozoides).
Antes do início do tratamento com ganciclovir, seu médico deve orientá-lo a respeito dos possíveis riscos ao feto e a utilizar medidas contraceptivas.
Mielossupressão (inibição da medula óssea)
Valcyte deve ser usado com precaução caso você possua citopenia hematológica (diminuição das células sanguíneas) preexistente, ou tenha recebido ou está recebendo medicamentos mielossupressores ou irradiação. Citopenia pode ocorrer a qualquer momento durante o tratamento e pode piorar com a dosagem contínua.
Leucopenia (diminuição de glóbulos brancos do sangue, responsáveis pela defesa do organismo), neutropenia (redução de um dos tipos de glóbulos brancos, responsável pela defesa de infecções), anemia (diminuição dos níveis de hemoglobina, responsável pelo transporte de oxigênio), trombocitopenia (redução das plaquetas, que auxiliam na coagulação do sangue), pancitopenia (diminuição global das células do sangue) graves, falência da medula óssea e anemia aplástica (insuficiência da produção dos precursores de hemácias) foram observadas em pacientes tratados com Valcyte (e ganciclovir). Portanto, seu médico deve solicitar testes laboratoriais para contagem de células do sangue antes do início do tratamento com Valcyte e durante o tratamento, principalmente em pacientes com comprometimento renal e em recém-nascidos e crianças. Pode ser necessário o tratamento com fator de crescimento hematopoiético (favorece a proliferação de células do sangue) e/ou a interrupção do tratamento com Valcyte.
Ganciclovir oral não pode ser substituído por Valcyte na mesma quantidade (um para um) devido ao risco de superdose.
Efeitos sobre a capacidade de conduzir veículos ou operar máquinas
Convulsões, tontura e confusão foram relatadas em decorrência do uso de Valcyte e / ou ganciclovir. Caso ocorram, tais efeitos podem afetar tarefas que requerem agilidade, inclusive a habilidade para dirigir veículos ou operar máquinas.
Até o momento, não há informações de que Valcyte possa causar doping. Em caso de dúvidas, consulte o seu médico.
Gravidez e lactação
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe ao seu médico a ocorrência de gravidez na vigência do tratamento ou após seu término e se você estiver amamentando.
O uso seguro de Valcyte durante o trabalho de parto e o parto não foi estabelecido.
Os estudos de toxicidade reprodutiva com valganciclovir não foram repetidos por causa da rápida e extensa conversão para ganciclovir. Em estudos com animais, ganciclovir foi associado com toxicidade reprodutiva e teratogenicidade.
A segurança de Valcyte para uso em mulheres grávidas não foi estabelecida. No entanto, ganciclovir se dispersa rapidamente através da placenta humana. O uso de Valcyte deve ser evitado por mulheres grávidas, a menos que os benefícios para a mãe justifiquem os riscos potenciais ao feto.
Indivíduos do sexo masculino e feminino em idade fértil
Fertilidade
Em estudos com animais, verificou-se que o ganciclovir prejudicava a possibilidade de engravidar. Em um estudo com pacientes, os com transplante renal que receberam Valcyte para evitar infecção pelo vírus CMV por até 200 dias foram comparados com um grupo não tratado. A produção de espermatozoides foi prejudicada durante o tratamento com Valcyte. No companhamento, aproximadamente seis meses após a interrupção do tratamento, em ambos os grupos houve a recuperação da produção de espermatozoide, apesar de não ter voltado ao normal em alguns pacientes que iniciaram o estudo com baixa produção.
Contracepção
Se você estiver em idade fértil, deve ser orientada a utilizar métodos de contracepção eficazes durante o tratamento e por, no mínimo, 30 dias após o término do tratamento com Valcyte.
Recomenda-se que homens sexualmente ativos utilizem preservativo durante o tratamento e por, no mínimo, 90 dias após o término do tratamento com Valcyte, a menos que se tenha certeza de que a parceira do sexo feminino não apresenta risco de engravidar.
Como a possibilidade de ganciclovir ser excretado no leite materno não pode ser excluída, causando reações adversas sérias na criança, seu médico deve avaliar a necessidade de descontinuar o medicamento ou a amamentação, levando em conta o benefício potencial de Valcyte para a mãe lactante.
Idosos
A segurança e a eficácia não foram estabelecidas nessa população de pacientes.
Uso pediátrico
Crianças nos dois primeiros anos de vida requerem um cuidadoso acompanhamento do quadro hematológico devido ao maior risco de citopenias hematológicas. É recomendável também nas crianças, o monitoramento da função do fígado e dos rins e também da perda de líquidos por vômitos ou diarreia.
Insuficiência renal
Se você tem insuficiência renal, é necessário manter a hidratação adequada durante o tratamento e que o médico faça ajustes da dose de Valcyte baseados na depuração de creatinina e monitore cuidadosamente os níveis de creatinina sérica ou da depuração de creatinina. Se você faz hemodiálise, é recomendado o uso de ganciclovir intravenoso no lugar de Valcyte.
Insuficiência hepática
Não há dados disponíveis do uso de Valcyte em pacientes com insuficiência hepática.
Ingestão concomitante com outras substâncias (interações medicamentosas)
Valcyte é o pró-fármaco de ganciclovir; portanto, as interações associadas ao ganciclovir são esperadas para Valcyte.
Por isso, é muito importante que seu médico seja informado se você estiver tomando outros medicamentos, incluindo zidovudina, didanosina, estavudina, ciclosporina, tacrolimo, micofenolato de mofetila, doxorrubicina, vimblastina, vincristina, hidroxiureia, trimetoprima / sulfonamida, dapsona, anfotericina B, flucitosina, pentamidina, interferons peguilados / ribavirina), entre outros.
Deve-se ter cuidado especial se você já estiver em tratamento com zidovudina. A administração conjunta desse medicamento com Valcyte pode levar à redução do número de neutrófilos (glóbulos brancos) e anemia e alguns pacientes podem não tolerar a terapia concomitante com dose plena.
Os pacientes em uso de Valcyte e didanosina devem ser monitorados cuidadosamente devido ao risco de toxicidade por didanosina.
Pacientes que recebem probenecida e Valcyte devem ser monitorados rigorosamente quanto à toxicidade por ganciclovir.
Foram relatadas convulsões em pacientes em uso de imipenem-cilastatina (usado como antibiótico) e ganciclovir.
Valcyte não deve ser usado concomitantemente com imipenem-cilastatina, a menos que os benefícios potenciais superem os riscos potenciais.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Além dos efeitos benéficos de Valcyte, é possível que ocorram efeitos indesejáveis durante o tratamento, mesmo quando administrado conforme a prescrição. O médico pode interromper o tratamento temporária ou definitivamente, dependendo de suas condições.
Você deve verificar todos os possíveis efeitos adversos do uso de Valcyte com o seu médico. Se você apresentar sintomas, você deve contatar seu médico imediatamente.
Experiência dos estudos clínicos com Valcyte
Como valganciclovir é um pró-fármaco de ganciclovir, é esperado que os efeitos indesejáveis sabidamente associados ao uso de ganciclovir ocorram com Valcyte. Todas as reações adversas observadas nos estudos clínicos de Valcyte haviam sido observadas previamente nos estudos realizados com ganciclovir.
Dessa forma, reações adversas reportadas com ganciclovir intravenoso ou oral ou com valganciclovir estão descritas a seguir.
As seguintes categorias de frequência serão utilizadas nesta seção:
- Muito comum (ocorre em 10% ou mais dos pacientes que utilizam este medicamento).
- Comum (ocorre entre 1 e 10% dos pacientes que utilizam este medicamento).
- Incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento).
- Raro (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento).
- Muito raro (ocorre em 0,01% ou menos dos pacientes que utilizam este medicamento).
Em pacientes tratados com valganciclovir / ganciclovir, as reações adversas ao medicamento mais sérias e frequentes são reações hematológicas e incluem neutropenia, anemia e trombocitopenia.
O perfil de segurança global de ganciclovir / valganciclovir é consistente em populações com HIV e em receptores de transplante, com exceção de descolamento de retina, que foi relatado somente em pacientes com HIV com retinite por CMV. No entanto, existem algumas diferenças na frequência de determinadas reações.
Valganciclovir está associado a um maior risco de diarreia em comparação com ganciclovir intravenoso. Pirexia (febre), infecções por Candida, depressão, neutropenia grave e reações cutâneas são relatadas com mais frequência em pacientes com HIV.
Disfunções renal e hepática são relatadas com mais frequência em receptores de transplante de órgão.
Infecções e infestações:
Muito comum:
Infecções por Candida incluindo candidíase oral (infecção fúngica), infecção do trato respiratório superior.
Comum:
Sepse (infecção geral grave), gripe, infecção do trato urinário, celulite.
Distúrbios do sangue e do sistema linfático:
Muito comum:
Neutropenia (redução de um dos tipos de glóbulos brancos, responsável pela defesa de infecções), anemia (diminuição dos níveis de hemoglobina, responsável pelo transporte de oxigênio dos pulmões aos tecidos, na circulação sanguínea).
Comum:
Trombocitopenia (redução das plaquetas, que auxiliam na coagulação do sangue), leucopenia (diminuição de glóbulos brancos do sangue, que são responsáveis pela defesa do organismo), pancitopenia (diminuição global de elementos celulares do sangue como glóbulos brancos, vermelhos e plaquetas).
Incomum:
Insuficiência da medula óssea.
Rara:
Anemia aplástica, agranulocitose*, granulocitopenia*.
Distúrbios do sistema imunológico:
Comum:
Hipersensibilidade.
Rara:
Reação anafilática*.
Distúrbios do metabolismo e da nutrição:
Muito comum:
Redução de apetite.
Comum:
Redução de peso.
Distúrbios psiquiátricos:
Comum:
Depressão, estado de confusão, ansiedade.
Incomum:
Agitação, transtorno psicótico, pensamento anormal, alucinações.
Distúrbios do sistema nervoso:
Muito comum:
Cefaleia (dor de cabeça).
Comum:
Insônia, neuropatia periférica (comprometimento dos nervos periféricos que se manifesta por formigamentos, perda de sensibilidade), tontura, parestesia (formigamento ou dormência de uma região do corpo), hipoestesia (diminuição de diversas formas de sensibilidade), convulsão, disgeusia (distúrbio do paladar).
Incomum:
Tremor.
Distúrbios oculares:
Comum:
Comprometimento visual, descolamento de retina**, moscas volantes, dor ocular, conjuntivite, edema macular.
Distúrbios do ouvido e do labirinto:
Comum:
Dor de ouvido.
Incomum:
Surdez.
Distúrbios cardíacos:
Incomum:
Arritmias.
Distúrbios vasculares:
Comum:
Hipotensão.
Distúrbios respiratórios, torácicos e mediastinais:
Muito comum:
Tosse, dispneia (dificuldade para respirar).
Distúrbios gastrointestinais:
Muito comum:
Diarreia, náusea, vômito, dor abdominal.
Comum:
Dispepsia (dificuldade de digestão), flatulência, dor abdominal superior, constipação, ulceração na boca, disfagia (incapacidade ou dificuldade para engolir), distensão abdominal, pancreatite.
Distúrbios hepatobiliares:
Comum:
Aumento da fosfatase alcalina sanguínea (substância produzida por muitos tecidos, como fígado e ossos), função hepática anormal, aumento de aspartato aminotransferase, aumento de alanina aminotransferase.
Distúrbios da pele e do tecido subcutâneo:
Muito comum:
Dermatite.
Comum:
Sudorese noturna, prurido (coceira), erupção cutânea, alopecia (queda temporária de pelos e cabelos).
Incomum:
Pele seca, urticária.
Distúrbios musculoesqueléticos e do tecido conjuntivo:
Comum:
Dor nas costas, mialgia (dor muscular, localizada ou não), artralgia (dor na articulação), espasmos musculares.
Distúrbios renais e urinários:
Comum:
Comprometimento renal, redução da depuração de creatinina renal, aumento de creatinina sanguínea (substância que indica insuficiência renal).
Incomum:
Insuficiência renal, hematúria (presença de sangue na urina).
Distúrbios do sistema reprodutor e da mama:
Incomum:
Infertilidade masculina.
Distúrbios gerais e condições no local de administração:
Muito comum:
Pirexia (febre), fadiga.
Comum:
Dor, calafrios, mal-estar, astenia.
Incomum:
Dor torácica.
* As frequências dessas reações adversas são derivadas da experiência pós-comercialização.
** Descolamento de retina foi relatado somente em estudos em pacientes com HIV tratados para retinite por CMV.
Descrição de reações adversas selecionadas
Neutropenia:
O risco de neutropenia não é previsível com base no número de neutrófilos antes do tratamento. A neutropenia ocorre geralmente durante a primeira ou segunda semana da terapia de indução. A contagem de células é em geral normalizada no período de 2 a 5 dias após a descontinuação do medicamento ou a redução da dose.
Trombocitopenia:
Pacientes com baixa contagem de plaquetas apresentam um risco maior de desenvolver trombocitopenia. Pacientes com imunossupressão iatrogênica decorrente do tratamento com medicamentos imunossupressores estão em risco mais elevado de trombocitopenia do que os pacientes com HIV. A trombocitopenia grave pode estar associada a sangramento com possível risco à vida.
Influência da duração do tratamento ou indicação nas reações adversas
Neutropenia grave é observada com maior frequência em pacientes com retinite por CMV submetidos a tratamento com valganciclovir do que em pacientes de transplante de órgãos sólidos que receberam valganciclovir ou ganciclovir oral. Em pacientes que receberam valganciclovir ou ganciclovir oral até o dia 100 pós-transplante, a incidência de neutropenia grave foi de 5% e 3%, respectivamente, enquanto que em pacientes que receberam valganciclovir até o dia 200 pós-transplante, a incidência de neutropenia grave foi de 10%.
Houve um aumento maior na creatinina sérica observada em pacientes de transplante de órgãos sólidos tratados até o dia 100 ou dia 200 pós-transplante com ambos valganciclovir e ganciclovir oral, quando comparado com pacientes com retinite por CMV. No entanto, insuficiência renal é uma característica mais frequente em pacientes de transplante de órgãos sólidos.
O perfil de segurança global de Valcyte não se alterou com a extensão da profilaxia até 200 dias em pacientes transplantados renais de alto risco. Leucopenia foi relatada com uma incidência ligeiramente mais elevada no braço de 200 dias, enquanto a incidência de neutropenia, anemia e trombocitopenia foram semelhantes em ambos os braços.
Prevenção da doença causada por CMV em pacientes pediátricos de TOS
Em geral, o perfil de segurança global em pacientes pediátricos foi similar ao perfil em adultos. Neutropenia foi reportada com uma incidência ligeiramente maior nos dois estudos pediátricos em comparação aos estudos com adultos, porém neutropenia e eventos adversos infecciosos não foram, em geral, correlacionados nas populações pediátricas. Em pacientes pediátricos receptores de transplante de rim, a extensão do tratamento com Valcyte até 200 dias não se associou ao aumento da incidência de eventos adversos.
CMV congênita
A segurança e eficácia de Valcyte comprimidos revestidos não foram estabelecidas em crianças para tratamento de infecção por CMV congênita.
Anormalidades laboratoriais
As anormalidades laboratoriais reportadas em pacientes com retinite por CMV e pacientes adultos e pediátricos de TOS foram neutropenia, anemia, trombocitopenia e aumento da creatinina no sangue. A incidência de anormalidades em pacientes adultos laboratoriais foi comparável com a extensão da profilaxia em até 200 dias em pacientes transplantados renais de alto risco.
A incidência de neutropenia grave foi maior em pacientes pediátricos de transplante de rim tratados até o 200º dia em comparação com pacientes pediátricos de transplante de rim tratados até o 100º dia ou pacientes adultos de transplante de rim tratados até o 100º ou 200º dia.
Experiência pós-comercialização com ganciclovir e Valcyte
Os relatórios de segurança baseados nos dados recebidos de pacientes que utilizavam Valcyte são consistentes com os dados de segurança vistos quando o ganciclovir e valganciclovir foram avaliados dentro de pesquisas clínicas.
Atenção: este produto é um medicamento que possui uma ampliação de uso no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
Composição
Cada comprimido revestido contém:
496,3 mg de cloridrato de valganciclovir (equivalente a 450 mg de valganciclovir).
Excipientes: povidona, crospovidona, celulose microcristalina, ácido esteárico, mistura de revestimento (hipromelose, dióxido de titânio, macrogol, óxido de ferro vermelho e polissorbato).
Superdosagem
Experiência de superdose com Valcyte e ganciclovir intravenoso
A superdose de valganciclovir também pode resultar em aumento da toxicidade renal.
Foram recebidos relatórios de superdose com ganciclovir intravenoso, com alguns desfechos fatais, gerados de estudos clínicos e durante a experiência pós-comercialização. Em alguns desses casos não foram relatados eventos adversos.
A maioria dos pacientes experimentou um ou mais dos seguintes eventos adversos:
Mielossupressão incluindo pancitopenia (diminuição global de elementos celulares do sangue), falência da medula óssea, leucopenia (diminuição do número de glóbulos brancos no sangue), neutropenia (redução de um dos tipos de glóbulos brancos, responsável pelo combate às bactérias), granulocitopenia (redução dos granulócitos, subgrupo específico dos glóbulos brancos), hepatite (inflamação do fígado), distúrbio da função do fígado, agravamento da hematúria (presença de sangue na urina) em um paciente com insuficiência renal preexistente, lesão renal aguda, creatinina elevada, dor abdominal, diarreia, vômito, tremor generalizado e convulsão.
A hemodiálise e a hidratação podem ser benéficas para reduzir a concentração plasmática do fármaco em pacientes que tenham recebido superdose de valganciclovir.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações medicamentosas com Cloridrato de Valganciclovir (substância ativa)
Cloridrato de Valganciclovir (substância ativa) é o pró-fármaco de ganciclovir; portanto, as interações associadas ao ganciclovir são esperadas para Cloridrato de Valganciclovir (substância ativa).
Interações medicamentosas com ganciclovir
Imipenem-cilastatina
Convulsões têm sido relatadas em pacientes que receberam ganciclovir e imipenemcilastatina concomitantemente e uma interação farmacodinâmica entre esses dois medicamentos não pode ser descartada. Esses medicamentos não devem ser utilizados concomitantemente, a menos que os benefícios potenciais superem os riscos potenciais.
Interações medicamentosas potenciais
A toxicidade pode ser aumentada quando ganciclovir / Cloridrato de Valganciclovir (substância ativa) é administrado concomitantemente com outros medicamentos conhecidos por serem mielossupressores ou por estarem associados à insuficiência renal. Isso inclui análogos de nucleosídeos (ex.: zidovudina, didanosina, estavudina), imunossupressores (ex.: ciclosporina, tacrolimo, micofenolato de mofetila), agentes antineoplásicos (ex.: doxorrubicina, vimblastina, vincristina, hidroxiureia), anti-infecciosos (ex.: trimetoprima/sulfonamidas, dapsona, anfotericina B, flucitosina, pentamidina) e interferons peguilados / ribavirina. Portanto, esses medicamentos só devem ser considerados para uso concomitante com Cloridrato de Valganciclovir (substância ativa) se os potenciais benefícios superarem os riscos potenciais.
Zidovudina
Zidovudina e ganciclovir possuem o potencial de causar neutropenia e anemia; pode haver uma interação farmacodinâmica durante a administração concomitante desses medicamentos e alguns pacientes podem não tolerar a terapia concomitante na dose completa.
Didanosina
As concentrações plasmáticas da didanosina encontradas foram consistentemente aumentadas, quando administrada com ganciclovir i.v. Em doses intravenosas de 5 e 10 mg/kg/dia, observou-se aumento da ASC da didanosina que variou de 38% a 67%, confirmando uma interação farmacocinética durante a administração concomitante desses medicamentos. Não se observou efeito clinicamente significativo sobre as concentrações de ganciclovir. Pacientes devem ser monitorados cuidadosamente quanto à toxicidade por didanosina (por exemplo, pancreatite).
Probenecida
A probenecida administrada com ganciclovir oral resultou em diminuição estatisticamente significativa da depuração renal de ganciclovir (20%), levando a aumento estatisticamente significativo da exposição (40%). Essas mudanças foram consistentes com o mecanismo de interação que envolve excreção tubular renal competitiva. Portanto, os pacientes que recebem probenecida e Cloridrato de Valganciclovir (substância ativa) devem ser monitorados cuidadosamente quanto à toxicidade por ganciclovir.
Ação da Substância
Resultados de eficácia
Pacientes adultos
Tratamento da retinite por CMV
Estudos clínicos de Cloridrato de Valganciclovir (substância ativa) foram realizados em pacientes com AIDS e retinite por CMV. Cloridrato de Valganciclovir (substância ativa) apresentou eficácia comparável à do ganciclovir intravenoso para tratamento de retinite por CMV.
Pacientes com retinite por CMV recém-diagnosticada foram randomizados em um estudo, para terapia de indução com Cloridrato de Valganciclovir (substância ativa) ou ganciclovir intravenoso. A proporção de pacientes com progressão da retinite por CMV na quarta semana foi a mesma em ambos os grupos de tratamento.
Depois do tratamento de indução (dose de ataque), os pacientes receberam nesse estudo tratamento de manutenção com Cloridrato de Valganciclovir (substância ativa) na dose de 900 mg ao dia. O tempo médio (mediana) desde a randomização até a progressão da retinite por CMV no grupo que recebeu tratamento de indução e de manutenção com Cloridrato de Valganciclovir (substância ativa) foi de 226 (160) dias e no grupo que recebeu tratamento de indução com ganciclovir intravenoso e tratamento de manutenção com Cloridrato de Valganciclovir (substância ativa) foi de 219 (125) dias.
Cloridrato de Valganciclovir (substância ativa) promove exposição sistêmica de ganciclovir similar à atingida com as doses recomendadas de ganciclovir intravenoso, sendo demonstrado que o mesmo é eficaz no tratamento de retinite por CMV. Observouse que a ASC de ganciclovir correlaciona-se ao tempo de progressão da retinite por CMV.
Prevenção da doença por CMV em pacientes transplantados
Um estudo comparativo duplo-cego, controlado por placebo, foi realizado em pacientes receptores de transplante de coração, fígado e rim com alto risco de doença pelo CMV (D+/R-). Os pacientes receberam Cloridrato de Valganciclovir (substância ativa) 900 mg, uma vez ao dia, ou ganciclovir oral 1.000 mg, três vezes ao dia, iniciando até o 10º dia após o transplante e mantido até o 100º dia pós-transplante. A incidência de doença por CMV (síndrome causada pelo CMV e doença invasiva) nos seis meses após o transplante foi de 12,1% no grupo tratado com Cloridrato de Valganciclovir (substância ativa) (n = 239) e de 15,2% no grupo tratado com ganciclovir oral (n = 125). Os resultados não foram uniformes nos diferentes tipos de transplante.
A incidência de doença causada por CMV nos diferentes tipos de transplante, grupo tratado com Cloridrato de Valganciclovir (substância ativa) e no grupo tratado com ganciclovir, foi, respectivamente, 6,0% e 23,0% no transplante de rim, 6,0% e 10,0% no transplante de coração, 19,0% e 12,0% no transplante de fígado, e 0,0% e 17,0% no transplante de pâncreas e rim. Não foi esclarecido o porquê da maior incidência de doença causada por CMV em receptores de transplante de fígado no grupo tratado com Cloridrato de Valganciclovir (substância ativa). A maioria dos casos ocorreu após o término da profilaxia (100 dias após o transplante). Os casos no grupo tratado com Cloridrato de Valganciclovir (substância ativa) ocorreram, em média, mais tardiamente que no grupo tratado com ganciclovir. A incidência de rejeição aguda nos primeiros seis meses foi 29,7% em pacientes do grupo tratado com Cloridrato de Valganciclovir (substância ativa), comparado com 36,0% no grupo tratado com ganciclovir oral.
Um estudo duplo-cego, controlado por placebo foi realizado em 326 pacientes transplantados renais com alto risco de doença por CMV (D+ /R-) para avaliar a eficácia e a segurança de se estender a profilaxia para CMV com Cloridrato de Valganciclovir (substância ativa) de 100 para 200 dias pós-transplante. Os pacientes foram randomizados (1:1) para receber Cloridrato de Valganciclovir (substância ativa) comprimidos (900 mg ao dia) no prazo de 10 dias do transplante, até 200 dias após o transplante ou até 100 dias após o transplante, seguido por 100 dias de placebo.
100 dias após o transplante, seguido por 100 dias de placebo. Estender a terapia profilática para CMV com Cloridrato de Valganciclovir (substância ativa) até 200 dias pós-transplante demonstrou ser superior na prevenção da doença CMV nos primeiros 12 meses após o transplante renal em pacientes de alto risco em relação ao regime de dose 100 dias.
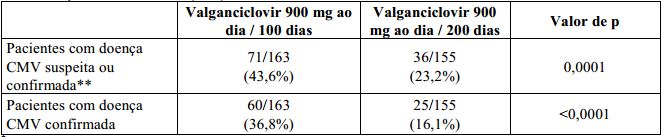
A proporção de pacientes que desenvolveram doença por CMV nos primeiros 12 meses pós-transplante é mostrada na Tabela 1 a seguir.
Tabela 1 – Porcentagem de pacientes com transplante de rim com doença CMV*, 12 meses - população com intenção de tratamento (ITT):
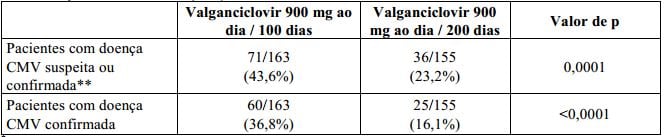 * Doença por CMV é definida como síndrome CMV ou invasão tecidual por CMV.
* Doença por CMV é definida como síndrome CMV ou invasão tecidual por CMV.
** CMV confirmado é um caso de doença por CMV clinicamente confirmado. Os pacientes foram considerados como tendo doença por CMV caso não tenha sido feito avaliação na semana 52 ou não tenha sido confirmada doença por CMV antes desse momento.
A taxa de sobrevida do enxerto em 12 meses pós-transplante foi de 98,2% (160/163) para o esquema posológico de 100 dias e 98,1% (152/155) para o esquema posológico de 200 dias. A incidência de rejeição aguda comprovada por biópsia em 12 meses pós-transplante foi de 17,2% (28/163) para o esquema posológico de 100 dias e 11,0% (17/155) para o esquema posológico de 200 dias.
Prevenção da doença por CMV em pacientes de TOS de risco moderado (D+/R+, D-/R+)
Estudos clínicos foram avaliados para compreender a eficácia de Cloridrato de Valganciclovir (substância ativa) na prevenção da doença por CMV em pacientes adultos receptores de TOS de risco moderado.
Em um estudo prospectivo e randomizado,13 dos 98 pacientes pós-transplante renal avaliados, 69 (70%) apresentavam risco moderado (D±/ R+) e desses, 33 receberam profilaxia e 36 foram tratados com terapia preemptiva. Os pacientes randomizados para profilaxia receberam Cloridrato de Valganciclovir (substância ativa) 900 mg/dia por 3 meses após o transplante, enquanto os pacientes que receberam terapia preemptiva foram monitorados semanalmente por PCR para detectar a carga viral de CMV durante 16 semanas e, posteriormente, nos meses 5, 6, 9 e 12. Quando detectado o CMV no grupo que recebeu terapia preemptiva, os pacientes receberam Cloridrato de Valganciclovir (substância ativa) 900 mg 2x/dia por 21 dias, seguido de manutenção até a negativação do CMV no sangue. A incidência de infecção por CMV nos pacientes D±/R+ foi menor no grupo que recebeu profilaxia (21%) em comparação com o grupo que recebeu terapia preemptiva (61%). A maioria das infecções de CMV (95%) foi assintomática.
O segundo estudo14 foi realizado com o objetivo de determinar se receptores de transplante renal R+ tinham maior taxa de infecção ativa e doença por CMV quando tratados preemptivamente comparados aos receptores sob profilaxia primária com Cloridrato de Valganciclovir (substância ativa); e se houve correlação com disfunção crônica do enxerto e sobrevida do enxerto/paciente em longo prazo. Duzentos e noventa e seis receptores foram analisados (168 D+/R+, 128 D-/R+, 146 receberam profilaxia e 150 terapia preemptiva). Os resultados do estudo mostraram que a profilaxia com Cloridrato de Valganciclovir (substância ativa) oral reduziu significativamente infecção e doença por CMV e suportam a profilaxia de rotina para pacientes R+.
Uma revisão realizada pela Sociedade Americana de Doenças Infecciosas de Transplante descreve a importância da prevenção de CMV em pacientes de TOS e explica que o risco de desenvolver doença por CMV varia de acordo com o órgão transplantado (maior risco em receptores de transplante de pulmão e intestino delgado), o nível de imunossupressão e o estado sorológico do doador e receptor. Esta revisão recomenda o uso de Cloridrato de Valganciclovir (substância ativa) profilático com nível de evidência I / II para pacientes com risco alto (D+/R-) e moderado (D+/R+ ou D-/R+) para CMV que são receptores de transplante de fígado, pulmão, coração, coração-pulmão, rim, pâncreas, rim-pâncreas ou intestino.
A recomendação de uma diretriz de consenso sobre o manejo da infecção por CMV descreve a profilaxia em receptores de TOS com risco alto (D+/R-) ou moderado (D+/R+ ou D-/R+), detalhando o uso preferencial de Cloridrato de Valganciclovir (substância ativa) em receptores de transplante de rim e coração (forte recomendação e alta evidência); fígado, intestino delgado e pâncreas (forte recomendação e baixa evidência) e; pulmão (forte recomendação e evidência moderada).
Essas recomendações são endossadas por uma diretriz de consenso internacional que recomenda Cloridrato de Valganciclovir (substância ativa) para profilaxia universal em receptores de TOS de risco moderado a alto para CMV e reconhece que os receptores de transplante de pulmão têm um alto risco de desenvolver CMV.
Pacientes pediátricos
Prevenção da doença por CMV em pacientes transplantados
Cloridrato de Valganciclovir (substância ativa) foi estudado em cinco estudos clínicos abertos e multicêntricos em pacientes pediátricos receptores de transplante de órgãos sólidos (TOS) de risco moderado (D+/R+, D-/R+) a alto (D+/R-).
Dois estudos avaliaram o desenvolvimento da doença por CMV, como medida de eficácia, após profilaxia com Cloridrato de Valganciclovir (substância ativa) por até 100 e 200 dias pós-transplante utilizando o algoritmo de dose pediátrica.
Um estudo de transplante de órgãos sólidos (WV16726) incluiu 63 pacientes pediátricos receptores de rim, fígado e coração com idade média de 9 anos (quatro meses a 16 anos) que receberam doses diárias de Cloridrato de Valganciclovir (substância ativa) por até 100 dias. Nenhum evento de CMV relatado durante o estudo foi enquadrado na definição de doença por CMV. Eventos de CMV foram relatados em sete pacientes durante o estudo, entre os quais três não necessitaram de ajuste do medicamento em estudo ou não foram tratados e, portanto, não foram considerados clinicamente significativos.
O segundo estudo em pacientes de TOS (NV25409) foi um estudo multicêntrico, aberto, não comparativo, com braço único que avaliou a tolerabilidade por até 200 dias de profilaxia com Cloridrato de Valganciclovir (substância ativa) tanto para solução oral quanto para comprimidos revestidos em 57 pacientes pediátricos receptores de transplante renal entre 4 meses e 16 anos de idade, com acompanhamento do período sem tratamento até a 52° semana pós-transplante.
Nenhum evento de CMV relatado durante o estudo foi enquadrado na definição de doença por CMV. Dos quatro pacientes que relataram eventos de CMV, um não pôde ser confirmado pelo laboratório central e um dos outros três eventos não necessitou de tratamento e, portanto, não foi considerado clinicamente significativo.
Resistência viral
A resistência viral ao ganciclovir pode surgir depois de administração crônica de Cloridrato de Valganciclovir (substância ativa) por seleção de mutações, tanto no gene da quinase viral (UL97), responsável pela monofosforilação de ganciclovir, como no gene da polimerase viral (UL54). As mutações no gene UL97 surgem antes e mais frequentemente que as mutações em UL54.
Vírus com mutações no gene UL97 são resistentes ao ganciclovir isolado, sendo M460V/I, H520Q, C592G, A594V, L595S, C603W as mutações mais frequentemente reportadas com resistência a gangiclovir associada a substituições. Mutações no gene UL54 podem levar à resistência cruzada a outros antivirais que têm a polimerase viral como alvo, e vice-versa. Substituições de aminoácidos no UL54 que conferem resistência cruzada a ganciclovir e cidofovir são geralmente localizadas no domínio da exonuclease e região V. As substituições de aminoácidos que conferem resistência cruzada ao foscarnete são diversas, mas concentram-se nas regiões II (códon 696-742) e III (códon 805-845) e entre elas.
Tratamento da retinite por CMV em adultos
Uma análise genotípica do CMV em isolados de leucócitos polimorfonucleares (LPMN) de 148 pacientes com retinite causada por CMV incluídos em um estudo clínico mostrou que 2,2%, 6,5%, 12,8% e 15,3% desses isolados apresentam mutações UL97 após 3, 6, 12 e 18 meses, respectivamente, de tratamento com Cloridrato de Valganciclovir (substância ativa).
Prevenção da doença por CMV em pacientes transplantados adultos
A resistência também foi estudada por análise genotípica do CMV em amostras de LPMN coletadas no 100º dia (fim da profilaxia) e em casos suspeitos de doença causada por CMV até seis meses após o transplante. Dos 245 pacientes randomizados para receber Cloridrato de Valganciclovir (substância ativa), 198 amostras do 100º dia estavam disponíveis para teste e nenhuma mutação de resistência ao ganciclovir foi identificada.
Em 103 amostras testadas no braço de pacientes tratados com ganciclovir oral, foram observadas duas mutações (1,9%) de resistência ao ganciglovir. Dos 245 pacientes randomizados para receber Cloridrato de Valganciclovir (substância ativa), amostras de 50 pacientes com suspeita de doença causada por CMV foram testadas e nenhuma mutação de resistência foi observada. Dos 125 pacientes do braço comparador de ganciclovir oral, 29 amostras de pacientes com suspeita de doença causada pelo CMV foram testadas, e duas mutações de resistência foram identificadas (incidência de resistência de 6,9%).
A resistência foi avaliada em um estudo para estender a profilaxia de CMV com Cloridrato de Valganciclovir (substância ativa) de 100 para 200 dias pós-transplante em pacientes adultos receptores de transplante renal de alto risco para doença por CMV (D+/R-). Cinco pacientes do grupo que recebeu 100 dias de tratamento e quatro pacientes do grupo que recebeu 200 dias de tratamento, os quais atingiram o critério de análise da resistência, apresentaram substituições de aminoácidos sabidamente associadas com resistência a ganciclovir. Em seis pacientes, foram detectadas as seguintes substituições de aminoácidos associadas com resistência em pUL97: A440V, M460V e C592G no grupo que recebeu 100 dias de tratamento, e M460V e C603W no grupo que recebeu 200 dias de tratamento.
Em três pacientes, foram detectadas as seguintes substituições de aminoácidos associadas com resistência em pUL54: E315D no grupo que recebeu 100 dias de tratamento e E315D e P522S no grupo que recebeu 200 dias de tratamento. Em geral, a detecção de substituições de aminoácidos sabidamente associadas com resistência a ganciclovir foi observada mais frequêntemente em pacientes durante a terapia profilática que após o fim dessa terapia (5/12 [42%] durante a terapia versus 4/58 [7%] após a terapia). A possibilidade de resistência viral deve ser considerada em pacientes que apresentam resposta clínica insatisfatória ou excreção viral persistente durante a terapia.
Características Farmacológicas
Farmacodinâmica
Mecanismo de ação
O Cloridrato de Valganciclovir (substância ativa) é um L-valil éster (pró-fármaco) de ganciclovir o qual, após administração oral, é rapidamente convertido para ganciclovir pelas esterases intestinais e hepáticas. O ganciclovir é um análogo sintético da 2’-desoxiguanosina, a qual inibe a replicação dos vírus do herpes, in vitro e in vivo. Os vírus humanos sensíveis incluem o citomegalovírus humano (HCMV), os vírus herpes simples 1 e 2 (HSV-1 e HSV-2), os vírus herpes humano 6, 7 e 8 (HHV-6, HHV-7, HHV-8), o vírus de Epstein-Barr (EBV), o vírus da varicela-zóster (VZV) e o vírus da hepatite B.
Nas células infectadas por CMV, o ganciclovir é inicialmente fosforilado para ganciclovir monofosfato pela quinase da proteína viral, UL97. As fosforilações adicionais são realizadas pelas quinases celulares, para produzir trifosfato de ganciclovir, o qual passa a ser lentamente metabolizado intracelularmente. Foi demonstrado que isso ocorre nas células infectadas por HSV e HCMV com meias-vidas de 18 e entre 6 e 24 horas, respectivamente, após a remoção do ganciclovir extracelular.
Como a fosforilação é muito dependente da quinase viral, a fosforilação do ganciclovir ocorre preferencialmente nas células infectadas por vírus.
A atividade virustática do ganciclovir é devida à inibição da síntese do DNA viral pela inibição competitiva da incorporação da desoxiguanosina trifosfato ao DNA viral pela DNA polimerase viral e pela incorporação do trifosfato de ganciclovir ao DNA viral, causando a finalização ou o prolongamento muito limitado do DNA viral.
O IC50 antiviral típico contra o CMV in vitro encontra-se na faixa de 0,08 ?M (0,02 mcg/mL) até 14 ?M (3,5 mcg/mcL).
O efeito antiviral de Cloridrato de Valganciclovir (substância ativa) foi clinicamente comprovado no tratamento de pacientes com AIDS e com diagnóstico recente de retinite causada pelo CMV (estudo clínico WV15376). A prevalência do CMV diminuiu de 46% (32/69), no início do estudo, para 7% (4/55) quatro semanas após o tratamento com Cloridrato de Valganciclovir (substância ativa).
Farmacocinética
As propriedades farmacocinéticas de Cloridrato de Valganciclovir (substância ativa) foram avaliadas em pacientes soropositivos para HIV e CMV, em pacientes com AIDS e retinite causada por CMV e em receptores de transplante de órgão sólido.
Os parâmetros que controlam a exposição de ganciclovir a partir de Cloridrato de Valganciclovir (substância ativa) são biodisponibilidade e função renal. A biodisponibilidade de ganciclovir a partir de Cloridrato de Valganciclovir (substância ativa) é comparável em todas as populações estudadas (pacientes adultos e pediátricos). A exposição sistêmica de ganciclovir em pacientes receptores de transplante de coração, rim e fígado foi similar após administração oral de Cloridrato de Valganciclovir (substância ativa), conforme algoritmo de dose para função renal em adultos e algoritmo de dose para pacientes pediátricos.
A proporcionalidade da dose em relação à ASC do ganciclovir, após administração de Cloridrato de Valganciclovir (substância ativa) na faixa de dose de 450 a 2.625 mg, foi demonstrada somente quando administrada no estado alimentado.
Absorção
A biodisponibilidade de ganciclovir, a partir de Cloridrato de Valganciclovir (substância ativa), é dez vezes maior que a partir de cápsulas de ganciclovir.
O Cloridrato de Valganciclovir (substância ativa) é o pró-fármaco do ganciclovir, e é bem absorvido no trato gastrintestinal e rapidamente metabolizado na parede intestinal e no fígado para ganciclovir. A biodisponibilidade de ganciclovir, a partir da administração oral de Cloridrato de Valganciclovir (substância ativa), é de aproximadamente 60% no estado em jejum. A exposição sistêmica ao Cloridrato de Valganciclovir (substância ativa) é temporária e baixa, com valores da ASC0 –24h e Cmáx de, aproximadamente, 1% e 3% daquelas do ganciclovir, respectivamente.
Efeito de alimentos
Quando os comprimidos de Cloridrato de Valganciclovir (substância ativa) foram administrados na dose recomendada de 900 mg, foram observados aumentos no valor médio da ASC24 de ganciclovir (aproximadamente 30%) e no valor médio da Cmáx de ganciclovir (aproximadamente 14%). Portanto, é recomendável que Cloridrato de Valganciclovir (substância ativa) seja administrado com alimentos.
Distribuição
Devido à rápida conversão de Cloridrato de Valganciclovir (substância ativa) para ganciclovir, a ligação proteica de Cloridrato de Valganciclovir (substância ativa) não foi determinada. A ligação de ganciclovir às proteínas plasmáticas é de 1% a 2% para concentrações de 0,5 e 51 mcg/mL. O volume de distribuição de ganciclovir no estado de equilíbrio, após administração intravenosa, foi de 0,680 ± 0,161 L/kg.
Metabolismo
O Cloridrato de Valganciclovir (substância ativa) é rapidamente hidrolisado à ganciclovir. Outros metabólitos não foram detectados. Nenhum metabólito de ganciclovir radiomarcado administrado por via oral (dose única de 1.000 mg) foi responsável por mais que 1% a 2% da radioatividade recuperada nas fezes ou na urina.
Eliminação
Após uma dose de Cloridrato de Valganciclovir (substância ativa), excreção renal de ganciclovir por filtração glomerular e secreção tubular ativa é a principal via de eliminação de Cloridrato de Valganciclovir (substância ativa). A depuração renal responde por 81,5% ± 22% da depuração sistêmica de ganciclovir.
Farmacocinética em populações especiais
Pacientes com insuficiência renal
A diminuição da função renal resultou em decréscimo na depuração de ganciclovir a partir do Cloridrato de Valganciclovir (substância ativa), com aumento correspondente da meia-vida terminal. Portanto, são necessários ajustes de dose em pacientes com insuficiência renal.
Para pacientes em hemodiálise (ClCr < 10 mL/min), recomenda-se o uso de ganciclovir intravenoso no lugar de Cloridrato de Valganciclovir (substância ativa), pois a dose individual de Cloridrato de Valganciclovir (substância ativa) requerida para esses pacientes é inferior à dose do comprimido de 450 mg. Aproximadamente metade do ganciclovir presente no início de uma sessão de diálise é removida durante o procedimento. A meiavida média intradiálise e a meia-vida média interdiálise são estimadas em 3,47 horas e 51,0 horas, respectivamente.
Pacientes com insuficiência hepática
A farmacocinética do ganciclovir a partir do Cloridrato de Valganciclovir (substância ativa) em receptores de transplante hepático estáveis foi investigada em um estudo cruzado, aberto, de quatro partes (n = 28). A biodisponibilidade absoluta do ganciclovir a partir de Cloridrato de Valganciclovir (substância ativa), após uma dose única de 900 mg de Cloridrato de Valganciclovir (substância ativa) com alimento, foi de, aproximadamente, 60%, de acordo com estimativas obtidas em outras populações de pacientes.
A ASC0–24h de ganciclovir foi comparável àquela atingida com uma dose de 5 mg/kg de ganciclovir intravenoso em receptores de transplante hepático.
População geriátrica As características farmacocinéticas de Cloridrato de Valganciclovir (substância ativa) em pacientes idosos não foram estabelecidas. A função renal deve ser avaliada antes e durante a administração de Cloridrato de Valganciclovir (substância ativa) nestes pacientes, pois indivíduos idosos têm frequêntemente uma taxa de filtração glomerular reduzida.
Pacientes com fibrose cística
Em um estudo farmacocinético de fase I, a exposição a ganciclovir no estado de equilíbrio foi avaliada em receptores de transplante de pulmão com ou sem fibrose cística (n=31) que estavam recebendo 900 mg/dia de Cloridrato de Valganciclovir (substância ativa) como parte da profilaxia pós-transplante. O estudo indicou que a presença de fibrose cística não teve influência estatisticamente significativa na exposição sistêmica global média a ganciclovir em receptores de transplante de pulmão. A exposição a ganciclovir em receptores de transplante de pulmão foi comparável à exposição demonstrada como sendo eficaz na prevenção da doença por CMV em outros pacientes receptores de transplante de órgãos sólido.
Pacientes pediátricos - prevenção da doença por CMV no transplante
A farmacocinética de ganciclovir foi avaliada após a administração de Cloridrato de Valganciclovir (substância ativa) em 63 pacientes pediátricos de transplante de órgãos sólidos com idades entre 4 meses e 16 anos e em 16 pacientes pediátricos de transplante de coração com menos de 4 meses de idade. Nestes estudos, os pacientes receberam doses orais de Cloridrato de Valganciclovir (substância ativa) (Cloridrato de Valganciclovir (substância ativa) para solução oral ou comprimidos) para produzir exposição equivalente a uma dose de 900 mg de adulto.
A farmacocinética de ganciclovir foi semelhante entre os tipos de órgãos e faixas etárias. Com base em uma avaliação farmacocinética da população, a depuração é influenciada pelo peso corporal e função renal, enquanto que os volumes de distribuição central e periférica foram influenciados pelo peso. A depuração total média foi 5,3 L/h (88,3 mL/min) para um paciente com depuração de creatinina de 70,4 mL/min.
O valor médio de Cmáx, ASC e meia-vida de ganciclovir por idade e tipo de órgão em estudos que utilizaram o algoritmo de dosagem pediátrica de Cloridrato de Valganciclovir (substância ativa) estão listados na Tabela 2. Em relação aos pacientes adultos transplantados, os valores de ASC em pacientes pediátricos foram ligeiramente aumentados, mas mantiveram-se dentro do intervalo considerado seguro e eficaz em adultos.
Tabela 2 – Resumo da farmacocinética média (±DP) de ganciclovir em pacientes pediátricos estimada por modelo por grupo etário:
 N= número de pacientes.
N= número de pacientes.
a Parâmetros farmacocinéticosforam estimados utilizando modelo farmacocinética populacional.
b 14 Pacientes de transplante de coração com 26 a 124 dias de idade foram incluídos no desenvolvimento do modelo de farmacocinética populacional.
c 19 observações, alguns pacientes contribuíram com mais de um valor.
d Houve um paciente neste grupo etário que recebeu transplante de rim e fígado. O perfil farmacocinético deste paciente não foi incluído na tabela, visto que não é possível determinar se os efeitos observados são do transplante de rim / fígado ou nenhum deles.
e Os perfis farmacocinéticos para dois pacientes neste grupo etário que receberam transplantes de rim não foram incluídos nesta tabela, visto que os dados foram determinados como não-avaliáveis.
Cuidados de Armazenamento
Você deve conservar Valcyte em temperatura ambiente (entre 15 e 30 ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Descarte de medicamentos não utilizados e / ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Características físicas
Os comprimidos revestidos de Valcyte são ovais, convexos, de coloração cor-de-rosa, com “VGC” gravado de um lado e “450” do outro.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS – 1.0100.0593
Farm. Resp.:
Tatiana Tsiomis Díaz – CRF-RJ nº 6942
Fabricado para F. Hoffmann-La Roche Ltd., Basileia, Suíça,por:
Patheon Inc., Mississauga, Canadá
Embalado por:
F. Hoffmann-La Roche Ltd., Kaiseraugst, Suíça
Registrado, importado e distribuído no Brasil por:
Produtos Roche Químicos e Farmacêuticos S.A.
Estrada dos Bandeirantes, 2.020 CEP 22775-109 – Rio de Janeiro – RJ
CNPJ 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289
www.roche.com.br
Venda sob prescrição médica.
Genéricos de Valcyte 450Mg 60 Comprimidos
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso