- Medicamentos
- Medicamentos de A-Z
- Hemitartarato De Rivastigmina 1,5Mg 30 Cápsulas Biosintética Genérico - Aché Genérico
Comparamos o preço de hemitartarato de rivastigmina 1,5mg 30 cápsulas biosintética genérico - aché genérico, veja o menor preço
Hemitartarato De Rivastigmina 1,5Mg 30 Cápsulas Biosintética Genérico - Aché Genérico

Oferta Patrocinada
R$ 112,23
- CATEGORIA: Medicamentos de A-Z
- PRINCÍPIO ATIVO: Hemitartarato De Rivastigmina
- FABRICANTE: ACHÉ
PARA QUE SERVE?
Para que serve Tratamento de pacientes com demência leve a moderadamente grave do tipo Alzheimer, também conhecida como doença de Alzheimer provável ou doença de Alzheimer.
G
Genérico
8
ofertasMelhores preços a partir de R$ 48,47 até R$ 144,11
Oferta patrocinada
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Oferta patrocinada
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Tratamento de pacientes com demência leve a moderadamente grave do tipo Alzheimer, também conhecida como doença de Alzheimer provável ou doença de Alzheimer.
Tratamento de pacientes com demência leve a moderadamente grave associada à doença de Parkinson.
Contraindicação
O uso de hemitartarato de rivastigmina (substância ativa) é contraindicado em pacientes com:
- Conhecida hipersensibilidade à rivastigmina, a outros derivados do carbamato ou aos excipientes da fórmula;
- História prévia de reações no local de aplicação sugestivas de dermatite alérgica de contato com rivastigmina sistema transdérmico.
Como usar
Administração
O hemitartarato de rivastigmina deve ser administrado duas vezes ao dia, com as refeições da manhã e da noite.
Dose inicial
1,5 mg duas vezes ao dia. Os pacientes que são reconhecidamente sensíveis aos efeitos de medicamentos colinérgicos devem iniciar o tratamento com dose de 1 mg, duas vezes ao dia.
Ajuste de dose
A dose inicial é de 1,5 mg, duas vezes ao dia. Se essa dose for bem tolerada após pelo menos 2 semanas de tratamento, a mesma pode ser aumentada para 3 mg, duas vezes ao dia.
Aumentos subsequentes para 4,5 mg e então para 6 mg, duas vezes ao dia também devem estar baseados em boa tolerabilidade à dose atual e podem ser considerados após um mínimo de 2 semanas de tratamento naquele nível de dose.
Se forem observados efeitos adversos (por ex.: náusea, vômito, dor abdominal ou perda do apetite) ou diminuição de peso durante o tratamento, estes deverão ser resolvidos com a omissão de uma ou mais doses. Se os efeitos adversos persistirem, a dose diária deve ser reduzida à dose anterior que apresentou boa tolerabilidade.
Dose de manutenção
1,5 mg a 6 mg, duas vezes ao dia; para atingir o benefício terapêutico máximo, os pacientes devem ser mantidos na dose bem tolerada mais elevada.
Dose máxima diária recomendada
6 mg duas vezes ao dia.
Reinício da terapia
A incidência e a gravidade de reações adversas geralmente aumentam com doses maiores.
Se o tratamento for interrompido por um período de alguns dias, deverá ser reiniciado com a menor dose diária e ajustado conforme descrito anteriormente.
Pacientes pediátricos
Crianças e adolescentes (idade inferior a 18 anos):
O uso do hemitartarato de rivastigmina em crianças não foi estudado e, portanto, não é recomendado.
Pacientes com Insuficiência renal ou hepática
Não é necessário realizar ajuste de dose em pacientes com insuficiência renal ou hepática. No entanto, devido ao aumento da exposição em insuficiência renal moderada e insuficiência hepática leve a moderada, a dose de ajuste recomendada deve ser de acordo com a tolerabilidade individual e deve ser acompanhada de perto, pois os pacientes com insuficiência renal ou hepática clinicamente significantes podem apresentar mais eventos adversos.
As cápsulas não devem ser partidas, abertas ou mastigadas.
Precauções
O tratamento deve sempre ser iniciado com a dose de 1,5 mg, duas vezes ao dia, e ser ajustado à dose de manutenção do paciente. Se o tratamento for interrompido por vários dias, deverá ser reiniciado com a menor dose diária a fim de se minimizar a possibilidade de reações adversas (por exemplo, vômitos graves).
Distúrbios gastrintestinais tais como náusea, vômito e diarreia podem ocorrer no início do tratamento e/ou no aumento da dose. Eles podem ser amenizados com a redução de dose. Em alguns casos, o uso do hemitartarato de rivastigmina (substância ativa) foi descontinuado. Pacientes que apresentam sinais ou sintomas de desidratação resultante de vômitos ou diarreia prolongada podem ser controlados com hidratação i.v. e redução da dose ou descontinuação, se reconhecidos e tratados prontamente. A desidratação pode estar associada a resultados graves.
Pacientes com doença de Alzheimer podem perder peso durante o tratamento com inibidores da colinesterase, incluindo a rivastigmina. O peso dos pacientes deve ser monitorado durante a terapia com hemitartarato de rivastigmina (substância ativa).
Pacientes com peso corporal abaixo de 50 kg podem apresentar mais reações adversas e podem ser mais propícios a descontinuar o tratamento por causa dos eventos.
Assim como outros colinomiméticos, deve-se ter cuidado ao utilizar o hemitartarato de rivastigmina (substância ativa) em pacientes com doença do nódulo sinusal ou defeitos na condução (bloqueio sinoatrial e bloqueio atrioventricular).
A estimulação colinérgica pode causar aumento da secreção ácido-gástrica e pode também exacerbar obstrução urinária e precipitar convulsões. Recomenda-se precaução ao tratar pacientes predispostos a essas patologias.
Como com outros colinomiméticos, o hemitartarato de rivastigmina (substância ativa) deve ser utilizado com precaução em pacientes que já tiveram crises asmáticas ou alguma doença de obstrução pulmonar.
Como outros colinomiméticos, a rivastigmina pode exacerbar os sintomas extrapiramidais. Em pacientes com demência associada à doença de Parkinson que foram tratados com hemitartarato de rivastigmina (substância ativa), agravamento dos sintomas parkinsonianos, em particular tremor, foram observados.
Reações cutâneas
Em pacientes que desenvolvem reações no local de aplicação sugestiva de dermatite de contato alérgica ao hemitartarato de rivastigmina (substância ativa) Patch e que continuam a necessitar da rivastigmina, o tratamento deve ser transferido para a rivastigmina oral somente após testes de alergia negativa e sob rigorosa supervisão médica. É possível que alguns pacientes sensibilizados à rivastigmina por exposição ao patch podem não ser capazes de tomar rivastigmina em qualquer forma farmacêutica.
A dermatite de contato alérgica deve ser suspeitada se reações no local de aplicação espalhar para além do tamanho do Patch, se houver evidência de uma reação mais intensa local (eritema aumentando, por exemplo, edema, pápulas, vesículas) e se os sintomas não melhoram significativamente dentro de 48 horas após a remoção do Patch. Nestes casos, o tratamento deve ser descontinuado.
Houve relatos isolados na pós-comercialização de pacientes com dermatite alérgica (disseminada) quando administrada rivastigmina, independentemente da via de administração (oral, transdérmica). Nestes casos, o tratamento deve ser descontinuado. Os pacientes e cuidadores devem ser instruídos.
Excipientes especiais
O benzoato de sódio é um dos excipientes de Exelon.
População especial
Pacientes com insuficiência renal ou hepática clinicamente significante podem apresentar mais eventos adversos. A dosagem de ajuste recomendada deve ser de acordo com a tolerabilidade individual e deve ser monitorado de perto. Os pacientes com insuficiência hepática grave não foram estudados, no entanto, o hemitartarato de rivastigmina (substância ativa) pode ser utilizado nesta população de pacientes, desde que haja acompanhamento próximo.
Mulheres com potencial para engravidar
Não há informações disponíveis sobre os efeitos da rivastigmina em mulheres em idade fértil.
Gravidez
Em estudos com animais, a rivastigmina não se mostrou teratogênica. Entretanto, a segurança do hemitartarato de rivastigmina (substância ativa) na gravidez humana não foi estabelecida e o mesmo deve ser utilizado em mulheres grávidas apenas se o benefício potencial for superior ao possível risco ao feto.
Este medicamento pertence à categoria B de risco na gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Lactação
Em animais, a rivastigmina e/ou metabólitos foram transferidos para o leite. Não se sabe se o hemitartarato de rivastigmina (substância ativa) é excretado no leite materno humano e, portanto, pacientes que utilizam o hemitartarato de rivastigmina (substância ativa) não devem amamentar.
Condução de veículos e utilização de máquinas
A demência da doença de Alzheimer e de Parkinson pode causar uma diminuição gradual da capacidade de dirigir veículos ou comprometer a capacidade de utilizar máquinas. A rivastigmina pode induzir tonturas e sonolência, principalmente no início do tratamento ou no aumento da dose. Por isso, em pacientes com demência tratados com o hemitartarato de rivastigmina (substância ativa), a habilidade de continuar a dirigir veículos ou operar máquinas complexas deve ser rotineiramente avaliada pelo médico.
Reações Adversas
As reações adversas relatadas mais comumente são gastrintestinais, incluindo náuseas (38%) e vômitos (23%), especialmente durante a titulação.
Os pacientes dos estudos clínicos foram mais suscetíveis às reações adversas gastrintestinais e perda de peso.
As reações adversas nas Tabelas 2 e 3 estão classificadas segundo a frequência, da mais para a menos frequente, utilizando o seguinte critério:
- Muito comum (?1/10);
- Comum (?1/100, <1/10);
- Incomum (?1/1.000, <1/100);
- Rara (?1/10.000, <1/1.000);
- Muito rara (<1/10.000), incluindo relatos isolados.
Tabela 2 - Reações adversas em pacientes com demência de Alzheimer tratados com cápsulas ou solução oral
| Infecções e infestações | |
| Muito rara | Infecção urinária |
| Distúrbios psiquiátricos | |
| Comum | Agitação, confusão, pesadelos e ansiedade |
| Incomum | Insônia e depressão |
| Muito rara | Alucinações |
| Distúrbios do sistema nervoso | |
| Muito comum | Tontura |
| Comum | Dor de cabeça, sonolência e tremor |
| Incomum | Síncope |
| Rara | Convulsões |
| Distúrbios cardíacos | |
| Rara | Angina pectoris e infarto do miocárdio |
| Muito rara | Arritmia cardíaca (por ex.: bradicardia, bloqueio atrioventricular, fibrilação atrial e taquicardia) |
| Distúrbios vasculares | |
| Muito rara | Hipertensão. |
|
Distúrbios gastrintestinais |
|
| Muito comum | Náusea, vômito, diarreia e perda do apetite |
| Comum | Dor abdominal e dispepsia |
| Rara | Úlceras gástrica e duodenal |
| Muito rara | Hemorragia gastrintestinal, pancreatite e vômito grave associado à ruptura esofágic |
| Distúrbios hepatobiliares | |
| Incomum | Alterações nos testes de função hepática |
| Distúrbios da pele e tecidos subcutâneos | |
| Comum | Hiperidrose |
| Rara | Erupção cutânea e prurido |
| Distúrbios gerais e condições no local da administração | |
| Comum | Fadiga, astenia e indisposição |
| Incomum | Queda |
| Laboratorial | |
| Comum | Perda de peso |
Tabela 3 - Reações adversas relatadas durante estudo clínico de 24 semanas em pacientes com demência associada com a doença de Parkinson tratados com cápsulas.
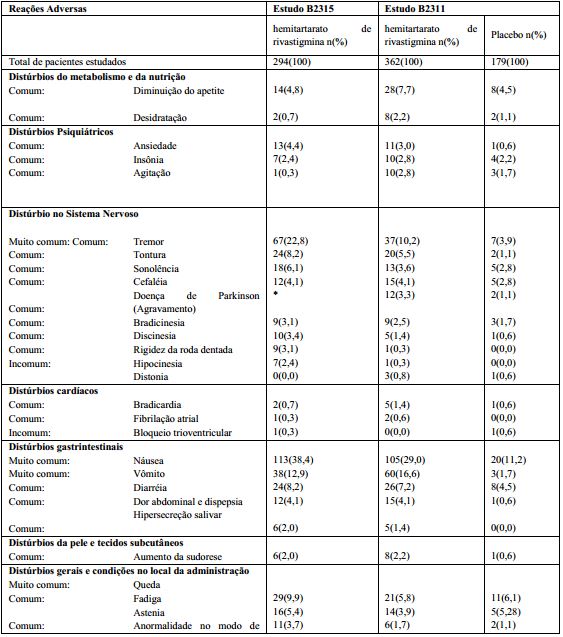
![]() * O agravamento da doença de Parkinson no estudo 2315 foi avaliado pelos relatos de reações adversas pré-identificadas (tremor, bradicinesia, rigidez da roda dentada e queda) e cada um deles foi listado com as frequências correspondentes.
* O agravamento da doença de Parkinson no estudo 2315 foi avaliado pelos relatos de reações adversas pré-identificadas (tremor, bradicinesia, rigidez da roda dentada e queda) e cada um deles foi listado com as frequências correspondentes.
Reações adversas adicionais obtidas de relatos espontâneos pós-comercialização (frequência desconhecida)
As seguintes reações adversas foram identificadas com hemitartarato de rivastigmina (substância ativa) cápsulas baseadas em relatos espontâneos na pós-comercialização. Tais reações são relatadas voluntariamente por uma população de tamanho incerto, portanto não é possível estimar com segurança sua frequência.
Informações de estudos clínicos em pacientes com demência associada à doença de Parkinson
A Tabela 4 relaciona o número e a porcentagem de pacientes do estudo clínico de 24 semanas de duração conduzido com hemitartarato de rivastigmina (substância ativa) em pacientes com demência associada à doença de Parkinson com reações pré-definidas que podem ter refletido o agravamento da doença de Parkinson.
Tabela 4 – Reações adversas pré-definidas que podem ter refletido o agravamento da doença de Parkinson em pacientes com demência associada à doença de Parkinson (Estudo B2311)
| hemitartarato de rivastigmina (substância ativa) | Placebo | |
| N(%) | N(%) | |
| Total de pacientes estudados | 362(100) | 179(100) |
| Total de pacientes com reações adversas pré-definidas | 99(27,3) | 28(15,6) |
| Tremor | 37 (10,2) | 7 (3,9) |
| Queda | 21 (5,8) | 11 (6,1) |
| Doença de Parkinson (agravamento) | 12 (3,3) | 2 (1,1) |
| Hipersecreção salivar | 5 (1,4) | 0 |
| Discinesia | 5 (1,4) | 1 (0,6) |
| Parkinsonismo | 8 (2,2) | 1 (0,6) |
| Hipocinesia | 1(0,3) | 0 |
| Distúrbio do movimento | 1 (0,3) | 0 |
| Bradicinesia | 9 (2,5) | 3 (1,7) |
| Distonia | 3 (0,8) | 1 (0,6) |
| Anormalidade no modo de andar | 5 (1,4) | 0 |
| Rigidez muscular | 1 (0,3) | 0 |
| Distúrbio do equilíbrio | 3 (0,8) | 2 (1,1) |
| Rigidez musculoesquelética | 3 (0,8) | 0 |
| Rigidez ou torpor | 1 (0,3) | 0 |
| Disfunção motora | 1 (0,3) | 0 |
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
A rivastigmina é metabolizada principalmente pela hidrólise por esterases. Um metabolismo mínimo ocorre através da maioria das isoenzimas do citocromo P450.
Dessa forma, não são antecipadas interações farmacocinéticas com outros medicamentos metabolizados por essas enzimas.
Interações antecipadas, resultando em uso concomitante não recomendado
Metoclopramida
Considerando a possibilidade de um efeito extrapiramidal aditivo não é recomendado o uso concomitante de metoclopramida e rivastigmina.
Medicamentos que agem no sistema colinérgico
Tendo em vista seus efeitos farmacodinâmicos, a rivastigmina não deve ser administrada concomitantemente com outros medicamentos colinomiméticos devido ao possível efeito aditivo. A rivastigmina também pode interferir com a atividade de medicamentos anticolinérgicos (por exemplo, a oxibutinina, tolterodina).
Relaxantes musculares do tipo succinilcolina
Como um inibidor de colinesterase, a rivastigmina pode potencializar os efeitos de relaxantes musculares do tipo succinilcolina durante a anestesia.
Interações observadas a serem consideradas
Betabloqueadores
Efeitos aditivos que levam à bradicardia (o que pode resultar em síncope) foram relatados com o uso combinado de vários betabloqueadores (incluindo atenolol) e rivastigmina. Espera-se que os betabloqueadores cardioseletivos sejam associados ao maior risco, mas relatos também foram recebidos em pacientes com outros betabloqueadores.
Interação com nicotina
A análise farmacocinética da população mostrou que o uso de nicotina aumenta o clearance (depuração) oral de rivastigmina em 23% em pacientes com demência de Alzheimer (n = 75 fumantes e 549 não- fumantes), após doses orais de até 12 mg/dia de cápsulas de rivastigmina.
Interações com medicamentos geralmente usados concomitantemente
Não foram observadas interações farmacocinéticas entre rivastigmina por via oral e digoxina, varfarina, diazepam ou fluoxetina em estudos com voluntários sadios. O aumento no tempo de protrombina onduzido pela varfarina não é afetado pela administração de rivastigmina. Não foram observados efeitos desfavoráveis na condução cardíaca após a administração concomitante de digoxina e rivastigmina.
A administração concomitante de rivastigmina com medicamentos prescritos comumente, tais como antiácidos, antieméticos, antidiabéticos, anti-hipertensivos de ação central, bloqueadores de canal de cálcio, medicamentos inotrópicos, antianginosos, anti-inflamatórios não-esteroidais, estrógenos, analgésicos, benzodiazepínicos e antihistamínicos, não foi associada às alterações na cinética de rivastigmina nem ao aumento do risco de efeitos desfavoráveis clinicamente relevantes.
Ação da Substância
Resultados de eficácia
Estudos clínicos na demência de Alzheimer
A eficácia do hemitartarato de rivastigmina (substância ativa) no tratamento da doença de Alzheimer foi demonstrada por estudos placebo-controlados. Os pacientes envolvidos tiveram um MEEM (Mini Exame do Estado Mental) de 10 - 24. Os resultados de dois estudos pivotais multicêntricos de 26 semanas de duração comparando a administração de 1 - 4mg/dia e 6 - 12mg/dia com placebo, assim como a análise conjunta dos estudos de Fase III, estabeleceram que o hemitartarato de rivastigmina (substância ativa) produz uma melhora significativa nos principais domínios cognitivos de desempenho global e de atividades diárias e na gravidade da doença. Tanto a faixa de dosagem baixa quanto a alta apresentaram benefícios para a cognição, desempenho global e gravidade da doença; além disso, a faixa de dose mais alta produziu uma melhora nas atividades diárias.
As seguintes variáveis prognósticas foram utilizadas nesses estudos
Escala de Avaliação da Doença de Alzheimer - Subescala Cognitiva (ADAS-Cog):
Um sistema de testes baseados no desempenho que mede áreas cognitivas relevantes em pacientes com doença de Alzheimer, tais como atenção, aprendizado, memória e linguagem.
Impressão de Mudança Baseada na Entrevista Clínica (CIBIC-Plus):
Avaliação clínica da alteração global do paciente nos domínios cognitivos, de comportamento e desempenho, incorporando opiniões separadas do paciente e do cuidador.
Escala de Deterioração Progressiva (PDS):
Avaliação realizada pelo cuidador da habilidade do paciente em realizar atividades diárias, tais como asseio pessoal, alimentação, ajuda nos afazeres domésticos e fazer compras.
Os resultados dos estudos indicam que o início da eficácia ocorre geralmente na 12a semana e é mantida até o final de 6 meses de tratamento. Pacientes tratados com 6 - 12mg apresentaram melhora da cognição, nas atividades diárias e no desempenho global, enquanto os pacientes que utilizaram placebo apresentaram uma deterioração dessas variáveis.
Os efeitos do hemitartarato de rivastigmina (substância ativa) nessas variáveis (por exemplo, diferença de 5 pontos de ADAS-Cog em relação ao placebo na 26a semana) indicam um atraso na velocidade de deterioração de pelo menos 6 meses.
Análises realizadas para detectar os subtestes e sintomas na ADAS-Cog e CIBIC-Plus, respectivamente, que melhoraram em pacientes tratados com hemitartarato de rivastigmina (substância ativa), indicam que todos os subtestes da ADAS-Cog (praxia ideatória, orientação, compreensão de instruções, teste de memorização de palavras, habilidade linguística e reconhecimento de palavras) melhoraram significativamente e todos os itens da avaliação CIBIC-Plus, com exceção da ansiedade, apresentaram melhora significativa na 26a semana com doses de hemitartarato de rivastigmina (substância ativa) de 6 - 12mg.
Os itens que apresentaram melhora de no mínimo 15%, mais evidentes nos pacientes que completaram o tratamento com hemitartarato de rivastigmina (substância ativa) em comparação aos pacientes com placebo, foram: memorização de palavras, desempenho, agitação, lacrimação ou choro, delírios, alucinações, atividades despropositadas e inapropriadas e ameaças físicas e/ou violência.
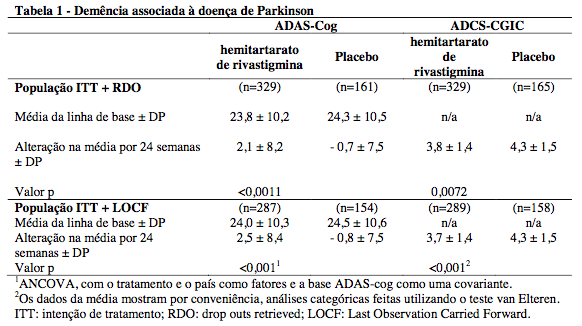
Estudos clínicos na demência associada à doença de Parkinson
A eficácia da rivastigmina na demência associada à doença de Parkinson foi demonstrada em um estudo núcleo placebo-controlado, duplo-cego, multicêntrico de 24 semanas na fase de extensão aberta. Os pacientes envolvidos neste estudo tiveram um MEEM (Mini Exame do Estado Mental) de 10 - 24. A eficácia foi estabelecida pelo uso de duas escalas independentes, as quais foram avaliadas em intervalos regulares durante o período de tratamento de 6 meses, conforme relatado na Tabela 1: a ADAS-cog, uma medida de cognição e a medida global ADCS-CGIC (Impressão de Mudança Clínica Global – Estudo Cooperativo da Doença de Alzheimer).
Características farmacológicas
Mecanismo de ação/ Propriedade farmacodinâmica
Classe farmacoterapêutica: Inibidor seletivo da colinesterase cerebral.
As alterações patológicas na demência, como na doença de Alzheimer, envolvem as vias neuronais colinérgicas que se projetam da base do cérebro anterior até o córtex cerebral e o hipocampo. Essas vias são conhecidas por estarem envolvidas na atenção, no aprendizado e na memória e em outros processos cognitivos. Acredita-se que a rivastigmina, um inibidor seletivo da acetil e butirilcolinesterase cerebral do tipo carbamato, facilita a neurotransmissão colinérgica pela diminuição da degradação da acetilcolina liberada por neurônios colinérgicos funcionalmente intactos. Dados de estudos com animais indicam que a rivastigmina aumenta seletivamente a disponibilidade de acetilcolina no córtex e no hipocampo. Dessa forma, o hemitartarato de rivastigmina (substância ativa) pode apresentar um benefício nos déficits cognitivos mediados pelo sistema colinérgico, associados à doença de Alzheimer e à doença de Parkinson. Além disso, existem evidências de que a inibição da colinesterase poderia diminuir a formação de fragmentos da proteína amiloidogênica precursora de betaamiloide (APP) e, dessa forma, das placas amiloides, que são uma das principais características patológicas da doença de Alzheimer.
A rivastigmina interage com suas enzimas-alvos pela formação de uma ligação covalente complexa que inativa temporariamente as enzimas. Em homens jovens e saudáveis, uma dose oral de 3,0mg diminui a atividade da acetilcolinesterase (AChE) no líquido cefalorraquidiano em aproximadamente 40% dentro das primeiras 1,5 horas após a administração. A atividade da enzima retorna aos níveis basais cerca de 9 horas após ter sido atingido o efeito inibitório máximo. A atividade da butirilcolinesterase (BuChE) no líquido cefalorraquidiano foi transitoriamente inibida e não foi muito diferente do valor basal após 3,6 horas em voluntários jovens e saudáveis.
Em pacientes com a doença de Alzheimer, a inibição da acetilcolinesterase no líquido cefalorraquidiano pela rivastigmina se mostrou dosedependente até 6mg administrados duas vezes ao dia, a maior dose testada. A inibição da atividade da BuChE no líquido cefalorraquidiano de pacientes com a doença de Alzheimer pela rivastigmina, foi similar àquela da AChE, com uma mudança, em relação ao valor basal de mais de 60% após a administração de 6mg duas vezes ao dia. O efeito da rivastigmina na atividade da AChE e BuChE no líquido cefalorraquidiano foi mantido após 12 meses de administração, o mais longo período estudado. Foram encontradas correlações estatisticamente significantes entre o grau de inibição pela rivastigmina da AChE e BuChE no líquido cefalorraquidiano e alterações em uma medida composta do desempenho cognitivo em pacientes com doença de Alzheimer; entretanto, somente a inibição da BuChE no líquido cefalorraquidiano se correlacionou significativa e consistentemente com melhoras nos subtestes relacionados com a velocidade, atenção e memória.
Propriedade farmacocinética
Absorção
A rivastigmina é absorvida rápida e completamente. Concentrações plasmáticas máximas são atingidas em aproximadamente 1 hora. Como consequência da interação do fármaco com a enzima-alvo, o aumento da disponibilidade é cerca de 1,5 vezes maior do que a esperada pelo aumento da dose. A biodisponibilidade absoluta após uma dose de 3mg é de cerca de 36%. A administração de cápsulas de rivastigmina com alimentos retarda a absorção (tmáx) em 90 min, e diminui a Cmáx e aumenta a AUC em aproximadamente 30%. Já a administração da solução oral de rivastigmina com alimentos retarda a absorção (tmáx) em 74 min, diminui a Cmáx em 43% e aumenta a AUC em aproximadamente 9%.
Distribuição
A rivastigmina apresenta uma fraca ligação às proteínas plasmáticas (aproximadamente 40%). A rivastigmina distribuise igualmente entre o sangue e o plasma com coeficiente de partição sangue-plasma de 0,9 nas concentrações compreendidas entre 1 e 400 ng/mL. Ela atravessa facilmente a barreira hematoencefálica atingindo concentrações máximas em 1 a 4 horas e com uma taxa AUC fluido cerebrospinal-plasma de 40%. A rivastigmina tem um volume de distribuição após administração i.v. variando de 1,8 - 2,7 L/kg.
Metabolismo
A rivastigmina é rápida e extensivamente metabolizada (meia-vida plasmática de aproximadamente 1 hora), principalmente via hidrólise mediada pela colinesterase ao metabólito descarbamilado. In vitro, esse metabólito apresenta uma inibição mínima da acetilcolinesterase (<10%). Com base na evidência de estudos in vitro e com animais, as isoenzimas principais do citocromo P450 estão minimamente envolvidas no metabolismo da rivastigmina. Consistente com essas observações está no fato de que não foram observadas quaisquer interações medicamentosas relacionadas ao citocromo P450 em seres humanos.
Excreção
A rivastigmina inalterada não é encontrada na urina; a excreção renal dos metabólitos é a principal via de eliminação.
Após a administração de 14C-rivastigmina, a eliminação renal foi rápida e essencialmente completa (>90%) em 24 horas. Menos de 1% da dose administrada é excretada nas fezes. Não há acúmulo de rivastigmina nem do metabólito descarbamilado em pacientes com doença de Alzheimer.
População especial
Pacientes idosos
Em um estudo para avaliar o efeito da idade sobre a farmacocinética de 1 e 2,5mg de rivastigmina oral, as concentrações plasmáticas de rivastigmina tenderam a ser maiores em idosos (n=24, idade 61-71 anos) em comparação com indivíduos mais novos (n=24, idade entre 19-40 anos) após a dose de 1mg. Essa diferença foi mais pronunciada com a dose mais elevada (2,5mg) em que as concentrações plasmáticas de rivastigmina foram 30% maiores nos idosos do que em indivíduos jovens. Os níveis plasmáticos do metabólito descarbamilado fenólico não foram significativamente afetados pela idade. Estudos em pacientes com Alzheimer com idade entre 50 e 92 anos, no entanto, não demonstraram alterações na biodisponibilidade da rivastigmina em função da idade.
Insuficiência renal
Os níveis plasmáticos da rivastigmina foram relatados não diferentes significativamente entre os pacientes com insuficiência renal grave (n = 10, taxa de filtração glomerular (TFG) < 10 mL/min) e os indivíduos controles (n = 10, TFG ? 60 mL/min) que receberam uma dose única oral de 3mg. O clearance (depuração) da rivastigmina foi de 4,8 L/min e 6,9 L/min em pacientes e indivíduos sadios, respectivamente. No entanto, em pacientes com insuficiência renal moderada (n = 8, GFR = 10 - 50 mL/min), as concentrações plasmáticas máximas da rivastigmina foram aumentadas em praticamente 2,5 vezes e os níveis plasmáticos totais (AUC) do metabólito descarbamilado fenólico foram aumentados em aproximadamente 50%. O clearance (depuração) da rivastigmina foi 1,7 L/min. A razão para esta discrepância entre os pacientes com insuficiência renal grave e moderada não está clara.
Insuficiência hepática
Após a administração oral, a Cmax da rivastigmina foi aproximadamente 60% superior e a AUC mais do que duas vezes maior em indivíduos com insuficiência hepática leve a moderada em comparação com indivíduos sadios. Após uma dose única de 3mg ou múltiplas doses de 6mg duas vezes ao dia, o clearance (depuração) médio oral da rivastigmina foi aproximadamente 60-65% mais baixo em pacientes com insuficiência hepática leve (n = 7, classificação Child-Pugh 5-6) e moderada (n = 3, Child-Pugh 7-9) (n = 10,comprovada por biópsia) do que em indivíduos sadios (n = 10). Estas alterações farmacocinéticas não teve efeito sobre a incidência ou severidade dos efeitos adversos.
Dados de segurança pré-clínicos
Toxicidade aguda
Os valores de DL50 oral estimados em camundongos foram de 5,6mg/kg (machos) e de 13,8mg/kg (fêmeas). Os valores de DL50 oral estimados em ratos foram de 8,1mg/kg (machos) e de 13,8mg/kg (fêmeas).
Toxicidade de dose múltipla
Estudos em ratos, camundongos, cães, mini porcos e macacos (doses máximas de 3,8; 6,3; 2,5; 6,0 e 6,3mg/kg/dia, respectivamente) mostraram evidência de estimulação colinérgica do sistema nervoso central e periférico. A tolerabilidade in vivo à rivastigmina se mostrou variável entre as espécies, sendo o cão a espécie mais sensível. Não foi observada toxicidade no órgão-alvo nem alterações de patologia clínica em nenhuma das espécies, embora efeitos gastrintestinais tenham sido proeminentes em cães.
Mutagenicidade
A rivastigmina não se apresentou mutagênica em testes in vitro de mutação genética e dano de DNA primário. Em testes de alterações cromossômicas in vitro, um pequeno aumento no número de células portadoras de aberrações cromossômicas ocorreu com concentrações muito elevadas. Entretanto, como não há evidência de atividade clastogênica nos testes in vivo de aberração cromossômica mais relevante, é mais provável que os resultados in vitro tenham configurado observações falso-positivas.
Carcinogenicidade
Nenhuma evidência de carcinogenicidade foi encontrada em estudos por via oral e tópica em camundongos e em estudo por via oral em ratos com a dose máxima tolerada. A exposição à rivastigmina e seu principal metabólito foi aproximadamente equivalente à exposição humana com maiores doses de cápsulas de rivastigmina e patches.
Toxicidade reprodutiva
Estudos por via oral em ratas e coelhas prenhas com níveis de dose de até 2,3mg/kg/dia não demonstraram indicações de potencial teratogênico relacionados à rivastigmina. Da mesma forma, não foi demonstrada evidência de efeitos adversos da rivastigmina na fertilidade, função reprodutiva ou crescimento no útero ou pós-natal em ratos e desenvolvimento em ratos que receberam níveis de dose de até 1,1mg/kg/dia.
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso