- Home
- Medicamentos
- Medicamentos de A-Z
- Mycamine - 50 Mg Pó Liofilizad...
- Bula de Mycamine - 50 Mg Pó Liofilizad...
para o que é indicado e para que serve?
Para que serve Seu médico prescreveu Mycamine para você nas seguintes circunstâncias Adultos >16 anos de idade e idosos Tratamento de infecções causadas por um fungo conhecido como Candida, tais como Candidíase invasiva e candidíase esofágica; Profilaxia de infecção por Candida em pacientes submetidos a transplante de medula (transplante alogênico de células-tronco hematopoiéticas) ou pacientes nos quais neutropenia é esperada (contagem absoluta de neutrófilos < 500 células / µl) por dez ou mais dias.Continue lendo...
ofertas de Mycamine - 50 Mg Pó Liofilizado Solução Injetável Frasco-Amp...

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Seu médico prescreveu Mycamine para você nas seguintes circunstâncias
Como Mycamine funciona?
Mycamine interfere com a produção de um componente da parede da célula do fungo, inibindo ativamente o seu crescimento.
Contraindicação
Não use Mycamine se você for alérgico (hipersensível) à micafungina, a qualquer outro ingrediente de Mycamine ou a outras substâncias do grupo das equinocandinas.
Como usar
Preparação
A preparação e aplicação do medicamento devem ser feitas exclusivamente por profissional de saúde com experiência e capacitação. Deve-se ter cuidado na reconstituição e diluição de Mycamine.
Diluição
Mycamine deve ser diluído com Solução de Cloreto de Sódio 0,9%, ou Solução de Dextrose a 5%. Após a reconstituição com Solução de Cloreto de Sódio 0,9%, o pH resultante da solução estará entre 5-7.
Não misturar ou coinfundir Mycamine com outras medicações. Mycamine mostrou que se precipita quando misturado diretamente com várias outras medicações usadas comumente.
Posologia
Uso em adultos ? 16 anos de idade e idosos
|
Indicação | Peso corporal > 40 kg |
Peso corporal ? 40 kg |
|
Tratamento de candidíase invasiva | 100 mg/dia |
2 mg/kg/dia |
|
Tratamento de candidíase esofágica | 150 mg/dia |
3 mg/kg/dia |
|
Profilaxia de infecção por Candida | 50 mg/dia |
1 mg/kg/dia |
Uso em crianças e adolescentes < 16 anos de idade
|
Indicação | Peso corporal > 40 kg |
Peso corporal ? 40 kg |
|
Tratamento de candidíase invasiva | 100 mg/dia |
2 mg/kg/dia |
|
Profilaxia de infecção por Candida | 50 mg/dia |
1 mg/kg/dia |
Uso em populações especiais
Nenhum ajuste de dose é necessário nos seguintes grupos de pacientes: pacientes com alteração da função dos rins, pacientes com insuficiência hepática, idosos.
Nenhum ajuste de dose de Mycamine é necessário com base em raça e sexo.
Duração do tratamento
A duração do tratamento será estabelecida pelo médico, conforme situação clínica de cada paciente.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Mycamine?
Este medicamento é de uso hospitalar. Seu médico é responsável pelo controle da frequência de administração.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Casos isolados de reações de hipersensibilidade como choque anafilático (reação anafilática e anafilactoide) grave (incluindo choque) foram relatados em pacientes recebendo Mycamine. Se essas reações ocorrerem, a infusão de Mycamine deve ser descontinuada e tratamento apropriado deve ser administrado.
Rompimento dos glóbulos vermelhoa
Pacientes que desenvolverem evidência clínica ou laboratorial de rompimento dos glóbulos vermelhos presentes no sangue (hemólise) ou anemia causada devido à hemólise, a quebra anormal de hemácias nos vasos sanguíneos (anemia hemolítica), durante o tratamento com Mycamine devem ser monitorados de perto para evidência de piora dessas condições e avaliado o risco/benefício de continuar a terapia com Mycamine.
Doenças hepáticas
Anormalidades laboratoriais de testes de função do fígado foram vistas em voluntários sadios e pacientes tratados com Mycamine.
Pacientes que desenvolvam testes de função anormal do fígado durante a terapia com Mycamine devem ser monitorados para a evidência de piora da função do fígado e avaliado o risco/benefício de continuar a terapia com o medicamento. A função do fígado deve ser monitorizada durante o tratamento com Mycamine. Recomenda-se a descontinuação precoce no caso de uma subida significativa e persistente dos níveis de enzimas hepáticas chamadas AST e ALT.
Interferência em exames laboratoriais
Alterações de exames de laboratório, tais como elevações do nitrogênio ureico no sangue e creatinina.
Doenças renais
Casos isolados de doença renal significativa ou diminuição importante da função dos rins foram relatados em pacientes que receberam Mycamine. Pacientes que desenvolvam exames de função renal anormais durante a terapia com Mycamine devem ser monitorados para a evidência de piora da função renal.
Amamentação e gravidez
Mycamine deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto.
Não se sabe se Mycamine é excretado no leite humano. Deve-se ter cuidado quando Mycamine for administrado a uma mulher amamentando.
Durante o período de aleitamento materno ou doação de leite humano, só utilize medicamentos com o conhecimento do seu médico ou cirurgião-dentista, pois alguns medicamentos podem ser excretados no leite humano, causando reações indesejáveis no bebê.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interação medicamentosa
Informe seu médico ou farmacêutico se você está tomando medicamentos contendo sirolimo, nifedipina ou itraconazol em combinação com Mycamine, de modo que ele possa monitorar a toxicidade do sirolimo, nifedipina ou itraconazol e reduzir a dose desses medicamentos, se necessário.
Mycamine contém 200 mg de lactose (açúcar do leite). Caso você apresente intolerância a alguns açúcares, informe seu médico antes da administração desse medicamento.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Como todos os medicamentos, Mycamine pode causar efeitos colaterais, embora nem todas as pessoas os apresentem.
A segurança de Mycamine foi avaliada em estudos clínicos. Os pacientes que fazem parte desses estudos estão criticamente doentes, apresentam uma variedade de outras condições médicas e requerem muitos outros medicamentos.
Mycamine pode causar os seguintes efeitos colaterais
As seguintes reações foram relatadas mais frequentemente em pacientes pediátricos do que em pacientes adultos
Composição
Ingrediente ativo: Micafungina sódica.
Excipientes: Lactose monoidratada, ácido cítrico e/ou hidróxido de sódio (usado para ajuste de pH).
Superdosagem
Seu médico vai monitorar a resposta e sua condição para determinar qual a dose necessária de Mycamine.
Entretanto, se você está preocupado que você possa ter recebido muito Mycamine, fale para seu médio ou outro profissional de saúde imediatamente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações Droga-droga
Um total de 14 estudos clínicos de interação droga-droga foi conduzido em voluntários sadios para avaliar o potencial de interação entre Mycafungina Sódica (substância ativa) e anfotericina B, micofenolato de mofetila, ciclosporina, tacrolimo, prednisolona, sirolimo, nifedipina, fluconazol, itraconazol, voriconazol, ritonavir, e rifampicina. Nestes estudos, não foi observada nenhuma interação que alterasse a farmacocinética da micafungina.
Não houve efeito de uma dose única ou múltipla de Mycafungina Sódica (substância ativa) na farmacocinética do micofenolato de mofetila, ciclosporina, tacrolimo, prednisolona, fluconazol e voriconazol.
A AUC do sirolimo estava aumentada em 21% com nenhum efeito na Cmáx na presença de Mycafungina Sódica (substância ativa) no estado de equilíbrio, comparado ao sirolimo sozinho. A AUC da nifedipina e Cmáx estavam aumentadas em 18% e 42%, respectivamente, na presença de Mycafungina Sódica (substância ativa) no estado de equilíbrio comparado com nifedipina sozinha. A AUC e Cmáx do itraconazol estavam aumentadas em 22% e 11%, respectivamente.
Pacientes recebendo sirolimo, nifedipina e itraconazol em combinação com Mycafungina Sódica (substância ativa) devem ser monitorados para a toxicidade de sirolimo, nifedipina ou itraconazol e a dose de sirolimo, nifedipina ou itraconazol deve ser reduzida, se necessário.
Micafungina não é substrato ou inibidor de P-glicoproteína e, portanto, não deve ser esperado que altere a atividade de transporte de droga mediada pela P-glicoproteína.
Ação da Substância
Resultados de Eficácia
Tratamento de Candidemia e Candidíase Invasiva
A micafungina (100 mg/dia ou 2 mg/kg/dia) foi tão eficaz quanto e melhor tolerada do que a anfotericina B lipossomal (3 mg/kg) como tratamento de primeira linha da candidemia e candidíase invasiva em um estudo randomizado, duplo-cego, multinacional de não-inferioridade. A micafungina e a anfotericina B lipossomal foram administradas durante um período mediano de 15 dias (intervalo, 4 a 42 dias em adultos; 12 a 42 dias em crianças).
A não-inferioridade foi provada em pacientes adultos, e foram demonstrados resultados similares para as subpopulações pediátricas (incluindo neonatos e bebês prematuros). Os achados de eficácia foram consistentes, independentemente da espécie de Candida causadora da infecção, do local primário da infecção e do estado de neutropenia (ver Tabela 1). A micafungina demonstrou uma menor diminuição média no pico da taxa de filtração glomerular estimada durante o tratamento (p < 0,001) e uma menor incidência de reações relacionadas com a infusão (p = 0,001) do que a anfotericina B lipossomal.
Tabela 1: Análise de Eficácia: Sucesso do Tratamento em Pacientes com Candidemia e outras Infecções por Candida no Estudo FG-463-21- 08
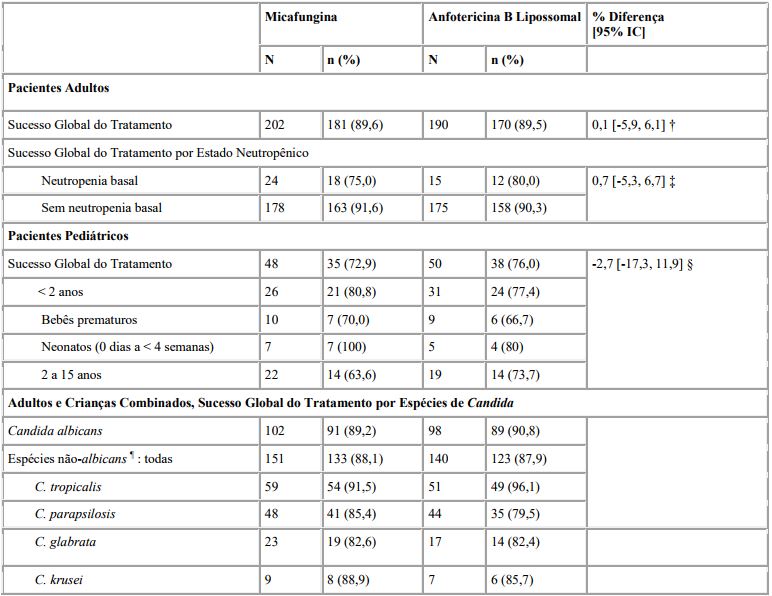
† Taxa de micafungina menos a taxa de anfotericina B lipossomal, intervalo de confiança bicaudal de 95 % para a diferença na taxa de sucesso global, baseada na aproximação normal de grandes amostras.
‡ Ajustado para o estado de neutropenia; objetivo primário. § A população pediátrica não foi dimensionada de forma a testar a não-inferioridade.
¶ A eficácia cínica também foi observada (< 5 pacientes) nas seguintes espécies de Candida: C. guilliermondii, C. famata, C. lusitaniae, C. utilis, C. inconspicua e C. dubliniensis.
Em um segundo grande estudo duplo-cego, fase 3, Mycafungina Sódica (substância ativa) foi avaliado versus caspofungina em pacientes com candidíase invasiva e candidemia.
Neste estudo, 111/578 (19,2 %) dos pacientes tiveram pontuação APACHE II basal >20, e 50/578 (8,7%) apresentavam neutropenia na avaliação basal (contagem absoluta de neutrófilos menor que 500 células/mm3 ). Resultados, dados de recidiva e mortalidade são mostrados para a dose recomendada de Mycafungina Sódica (substância ativa) (100 mg/dia) e caspofungina na Tabela 2.
Tabela 2: Análise de Eficácia: Sucesso do Tratamento em Pacientes no Estudo 03-0-192 com Candidemia e outras Infecções por Candida
|
Mycafungina Sódica (substância ativa) 100 mg/dia n (%) % diferença no tratamento (95%IC) |
Caspofungina 70/50 mg/dia1 n (%) | |
|
Sucesso no Tratamento ao Final da Terapia IV2 |
135/191 (70,7) 7,4 (-2,0, 16,3) |
119/188 (63,3) |
|
Sucesso em Pacientes com Neutropenia basal | 14/22 (63,6) |
5/11 (45,5) |
|
Sucesso pelo Local da Infecção | ||
|
Candidemia | 116/163 (71,2) |
103/161 (64) |
|
Abscesso | 4/5 (80 |
5/9 (55,6) |
|
Disseminada Aguda3 | 6/13 (46,2) |
5/9 (55,6) |
|
Endoftalmite | 1/3 | 1/1 |
|
Coriorretinite | 0/3 | 0 |
|
Pele | 1/1 | 0 |
|
Rim | 2/2 | 1/1 |
|
Pâncreas | 1/1 | 0 |
|
Peritônio | 1/1 | 0 |
|
Pulmão/Pele | 0/1 | 0 |
|
Pulmão/Baço | 0/1 | 0 |
|
Fígado | 0 | 0/2 |
|
Abscesso Intra-abdomina | 0 | 3/5 |
|
Disseminada Crônica | 0/1 | 0 |
|
Peritonite | 4/6 (66,7) | 2/5 (40) |
|
Sucesso por Organismo4 | ||
|
C. albicans | 57/81 (70,4) |
45/73 (61,6) |
|
C. glabrata | 16/23 (69,6) |
19/31 (61,3) |
|
C. tropicalis | 17/27 (63) |
22/29 (75,9) |
|
C. parapsilosis | 21/28 (75) |
22/39 (56,4) |
|
C. krusei | 5/8 (62,5) |
2/3 (66,7) |
|
C. guilliermondii | 1/2 |
0/1 |
|
C. lusitaniae | 2/3 (66,7) |
2/2 |
|
Recidiva em seis Semanas5 | ||
|
Geral | 49/135 (36,3) |
44/119 (37) |
|
Recidiva confirmada por Cultura | 5 | 4 |
|
Necessitaram terapia antifúngica sistêmica | 11 | 5 |
|
Morreram durante acompanhamento | 17 | 16 |
|
Não acessado | 16 | 19 |
|
Mortalidade geral no estudo | 28/200 (29) | 51/193 (26,4) |
|
Mortalidade durante a terapia IV | 28q200 (14) | 27/193 (14) |
1 70 mg de dose de ataque no dia 1 seguido por 50 mg/dia daí em diante (caspofungina). 2 Todos os pacientes que receberam pelo menos uma dose da medicação do estudo e tiveram candidíase invasiva ou candidemia documentada. Pacientes com endocardite por Candida foram excluídos das análises.
3 Um paciente pode ter tido >1 órgão de disseminação.
4 Um paciente pode ter tido >1 espécie de infecção no momento basal.
5 Todos os pacientes que tiveram recidiva confirmada por cultura ou terapia antifúngica sistêmica requerida no período pós-tratamento de uma infecção por Candida suspeita ou provada. Também inclui pacientes que morreram ou não foram analisados no acompanhamento.
Tratamento de Candidíase Esofágica
Num estudo randomizado, duplo-cego, que comparou a micafungina com o fluconazol, como tratamento de primeira linha de candidíase esofágica, 518 pacientes receberam pelo menos uma dose do medicamento em estudo. A duração mediana do tratamento foi de 14 dias e a média da dose diária mediana foi de 150 mg para a micafungina (N = 260) e 200 mg para o fluconazol (N = 258). No fim do tratamento foi observado um grau endoscópico de 0 (cura endoscópica) em 87,7% (228/260) e 88,0% (227/258) dos pacientes nos grupos da micafungina e do fluconazol, respectivamente (IC 95% para a diferença: [-5,9%; 5,3%]). O limite inferior do IC 95% foi acima da margem de não-inferioridade predefinida de - 10%, provando a não-inferioridade. A natureza e a incidência das reações adversas foram similares entre os grupos de tratamento.
Características Farmacológicas
Farmacocinética
Farmacodinâmica
Cuidados de Armazenamento
Frascos fechados de material liofilizado devem ser armazenados abaixo de 25ºC, por até 36 meses a partir da data de fabricação.
O produto reconstituído pode ser armazenado no frasco original por até 24 horas abaixo de 25ºC.
A infusão diluída deve ser protegida da luz e pode ser armazenada por até 24 horas abaixo de 25ºC.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Todo medicamento deve ser mantido fora do alcance das crianças.
Características organolépticas
Mycamine é um pó branco, sensível à luz, e que absorve umidade do ar facilmente.
Os cartuchos de Mycamine 50 mg e 100 mg contêm 01 frasco-ampola de vidro incolor, de uso único, embalados individualmente, cobertos com um filme protetor de luz e selados com uma tampa do tipo flip-off.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja dentro do prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais
Registro MS-1.7717.0001.
Farmacêutico Responsável:
Sandra Winarski
CRF-SP 18.496.
Fabricado por:
Astellas Pharma Tech Co., Ltd.
Takaoka Plant, 30 Toidesakae-machi
Takaoka city, Toyama 939-1118, Japão.
Registrado e importado por:
Astellas Farma Brasil Importação e Distribuição de Medicamentos Ltda.
Av. Guido Caloi, 1.935, Bloco B, 2º andar
Santo Amaro, CEP: 05802-140
São Paulo – SP.
CNPJ 07.768.134/0001-04.
Venda sob prescrição médica.
Só pode ser vendido com retenção de receita.
informações complementares
| Fabricante |
| ASTELLAS FARMA |
| Princípio ativo |
| Micafungina |
| Categoria do medicamento |
| Medicamentos de A-Z |
MYCAMINE - 50 MG PÓ LIOFILIZADO SOLUÇÃO INJETÁVEL FRASCO-AMPOLA 10 É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
