- Home
- Medicamentos
- Medicamentos de A-Z
- Spiriva - Respimat 2,5Mcg C 1 ...
- Bula de Spiriva - Respimat 2,5Mcg C 1 ...
para o que é indicado e para que serve?
Para que serve Spiriva Respimat é indicado para o tratamento de manutenção de pacientes com Doença Pulmonar Obstrutiva Crônica (DPOC) que, caracterizada por tosse, catarro e falta de ar, ocorre principalmente em decorrência da inalação da fumaça de cigarro, incluindo também bronquite crônica e enfisema pulmonar (irritação respiratória crônica), associada à dispneia (falta de ar), melhora da qualidade de vida e redução dos episódios de exacerbação (crises de agravamento) da doença.Continue lendo...
ofertas de Spiriva - Respimat 2,5Mcg C 1 Frasco De 4Ml 60 Doses E Inala...

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Spiriva Respimat é indicado para o tratamento de manutenção de pacientes com Doença Pulmonar Obstrutiva Crônica (DPOC) que, caracterizada por tosse, catarro e falta de ar, ocorre principalmente em decorrência da inalação da fumaça de cigarro, incluindo também bronquite crônica e enfisema pulmonar (irritação respiratória crônica), associada à dispneia (falta de ar), melhora da qualidade de vida e redução dos episódios de exacerbação (crises de agravamento) da doença.
Spiriva Respimat é indicado também como tratamento adicional de manutenção para melhora dos sintomas da asma (cansaço, falta de ar, chiado no peito e tosse), qualidade de vida e redução das exacerbações em pacientes adultos com asma grave em tratamento com corticosteroides inalatórios e agonistas beta adrenérgicos de longa duração e que permaneçam sintomáticos.
Como o Spiriva Respimat funciona?
Spiriva Respimat atua dilatando os brônquios (broncodilatador), facilitando assim a passagem de ar pelos pulmões. O efeito se inicia em até 30 minutos após a inalação e dura 24 horas.
Contraindicação
Você não deve usar Spiriva Respimat se tiver alergia à atropina ou seus derivados (como ipratrópio ou oxitrópio) ou a qualquer um dos componentes da fórmula.
A administração de Spiriva Respimat em crianças não é recomendada pelo fato de não haver estudos que comprovem, até o momento, a segurança e eficácia do medicamento para esta faixa etária.
Como usar
Leia estas instruções antes de começar a usar Spiriva Respimat.
Você precisará usar esse inalador apenas uma vez ao dia.
Cada vez que você utilizá-lo inale duas doses liberadas (2 puffs) consecutivas.
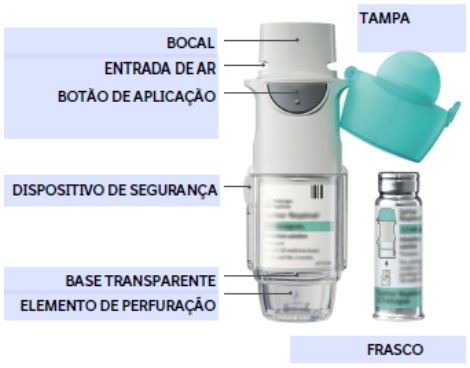
Se Spiriva Respimat não for utilizado por mais de 7 dias, liberar uma dose liberada (1 puff) em direção ao chão.
Se Spiriva Respimat não for utilizado por mais de 21 dias, repita os passos 4-6 em "Preparar para uso pela primeira vez" até que uma nuvem seja visível. Em seguida, repita os passos 4 a 6 mais 3 vezes.
Como cuidar do seu Spiriva Respimat
Limpe o bocal, inclusive a parte metálica dentro dele, apenas com um pano úmido ou um lenço, pelo menos uma vez por semana.
Uma pequena descoloração do bocal não afeta o funcionamento do seu inalador Spiriva Respimat.
Quando providenciar um novo Spiriva Respimat
Seu inalador Spiriva Respimat contém 60 doses liberadas (60 puffs) se usado conforme indicado, ou seja, duas doses liberadas (2 puffs) uma vez ao dia.
O indicador mostra aproximadamente quanto de medicação resta no frasco.
Quando o indicador entrar na área vermelha da escala você precisa de uma nova prescrição médica; existe medicação para aproximadamente mais 7 dias, ou seja, 14 doses liberadas (14 puffs).
Uma vez que o indicador de doses tenha atingido o final da escala vermelha, seu Spiriva Respimat se travará automaticamente e não haverá mais doses a serem liberadas. Neste momento, a base não poderá mais ser girada.
Três meses depois do primeiro uso, Spiriva Respimat deverá ser descartado mesmo se todo o medicamento não tiver sido utilizado.

Preparar para uso pela primeira vez
Uso diário
Respostas às perguntas mais frequentes
Posologia
1 dose liberada (puff) = conteúdo expelido após apertar 1 vez o botão do inalador Respimat.
A dose terapêutica diária recomendada de Spiriva Respimat é a inalação de 5 mcg, ou seja, 2 doses liberadas (2 puffs) consecutivas uma vez ao dia, pelo inalador Respimat, no mesmo horário do dia.
No tratamento da asma, os benefícios aparecem após diversas doses de Spiriva Respimat.
Pacientes idosos ou com alterações da função do fígado podem utilizar Spiriva Respimat na dose recomendada.
O uso de Spiriva Respimat deve ser acompanhado de perto em pacientes com comprometimento da função dos rins.
A segurança e eficácia de Spiriva Respimat em pacientes pediátricos com asma não foram estabelecidas.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e duração do tratamento.
Não interrompa o tratamento sem conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Spiriva Respimat?
Continue inalando as próximas doses regularmente no horário habitual. Não duplique a dose na próxima inalação.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico ou cirurgião-dentista.
Precauções
Spiriva Respimat é um broncodilatador para tratamento crônico, com dose única diária, e não se destina ao tratamento inicial de casos agudos de estreitamento dos brônquios (episódios de falta de ar) ou para o alívio de sintomas agudos. No caso de um ataque agudo, um beta-2-agonista de ação rápida (como fenoterol ou salbutamol) deve ser usado sob orientação médica. Caso não observe melhora do ataque agudo ou em caso de dúvidas, procure um médico ou serviço de emergência imediatamente.
Spiriva Respimat não deve ser usado como primeira linha para o tratamento da asma.
Pacientes asmáticos devem ser orientados a continuar com o tratamento usual, por exemplo, corticosteroides inalatórios sem necessidade de alterá-lo após a introdução de Spiriva Respimat, mesmo após os sintomas da asma terem melhorado.
Após administração de Spiriva Respimat, podem ocorrer reações alérgicas imediatas.
Spiriva Respimat deve ser usado com cuidado se você tiver glaucoma de ângulo fechado (aumento da pressão dentro do olho), aumento da próstata ou obstrução do colo da bexiga. Caso você apresente uma destas condições, avise o seu médico.
Pode ocorrer broncoespasmo (estreitamento dos brônquios) induzido pela inalação.
Spiriva Respimat é eliminado predominantemente pelos rins. Se você tiver alguma doença que afete a função dos rins, é necessário o acompanhamento cuidadoso do médico. Portanto, informe seu médico se tiver algum problema nos rins.
Evite contato do medicamento com os olhos. Dor nos olhos, visão embaçada, visão de halos ou imagens coloridas com olhos avermelhados podem ser sinais de glaucoma. Nestes casos, procure um oftalmologista imediatamente. Colírios para contrair a pupila não são considerados um tratamento eficaz.
A administração de Spiriva Respimat em crianças não é recomendada pelo fato de não haver estudos que comprovem, até o momento, a segurança e eficácia do medicamento para esta faixa etária.
A dose recomendada de Spiriva Respimat é 2 doses liberadas (2 puffs) consecutivas, uma vez ao dia. Você não deve usar Spiriva Respimat mais de uma vez ao dia. O frasco de Spiriva só deve ser utilizado com o inalador Respimat que acompanha o produto.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem conhecimento do seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
Reações incomuns
Tontura, insônia, palpitações, tosse, faringite, disfonia (rouquidão), broncoespasmo (estreitamento dos brônquios), boca seca (geralmente leve), candidíase orofaríngea (sapinho), erupção cutânea (rash).
Reações raras
Epistaxe (sangramento nasal), constipação (prisão de ventre), gengivite (inflamação da gengiva), estomatite, prurido (coceira), edema angioneurótico (alergia com inchaço da língua, lábios e garganta), urticária, hipersensibilidade (inclusive reações imediatas), infecção do trato urinário.
Reações com frequência desconhecida
Desidratação, glaucoma, aumento da pressão intraocular, visão borrada, alterações nos batimentos do coração (como fibrilação atrial, taquicardia supraventricular, taquicardia), laringite (inflamação da laringe), sinusite, disfagia (dificuldade para engolir), refluxo gastroesofágico (doença do refluxo), glossite (inflamação da língua), obstrução intestinal inclusive íleo paralítico (obstrução do intestino interrompendo a passagem das fezes), infecção e úlcera cutânea (na pele), pele seca, inchaço das articulações, retenção urinária (geralmente em homens com fatores de predisposição), disúria (dificuldade e dor para urinar).
Atenção: este produto é um medicamento que possui uma nova indicação terapêutica e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
População Especial
Habilidade de dirigir e operar máquinas
A ocorrência de tontura ou visão embaçada pode prejudicar a habilidade de dirigir e operar máquinas.
Fertilidade, gravidez e amamentação
O uso de Spiriva Respimat não é recomendado durante a gravidez e amamentação. Existem dados limitados do uso deste medicamento durante a gravidez. Não existem dados clínicos sobre o uso deste medicamento em lactantes (mulheres amamentando) e a respeito da fertilidade.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
Cada dose (puff) libera:
2,5 mcg de tiotrópio, correspondentes a 3,1 mcg de brometo de tiotrópio monoidratado.
Dose terapêutica diária = 5 mcg, ou seja, 2 doses liberadas (2 puffs consecutivos).
Excipientes: cloreto de benzalcônio, edetato dissódico, ácido clorídrico, água purificada.
Superdosagem
Altas doses de Spiriva Respimat podem acelerar os batimentos cardíacos, alterar a movimentação do estômago e intestinos e reter urina. Não foram observados eventos adversos relevantes, além de boca, garganta e nariz secos.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Embora não se tenham realizado estudos para avaliar interações medicamentosas, o Brometo de Tiotrópio (substância ativa) tem sido utilizado concomitantemente com outros medicamentos comumente utilizados no tratamento da DPOC e asma, incluindo broncodilatadores simpaticomiméticos, metilxantinas, esteroides orais e inalatórios, anti-histamínicos, mucolíticos, modificadores de leucotrienos, cromonas e tratamento anti-IgE sem evidência clínica de interações medicamentosas.
Medicações concomitantes comuns (LABA, corticosteroides inalatórios e suas combinações) usadas por pacientes com DPOC não demonstraram alterar a exposição ao tiotrópio.
A administração crônica de Brometo de Tiotrópio (substância ativa) com outras medicações anticolinérgicas não foi estudada. Portanto, a administração crônica de outras medicações anticolinérgicas com Brometo de Tiotrópio (substância ativa) não é recomendada.
Ação da Substância
Resultados de eficácia
DPOC
O programa de fase III para DPOC incluiu dois estudos de 1 ano, dois estudos de 12 semanas e dois estudos de 4 semanas randomizados, duplos-cegos, em 2.901 pacientes com DPOC (1.038 deles recebendo 5 mcg de tiotrópio). O programa de 1 ano consistiu de dois estudos controlados com placebo. Os dois estudos de 12 semanas foram ambos ativos (ipratrópio) e controlados com placebo.
Os seis estudos incluíram mensurações da função pulmonar. Além disto, os dois estudos de 1 ano incluíram medidas de desfechos de saúde: medidas da intensidade da dispneia, qualidade de vida e efeito nas exacerbações.
Estudos controlados por placebo
Dispneia, Qualidade de Vida Relacionada à Saúde, exacerbações de DPOC em estudos de longo prazo de 1 ano
Brometo de Tiotrópio (substância ativa) melhorou de forma significativa a dispneia (avaliado utilizando o Índice Transicional de Dispneia). A melhora foi mantida durante todo o período de tratamento.
A avaliação da Qualidade de Vida dos pacientes (avaliada utilizando o Questionário Respiratório St. George QRSG) mostrou que Brometo de Tiotrópio (substância ativa) teve efeito positivo nos impactos psicossociais da DPOC, nas atividades afetadas pela DPOC, e no desconforto devido aos sintomas de DPOC. A melhora no índice médio global entre Brometo de Tiotrópio (substância ativa) comparativamente ao placebo ao final dos dois estudos de 1 ano foi estatisticamente significativa e mantida durante todo o período de tratamento.
Exacerbações de DPOC
Em 3 estudos clínicos de um ano, randomizados, duplo-cegos, controlados por placebo, o tratamento com Brometo de Tiotrópio (substância ativa) resultou em uma significante redução de risco para exacerbação de DPOC, em comparação com placebo.
Exacerbações de DPOC foram definidas como “um complexo de pelo menos 2 eventos respiratórios/sintomas com uma duração de 3 dias ou mais, requerendo uma mudança no tratamento (prescrição de antibióticos e/ou corticosteroides sistêmicos e/ou uma mudança significativa da medicação respiratória prescrita)”.
O tratamento com Brometo de Tiotrópio (substância ativa) resultou num risco reduzido de hospitalização devido à exacerbação de DPOC (significante no estudo clínico apropriado da primeira exacerbação e das subsequentes). A análise agrupada dos dois ensaios de Fase III e avaliação separada de um estudo clínico de exacerbação adicional é demonstrada na Tabela 1.
Todos os medicamentos respiratórios, exceto anticolinérgicos e beta-agonistas de ação longa foram autorizados como tratamento concomitante, ou seja, beta-agonistas de ação rápida, corticoides inalados e xantinas. Beta-agonistas de ação longa foram permitidos, em adição ao estudo clínico de exacerbação.
Tabela 1: Análise estatística de exacerbações de DPOC e pacientes hospitalizados por exacerbações de DPOC em pacientes portadores de DPOC moderada a grave:
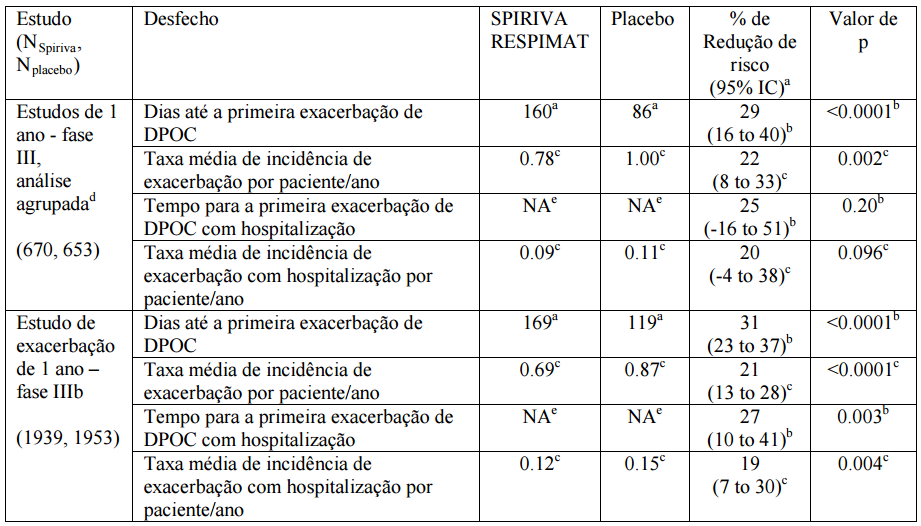 a Tempo até o primeiro evento: dias em tratamento quando 25% de pacientes tiveram pelo menos uma exacerbação de DPOC / exacerbação de DPOC com hospitalização. No estudo A, 25% dos pacientes com placebo apresentaram a primeira exacerbação no dia 112, enquanto para Spiriva Respimat 25% apresentaram a primeira exacerbação somente no dia 173 (p=0.09); no estudo B, 25% os pacientes com placebo apresentaram a primeira exacerbação no dia 74, enquanto para Spiriva Respimat 25% apresentaram a primeira exacerbação apenas no dia 149 (p<0.0001).
a Tempo até o primeiro evento: dias em tratamento quando 25% de pacientes tiveram pelo menos uma exacerbação de DPOC / exacerbação de DPOC com hospitalização. No estudo A, 25% dos pacientes com placebo apresentaram a primeira exacerbação no dia 112, enquanto para Spiriva Respimat 25% apresentaram a primeira exacerbação somente no dia 173 (p=0.09); no estudo B, 25% os pacientes com placebo apresentaram a primeira exacerbação no dia 74, enquanto para Spiriva Respimat 25% apresentaram a primeira exacerbação apenas no dia 149 (p<0.0001).
b Razões de risco foram estimadas de um modelo de risco proporcional de Cox. A porcentagem de redução de risco é 100 (1 – razão de risco).
c Regressão de Poisson. Redução de risco é 100 (1 – razão de risco).
d A análise agrupada foi especificada quando os estudos foram desenhados. Os desfechos de exacerbação foram significantemente aperfeiçoados em análises individuais dos dois estudos de um ano. e Menos de 25% de pacientes tiveram uma exacerbação de DPOC levando a hospitalização.
Estudo de longo prazo controlado com ativo tiotrópio
Um estudo de longo prazo, em grande escala, randomizado, duplo-cego, ativo controlado, com um período de tratamento de até 3 anos foi realizado para comparar a eficácia e a segurança de Brometo de Tiotrópio (substância ativa) e Spiriva HandiHaler (5.711 pacientes que receberam Brometo de Tiotrópio (substância ativa) 2,5 microgramas (5 microgramas da dose medicinal); 5.694 pacientes recebendo Spiriva HandiHaler). Os desfechos primários foram: tempo até a primeira exacerbação de DPOC, o tempo para a mortalidade por todas as causas e, em um sub-estudo (906 pacientes), curva (variação) do volume expiratório forçado FEV1 (pré-dose).
O tempo até a primeira exacerbação de DPOC foi semelhante durante o estudo com Brometo de Tiotrópio (substância ativa) e Spiriva HandiHaler (razão de risco (Brometo de Tiotrópio (substância ativa) / Spiriva HandiHaler) 0,98 com um IC 95% de 0,93 a 1,03).
O número médio de dias para a primeira exacerbação de DPOC foi de 756 dias para Brometo de Tiotrópio (substância ativa) e 719 dias para Spiriva HandiHaler.
O efeito broncodilatador do Brometo de Tiotrópio (substância ativa) foi sustentado por 120 semanas e foi semelhante ao Spiriva HandiHaler. A diferença média de volume expiratório forçado FEV1 para Brometo de Tiotrópio (substância ativa) versus Spiriva HandiHaler foi -0,010 L (IC 95% -0,038 a 0,018mL).
Mortalidade por todas as causas foi semelhante durante o estudo com Brometo de Tiotrópio (substância ativa) e Spiriva HandiHaler (razão de risco (Brometo de Tiotrópio (substância ativa) / Spiriva HandiHaler) 0,96 com um IC 95% de 0,84 a 1,09).
Asma
O programa de fase III para asma persistente incluiu dois estudos de 1 ano, dois estudos de 6 meses e um estudo de 12 semanas randomizados, duplos-cegos, controlados por placebo em um total de 3.476 pacientes com asma (1.128 deles recebendo Brometo de Tiotrópio (substância ativa)) com histórico de tratamento com pelo menos corticoide inalatório (CIs) ou CIs/ Beta 2 agonista de longa duração (LABA). Os dois estudos de 6 meses foram ambos controlados com ativo (salmeterol). Os cinco estudos incluíram mensurações da função pulmonar, avaliação dos sintomas incluindo exacerbações e qualidade de vida relacionada à saúde.
Nos dois estudos de 1 ano Primo-TinA-asma em pacientes sintomáticos na manutenção do tratamento com pelo menos altas doses de CIs e LABA, Brometo de Tiotrópio (substância ativa), usado em adição ao tratamento prévio, mostrou melhora significativa da função pulmonar comparativamente ao placebo.
Na semana 24, a melhoria na média do pico e vale da VEF1 foi de 0,110 litros (IC 95%: 0,063 a 0,158 litros, p<0,0001) e 0,093 litros (IC 95%: 0,050 a 0,137 litros, p<0,0001), respectivamente.
A melhora na função pulmonar comparada com o placebo foi mantida por 24 horas (Figura 4).
Figura 4: perfil de FEV1 durante 24 horas em um subconjunto de pacientes do estudo Primo-TinA-asma na semana 24:
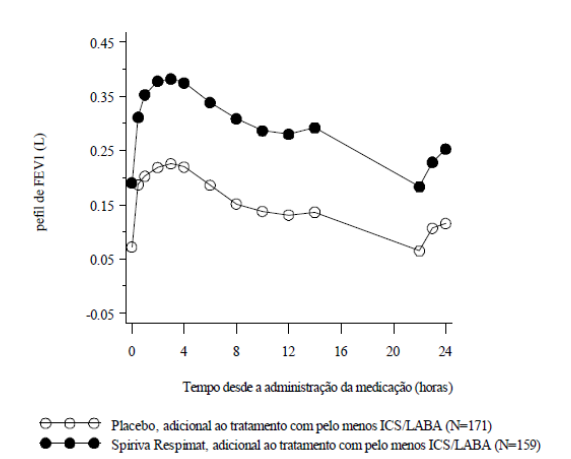
Na semana 24, observa-se que Brometo de Tiotrópio (substância ativa) melhorou significativamente as taxas matutinas e vespertinas de pico de fluxo expiratório (PFE, média matutina melhorada: 23 L/min; IC 95%: 16 a 29 L/min; p<0,0001; média vespertina melhorada: 26 L/min; IC 95%: 20 a 33 L/min; p<0,0001).
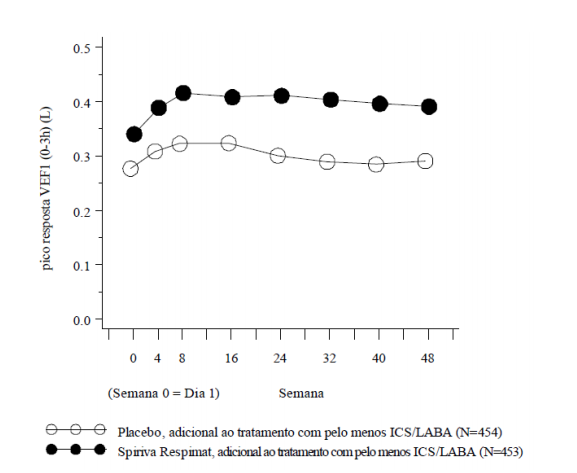
Os efeitos broncodilatadores de Brometo de Tiotrópio (substância ativa) foram mantidos durante o período de 1 ano de administração sem qualquer evidência de taquifilaxia ou tolerância.
Figura 5: resposta da FEV1 durante 48 semanas nos estudos Primo-TinA-asma:
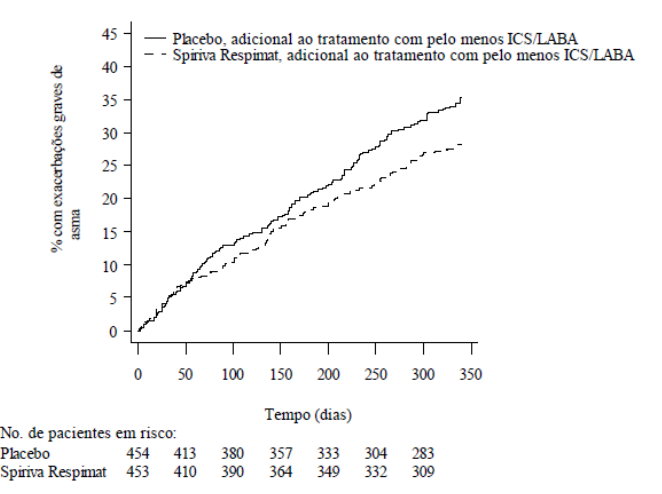
Brometo de Tiotrópio (substância ativa) reduziu significativamente o risco de exacerbações da asma severa (vide Tabela 2 e Figura 6).
Tabela 2: Exacerbações em pacientes sintomáticos em tratamento com CIs e LABA (estudos Primo-TinA-asma):
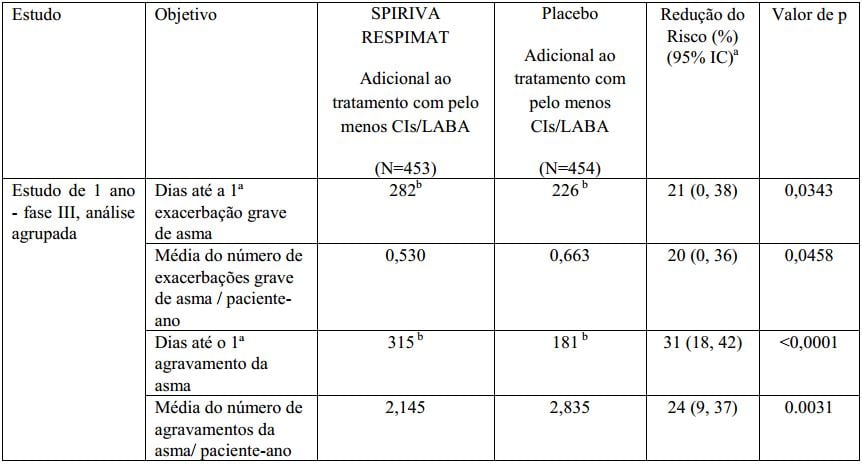 a Razão de risco, intervalo de confiança e valor-p foram obtidos do modelo de perigo proporcional Cox com apenas o tratamento como efeito. A porcentagem de redução do risco é 100 (1-razão de risco).
a Razão de risco, intervalo de confiança e valor-p foram obtidos do modelo de perigo proporcional Cox com apenas o tratamento como efeito. A porcentagem de redução do risco é 100 (1-razão de risco).
b Tempo para o primeiro evento: dias em tratamento quando 25% dos pacientes tiveram pelo menos uma exacerbação grave de asma / agravamento da asma.
Figure 6: Exacerbações graves de asma ao longo do estudo PrimoTinA-asma:
As taxas de resposta do questionário de controle da asma (ACQ), definido como porcentagem de paciente com melhora por pelo menos 0,5 pontos, foram significativamente maiores com Brometo de Tiotrópio (substância ativa) (53,9% versus 46,9%; p=0,0427).
A média da melhora em pontuação do questionário de Qualidade de Vida para Asma (AQLQ(S)) demonstrou que Brometo de Tiotrópio (substância ativa) melhorou significativamente em comparação com o placebo na 24ª semana.
Características farmacológicas
Farmacodinâmica
O Brometo de Tiotrópio (substância ativa) é um agente antimuscarínico específico, de longa duração, comumente denominado de anticolinérgico. O Brometo de Tiotrópio (substância ativa) apresenta afinidade similar aos subtipos de receptores muscarínicos M1 ao M5. Nas vias aéreas, a inibição de receptores M3 promove relaxamento da musculatura lisa. A natureza competitiva e reversível desse antagonismo foi demonstrada em estudos com receptores de origem humana e animal e em preparações de órgãos isolados. Nos estudos não clínicos in vitro e in vivo, os efeitos bronco-protetores foram dose-dependentes e duraram por mais de 24 horas. A longa duração do efeito é provavelmente devido à sua dissociação muito lenta dos receptores M3, apresentando uma meia-vida de dissociação significativamente maior que a observada com o ipratrópio.
Por ser um anticolinérgico N-quaternário, o tiotrópio é topicamente bronco-seletivo quando administrado por inalação, demonstrando uma margem terapêutica aceitável antes de apresentar efeitos anticolinérgicos sistêmicos. A dissociação dos receptores M2 é mais rápida que dos receptores M3; o que, em estudos funcionais in vitro, levou à seletividade (controlada cineticamente) ao subtipo de receptor M3 em relação ao M2. A elevada potência e lenta dissociação do receptor promovem broncodilatação importante e de longa duração nos pacientes com DPOC e asma.
A broncodilatação observada após a inalação de tiotrópio é fundamentalmente um efeito local (nas vias aéreas) e não um efeito sistêmico.
Farmacocinética
O Brometo de Tiotrópio (substância ativa) é um composto de amônio quaternário não-quiral e é pouco solúvel em água. O Brometo de Tiotrópio (substância ativa) está disponível como solução para inalação administrada com o inalador Respimat. Aproximadamente 40% da dose inalada é depositada nos pulmões, o órgão alvo, sendo a quantidade restante depositada no trato gastrintestinal. Alguns dos dados farmacocinéticos abaixo descritos foram obtidos com doses mais altas do que as recomendadas para tratamento.
Absorção
Após inalação da solução por voluntários jovens saudáveis, os dados da excreção urinária sugerem que aproximadamente 33% da dose inalada atinge a circulação sistêmica. As soluções orais de tiotrópio têm uma biodisponibilidade absoluta de 2-3%. Não se espera que os alimentos influenciem a absorção de tiotrópio pelas mesmas razões. As concentrações plasmáticas máximas do tiotrópio foram observadas 5 7 minutos após a inalação.
No estado de equilíbrio, os picos de níveis plasmáticos de tiotrópio em pacientes com DPOC foram de 10,5 – 11,7pg/mL quando medidos 10 minutos após a administração de 5 mcg aplicada através do inalador Respimat e diminuíram rapidamente de modo multi-compartimental. As concentrações plasmáticas no estado de equilíbrio foram 1,60 pg/mL.
A concentração plasmática de 5,15 pg/mL de tiotrópio no estado de equilíbrio foi obtida 5 minutos após administração da mesma dose para pacientes com asma.
Distribuição
A medicação tem uma ligação de 72% às proteínas plasmáticas, e demonstra um volume de distribuição de 32L/kg. As concentrações locais pulmonares não são conhecidas, mas a forma de administração sugere concentrações substancialmente superiores nos pulmões. Estudos em ratos demonstraram que o Brometo de Tiotrópio (substância ativa) não atravessa a barreira hematoencefálica em extensão relevante.
Metabolização
O grau de metabolização do fármaco é pequeno. Este fato é evidenciado pela excreção urinária de 74% da substância inalterada após administração intravenosa a voluntários sadios jovens. O Brometo de Tiotrópio (substância ativa), um éster, é clivado de maneira não-enzimática em álcool N-metilescopina e ácido ditienilglicólico, que não se ligam aos receptores muscarínicos.
Estudos in vitro com microssomos hepáticos e hepatócitos humanos sugerem que uma parcela do fármaco (<20% da dose administrada por via endovenosa) é metabolizada pela oxidação dependente de citocromo P450 e subsequente conjugação glutatiônica para uma variedade de metabólitos de fase II. Esta via enzimática pode ser inibida pelos inibidores do citocromo P450 2D6 (e 3A4), quinidina, cetoconazol e gestodeno. Dessa forma, os citocromos P450 2D6 e 3A4 estão envolvidos na via metabólica responsável pela eliminação da menor parte da dose. O Brometo de Tiotrópio (substância ativa), mesmo em concentrações superiores às terapêuticas, não inibe o citocromo P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A nos microssomos hepáticos humanos.
Eliminação
A meia-vida efetiva de tiotrópio varia entre 27 a 45 horas após a inalação, como em pacientes com DPOC. A meia-vida efetiva foi de 34 horas em pacientes com asma. O clearance total foi de 880mL/min após uma administração endovenosa em voluntários sadios jovens. A administração endovenosa de Brometo de Tiotrópio (substância ativa) é principalmente excretada de forma inalterada na urina (74%). Após inalação da solução por pacientes com DPOC, a excreção urinária é 18,6 % (0,93mcg) da dose, sendo o restante principalmente medicação não absorvida no intestino que é eliminada pelas fezes.
Em pacientes com asma, 11,9% (0,595mcg) da dose é excretada de forma inalterada na urina mais de 24 horas após a dose no estado de equilíbrio. O clearance renal de tiotrópio excede o clearance de creatinina, indicando secreção para a urina. Após inalação crônica uma vez ao dia, o estado de equilíbrio farmacocinético foi alcançado até o dia 7, sem acúmulo a partir de então.
Linearidade/não linearidade
O tiotrópio apresenta farmacocinética linear dentro da faixa terapêutica independente da formulação.
Pacientes idosos
Assim como esperado para todos os fármacos excretados predominantemente por via renal, a idade avançada foi associada com uma diminuição da depuração renal de tiotrópio (347mL/min em pacientes com DPOC e idade inferior a 65 anos a 275mL/min em pacientes com DPOC e idade superior ou igual a 65 anos). Isso não resultou num aumento correspondente nos valores de AUC0–6, ss ou Cmáx,ss.
Para pacientes com asma, não foi encontrado diferenças das exposições ao tiotrópio com a idade.
Pacientes com insuficiência renal
Após a administração de tiotrópio uma vez ao dia até o estado de equilíbrio em pacientes com DPOC com insuficiência renal leve (CLCR 50-80mL/min), resultou numa AUC0-6,ss um pouco maior (entre 1,8 a 30% maior) e semelhantes Cmáx comparado com pacientes com função renal normal (CLcr> 80mL/min). Em pacientes com DPOC com insuficiência renal moderada a severa (CLCR <50mL/min) a administração intravenosa de Brometo de Tiotrópio (substância ativa) resultou na duplicação da exposição total (82% maior AUC0-4h e 52% maior Cmáx em comparação com pacientes com DPOC com função renal normal, o que foi confirmado pelas concentrações plasmáticas após inalação de pó seco.
Em pacientes asmáticos com insuficiência renal leve (CLCR 50-80mL/min), a inalação do tiotrópio não resultou em aumentos relevantes na exposição quando comparados aos pacientes com função renal normal.
Pacientes com comprometimento hepático
Não é esperado que a insuficiência hepática exerça alguma influência relevante na farmacocinética do Brometo de Tiotrópio (substância ativa). O Brometo de Tiotrópio (substância ativa) é predominantemente eliminado por via renal (74% em voluntários sadios jovens) e por clivagem simples não enzimática do éster para produtos inativos.
Cuidados de Armazenamento
Mantenha em temperatura ambiente (15ºC a 30ºC). Não congelar.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Descartar o conjunto frasco + inalador Respimat após 3 meses da inserção do frasco no inalador Respimat. Este dispositivo inalatório não deve ser reutilizado.
Características físicas
Piriva é uma solução transparente e incolor para ser usada com o inalador Respimat.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS 1.0367.0137
Farm. Resp.:
Dímitra Apostolopoulou
CRF-SP 08828
Importado por:
Boehringer Ingelheim do Brasil Quím. e Farm. Ltda.
Rod. Régis Bittencourt, km 286
Itapecerica da Serra – SP
CNPJ 60.831.658/0021-10
SAC 0800 701 6633
Fabricado por:
Boehringer Ingelheim Pharma GmbH & Co. KG.
Ingelheim am Rhein – Alemanha
Venda sob prescrição médica.
informações complementares
| Fabricante |
| BOEHRINGER |
| Princípio ativo |
| Brometo De Tiotrópio |
| Categoria do medicamento |
| Medicamentos de A-Z |
SPIRIVA - RESPIMAT 2,5MCG C 1 FRASCO DE 4ML 60 DOSES E INALADOR RESPIMAT É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
