- Home
- Medicamentos
- Medicamentos de A-Z
- Versa - Solução Injetável 40 M...
- Bula de Versa - Solução Injetável 40 M...
para o que é indicado e para que serve?
À base de enoxaparina sódica, a Versa 40mg Eurofarma Labs 2 Seringas é uma solução injetável de uso subcutâneo ou intravenoso.Continue lendo...
ofertas de Versa - Solução Injetável 40 Mg Com 0,4 Ml Com 2 Seringas

ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Versa é indicado no:
- Tratamento da trombose (oclusão por trombo) de veias profundas já estabelecida com ou sem embolia pulmonar (oclusão de algum vaso no pulmão por trombo que migrou de outra veia);
- Prevenção de tromboses venosas associadas à cirurgia ortopédica ou à cirurgia geral;
- Prevenção de tromboses venosas em pacientes acamados, devido a doenças agudas, incluindo insuficiência cardíaca, insuficiência respiratória, infecções graves e doenças reumáticas;
- Prevenção da coagulação do circuito de circulação extracorpórea durante a hemodiálise;
- Tratamento da angina instável (dor no peito causada pela diminuição do suprimento de oxigênio no coração) e do infarto agudo do miocárdio sem onda Q (tipo de infarto), quando administrado concomitantemente ao ácido acetilsalicílico.
Como Versa funciona?
Este medicamento diminui o risco de desenvolvimento de tromboses de veias profundas e sua consequência mais grave, a embolia pulmonar.
Versa previne e trata estas duas condições, evitando sua progressão ou recorrência, além de tratar angina instável e infarto agudo do miocárdio sem onda Q.
A duração de uso de Versa pode variar de um indivíduo para o outro. A ação de Versa inicia-se após 3 (três) a 5 (cinco) horas da injeção.
Versa também evita a coagulação do sangue no circuito de hemodiálise.
Contraindicação
Versa (enoxaparina sódica) não deve ser utilizado por pacientes que apresentam:
- Alergia à enoxaparina sódica, à heparina e seus derivados, inclusive outras heparinas de baixo peso molecular;
- Sangramentos ativos de grande porte e condições com alto risco de desenvolvimento de sangramento incontrolável, incluindo acidente vascular cerebral (“derrame”) hemorrágico recente.
Não administrar Versa (enoxaparina sódica) por via intramuscular.
Este medicamento é contraindicado em crianças.
Como usar
Para administração do Versa pela via subcutânea, deve-se seguir as instruções de uso mencionadas abaixo como técnica de injeção subcutânea, ignorando-se "Prevenção da coagulação do circuito extracorpóreo durante a hemodiálise - Administração por via intravenosa".
Técnica de injeção subcutânea:
- Antes de administrar Versa, confira a embalagem com a prescrição do médico.
- Retire a capa protetora da agulha.
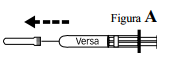
- A seringa já está pronta para uso. Observe que existe uma pequena bolha de gás dentro da seringa. Este gás é inerte e não se deve retirar esta bolha de gás da seringa. Uma gota pode aparecer na ponta da agulha. Caso isto ocorra, remova-a antes de injetar o medicamento através de batidas suaves no corpo da seringa com a agulha apontada para baixo.

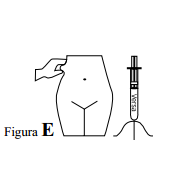
- Versa deverá ser administrado, de preferência, com o paciente deitado.

- O local ideal para a injeção subcutânea é no tecido subcutâneo do abdômen (cintura), alternando-se, a cada aplicação, o lado direito com o esquerdo.
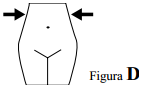
- Deve-se proceder a limpeza do local da aplicação com algodão ou gaze embebidos em antiséptico (álcool 70%, por exemplo). A injeção subcutânea consiste na introdução da agulha verticalmente em todo o seu comprimento, na espessura de uma prega cutânea feita entre os dedos polegar e indicador.
- Injete lentamente o conteúdo da seringa.
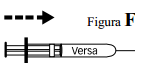
- Mantenha esta prega cutânea até o final da injeção.
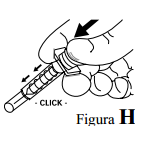
- Para acionar o mecanismo de segurança, após completar a injeção, deve-se retirar a seringa do local da aplicação e continuar empurrando o êmbolo até que o mecanismo de segurança automático seja ativado. O escudo de segurança irá cobrir automaticamente a agulha. O mecanismo de segurança será ativado quando a seringa estiver completamente vazia, e o êmbolo estiver pressionado até o limite. A seringa poderá ser descartada no local apropriado.
- Ao final, faça discreta compressão local sem massagear.
Depois de abertas, as seringas de Versa devem ser utilizadas imediatamente.
Se houver solução remanescente após o uso, descartá-la.
Prevenção de trombose de veias profundas e de embolia pulmonar
A posologia de Versa é determinada pela predisposição individual de ocorrer trombose venosa em situações desencadeantes como cirurgia, imobilização prolongada e trauma, entre outras.
Dessa maneira, são considerados com risco moderado os indivíduos que apresentem os seguintes fatores predisponentes:
Idade superior a 40 (quarenta) anos, obesidade, varizes dos membros inferiores, tumores, doença pulmonar ou cardíaca crônica, uso de estrógeno, fase após o parto, infecções sistêmicas, entre outros. São considerados com alto risco os indivíduos com história de embolia e trombose venosa prévia, tumores abdominais ou pélvicos, cirurgia ortopédica de grande porte dos membros inferiores, entre outros.
Pacientes cirúrgicos
- Em pacientes que apresentam risco moderado de trombose venosa (por exemplo: cirurgia abdominal), a prevenção é obtida com a dose recomendada de Versa de 20mg 1 (uma) vez ao dia por via subcutânea. Na cirurgia geral, a primeira injeção deve ser administrada 2 (duas) horas antes da intervenção cirúrgica;
- Em pacientes com alto risco de trombose venosa (por exemplo: cirurgia ortopédica), a prevenção é obtida com injeção única diária subcutânea de Versa de 40mg. A primeira injeção deve ser aplicada 12 (doze) horas antes da intervenção.
A duração do tratamento depende da persistência do risco de trombose, em geral, até a deambulação do paciente (em média, 7 (sete) a 10 (dez) dias após a intervenção). Tratamento mais prolongado pode ser apropriado em alguns pacientes e deve ser mantido enquanto houver risco de trombose venosa e até a deambulação do paciente. A administração única diária de 40mg de Versa por 3 (três) semanas adicionais, além da profilaxia inicial (em geral, após a alta hospitalar), comprovou ser benéfica em pacientes submetidos à cirurgia ortopédica.
Pacientes clínicos
A dose recomendada para pacientes clínicos é de 40mg de enoxaparina sódica, 1 (uma) vez ao dia, administrada por via subcutânea. A duração do tratamento deve ser de, no mínimo, 6 (seis) dias, devendo ser mantido até a deambulação total do paciente, por um período máximo de 14 (quatorze) dias.
Tratamento da trombose de veias profundas
A posologia recomendada de Versa recomendada para o tratamento de tromboses de veias profunda é de 1,5mg/kg, 1 vez ao dia ou 1mg/kg, 2 (duas) vezes ao dia, administrada por via subcutânea. A enoxaparina sódica é geralmente prescrita por um período médio de 10 (dez) dias. A terapia anticoagulante oral deve ser iniciada quando apropriado, e o tratamento com Versa deve ser mantido até o início do efeito terapêutico do anticoagulante oral.
Tratamento de angina instável e infarto agudo do miocárdio sem onda Q
A posologia recomendada de Versa é de 1mg/kg a cada 12 (doze) horas, por via subcutânea, administrada concomitantemente com ácido acetilsalicílico (100 a 325mg, 1 (uma) vez ao dia).
Nestes pacientes, o tratamento com Versa deve ser prescrito por no mínimo 2 (dois) dias, e mantido até estabilização clínica. A duração normal do tratamento é de 2 (dois) a 8 (oito) dias.
Prevenção da coagulação do circuito extracorpóreo durante a hemodiálise:
Administração por via intravenosa
A dose recomendada é de 1mg/kg de Versa injetada na linha arterial do circuito, no início da sessão de hemodiálise. O efeito desta dose geralmente é suficiente para uma sessão com duração de 4 horas. No caso de aparecimento de anéis de fibrina ou de uma sessão mais longa que o normal deve-se administrar dose complementar de 0,5 a 1,0mg/Kg de Versa. Em pacientes sob alto risco hemorrágico, a dose deve ser reduzida para 0,5mg/Kg quando o acesso vascular for duplo ou 0,75mg/kg quando o acesso vascular for simples.
Risco de uso por via de administração não recomendada
Não há estudos dos efeitos de Versa administrado por vias não recomendadas. Portanto, por segurança e para eficácia deste medicamento, a administração deve ser somente pela via subcutânea e intravenosa, conforme recomendado pelo médico.
Posologia para populações especiais
Idosos
Não é necessário realizar ajuste posológico em idosos, a menos que a função renal (dos rins) esteja prejudicada.
Insuficiência renal
Insuficiência renal grave:
É necessário realizar ajuste posológico em pacientes com insuficiência renal grave (clearance de creatinina < 30mL/min), de acordo com as tabelas a seguir, visto que a exposição à enoxaparina sódica é significativamente aumentada nesta população.
Para uso terapêutico, os seguintes ajustes posológicos são recomendados:
| Dose padrão | Insuficiência grave dos rins |
|
1mg/kg, por via subcutânea, duas vezes ao dia | 1mg/kg, por via subcutânea, uma vez ao dia |
|
1,5mg/kg, por via subcutânea, uma vez ao dia |
1mg/kg, por via subcutânea, uma vez ao dia |
Para uso profilático, os seguintes ajustes posológicos são recomendados:
| Dose padrão | Insuficiência grave dos rins |
|
40mg, por via subcutânea, uma vez ao dia |
20mg, por via subcutânea, uma vez ao dia |
|
20mg, por via subcutânea, uma vez ao dia |
20mg, por via subcutânea, uma vez ao dia |
Estes ajustes posológicos não se aplicam à indicação de hemodiálise.
Insuficiência renal leve e moderada:
Embora não seja recomendado realizar ajuste posológico em pacientes com insuficiência renal moderada (clearance de creatinina 30-50mL/min) e leve (clearance de creatinina 50-80mL/min), é aconselhável que se faça monitorização clínica cuidadosa.
Insuficiência hepática (do fígado)
Devido à ausência de estudos clínicos, recomenda-se cautela em pacientes com insuficiência hepática.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento de seu médico.
O que devo fazer quando eu me esquecer de usar Versa?
Use o medicamento assim que se lembrar de que esqueceu uma dose. Se o horário estiver próximo ao que seria a dose seguinte, pule a dose perdida e siga o horário das outras doses normalmente. Não dobre a dose para compensar a dose omitida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Hemorragia (sangramento):
Assim como outros anticoagulantes, pode ocorrer sangramento em qualquer local. Se ocorrer sangramento, a origem da hemorragia deve ser investigada e tratamento apropriado deve ser instituído.
Monitorização da contagem de plaquetas (célula sanguínea necessária para a coagulação):
O risco de redução no número de plaquetas induzida por heparina também existe com heparinas de baixo peso molecular e pode ocorrer entre o 5º e 21º dia após o início do tratamento com enoxaparina sódica. Por essa razão, deve-se realizar a contagem do número de plaquetas antes do início e regularmente durante o tratamento com enoxaparina sódica. Na prática, em caso de confirmação de diminuição do número de plaquetas (30 a 50% do valor inicial), o tratamento com enoxaparina sódica deve ser imediatamente interrompido e substituído por outra terapia.
As heparinas de baixo peso molecular (HBPM):
As heparinas de baixo peso molecular (HBPM) devem ser utilizadas individualmente, pois existem diferenças básicas entre elas quanto ao: processo de produção, peso molecular, unidade e dosagem. Isto ocasiona diferenças em suas atividades farmacológicas; portanto, é necessário obedecer às instruções de uso de cada medicamento.
Anestesia espinhal/peridural (“raqui” e “peri”, tipos de anestesias locais, aplicadas nas costas):
Assim como com outros anticoagulantes, foram relatados casos de hematoma intraespinhal (dentro da medula espinhal) com o uso concomitante de enoxaparina sódica e anestesia espinhal/peridural, que podem resultar em paralisia prolongada ou permanente. Estes eventos são raros com a administração de doses ? 40mg/dia de enoxaparina sódica. O risco destes eventos pode ser aumentado pela administração de doses maiores de enoxaparina sódica, uso de cateter epidural (catéter de anestesia aplicado dentro do espaço peridural) pós-operatório ou em caso de administração concomitante de outros medicamentos, como alguns anti-inflamatórios. O risco parece também ser aumentado por traumatismo ou punções espinhais repetidas.
Para reduzir o risco potencial de sangramento associado ao uso concomitante de enoxaparina sódica e anestesia/analgesia peridural ou espinhal, a introdução e remoção do cateter devem ser realizadas quando o efeito anticoagulante da enoxaparina sódica estiver baixo.
A introdução ou remoção do cateter deve ser postergada para 10 (dez) - 12 (doze) horas após a administração de enoxaparina sódica, na profilaxia das tromboses de veias profundas, enquanto que, em pacientes recebendo doses maiores de enoxaparina sódica, a introdução ou remoção do cateter deverá ocorrer 24 (vinte e quatro) horas após a administração. A dose subsequente de enoxaparina sódica deve ser administrada no mínimo 2 (duas) horas após a remoção do cateter.
O médico deve decidir sobre a administração de anticoagulantes, durante o uso de anestesia peridural/espinhal. Os pacientes devem informar imediatamente seu médico caso apresentem qualquer sintoma, tais como dor na região lombar, entorpecimento ou fraqueza dos membros inferiores, alterações intestinais e/ou urinárias. Em caso de suspeita de sinais ou sintomas de hematoma intraespinhal, devem ser efetuados o diagnóstico e tratamento com urgência.
Procedimentos de revascularização coronária percutânea (procedimento para o tratamento do infarto):
Para minimizar o risco de sangramento após procedimentos de revascularização, deve-se ter atenção especial ao local do procedimento, para detecção de sinais de sangramento ou formação de hematoma.
Reações Adversas
Assim como com todos os anticoagulantes, hemorragias são o principal evento adverso de Versa, que podem ocorrer em qualquer local, principalmente na presença de fatores de risco associados como: lesões suscetíveis a sangramento, procedimentos cirúrgicos ou uso de certas associações medicamentosas que afetam a coagulação.
Os eventos adversos de Versa estão apresentados em ordem de frequência decrescente a seguir:
Comuns, > 1% e < 10%:
- Sistema nervoso central: febre, confusão, dor;
- Dermatológico: vermelhidão, escoriações;
- Gastrointestinal: náuseas, diarreia;
- Hematológico: sangramentos (inclui casos de intracraniana e intraocular), anemia e redução no número de plaquetas. Já foram relatados casos de redução no número de plaquetas de intensidade leve, transitória e assintomática durante os primeiros dias de tratamento;
- Hepática: aumento das enzimas do fígado ALT e AST;
- Local: hematoma, dor e vermelhidão no local da injeção;
- Renal: saída de glóbulos vermelhos na urina.
Incomuns, > 0,1% e <1%:
Reações alérgicas, reação alérgica de intensidade grave (anafilaxia), inflamação dos vasos da pele, inflamação da pele, hematoma na espinha, aumento das concentrações de potássio no sangue, aumento do colesterol, aumento de triglicérides, lesão vermelha na pele com coceira, manchas roxas na pele, hemorragia na região posterior do abdômen, necrose da pele (geralmente precedida por manchas roxas ou placas avermelhadas, infiltradas e dolorosas, devendo-se interromper o tratamento com enoxaparina sódica), aumento do número de plaquetas, lesões avermelhadas e bolhosas.
Foram relatados raros casos de redução no número de plaquetas de origem alérgica com trombose. Em alguns casos, a trombose foi complicada por menor irrigação sanguínea das extremidades.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe a empresa sobre o aparecimento de reações indesejáveis e problemas com este medicamento, entrando em contato através do Sistema de Atendimento ao Consumidor (SAC).
População Especial
A utilização de Versa não afeta a habilidade de dirigir ou operar máquinas.
Gravidez
Estudos em animais não demonstraram qualquer evidência de toxicidade ao feto ou malformação fetal. Em ratas prenhes, a passagem de enoxaparina sódica por meio da placenta é mínima. Em humanos, não existe evidência da passagem da enoxaparina sódica por meio da placenta durante o segundo trimestre da gravidez. Ainda não existem informações disponíveis a este respeito, durante o primeiro e terceiro trimestres da gravidez. Como não foram realizados estudos adequados e bem controlados em gestantes e como os estudos realizados em animais nem sempre são bons indicativos da resposta no ser humano, deve-se utilizar enoxaparina sódica durante a gravidez, somente se o médico considerar como estritamente necessário.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Amamentação
Em ratas lactantes, a concentração de enoxaparina sódica ou de seus metabólitos marcados no leite é muito baixa. Não se sabe se a enoxaparina sódica inalterada é excretada no leite humano. A absorção oral da enoxaparina sódica é improvável; porém, como precaução, não se deve amamentar durante o tratamento com Versa.
Pacientes idosos
Não foi observado aumento na tendência de sangramento em idosos com doses usadas para prevenção de tromboses; porém, pacientes idosos (especialmente ? 80 anos de idade) podem ter um aumento no risco de complicações hemorrágicas, com doses terapêuticas. Portanto, aconselha-se monitorização clínica cuidadosa.
Pacientes idosos podem apresentar eliminação reduzida da enoxaparina.
Crianças
A segurança e eficácia da enoxaparina sódica em crianças ainda não foram estabelecidas.
Restrições a grupos de risco
A enoxaparina sódica, assim como qualquer outro anticoagulante, deve ser utilizada com cautela, em pacientes com alto risco de sangramento, como nos seguintes casos:
- Alterações na coagulação;
- História de úlcera ou sangramento gastrointestinal recente;
- Acidente vascular cerebral (“derrame”) isquêmico recente;
- Hipertensão arterial grave não controlada por medicamentos;
- Retinopatia por diabetes ou por hipertensão arterial (“pressão alta”);
- Doença grave do fígado;
- Neurocirurgia ou cirurgia nos olhos recente;
- Uso concomitante de medicamentos que afetem a coagulação.
Próteses mecânicas valvulares cardíacas
O uso de Versa não foi adequadamente estudado para casos de prevenção de tromboses em pacientes com próteses valvulares cardíacas. Foram relatados casos isolados de trombose em pacientes com próteses mecânicas valvulares que receberam enoxaparina para prevenção de trombose. A avaliação destes casos é limitada devido aos fatores causais serem confusos. Alguns destes casos foram em gestantes nas quais a trombose resultou em óbitos materno e fetal. Gestantes com próteses mecânicas valvulares cardíacas podem apresentar maior risco para tromboses e embolias.
Insuficiência dos rins
Em pacientes com insuficiência renal, existe aumento no risco de hemorragias. Como a exposição à enoxaparina sódica aumenta significantemente em pacientes com insuficiência renal grave (clearance de creatinina < 30mL/min), o ajuste de doses é recomendado para uso terapêutico e preventivo. Embora não seja recomendado ajuste de doses em pacientes com clearance de creatinina entre 30-80mL/min, é aconselhável realizar monitorização clínica cuidadosa.
Peso baixo
Um aumento na exposição à enoxaparina sódica em doses preventivas não ajustadas ao peso tem sido observado em mulheres de peso baixo (< 45kg) e homens de baixo peso (< 57kg), que pode resultar em maior risco de hemorragia. Portanto, é aconselhável realizar monitorização clínica cuidadosa nestes pacientes.
Diminuição no número de plaquetas induzida pela heparina
Versa deve ser utilizada com extrema cautela em pacientes, com história de redução no número de plaquetas induzida pela heparina, com ou sem trombose, pois o risco pode persistir por vários anos. A decisão do uso de enoxaparina sódica em tais casos deve ser tomada somente por um médico especialista;
Gestantes com próteses mecânicas valvulares cardíacas
Não foram realizados estudos adequados para avaliar a utilização de Versa na prevenção de tromboses em gestantes, com próteses mecânicas valvulares cardíacas.
Composição
Cada seringa preenchida contém:
| Apresentação | 20mg | 40mg | 60mg | 80mg |
|
Enoxaparina sódica | 20mg | 40mg | 60mg | 80mg |
|
Água para injetáveis q.s.p. | 0,2mL | 0,4mL | 0,6mL | 0,8mL |
Superdosagem
Sintomas e gravidade:
A superdosagem acidental após administração intravenosa, extracorporal ou subcutânea de Versa pode causar complicações hemorrágicas. A absorção de enoxaparina sódica após a administração oral, mesmo em altas doses, é pouco provável.
Tratamento:
Os efeitos anticoagulantes podem ser, em grande parte, neutralizados pela administração intravenosa lenta de protamina. A dose de protamina deve ser idêntica à dose de enoxaparina sódica administrada, ou seja, 1mg de protamina neutraliza o efeito anticoagulante de 1mg de enoxaparina sódica, se a enoxaparina sódica foi administrada nas primeiras 8 (oito) horas. Uma infusão de 0,5mg de protamina para 1mg de enoxaparina sódica pode ser administrada se a enoxaparina sódica foi administrada em um período maior que 8 (oito) horas anteriores à administração da protamina, ou se tiver sido determinado que uma segunda dose de protamina seja necessária. Após 12 (doze) horas da injeção de enoxaparina sódica, a administração da protamina pode não ser necessária. Entretanto, mesmo com doses elevadas de protamina, a atividade anti-Xa nunca é completamente neutralizada (máximo de aproximadamente 60%).
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações sobre como proceder.
Interação Medicamentosa
Medicamento-medicamento
Recomenda-se a interrupção do uso de medicamentos que afetam a hemostasia antes do início do tratamento com enoxaparina sódica (substância ativa deste medicamento), a menos que seu uso seja estritamente indicado. Tais medicamentos incluem:
- Salicilatos sistêmicos, ácido acetilsalicílico e outros AINEs, incluindo o cetorolaco;
- Dextrana 40, ticlopidina e clopidogrel;
- Glicocorticoides sistêmicos;
- Agentes trombolíticos e anticoagulantes;
- Outros agentes antiplaquetários, incluindo os antagonistas de glicoproteína IIb/IIIa.
Em caso de indicação do uso de qualquer uma destas associações, deve-se utilizar enoxaparina sódica (substância ativa deste medicamento) sob cuidadoso monitoramento clínico e laboratorial quando apropriado.
Medicamento-exame laboratorial
Nas doses utilizadas na profilaxia do tromboembolismo venoso, enoxaparina sódica (substância ativa deste medicamento) não influencia significativamente o tempo de sangramento e os testes de coagulação sanguínea global, nem afeta a agregação plaquetária ou a ligação do fibrinogênio às plaquetas.
Pode ocorrer aumento do tempo de tromboplastina parcial ativada (TTPa) e do tempo de coagulação ativada (TCA) com a administração de doses mais altas. Aumentos no TTPa e TCA não estão linearmente correlacionados ao aumento da atividade antitrombótica de enoxaparina sódica (substância ativa deste medicamento), sendo, portanto, inadequados e inseguros para monitoramento da atividade de enoxaparina sódica (substância ativa deste medicamento).
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados de eficácia
Cirurgia abdominal
Em um estudo duplo-cego em pacientes submetidos à cirurgia eletiva de tumores gastrointestinais, urológicos, ou do trato ginecológico, um total de 1116 pacientes foram incluídos e 1115 receberam profilaxia de TEV.
Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC, uma vez ao dia, começando 2h antes da cirurgia e continuado por um período de no máximo 12 dias após a cirurgia, teve sua eficácia comparada a da heparina não fracionada (HNF) 5000 U SC a cada 8h na redução do risco de trombose venosa profunda (TVP). Os dados de eficácia são apresentados abaixo [ver tabela 1] (Bergqvist et al, 1997).
Tabela 1 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após cirurgia abdominal
| Indicação | Regime | |
|
Enoxaparina sódica (substância ativa deste medicamento) | Heparina 5000 U SC cada 8h n (%) | |
| Todos os pacientes submetidos à cirurgia abdominal que receberam profilaxia | 555 (100) | 560 (100) |
| TEV total1 (%) | 56 (10,1) (95% IC2: 8 a 13) | 63 (11,3) (95% IC: 9 a 14) |
| Somente TVP (%) | 54 (9,7) (95% IC: 7 a 12) | 61 (10,9) (95% IC: 8 a 13) |
1 TEV: tromboembolismo venoso incluíram TVP, EP e óbitos considerados de causa tromboembólica.
2 IC: Intervalo de Confiança.
Em outro estudo duplo-cego, enoxaparina sódica (substância ativa deste medicamento) 40 mg SC uma vez ao dia foi comparado com HNF 5000 U SC a cada 8h, em pacientes submetidos à cirurgia colorretal (um terço deles com câncer).
Um total de 1347 pacientes foi incluído no estudo e todos receberam tratamento. A profilaxia foi iniciada aproximadamente 2h antes da cirurgia e continuada por aproximadamente 7 a 10 dias após a cirurgia. Os dados de eficácia são apresentados abaixo [ver tabela 2] (MacLeod RS et al, 2001).
Tabela 2 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após cirurgia de câncer colorretal
| Indicação | Regime | |
| Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC cada 24h n (%) | Heparina 5000 U SC cada 8h n (%) | |
| Todos os pacientes submetidos à cirurgia abdominal que receberam profilaxia | 555 (100) | 674 (100) |
| TEV total1 (%) | 48 (7,1) (95% IC2: 5 a 9) | 45 (6,7) (95% IC: 5 a 9) |
| Somente TVP (%) | 47 (7,0) (95% IC: 5 a 9) | 44 (6,5) (95% IC: 5 a 8) |
1 TEV: tromboembolismo venoso incluíram TVP, EP e óbitos considerados de causa tromboembólica.
2 IC: Intervalo de Confiança.
Artroplastia de quadril
Em um estudo duplo-cego, randomizado, enoxaparina sódica (substância ativa deste medicamento) 40 mg SC uma vez ao dia foi comparado com HNF 5000 U SC a cada 8h, após artroplastia total de quadril. A profilaxia foi iniciada 12h antes da cirurgia, no caso da enoxaparina, e 2h antes da cirurgia, no caso da heparina. Um total de 237 pacientes foram randomizados no estudo e receberam profilaxia. Os resultados de eficácia são mostrados na tabela abaixo [ver tabela 3] (Planes et al 1988).
Tabela 3 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após artroplastia total de quadril
| Indicação | Regime | |
| Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC cada 24h | Heparina 5000 U SC cada 8h | |
| TVP total | 12,5%1 | 25% |
| TVP proximal (%) | 7,5%2 | 18,5% |
1 Valor de p versus heparina: 0,03; redução de risco relativo de 50%.
2 Valor de p versus heparina: 0,014; redução de risco relativo de 59%.
Um estudo duplo-cego, multicêntrico, comparou três regimes de dose de enoxaparina sódica (substância ativa deste medicamento) em pacientes submetidos à artroplastia de quadril. Um total de 572 pacientes foram randomizados e 568 receberam a profilaxia proposta.
Profilaxia com enoxaparina sódica (substância ativa deste medicamento) foi iniciada 2 dias após a cirurgia e continuou por 7 a 11 dias após a cirurgia. Os dados de eficácia são fornecidos abaixo [ver tabela 4] (Spiro et al, 1994).
Tabela 4 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após cirurgia de artroplastia de quadril


1 Valor de p versus enoxaparina sódica (substância ativa deste medicamento) 10 mg cada 24h: 0,0008.
2 Valor de p versus enoxaparina sódica (substância ativa deste medicamento) 10 mg cada 24h: 0,0168.
Não houve diferença significativa entre os regimes de 30 mg cada 12h e 40 mg cada 24h.
Em um estudo de profilaxia estendida para pacientes submetidos à artroplastia de quadril, os pacientes receberam durante a internação, enoxaparina sódica (substância ativa deste medicamento) 40 mg SC iniciado 12h antes da cirurgia para prevenir TVP pósoperatória.
Ao final do período perioperatório, todos os pacientes foram submetidos à venografia bilateral.
Seguindo um desenho duplo-cego, todos os pacientes sem evidência de doença tromboembólica foram randomizados para um regime pós-alta de enoxaparina sódica (substância ativa deste medicamento) 40 mg (n = 90) por via SC, uma vez ao dia ou de placebo (n = 89) por 3 semanas. Nessa população de pacientes, a incidência de TVP durante a fase de profilaxia estendida foi significativamente mais baixa no grupo que recebeu enoxaparina sódica (substância ativa deste medicamento) comparado ao placebo. Os dados de eficácia são apresentados na tabela abaixo [ver tabela 5] (Planes et al 1996).
Tabela 5 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia estendida de TVP após artroplastia de quadril
| Indicação (Pós-alta) | Regime pós-alta | |
| Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC cada 24h n (%) | Placebo SC cada 24h n (%) | |
| Todos os pacientes com profilaxia estendida | 90 (100) | 89 (100) |
| TVP total (%) | 6 (7)1 (95% IC2: 3 a 14) | 18 (20) (95% IC: 12 a 30) |
| TVP proximal (%) | 5 (6)3 (95% IC: 2 a 13) | 7 (8) (95% IC: 3 a 16) |
1 Valor de p versus placebo: 0,008.
2 IC: Intervalo de confiança.
3 Valor de p versus placebo: 0,537.
Em um segundo estudo, pacientes submetidos à artroplastia de quadril receberam durante a hospitalização enoxaparina sódica (substância ativa deste medicamento) 40 mg SC, iniciado 12h antes da cirurgia. Todos os pacientes foram examinados em busca de sinais e sintomas de doença tromboembólica. Pacientes sem qualquer sinal de TEV foram randomizados para um regime pós-alta com enoxaparina sódica (substância ativa deste medicamento) 40 mg SC uma vez ao dia (n = 131) ou placebo (n = 131) por 3 semanas. Um total de 262 pacientes foram randomizados nessa fase duplo-cega. De modo semelhante ao primeiro estudo, a incidência de TVP durante a profilaxia estendida foi significativamente menor com enoxaparina sódica (substância ativa deste medicamento) quando comparado ao placebo, com diferença estatisticamente significativa tanto na incidência TVP total (enoxaparina sódica (substância ativa deste medicamento) [16%] versus placebo 45 [34%]; p = 0,001) quanto na de TVP proximal (enoxaparina sódica (substância ativa deste medicamento) 8 [6%] versus placebo 28 [21%]; p = <0,001) (Bergqvist et al, 1996).
Artroplastia de joelho
Um total de 132 pacientes foram randomizados no estudo e 131 receberam profilaxia. Após hemostasia, profilaxia foi iniciada 12 a 24h após a cirurgia e continuada por até 15 dias. A incidência de TVP total e proximal após cirurgia foi significativamente mais baixa no grupo que recebeu enoxaparina sódica (substância ativa deste medicamento) comparado ao placebo. Os dados de eficácia são mostrados abaixo [ver tabela 6] (Leclerc et al, 1992).
Tabela 6 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de trombose venosa profunda após artroplastia total de joelho
| Indicação | Regime | |
|
Enoxaparina sódica (substância ativa deste medicamento) 30 mg n (%) |
Placebo q12h SC n (%) | |
| Todos os pacientes submetidos a artroplastia de joelho | 47 (100) | 52 (100) |
| TVP Total (%) | 5 (11)1 (95% IC2: 1 a 21) | 32 (62) (95% IC: 47 a 76) |
| TVP proximal (%) | 0 (0)3 (95% LC superior4: 5) | 7 (13) (95% IC: 3 a 24) |
1 Valor de p versus placebo: 0,0001.
2 IC: Intervalo de Confiança.
3 Valor de p versus placebo: 0,013.
4 LC: Limite de Confiança.
Ainda em artroplastia eletiva de joelho, outro estudo clínico aberto, de grupos paralelos, randomizado, comparou enoxaparina sódica (substância ativa deste medicamento) 30 mg SC a cada 12h com heparina 5000 U SC a cada 8h. Um total de 453 pacientes foram randomizados e todos receberam profilaxia conforme o grupo designado. A profilaxia iniciou-se após a cirurgia e continuou até 14 dias. A incidência de trombose venosa profunda foi significativamente menor com enoxaparina sódica (substância ativa deste medicamento), comparada com heparina (Cowell et al, 1995).
Profilaxia de tromboembolismo em pacientes clínicos com mobilidade reduzida durante doença aguda
Em um estudo multicêntrico, duplo-cego, de grupos paralelos, enoxaparina sódica (substância ativa deste medicamento) 20 mg ou 40 mg SC uma vez ao dia foi comparado com placebo na profilaxia de TVP em pacientes clínicos com mobilidade restrita durante uma doença aguda (definida como distância percorrida <10 metros em tempo ? 3 dias).
Esse estudo incluiu pacientes com insuficiência cardíaca (NYHA Classe funcional III ou IV); insuficiência respiratória aguda ou insuficiência respiratória crônica complicada (sem necessidade de suporte ventilatório): infecção aguda (exceto choque séptico) ou doença reumatológica aguda. Um total de 1102 pacientes foi incluído no estudo, e 1073 pacientes receberam profilaxia. A terapia foi continuada por até 14 dias (media de duração de 7 dias). Quando administrado numa dose de 40 mg SC 1x/dia, enoxaparina sódica (substância ativa deste medicamento) reduziu significativamente a incidência de TVP comparado ao placebo. Dados de eficácia são mostrados abaixo [ver tabela 7] (Samama et al, 1999).
Tabela 7 - Eficácia do enoxaparina sódica (substância ativa deste medicamento) em pacientes clínicos com mobilidade reduzida durante doença aguda
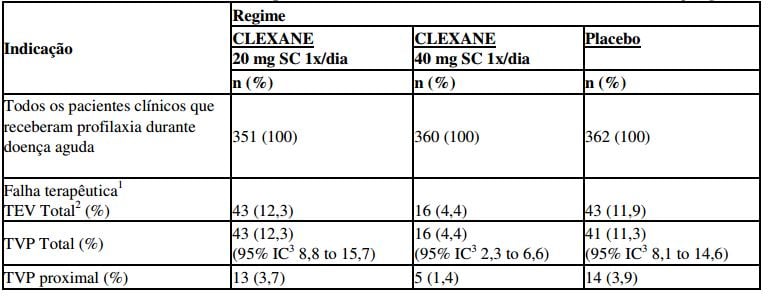
1 Falha terapêutica durante os dias 1 e 14.
2 TEV: Eventos tromboembólicos, os quais incluem TVP, EP e óbito considerado de origem embólica.
3 IC: Intervalo de Confiança
O tratamento profilático com enoxaparina sódica (substância ativa deste medicamento) 40 mg SC ao dia reduziu em 63% o risco de TEV. Em aproximadamente 3 meses após a inclusão, a incidência de tromboembolismo permaneceu significativamente mais baixa no grupo que recebeu enoxaparina sódica (substância ativa deste medicamento) 40 mg versus o grupo placebo.
Tratamento de trombose venosa profunda (TVP) com ou sem embolia pulmonar (EP)
Em um estudo multicêntrico, de grupos paralelos, 900 pacientes com TVP aguda de membro inferior associada ou não à embolia pulmonar foram randomizados para tratamento hospitalar com enoxaparina sódica (substância ativa deste medicamento) 1,5 mg/kg SC 1x/dia, enoxaparina sódica (substância ativa deste medicamento) 1 mg/kg SC cada 12h ou heparina em bolus (5000 UI) seguido de infusão contínua (administrada até atingir um TTPa de 55 a 85 segundos). Todos os pacientes receberam tratamento. Todos os pacientes também receberam varfarina sódica (dose ajustada de acordo com o TP para atingir um RNI (relação normatizada internacional) entre 2 e 3), a partir de 72h do início da terapia com enoxaparina sódica (substância ativa deste medicamento) ou HNF. Enoxaparina sódica (substância ativa deste medicamento) ou HNF foram administrados por no mínimo 5 dias e até que o RNI desejado fosse atingido.
Ambos os regimes de enoxaparina sódica (substância ativa deste medicamento) foram equivalentes à terapia com HNF em reduzir o risco de TEV recorrente. Os dados de eficácia são mostrados abaixo [ver tabela 8] (Merli et al, 2001).
Tabela 8 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) no tratamento da trombose venosa profunda com ou sem embolia pulmonar
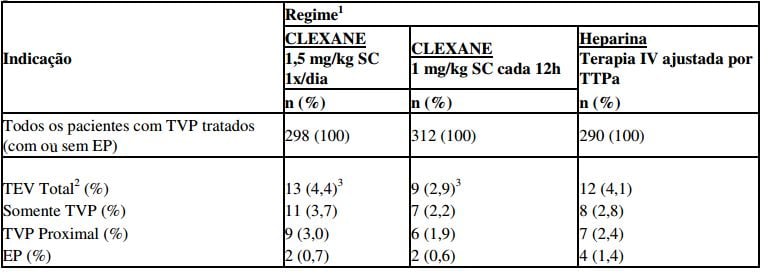
1 Todos os pacientes também foram tratados com varfarina sódica a partir de 72h do início do tratamento com enoxaparina sódica (substância ativa deste medicamento) ou heparina padrão.
2 TEV: evento tromboembólico (trombose venosa profunda [TVP] e/ou embolia pulmonar [EP]).
Os intervalos de confiança de 95% para a diferença de tratamento no TEV total foram: Enoxaparina Sódica (substância ativa deste medicamento) 1x/dia versus heparina (-3,0 a 3,5).
Enoxaparina Sódica (substância ativa deste medicamento) cada 12h versus heparina (-4,2 a 1,7).
Hemodiálise
Em um estudo, pacientes com insuficiência renal terminal (n=36) fazendo hemodiálise 3 vezes por semana, receberam Enoxaparina Sódica (substância ativa deste medicamento) ou HNF e depois foram trocados para o outro tratamento, a cada 12 semanas.
Enoxaparina 1 mg/kg foi administrada na forma de bolus dentro da linha arterial antes da diálise. Doses subsequentes de enoxaparina eram reduzidas para 0,2 mg/kg caso ocorresse sangramento. HNF 50 UI/kg foi administrada na forma de bolus dentro da linha arterial, seguida por uma dose de manutenção de 1000 UI/hora.
As linhas e filtros de diálise ficaram significativamente mais limpas (sem coágulos) com Enoxaparina Sódica (substância ativa deste medicamento) em comparação com HNF (p<0,001) (Saltissi et al, 1999).
Tratamento de angina instável e infarto do miocárdio (IM) sem elevação do segmento ST (Cohen et al, 1997)
Em um grande estudo multicêntrico, 3171 pacientes incluídos na fase aguda de angina instável ou IM sem elevação do segmento ST foram randomizados para receber, em associação com ácido acetilsalicílico (100 a 325 mg, uma vez ao dia), 1 mg/kg de enoxaparina sódica em injeção subcutânea a cada 12 horas, ou HNF por administração IV, ajustada com base no tempo de tromboplastina parcial ativada (TTPa). Os pacientes foram tratados em ambiente hospitalar por um período mínimo de 2 e máximo de 8 dias, até estabilização clínica, procedimentos de revascularização ou alta hospitalar. Os pacientes foram acompanhados por 30 dias. A enoxaparina sódica, em comparação à HNF, diminuiu significativamente a incidência de angina recorrente, IM e óbito, com redução do risco relativo de 16,2% no 14º dia, sustentado durante o período de 30 dias. Além disto, um número menor de pacientes do grupo tratado com enoxaparina sódica foi submetido à revascularização por angioplastia coronariana transluminal percutânea (ACTP) ou por enxerto de ponte arterial coronariana (15,8% de redução do risco relativo no 30º dia).
Tratamento do IM com elevação do segmento ST (Antman et al, 2006)
Em um grande estudo multicêntrico, 20479 pacientes diagnosticados com IM com elevação do segmento ST, elegíveis para receber terapia fibrinolítica, foram randomizados para receber: 1) enoxaparina sódica em bolus IV único de 30 mg acompanhado de 1 mg/kg por via SC, seguido de doses SC de 1 mg/kg a cada 12 horas; ou, 2) HNF por administração IV, ajustada com base no tempo de TTPa por 48 horas. Todos os pacientes também foram tratados com ácido acetilsalicílico por um período mínimo de 30 dias. A estratégia posológica de enoxaparina foi ajustada para pacientes acometidos por insuficiência renal severa e para pacientes idosos com idade maior ou igual a 75 anos. As injeções SC de enoxaparina foram administradas por um período máximo de 8 dias ou até que o paciente recebesse alta do hospital (considerando o que ocorresse primeiro).
Em um subgrupo deste mesmo estudo, 4716 pacientes foram submetidos à intervenção coronariana percutânea (ICP) recebendo suporte antitrombótico com fármaco do estudo de modo cego. Portanto, para pacientes que utilizaram a enoxaparina, a ICP foi realizada com enoxaparina (sem troca) utilizando-se o regime estabelecido em estudos prévios, ou seja, caso a última dose SC tenha sido administrada há menos de 8 horas antes de o balão ser inflado, não se administra dose adicional e caso a última dose subcutânea tenha sido administrada há mais de 8 horas antes de o balão ser inflado, administra-se uma dose adicional de 0,3 mg/kg através de bolus intravenoso.
A enoxaparina sódica quando comparada com a HNF reduziu significativamente a incidência do desfecho primário, uma combinação de morte por qualquer causa ou reinfarto do miocárdio nos primeiros 30 dias após a randomização [9,9% no grupo tratado com enoxaparina, comparado a 12,0% no grupo tratado com heparina nãofracionada] com uma redução relativa do risco igual a 17% (P<0,001).
Os benefícios do tratamento com enoxaparina, evidenciados por uma série de resultados de eficácia, surgiram em 48 horas, tempo no qual houve uma redução de 35% do risco relativo de reinfarto do miocárdio, quando comparado com o tratamento com HNF (P<0,001).
O efeito benéfico da enoxaparina no desfecho primário foi consistente entre os subgrupos principais do estudo, incluindo idade, sexo, local do infarto, histórico de diabetes, histórico de infarto do miocárdio anterior, tipo do fibrinolítico administrado e tempo para tratamento com o fármaco em estudo.
Houve um benefício significativo do tratamento com enoxaparina, quando comparado com o tratamento com HNF, em pacientes submetidos à ICP dentro de 30 dias após a randomização (23% de redução do risco relativo) ou em pacientes tratados com terapia medicamentosa (15% de redução do risco relativo, P = 0,27 para interação).
A incidência do desfecho composto de morte, reinfarto do miocárdio ou hemorragia intracraniana (uma medida do benefício clínico líquido), considerando-se os 30 primeiros dias, foi significativamente menor (p<0,0001) no grupo tratado com enoxaparina (10,1%) quando comparado com o grupo tratado com HNF (12,2%), representando uma redução de 17% do risco relativo em favor do tratamento com Enoxaparina Sódica (substância ativa deste medicamento).
O efeito benéfico da enoxaparina no desfecho primário, observado durante os primeiros 30 dias, foi mantido por um período de acompanhamento de 12 meses.
Características farmacológicas
Propriedades farmacodinâmicas
O princípio ativo de enoxaparina sódica (substância ativa deste medicamento) é a enoxaparina sódica. Trata-se de uma heparina de baixo peso molecular com peso médio de 4.500 dáltons. A enoxaparina sódica é um sal de sódio. A distribuição do peso molecular é:
| < 2000 dáltons | ? 20% |
| 2000 a 8000 dáltons | ? 68% |
| > 8000 dáltons | ? 18% |
A enoxaparina sódica é obtida pela despolimerização alcalina do éster benzil heparina derivado da mucosa intestinal suína. Sua estrutura é caracterizada por um grupo ácido 2-O-sulfo-4 enepiranosurônico no final não redutor da cadeia e um 2-N, 6-O-dissulfo-D-glicosamina no final redutor da cadeia. Aproximadamente 20% (variando entre 15% e 25%) da estrutura da enoxaparina contêm um derivado 1,6 anidro no final redutor da cadeia polissacarídica.
Em um sistema purificado in vitro, a enoxaparina sódica apresenta alta atividade anti-Xa (aproximadamente 100 UI/mg) e baixa atividade anti-IIa ou antitrombina (aproximadamente 28 UI/mg).
Estas atividades anticoagulantes são mediadas por antitrombina III (ATIII) resultando em atividade antitrombótica em humanos.
Além da sua atividade anti-Xa/IIa, as propriedades antitrombótica e anti-inflamatória da enoxaparina foram identificadas em indivíduos saudáveis e em pacientes, bem como em modelos não clínicos.
Estes incluem inibição ATIII-dependente de outros fatores de coagulação, como fator VIIa, indução da liberação do inibidor da Via do Fator Tecidual endógeno, assim como uma liberação reduzida de fator de von Willebrand do endotélio vascular para a circulação sanguínea. Estes fatores são conhecidos por contribuir para o efeito antitrombótico global da enoxaparina.
Propriedades farmacocinéticas:
Características gerais
Os parâmetros farmacocinéticos da enoxaparina sódica foram estudados principalmente com relação ao tempo da atividade plasmática anti-Xa e também com relação à atividade anti-IIa, nos intervalos de dose recomendados após administrações subcutâneas únicas e repetidas e após administração intravenosa única.
A determinação quantitativa das atividades farmacocinéticas anti-Xa e anti-IIa foi realizada por métodos amidolíticos validados com substratos específicos e com a enoxaparina padrão calibrada contra o padrão internacional para heparinas de baixo peso molecular (NIBSC).
Biodisponibilidade e absorção
A biodisponibilidade absoluta da enoxaparina sódica após administração subcutânea, baseada na atividade anti-Xa, é próxima de 100%. Os volumes de injeção e concentração de doses no intervalo de 100–200 mg/mL não afetam os parâmetros farmacocinéticos em voluntários saudáveis.
A máxima atividade anti-Xa plasmática média é observada 3 a 5 horas após administração subcutânea alcançando, aproximadamente, 0,2; 0,4; 1,0 e 1,3 UI anti-Xa/mL após administração subcutânea de doses únicas de 20 mg, 40 mg, 1 mg e 1,5 mg/kg, respectivamente.
Um bolus intravenoso de 30 mg seguido imediatamente por uma dose subcutânea de 1 mg/kg a cada 12 horas forneceu um pico inicial de níveis de fator anti-Xa igual a 1,16 UI/mL (n = 16) e uma exposição média correspondente a 88% dos níveis do estado de equilíbrio. O estado de equilíbrio é alcançado no segundo dia de tratamento.
A farmacocinética da enoxaparina parece ser linear nos intervalos de dose recomendados. A variabilidade intra e interpacientes é baixa. Após repetidas administrações subcutâneas de 40 mg, uma vez ao dia, e de 1,5 mg/kg uma vez ao dia, em voluntários saudáveis, o estado de equilíbrio é alcançado no 2° dia, com uma taxa de exposição média aproximadamente 15% maior do que após a administração de dose única. O nível de atividade da enoxaparina no estado de equilíbrio é bem previsível pela farmacocinética de dose única. Após administrações subcutâneas repetidas de 1 mg/kg, num regime de 2 vezes ao dia, o estado de equilíbrio é alcançado entre o 3° e o 4° dia, com uma exposição média aproximadamente 65% maior do que após administração de dose única, e as concentrações máxima e mínima médias de aproximadamente 1,2 e 0,52 UI/mL, respectivamente. Baseada na farmacocinética da enoxaparina sódica, esta diferença no estado de equilíbrio é esperada e está dentro do intervalo terapêutico.
A atividade plasmática anti-IIa após a administração subcutânea é aproximadamente 10 vezes menor do que a atividade anti-Xa. A máxima atividade anti-IIa média é observada aproximadamente 3-4 horas após administração subcutânea e alcança 0,13 UI/mL e 0,19 UI/mL após administração repetida de 1 mg/kg, duas vezes ao dia e de 1,5 mg/kg, uma vez ao dia, respectivamente.
Distribuição
O volume de distribuição da atividade anti-Xa da enoxaparina sódica é de aproximadamente 5 L e é próximo do volume sanguíneo.
Metabolismo
A enoxaparina é metabolizada principalmente no fígado por dessulfatação e/ou despolimerização formando moléculas de peso menor, que apresentam potência biológica muito reduzida.
Eliminação
A enoxaparina sódica é um fármaco de baixa depuração, com média de clearance plasmático anti-Xa de 0,74 L/h após infusão intravenosa de 1,5 mg/kg em 6 horas.
A eliminação parece ser monofásica, com meia-vida de aproximadamente 4 horas após uma dose subcutânea única, e até aproximadamente 7 horas após doses repetidas.
O clearance renal dos fragmentos ativos representa aproximadamente 10% da dose administrada e a excreção renal total dos fragmentos ativos e não-ativos é de 40% da dose.
Características em Populações Especiais:
Idosos
Com base nos resultados da análise farmacocinética populacional, o perfil cinético da enoxaparina sódica não é diferente em voluntários idosos comparados a voluntários jovens quando a função renal é normal.
Entretanto, como é conhecido que a função renal diminui com o aumento da idade, pacientes idosos podem apresentar retardo na eliminação da enoxaparina sódica.
Insuficiência renal
Observou-se uma relação linear entre o clearance plasmático de anti-Xa e o clearance de creatinina no estado de equilíbrio, o que indica um decréscimo do clearance da enoxaparina sódica em pacientes com função renal reduzida. A exposição anti-Xa representada pela AUC (área sob a curva), no estado de equilíbrio, é levemente aumentada na insuficiência renal leve (clearance decreatinina 50 – 80 mL/min) e moderada (clearance de creatinina 30 – 50 mL/min) após repetidas doses subcutâneas de 40 mg, uma vez ao dia.
Em pacientes com insuficiência renal severa (clearance de creatinina < 30 mL/min), a AUC no estado de equilíbrio é significativamente aumentada em média em 65% após repetidas doses únicas diárias subcutâneas de 40 mg.
Peso
Após repetidas doses subcutâneas de 1,5 mg/kg, uma vez ao dia, a AUC média de atividade anti-Xa é levemente maior no estado de equilíbrio em voluntários saudáveis obesos (IMC 30 – 48 kg/m2) em comparação aos voluntários controle não-obesos, embora a atividade máxima observada não tenha aumentado. Há menor clearance ajustado ao peso em voluntários obesos tratados com doses subcutâneas.
Quando se administram doses não ajustadas ao peso, a exposição da atividade anti-Xa é 52% maior em mulheres de peso baixo (< 45 kg) e 27% maior em homens de peso baixo (< 57 kg), após uma dose subcutânea única de 40 mg, quando comparada aos voluntários controle com peso normal.
Hemodiálise
Em um único estudo, a taxa de eliminação apresentou-se semelhante, porém a AUC foi duas vezes maior que na população controle, após uma dose intravenosa única de 0,25 ou 0,50 mg/kg.
Interações farmacocinéticas
Não foram observadas interações farmacocinéticas entre a enoxaparina e trombolíticos quando administrados concomitantemente.
Dados de Segurança Pré-Clínicos
Não foram realizados estudos de longa duração em animais para avaliar o potencial carcinogênico da enoxaparina.
A enoxaparina não se mostrou mutagênica em testes in vitro, incluindo o teste Ames, o teste de mutação de células de linfoma em camundongos, o teste de aberração cromossômica linfocítica em humanos e os testes in vivo de aberração cromossômica na medula óssea de ratos.
Demonstrou-se que a enoxaparina não tem nenhum efeito na fertilidade ou no desempenho reprodutivo de ratos machos e fêmeas em doses subcutâneas de até 20 mg/kg/dia. Estudos teratológicos foram conduzidos em ratas e coelhas prenhes em doses subcutâneas de enoxaparina de até 30 mg/kg/dia. Não houve nenhuma evidência de efeitos teratogênicos ou fetotoxicidade devido à enoxaparina.
Além dos efeitos anticoagulantes da enoxaparina, não houve evidência de efeitos adversos em doses de 15 mg/kg/dia em 13 semanas de estudos de toxicidade subcutânea, ambos em ratos e cães e em doses de 10 mg/kg/dia em 26 semanas de estudos de toxicidade subcutânea e intravenosa ambos em ratos e macacos.
Cuidados de Armazenamento
Versa deve ser conservado dentro da embalagem original, em temperatura ambiente (entre 15oC e 30oC) e protegido da luz. Não congelar as seringas preenchidas.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido.
Para sua segurança, mantenha o medicamento na embalagem original.
Características físicas e organolépticas:
Solução límpida, isenta de partículas estranhas. Incolor a levemente amarelada.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Venda sob prescrição médica.
Registro M.S.: 1.0043.1016
Farm. Resp.:
Dra. Sônia Albano Badaró
CRF-SP 19.258
Eurofarma Laboratórios S/A
Av. Vereador José Diniz, 3.465 - São Paulo - SP
CNPJ: 61.190.096/0001-92
Indústria Brasileira
informações complementares
| Fabricante |
| EUROFARMA |
| Princípio ativo |
| Enoxaparina sódica |
| Categoria do medicamento |
| Medicamentos de A-Z |
VERSA - SOLUÇÃO INJETÁVEL 40 MG COM 0,4 ML COM 2 SERINGAS É UM MEDICAMENTO, NÃO USE SEM PRESCRIÇÃO MÉDICA E ORIENTAÇÃO DO FARMACÊUTICO. AO PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
