- Medicamentos
- Medicamentos Especiais
- Berinert - 500 Ui Liofilizado Injetável Frasco-Ampola + Frasco-Ampola Diluente 10Ml + Dispositivo Transf
Menor preço para Berinert - 500 Ui Liofilizado Injetável Frasco-Ampola + Frasco-Ampola Diluente 10Ml + Dispositivo Transf, você encontra no CliqueFarma
Berinert - 500 Ui Liofilizado Injetável Frasco-Ampola + Frasco-Ampola Diluente 10Ml + Dispositivo Transf

Menor Preço
R$ 3.897,70
- CATEGORIA: Medicamentos Especiais
- PRINCÍPIO ATIVO: Inibidor De C1 Esterase Derivado De Plasma Humano
- FABRICANTE: CSL BEHRING
PARA QUE SERVE?
Para que serve Este medicamento é indicado para o tratamento de episódios agudos de angioedema hereditário tipo I e II (AEH). O angioedema hereditário é uma doença hereditária rara caracterizada por um inchaço recorrente (edema) da pele, membranas mucosas e órgãos internos, que pode ser fatal.
B
Biológicos
8
ofertasMelhores preços a partir de R$ 3.897,70 até R$ 4.120,00
Menor preço
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Menor preço
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
Para que serve
Este medicamento é indicado para o tratamento de episódios agudos de angioedema hereditário tipo I e II (AEH).
O angioedema hereditário é uma doença hereditária rara caracterizada por um inchaço recorrente (edema) da pele, membranas mucosas e órgãos internos, que pode ser fatal.
Como este medicamento funciona?
Berinert é uma terapia de substituição. O efeito terapêutico de Berinert no angioedema hereditário é produzido pela reposição da atividade deficiente do inibidor de C1 esterase.
Por ser administrado por via intravenosa, o produto é imediatamente disponível no plasma (componente líquido do sangue), com uma concentração correspondente à dose administrada.
Contraindicação
Você não deve usar este medicamento se tiver hipersensibilidade (alergia) conhecida a quaisquer dos componentes do produto.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Como usar
O tratamento deve ser iniciado sob a supervisão de um médico experiente no tratamento da deficiência do inibidor de C1 esterase.
Instruções de uso
A solução reconstituída deve ser administrada por injeção intravenosa lenta ou infusão (4 mL/minuto). Qualquer produto não utilizado ou os resíduos devem ser descartados de acordo com as exigências locais.
Método de administração
Instruções gerais
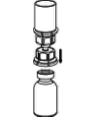
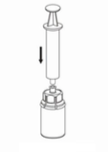
A solução deve ser incolor e límpida. Após a filtração / aspiração, o produto reconstituído deve ser inspecionado visualmente quanto à presença de partículas ou alteração de cor antes da aplicação. Não usar soluções turvas ou que apresentem resíduos (depósitos/partículas).
A reconstituição e aspiração do produto para a seringa devem ser realizadas sob condições assépticas. Utilize uma seringa que não contenha silicone.
Reconstituição
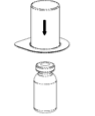
Sem violar nenhum dos frascos-ampola, deixar o frasco-ampola deste medicamento pó liofilizado e o frasco- ampola de diluente atingirem a temperatura ambiente. Isso pode ser feito deixando os frascos-ampola em temperatura ambiente por cerca de uma hora ou mantendo-os em suas mãos por alguns minutos.
Não exponha os frascos ao calor direto. Os frascos-ampola não devem atingir temperatura acima da temperatura corporal (37 °C).
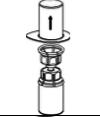
Assegurar que as tampas removíveis dos frascos do produto e do diluente foram retiradas, as tampas de borracha foram tratadas com solução antisséptica e secas antes da abertura da embalagem do dispositivo de transferência (Mix2Vial).
O produto contém 50 UI/mL de inibidor de C1 esterase derivado de plasma humano, após a reconstituição com 10 mL de água para injetáveis.
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
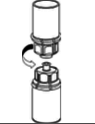
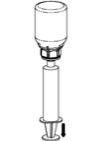
Aspiração e Aplicação |
|
 |
|
 |
|
A solução reconstituída deve ser administrada por injeção lenta via intravenosa ou infusão (4 mL/minuto). A solução reconstituída deve ser administrada imediatamente ou em até 8 horas (ver item 7. Cuidados de armazenamento do medicamento).
Posologia
Adultos e População pediátrica
Tratamento de crises agudas de angioedema
A dose utilizada é de 20 Unidades Internacionais por quilograma de peso corporal (20 UI/kg pc).
Precauções
Avise seu médico imediatamente se você tiver algum dos sintomas a seguir: chiado, dificuldade em respirar, aperto no peito, estiver ficando arroxeado ou azulado (por exemplo, com os lábios e gengiva roxos), batimentos do coração mais rápidos, inchaço do rosto, desmaio, erupção cutânea, coceira ou pressão baixa e/ou anafilaxia durante ou depois da injeção de Berinert. Ele irá interromper a infusão e iniciar o tratamento adequado. Esse tratamento irá depender do tipo e da gravidade dos sintomas. Se você tiver uma reação alérgica grave, pode ser necessária a aplicação de adrenalina. Os pacientes com edema de laringe exigem um acompanhamento cuidadoso especial com pronto tratamento de emergência.
O uso não aprovado ou o tratamento da síndrome do extravasamento capilar com Berinert não é aconselhável.
Avise seu médico se você tiver histórico de problemas de coagulação do sangue. A formação indevida de coágulos de sangue (trombose) tem sido relatada após o tratamento com Berinert. Doses muito altas de inibidor de C1 esterase podem aumentar os riscos de trombose.
Berinert contém até 486 mg de sódio (aproximadamente 21 mmol) por 100 mL de solução, o que deve ser levado em consideração para os pacientes sob dieta controlada de sódio.
Reações Adversas
As reações indesejadas com Berinert são raras.
Podem ocorrer reações alérgicas com o uso de Berinert.
Avise seu médico imediatamente se você tiver algum dos sintomas a seguir durante ou depois da injeção de Berinert:
- Chiado;
- Dificuldade em respirar;
- Aperto no peito;
- Estiver ficando arroxeado ou azulado (por exemplo, com os lábios e gengiva roxos);
- Batimentos mais rápidos do coração;
- Inchaço do rosto;
- Desmaio;
- Erupção cutânea;
- Coceira;
- Pressão baixa e/ou alta.
- Podem ocorrer também dor de cabeça, tontura, enjoo, aumento da temperatura ou reações no local da injeção. Muito raramente pode ocorrer choque.
- Raramente, pode ocorrer o desenvolvimento de trombose (veja também item 4. O que devo saber antes de usar este medicamento?). Sinais de trombose incluem:
- Inchaço e dor nos membros ou abdômen;
- Dor no peito;
- Falta de ar;
- Perda da sensibilidade ou do controle dos músculos/fraqueza muscular de um lado do corpo;
- Consciência, visão ou fala alteradas. Nos estudos clínicos, a reação adversa mais grave relatada em pacientes que receberam Berinert foi o aumento da gravidade de dor associada com o angioedema hereditário.
Nos estudos clínicos controlados por placebo, a reação adversa mais relatada em indivíduos que receberam Berinert foi disgeusia (gosto ruim na boca).
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Neste caso informe seu médico ou cirurgião-dentista.
População Especial
Há uma quantidade limitada de dados que indicam que não há risco aumentado no uso de Berinert em mulheres grávidas. Inibidor de C1 esterase é um componente fisiológico do plasma humano. Portanto, estudos sobre toxicidade na reprodução e no desenvolvimento não foram realizados em animais e efeitos adversos sobre a fertilidade, desenvolvimento pré e pós-natal não são esperados em seres humanos. No entanto, Berinert deve ser administrado a uma mulher grávida somente se for realmente necessário.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Amamentação
Não se sabe se Berinert é excretado no leite humano, mas devido ao seu alto peso molecular, a transferência de Berinert para o leite materno parece improvável. No entanto, a amamentação é questionável em mulheres que sofrem de angioedema hereditário. A decisão de interromper a amamentação ou interromper a terapia com Berinert deve ser tomada levando-se em conta os benefícios da amamentação para a criança e o benefício do tratamento para a mulher.
Fertilidade
Berinert é um componente fisiológico do plasma humano. Assim, nenhum estudo relativo à reprodução ou ao desenvolvimento de toxicidade foi realizado em animais e nenhum efeito adverso na fertilidade ou no desenvolvimento pré ou pós-natal é esperado em humanos.
Efeito na habilidade de dirigir e utilizar máquinas
Berinert não possui influencia na habilidade de dirigir ou utilizar máquinas.
Segurança viral
Quando medicamentos são produzidos a partir do sangue humano ou plasma, algumas medidas são tomadas para prevenir as infecções que podem ser transmitidas para os pacientes. Estas medidas incluem:
- A seleção cuidadosa dos doadores de sangue e plasma, para garantir que aqueles com risco de apresentar infecções foram excluídos e;
- A análise de cada doação e pools de plasma quanto à presença de vírus/infecções.
Os fabricantes destes medicamentos também incluem etapas no processamento do sangue ou plasma que podem inativar ou remover os vírus. Apesar destas medidas, quando medicamentos preparados a partir do sangue humano ou plasma são administrados, a possibilidade de transmissão de infecção não pode ser totalmente excluída. Isto também se aplica a vírus desconhecidos ou emergentes ou outros tipos de infecções. As medidas tomadas são consideradas eficazes para vírus envelopados, como o vírus da imunodeficiência humana (HIV, o vírus da AIDS), vírus da hepatite B, vírus da hepatite C (inflamação do fígado) e para os vírus não-envelopados da hepatite A (inflamação do fígado) e parvovírus B19.
O seu médico poderá aconselhá-lo a considerar a vacinação contra a hepatite A e B, caso você receba regularmente/ repetidamente produtos derivados do plasma humano.
É altamente recomendado que toda vez que Berinert for administrado, a data da aplicação, o número do lote e o volume injetado seja registrado.
Avise seu médico se estiver tomando outros medicamentos, suplementos ou medicamentos feitos com plantas.
Berinert não deve ser misturado com outros medicamentos e diluentes na seringa/dispositivo de infusão. Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Composição
Berinert
Inibidor de C1 esterase derivado de plasma humano
Apresentação
Berinert 500 UI: embalagem contendo 1 frasco-ampola com pó liofilizado para solução injetável contendo 500 UI de inibidor de C1 esterase derivado do plasma humano, 1 frasco-ampola de diluente com 10 mL de água para injetáveis e 1 dispositivo de transferência com filtro.
VIA INTRAVENOSA
USO ADULTO E PEDIÁTRICO
Composição
Berinert contém 500 Unidades Internacionais de inibidor de C1esterase derivado de plasma humano por frasco-ampola.
A potência do inibidor de C1 esterase derivado de plasma humano é expressa em Unidades Internacionais (UI), que está relacionada ao padrão da Organização Mundial de Saúde (OMS) para produtos que repõem a enzima inibidora de C1 esterase.
O teor de proteína total da solução reconstituída é de 6,5 mg/mL.
Excipientes: glicina, cloreto de sódio e citrato de sódio.
Excipiente com efeito conhecido: até 486 mg de sódio (aproximadamente 21 mmol) por 100 mL de solução. Diluente: água para injetáveis.
Superdosagem
Não foram relatados casos de superdose.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Não foram realizados estudos de interação medicamentosa.
Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) não deve ser misturado com outros medicamentos e diluentes na seringa/dispositivo de infusão.
Ação da Substância
Resultados de Eficácia
Estudo controlado por placebo
A segurança e eficácia de Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) no tratamento de crises agudas faciais ou abdominais em indivíduos com AEH foi demonstrada em um estudo clínico controlado por placebo, duplo-cego, prospectivo, multinacional, randomizado, grupo paralelo, dose ideal e três ramificações.
Este estudo avaliou a eficácia e a segurança de Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) em 124 indivíduos com deficiência de inibidor C1 esterase que estavam apresentando uma crise aguda, moderada ou grave, de AEH facial ou abdominal.
Os objetivos do estudo foram avaliar se Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) proporciona uma redução do tempo de início do alívio dos sintomas de uma crise facial ou abdominal comparada com placebo e comparar a eficácia de duas doses diferentes Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa).
Os indivíduos foram randomizados para receber uma dose única de 10 UI/kg de peso corporal Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) (39 indivíduos), uma dose única de 20 UI/kg Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) (43 indivíduos), ou uma dose única de placebo (42 indivíduos), por infusão intravenosa lenta (recomendada a uma taxa de aproximadamente 4 mL/min) em até 5 horas após um ataque de AEH. Pelo menos 70% dos indivíduos de cada grupo de tratamento deveriam ter apresentado uma crise abdominal.
Se um indivíduo não apresentou alívio ou apresentou alívio insuficiente dos sintomas por 4 horas após a infusão, os investigadores poderiam administrar uma segunda infusão Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) (20 UI/kg para o grupo de placebo, 10 UI/kg para o grupo de 10 UI/kg), ou de placebo (para o grupo de 20 UI/kg). Esse “medicamento do estudo de recuperação” mascarado (cego) foi administrado nos indivíduos e eles foram então acompanhados até a completa resolução dos sintomas.
Todos os indivíduos que receberam a “medicação de recuperação” antes do alívio dos sintomas foram considerados como "não respondedores". Portanto, o tempo até ao início do alívio dos sintomas foi marcado como 24 horas se o indivíduo recebeu qualquer medicação de recuperação (como medicação do estudo de recuperação, analgésicos narcóticos, analgésicos não narcóticos, antieméticos, inibidor de C1 aberto, andrógenos em dose aumentada ou plasma fresco congelado) entre 5 horas antes da administração da medicação em estudo cego até ao tempo de início de alívio.
Os indivíduos tratados com 20 UI/kg de peso corporal Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) apresentaram uma redução significativa (p = 0,0016; "teste de Wilcoxon Rank Sum") no momento de início do alívio dos sintomas em comparação ao placebo (média de 48 minutos para Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) 20 UI/kg, em comparação com uma média de > 4 horas para o placebo). O tempo para o início do alívio dos sintomas de um ataque de AEH para os indivíduos que receberam uma dose de 10 UI/kg Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) não foi significativamente diferente do tempo para os indivíduos no grupo de placebo.
Além disso, a eficácia do Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) 20 UI/kg pôde ser confirmada pela redução na intensidade dos sintomas individuais de AEH mais cedo do que para o placebo.
Tanto a proporção de indivíduos com intensidade aumentada de sintomas clínicos de AEH entre 2 e 4 horas após o início do tratamento comparado à linha de base, quanto o número de episódios de vômitos dentro de 4 horas após o início do tratamento do estudo demonstraram uma tendência em relação ao Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) comparando-o ao placebo (valores de p <0,1).
Nenhum indivíduo tratado com Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) 20 UI/kg relatou o agravamento dos sintomas em 4 horas após a administração da medicação em estudo, comparado com a linha de base.
O estudo demonstrou que a dose de 20 UI/kg de peso corpóreo Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) foi significativamente mais eficaz do que a dose de 10 UI/kg de peso corpóreo Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) ou placebo.
Estudo de extensão aberto
Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) foi avaliado em um estudo de extensão prospectivo, aberto, não controlado, multicêntrico com os indivíduos que participaram do estudo anterior.
O objetivo deste estudo foi de fornecer Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) aos indivíduos que participaram do estudo anterior e que apresentaram algum tipo de crise de AEH subsequente (como abdominal, facial, periferal ou laríngea).
Uma análise das crises de AEH laríngeas mostrou que o tempo médio para o aparecimento inicial de alívio dos sintomas e o tempo médio de resolução completa na análise por ataque era de 0,25 horas e 8,4 horas, respectivamente, as quais foram os menores tempos entre os vários ataques locais.
Não houve dados clinicamente relevantes ou consistentes sugerindo que o sexo, faixa etária, raça/etnia, tipo de AEH, o uso rotineiro de andrógenos, ou a presença de anticorpos anti-C1 esterase tiveram efeito sobre o tempo para o alívio inicial ou completo dos sintomas após o tratamento com Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa).
Este estudo demonstrou que, em comparação com os dados de controle históricos de não tratados, retrospectivamente coletados na Alemanha por 20 anos, Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) na dose de 20 UI/kg de peso corporal pareceu ser mais eficaz na melhoria das crises laríngeas de AEH por causar a resolução completa dos sintomas de AEH dentro de 24 horas do início dos ataques na maioria dos indivíduos.
Os efeitos do tratamento observados com Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) no estudo de extensão são consistentes com os resultados do teste de eficácia controlado com placebo.
Características Farmacológicas
Propriedades farmacodinâmicas
O inibidor de C1 esterase é uma glicoproteína plasmática com peso molecular de 105 kD e uma parte de carboidrato correspondente à 40%. A sua concentração no plasma humano varia em torno de 240 mg/L. Além de sua ocorrência no plasma humano, a placenta, as células do fígado, os monócitos e as plaquetas também contêm inibidor de C1-esterase.
O inibidor de C1 esterase pertence ao sistema inibidor de serino-proteases (serpinas) do plasma humano, assim também como outras proteínas como antitrombina III, alfa-2-antiplasmina, alfa-1-antitripsina e outras. Em condições fisiológicas, o inibidor de C1 esterase bloqueia a via clássica do sistema complemento inativando os componentes enzimáticos ativos C1s e C1r. A enzima ativa forma um complexo com o inibidor em uma estequiometria de 1:1.
Além disso, o inibidor de C1 esterase representa o mais importante inibidor da ativação por contato da coagulação, inibindo o fator XIIa e seus fragmentos. Adicionalmente, o inibidor de C1 esterase funciona, além da alfa-2-macroglobulina, como o principal inibidor da calicreína plasmática.
O efeito terapêutico Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) no angioedema hereditário é produzido pela reposição da atividade deficiente do inibidor de C1 esterase.
Propriedades farmacocinéticas
O produto deve ser administrado por via intravenosa e fica imediatamente disponível no plasma com uma concentração plasmática correspondente à dose administrada.
As propriedades farmacocinéticas foram investigadas em 40 pacientes com angioedema hereditário (6 pacientes <18 anos), incluindo 15 pacientes sob tratamento profilático (com ataques frequentes/graves), assim como 25 pacientes com ataques menos frequentes/moderados e com necessidade de tratamento. Os dados foram gerados em um intervalo livre de ataques.
A mediana da recuperação in vivo (RIV) foi de 86,7% (variação: 54,0 – 254,1%). A RIV para as crianças foi ligeiramente superior (98,2%, variação: 69,2 – 106,8%) em comparação com os adultos (82,5%, variação: 54,0 – 254,1%). Os pacientes com ataques graves tiveram uma RIV maior (101,4%) em comparação com pacientes com ataques moderados (75,8%, variação: 57,2 – 195,9%).
O aumento mediano na atividade foi de 2,3% / UI / kg de peso corporal (variação: 1,4 – 6,9% / UI / kg de peso corporal). Nenhuma diferença significativa foi observada entre adultos e crianças. Os pacientes com ataques graves apresentaram um aumento levemente maior na atividade do que os pacientes com ataques leves (2,9, variação: 1,4 – 6,9 contra 2,1, variação: 1,5 – 5,1% / UI / kg de peso corporal).
A concentração máxima da atividade do inibidor de C1 esterase derivado de plasma humano no plasma foi alcançada dentro de 0,8 hora após a administração Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) sem diferenças significativas entre os grupos de pacientes.
A meia-vida mediana foi de 36,1 horas. Esta foi ligeiramente menor nas crianças do que nos adultos (32,9 contra 36,1 horas) e em pacientes com ataques graves do que em pacientes com ataques leves (30,9 contra 37,0 horas).
Propriedades toxicológicas
Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) contém como componente ativo o inibidor de C1 esterase derivado de plasma humano. Este age como um componente endógeno do plasma. A aplicação de dose única Inibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) em ratos e camundongos e a aplicação de dose repetida em ratos não demonstraram qualquer evidência de toxicidade.
Não foram realizados estudos pré-clínicos com a aplicação de dose repetida, para investigar a carcinogenicidade e a toxicidade reprodutiva, porque estes estudos não podem ser razoavelmente realizados em modelos animais convencionais, devido ao desenvolvimento de anticorpos após a aplicação de proteínas heterólogas humanas.
O teste Ouchterlony in vitro e o modelo PCA in vivo em cobaias não mostraram nenhuma evidência do recém-aparecimento de determinantes antigênicos nInibidor de C1 Esterase Derivado de Plasma Humano (substância ativa) após a pasteurização.
Cuidados de Armazenamento
Conservar sob refrigeração (temperatura entre 2°C e 8°C). Não congelar. Manter o frasco dentro da embalagem externa, a fim de proteger da luz. O prazo de validade é de 30 meses a partir da data de fabricação, quando armazenado conforme recomendado.
Do ponto de vista microbiológico, como Berinert não contém conservantes, o produto reconstituído deve ser utilizado imediatamente. No entanto, se o produto não for administrado imediatamente, o armazenamento não deve exceder 8 horas à temperatura ambiente. O produto reconstituído deve ser armazenado exclusivamente em seu frasco-ampola.
A solução reconstituída deve ser incolor e límpida.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com prazo de validade vencido. Guarde-o em sua embalagem original.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico ou o médico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS 1.0151.0125
Farm. Resp.: Cristina J. Nakai CRF – SP 14.848
Fabricado por:
CSL Behring GmbH
Marburg, Alemanha
Importado por:
CSL Behring Comércio de Produtos Farmacêuticos Ltda.
Rua Olimpíadas, 134, 9o andar
CEP: 04551-000 São Paulo – SP - Brasil CNPJ 62.969.589/0001-98
VENDA SOB PRESCRIÇÃO MÉDICA
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso