- Medicamentos
- Medicamentos de A-Z
- Dutasterida 0,5Mg 30 Cápsulas - Aché Genérico
Menor preço para Dutasterida 0,5Mg 30 Cápsulas - Aché Genérico, você encontra no CliqueFarma
Dutasterida 0,5Mg 30 Cápsulas - Aché Genérico

Menor Preço
R$ 125,50
- CATEGORIA: Medicamentos de A-Z
- PRINCÍPIO ATIVO: Dutasterida
- FABRICANTE: ACHÉ
PARA QUE SERVE?
Para que serve A dutasterida (substância ativa) trata e previne a progressão da hiperplasia prostática benigna (HPB), promove o alívio dos sintomas e diminui o tamanho (volume) da próstata, além de melhorar o fluxo urinário e reduzir o risco de retenção urinária aguda (RUA) e a necessidade de cirurgia relacionada à HPB.
G
Genérico
9
ofertasMelhores preços a partir de R$ 125,50 até R$ 155,00
Menor preço
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Menor preço
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
A dutasterida (substância ativa) trata e previne a progressão da hiperplasia prostática benigna (HPB), promove o alívio dos sintomas e diminui o tamanho (volume) da próstata, além de melhorar o fluxo urinário e reduzir o risco de retenção urinária aguda (RUA) e a necessidade de cirurgia relacionada à HPB.
A dutasterida (substância ativa) em combinação com tansulosina, um alfa-bloqueador, trata e previne a progressão da HPB, diminui o tamanho da próstata e alivia os sintomas, além de melhorar o fluxo urinário e reduzir o risco de retenção urinária aguda (RUA) e a necessidade de cirurgia relacionada à HPB (ver o item Resultados de Eficácia).
Contraindicação
Dutasterida (substância ativa) (substância ativa deste medicamento) é contraindicado para pacientes com hipersensibilidade conhecida à dutasterida (substância ativa), a outros inibidores da 5?-redutase ou a qualquer componente da fórmula.
Este medicamento é contraindicado para uso por mulheres.
Este medicamento é contraindicado para uso por menores de 18 anos.
Como usar
A dutasterida (substância ativa) pode ser ingerida com ou sem alimentos (ver o item Propriedades Farmacocinéticas). As cápsulas devem ser engolidas inteiras e não podem ser mastigadas nem abertas, pois o contato com seu conteúdo provoca irritação da mucosa orofaríngea. Para homens adultos, inclusive idosos, a dose recomendada é de uma cápsula (0,5 mg) diária administrada por via oral.
Embora seja possível observar melhora em estágio inicial, pode ser necessário prolongar o tratamento durante pelo menos 6 meses para avaliar objetivamente a existência ou não de resposta terapêutica satisfatória.
Este medicamento não deve ser partido, aberto ou mastigado.
Posologia
Homens adultos (inclusive idosos)
A dose recomendada de dutasterida (substância ativa) é uma cápsula (0,5 mg) administrada por via oral uma vez ao dia.
Para o tratamento de HPB, a dutasterida (substância ativa) pode ser administrada como monoterapia ou associado ao alfa-bloqueador tansulosina (0,4 mg).
Insuficiência renal
O efeito da insuficiência renal sobre a farmacocinética de dutasterida (substância ativa) não foi estudado. No entanto, nenhum ajuste dose está previsto para pacientes com essa condição.
Insuficiência hepática
O efeito da insuficiência hepática sobre a farmacocinética de dutasterida (substância ativa) não foi estudado.
Precauções
A dutasterida (substância ativa) é absorvida pela pele, portanto mulheres e crianças devem evitar o contato com cápsulas que estejam vazando (ver o item Uso em Idosos, Crianças e Outros Grupos de Risco). Se ocorrer contato com cápsulas que estejam vazando, a área afetada deve ser lavada imediatamente com água e sabão.
O efeito da insuficiência hepática sobre a farmacocinética de dutasterida (substância ativa) não foi estudado. Uma vez que a dutasterida (substância ativa) é extensivamente metabolizada e tem meia-vida de 3 a 5 semanas, deve-se usar de cautela ao administrá-la a pacientes com doença hepática.
Terapia combinada com tansulosina e a ocorrência do termo composto falência cardíaca
Em dois estudos clínicos de 4 anos de duração, a incidência de falência cardíaca (um grupo de doenças composto de eventos relatados, primariamente insuficiência cardíaca e insuficiência cardíaca congestiva) foi mais elevada entre os indivíduos que faziam uso da combinação de dutasterida (substância ativa) e de um alfa-bloqueador, principalmente tansulosina, do que entre os indivíduos que não recebiam a combinação. Nesses dois ensaios, a incidência de insuficiência cardíaca foi baixa (?1%) e variável entre os estudos. Não se observou desequilíbrio da incidência total de eventos adversos cardiovasculares em nenhum dos ensaios. Também não se estabeleceu relação causal entre o uso de dutasterida (substância ativa) (em monoterapia ou em combinação com um alfa-bloqueador) e a falência cardíaca.
Efeitos sobre o antígeno específico (PSA) e detecção do câncer de próstata
O exame retal digital, bem como outras avaliações do câncer de próstata, deve ser conduzido em pacientes com HPB antes do início do tratamento com dutasterida (substância ativa) e periodicamente a partir de então. A concentração sérica de antígeno específico da próstata (PSA) é um importante componente do processo de investigação para detectar o câncer de próstata. A dutasterida (substância ativa) causa uma redução nos níveis séricos médios de PSA de aproximadamente 50%, após 6 meses de tratamento.
Deve-se estabelecer um novo nível basal de PSA em pacientes depois de 6 meses de tratamento com dutasterida (substância ativa). Recomenda-se monitorar os valores de PSA regularmente a partir de então.
Quaisquer aumentos confirmados continuados nos níveis de PSA desde os níveis mais baixos de PSA durante o tratamento com dutasterida (substância ativa) podem apontar a presença de câncer de próstata (sobretudo cancer de alto grau) ou o não cumprimento da terapia com dutasterida (substância ativa) e devem ser cuidadosamente avaliados, mesmo se esses valores ainda estiverem dentro da faixa normal para homens que não recebem tratamento com um inibidor de 5?-redutase (ver o item Resultados de Eficácia). Para a interpretação dos níveis de PSA para o paciente em uso de dutasterida (substância ativa), os valores anteriores de PSA devem ser procurados para comparação.
O tratamento com dutasterida (substância ativa) não interfere no uso de PSA como ferramenta para auxiliar o diagnóstico de câncer de próstata após um valor basal ter sido estabelecido.
Os níveis séricos totais do PSA retornam aos valores basais no período de 6 meses após a descontinuação do tratamento.
A proporção entre o PSA livre e o PSA total permanece constante mesmo sob a influência de dutasterida (substância ativa). Se os médicos escolherem o percentual do PSA livre como auxiliar na detecção de câncer de próstata em homens sob tratamento com dutasterida (substância ativa), nenhum ajuste do valor será necessário.
Os homens tratados com dutasterida (substância ativa) não devem doar sangue por pelo menos 6 meses após a administração da última dose. Essa é uma forma de prevenção contra o risco de que mulheres grávidas recebam dutasterida (substância ativa) através de transfusão de sangue.
Câncer de próstata e tumores de alto grau
Em um estudo de quatro anos em mais de 8.000 homens com idade entre 50 e 75 anos, com biópsia anterior negativa de câncer de próstata e PSA basal entre 2,5 ng/mL e 10,0 ng/mL (estudo REDUCE), 1.517 homens tiveram diagnóstico de câncer de próstata. Houve maior incidência de cânceres de próstata (pontuação de Gleason 8-10) no grupo dutasterida (substância ativa) (n=29, 0,9%) em comparação com o grupo placebo (n=19, 0,6%).
Não houve aumento da incidência de câncer de próstata com pontuação de Gleason 5-6 ou 7-10. Não se estabeleceu relação causal entre dutasterida (substância ativa) e câncer de próstata de grau elevado. A significância clínica do desequilíbrio numérico é desconhecida. Os homens que usam dutasterida (substância ativa) devem ser avaliados regularmente quanto ao risco de câncer de próstata, inclusive com exame do PSA.
Câncer de mama em homens
Câncer de mama foi relatado em homens que tomaram dutasterida (substância ativa) em estudos clínicos e durante o período pós-comercialização. Os pacientes devem ser orientados a relatar prontamente quaisquer alterações no tecido mamário, tais como nódulos ou secreção no mamilo. Não está claro se há uma relação causal entre a ocorrência de câncer de mama masculino e o uso em longo prazo de dutasterida (substância ativa).
Efeitos sobre a capacidade de dirigir e de operar máquinas
Com base nas propriedades farmacocinéticas e farmacodinâmicas da dutasterida (substância ativa), não há previsão de que o fármaco interfira na capacidade de dirigir nem de operar máquinas.
Uso em idosos, crianças e outros grupos de risco
O uso de dutasterida (substância ativa) não é indicado para mulheres nem para crianças. Não é necessário ajuste de dose para idosos. Não está previsto nenhum ajuste de dose para pacientes com insuficiência renal. Uma vez que a dutasterida (substância ativa) é extensivamente metabolizada e tem meia-vida de 3 a 5 semanas, deve-se usar de cautela ao administrá-la a pacientes com doença hepática.
Mulheres, crianças e adolescentes não devem manusear dutasterida (substância ativa), pois o ingrediente ativo contido nas cápsulas pode ser absorvido pela pele. Lavar imediatamente a área afetada com água e sabão caso haja qualquer contato com a pele.
Fertilidade
Os efeitos da dutasterida (substância ativa) 0,5 mg/dia (dutasterida (substância ativa): n=27; placebo: n=23) no líquido seminal foram avaliados em voluntários normais de 18 a 52 anos, durante 52 semanas de tratamento e nas 24 semanas posteriores. Nas 52 semanas, a média de redução em relação à contagem inicial dos espermatozoides, ao volume de sêmen e à motilidade dos espermatozoides foi de 23%, 26% e 18%, respectivamente, no grupo tratado com dutasterida (substância ativa) (quando ajustado ao grupo placebo). A concentração e a morfologia dos espermatozoides permaneceram inalteradas.
Completadas 24 semanas pós-tratamento, a média de alteração da contagem total de espermatozoides foi 23% inferior à contagem inicial. Embora os valores médios de todos os parâmetros seminais tenham permanecido dentro dos intervalos normais durante todo o período avaliado e não tenham atingido o critério predefinido para ser considerados como mudança significativa (30%), dois indivíduos do grupo que recebeu dutasterida (substância ativa) apresentaram redução da contagem de espermatozoides maior que 90% em comparação aos valores iniciais, com recuperação parcial durante as 24 semanas subsequentes ao tratamento. A importância clínica do efeito da dutasterida (substância ativa) nas características seminais vinculadas à fertilidade dos pacientes não é conhecida.
Gravidez
A dutasterida (substância ativa) é contraindicada para uso por mulheres. Não se estudou o uso da dutasterida (substância ativa) em mulheres porque os dados pré-clínicos sugerem que a supressão dos níveis circulantes de di- hidrotestosterona pode inibir o desenvolvimento dos órgãos genitais externos de um feto do sexo masculino gerado por uma mulher exposta a esse medicamento.
Lactação
Não se sabe se a dutasterida (substância ativa) é eliminada pelo leite materno.
Categoria C de risco na gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Reações Adversas
A dutasterida (substância ativa) como monoterapia
Impotência, diminuição da libido, distúrbios da ejaculação e ginecomastia foram os eventos relatados com mais frequência nos estudos clínicos.
Reações adversas relacionadas à droga (com incidência ?1%) foram relatadas com mais frequência nos três estudos de fase III de dutasterida (substância ativa) em comparação com placebo:
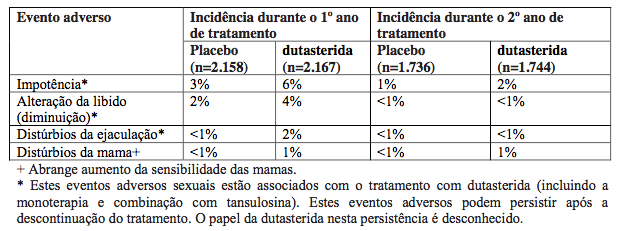
Não se observou nenhuma evidência de alteração dos eventos adversos durante os 2 anos de acompanhamento em estudos de extensão abertos.
Tratamento Combinado com dutasterida (substância ativa) e tansulosina para HPB
Houve relatos de reações adversas relacionadas à droga (com incidência cumulativa ?1%) na análise do estudo CombAT (Combinação de dutasterida (substância ativa) e tansulosina), sobre a comparação de dutasterida (substância ativa) 0,5 mg e tansulosina 0,4 mg uma vez ao dia por 4 anos (em combinação ou em monoterapia).
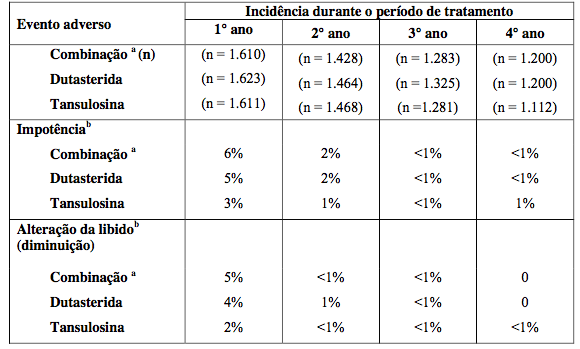
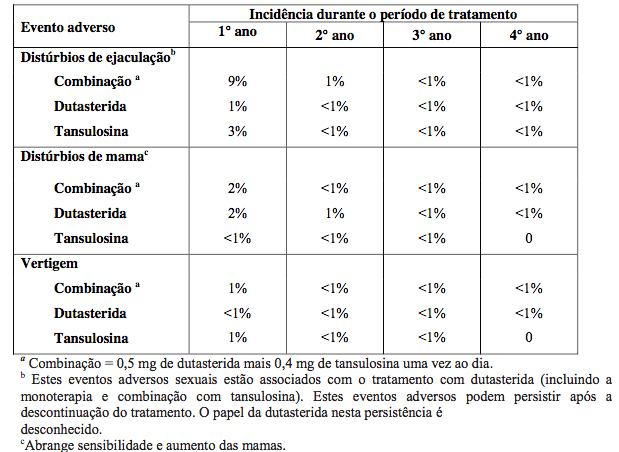
Reações adversas - Dados pós-comercialização
As reações adversas relacionadas à droga são classificadas, de acordo com a frequência, em: muito comuns (>1/10), comuns (>1/100 e <1/10), incomuns (>1/1.000 e <1/100), raras (>1/10.000 e <1/1.000) e muito raras (<1/10.000), incluindo-se relatos isolados. As categorias de frequência determinadas por dados pós-comercialização referem-se mais à taxa de relatos do que às frequências reais.
Desordens do Sistema Imune
Muito raro:
Reação alérgica, incluindo rash, prurido, urticária, edema localizado, e angioedema;
Desordens psiquiátricas
Muito raro:
Sintomas depressivos.
Desordens da pele e do tecido subcutâneo
Raro:
Alopecia (principalmente perda de pelos corporais), hipertricose.
Desordens do sistema reprodutivo e da mama
Muito raros:
Dor e inchaço nos testículos.
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos.
Nesse caso, notifique os eventos adversos ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, disponível em http://www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
Estudos sobre metabolismo in vitro mostram que a dutasterida (substância ativa) é metabolizada pela isoenzima CYP3A4 do citocromo P450 humano. Portanto, as concentrações sanguíneas da dutasterida (substância ativa) podem aumentar na presença de inibidores da CYP3A4.
Dados de estudos de fase II mostraram redução do clearance da dutasterida (substância ativa) quando esta é coadministrada o com verapamil (37%) e diltiazem (44%), inibidores da CYP3A4. Por outro lado, não se observou nenhuma redução do clearance com a coadministração de anlodipino nem de outro antagonista dos canais de cálcio.
É improvável que a redução do clearance (e o aumento subsequente da exposição à dutasterida (substância ativa)) , seja clinicamente significativa, na presença de inibidores da CYP3A4, devido à larga margem de segurança (administraram-se a pacientes, por até 6 meses, doses até 10 vezes mais altas que a recomendada). Portanto, nenhum ajuste de dose é necessário.
A dutasterida (substância ativa) não é metabolizada, in vitro, pelas isoenzimas CYP1A2, CYP2A6, CYP2E1, CYP2C8, CYP2C9, CYP2C19, CYP2B6 e CYP2D6, do citocromo P450 humano.
A dutasterida (substância ativa) não inibe, in vitro, as enzimas metabolizadoras de drogas do citocromo P450 nem induz, in vivo, as isoenzimas CYP1A, CYP2B e CYP3A, do citocromo P450, em ratos e cães.
Estudos in vitro demonstram que a dutasterida (substância ativa) não desloca a varfarina, o diazepam, acenocumarol, femprocumona, nem a fenitoína das proteínas plasmáticas e que esses modelos de compostos não deslocam a dutasterida (substância ativa). Os compostos testados com relação a interações medicamentosas ocorridas no homem incluem tansulosina, terazosina, varfarina, digoxina e colestiramina, e não se observou nenhuma interação farmacocinética ou farmacodinâmica clinicamente significativa.
Embora pesquisas sobre interações específicas não tenham sido feitas com outros compostos, aproximadamente 90% dos participantes de estudos de fase III de grande porte que receberam dutasterida (substância ativa) tomavam concomitantemente outras medicações.
Não se observou nenhuma interação adversa clinicamente significativa em estudos clínicos quando a dutasterida (substância ativa) foi coadministrada com anti-hiperlipidêmicos, inibidores da enzima conversora de angiotensina (ECA), agentes bloqueadores ?-adrenérgicos, bloqueadores dos canais de cálcio, corticosteroides, diuréticos, drogas anti- inflamatórias não esteroidais (AINEs), inibidores da fosfodiesterase tipo 5 e antibióticos da classe das quinolonas.
Ação da Substância
Resultados de eficácia
A dutasterida (substância ativa) como monoterapia para HPB
Avaliou-se a administração de dutasterida (substância ativa) 0,5 mg/dia ou de placebo em 4.325 indivíduos do sexo masculino que apresentavam aumento de próstata (mais de 30 cm3) em três estudos de eficácia primária, duplo-cegos, multicêntricos, controlados com placebo, com duração de 2 anos.
Nos homens com HPB, a dutasterida (substância ativa) trata e previne a progressão da doença, reduz o risco de RUA e a necessidade de intervenção cirúrgica, além de proporcionar melhora estatisticamente significativa dos sintomas do trato urinário inferior (STUI), da taxa de fluxo urinário máximo (Qmáx) e do volume da próstata, em comparação a placebo. Essa melhora de STUI, Qmáx e volume da próstata ocorreu ao longo de 24 meses. Nos estudos de extensão abertos, os STUI e a Qmáx continuaram a melhorar por mais 2 anos e se manteve a redução do volume da próstata durante esse mesmo período.
Tratamento do HPB com dutasterida (substância ativa) e tansulosina em combinação
O uso de dutasterida (substância ativa) 0,5 mg/dia, tansulosina 0,4 mg/dia ou a combinação de dutasterida (substância ativa) 0,5 mg com tansulosina 0,4 mg foi avaliados em 4.844 indivíduos do sexo masculino que apresentavam aumento de próstata (?30 cc) em um estudo multicêntrico, duplo-cego, de grupos paralelos, durante 2 anos. O desfecho primário de eficácia após 2 anos de tratamento foi o nível de melhora em relação à avaliação basal segundo a Pontuação Internacional de Sintomas da Próstata (IPSS).
Após 2 anos de tratamento, a combinação mostrou melhora média ajustada estatisticamente significativa da pontuação dos sintomas, de -6,2 unidades, em relação à avaliação basal. As melhoras médias ajustadas da pontuação dos sintomas com os tratamentos individuais foram de -4,9 unidades com dutasterida (substância ativa) e de -4,3 unidades com tansulosina. A melhora média ajustada da taxa de fluxo em relação à avaliação basal foi de 2,4 mL/seg com a combinação, de 1,9 mL/seg com dutasterida (substância ativa) e de 0,9 mL/seg com tansulosina. A melhora média ajustada do índice de impacto da HPB (BII) em relação à avaliação basal foi de -2,1 unidades com a combinação, de -1,7 unidade com dutasterida (substância ativa) e de -1,5 unidade com tansulosina.
A redução do volume total da próstata e do volume da zona de transição após 2 anos de tratamento foi estatisticamente significativa com a combinação em comparação à monoterapia com tansulosina.
O desfecho de eficácia primária aos 4 anos de tratamento foi o tempo até o primeiro evento relacionado com RUA ou a cirurgia associada à HPB. Depois de 4 anos de tratamento, a terapia combinada reduziu de maneira estatisticamente significativa o risco de RUA ou de cirurgia relacionada à HPB (redução de risco: 65,8%; p<0,001; IC de 95%: 54,7%-74,1%) em comparação à monoterapia com tansulosina. A incidência de RUA ou de cirurgia relacionada à HPB no ano 4 foi de 4,2% com a terapia combinada e de 11,9% com tansulosina (p<0,001).
Em comparação à monoterapia com dutasterida (substância ativa), o tratamento combinado reduziu o risco de RUA ou de cirurgia relacionada à HPB em 19,6%. A diferença entre os grupos de tratamento não foi significativa (p=0,18; IC de 95%: -10,9% a 41,7%). A incidência de RUA ou de cirurgia relacionada à HPB no ano 4 foi de 4,2% com a terapia combinada e de 5,2% com dutasterida (substância ativa).
Definiu-se a progressão clínica como um composto de agravamento dos sintomas (IPSS) e de eventos de RUA relacionados com HPB, incontinência, infecção do trato urinário (ITU) e insuficiência renal. A terapia combinada foi associada à significância estatística da redução da taxa de progressão clínica em comparação com a tansulosina (redução de risco: 44,1%; p<0,001; IC de 95%: 33,6%-53,0%) após 4 anos. As taxas de progressão clínica com a terapia combinada, a tansulosina e dutasterida (substância ativa) foram, respectivamente, de 12,6%, 21,5% e de 17,8%.
A melhora média ajustada estatisticamente significativa na pontuação dos sintomas, da IPSS com relação ao início do estudo se manteve do ano 2 ao ano 4. Aos 4 anos, as melhoras médias corrigidas das pontuações de sintomas observados foram de -6,3 unidades com a terapia combinada, de -5,3 unidades com dutasterida (substância ativa) e de -3,8 unidades com tansulosina.
Depois de 4 anos de tratamento, a melhora média corrigida da taxa de fluxo urinário máximo (Qmáx) em relação ao início do estudo foi de 2,4 mL/seg com a terapia combinada, de 2,0 mL/seg com dutasterida (substância ativa) e de 0,7 mL/seg com tansulosina.
Em comparação com a tansulosina, a melhora média corrigida da Qmáx em relação ao início do estudo foi maior, de modo estatisticamente significativo, com a terapia combinada, em cada avaliação semestral, do mês 6 ao 48 (p<0,001). Em comparação ao observado com dutasterida (substância ativa), não foi diferente em termos de significância estatística (p=0,050 no mês 48).
A terapia combinada foi significativamente superior (p<0,001) à monoterapia com tansulosina ou com dutasterida (substância ativa) no tocante à melhora dos parâmetros BII de desfechos de saúde e estado de saúde relacionado com a HPB (BHS) aos 4 anos. A melhora média corrigida de BII em relação ao início do estudo foi de -2,2 unidades com a combinação, -1,8 unidade com dutasterida (substância ativa) e de -1,2 unidade com tansulosina. A melhora média corrigida de BHS em relação ao início do estudo foi de -1,5 unidade com a combinação, de -1,3 unidade com dutasterida (substância ativa) e de -1,1 unidade com tansulosina.
A redução do volume total da próstata e do volume da zona de transição depois de 4 anos de tratamento foi estatisticamente significativa com a terapia combinada em comparação à monoterapia com tansulosina.
Falência cardíaca
Em comparação de quatro anos (estudo CombAT) entre dutasterida (substância ativa) em coadministração com tansulosina e dutasterida (substância ativa) e monoterapia com tansulosina em homens com HPB (hiperplasia prostática benigna), a incidência do termo composto falência cardíaca no grupo que recebeu a combinação (14/1.610 [0,9%]) foi mais alta do que nos dois grupos de monoterapia: dutasterida (substância ativa) (4/1.623 [0,2%]) e tansulosina (10/1.611 [0,6%]).
O risco relativo estimado do tempo até o primeiro evento de falência cardíaca foi de 3,57 (IC de 95%: 1,17-10,8) com o tratamento combinado em comparação com dutasterida (substância ativa) em monoterapia e de 1,36 [IC de 95%: 0,61-3,07] em comparação com tansulosina em monoterapia. Não se estabeleceu relação causal entre o uso de dutasterida (substância ativa) (em monoterapia ou em combinação com um alfa-bloqueador) e a falência cardíaca (ver o item Advertências e Precauções).
Em comparação de quatro anos (estudo REDUCE) entre placebo e dutasterida (substância ativa) em 8.231 homens com idade entre 50 e 75 anos com biópsia prévia negativa de câncer de próstata e PSA basal entre 2,5 ng/mL e 10,0 ng/mL, houve maior incidência do termo composto falência cardíaca nos indivíduos que usavam dutasterida (substância ativa) (30/4.105, 0,7%) com relação a placebo (16/4.126, 0,4%) na estimativa de risco relativo de tempo de 1,91 [IC de 95%: 1,04-3,50] até a primeira falência cardíaca.
Em uma análise post hoc de uso de alfa-bloqueador concomitante, houve maior incidência do termo composto falência cardíaca em indivíduos que usavam dutasterida (substância ativa) e um alfa-bloqueador concomitante (12/1.152, 1,0%) em comparação com os indivíduos que não usaram dutasterida (substância ativa) e alfa-bloqueador simultâneo: A dutasterida (substância ativa) sem alfa-bloqueador (18/2.953, 0,6%), placebo e um alfa-bloqueador (1/1.399, <0,1%), placebo sem alfa-bloqueador (15/2.727, 0,6%). Não se estabeleceu relação causal entre o uso de dutasterida (substância ativa) (isolada ou em combinação com um alfa-bloqueador) e a incidência do termo composto falência cardíaca.
Câncer de próstata e tumores de alto grau
Em comparação de quatro anos entre placebo e dutasterida (substância ativa) em 8.231 homens com idade entre 50 e 75 anos, com biópsia anterior negativa de câncer de próstata e PSA basal entre 2,5 ng/mL e 10,0 ng/mL (estudo REDUCE), 6.704 participantes tiveram dados de biópsia de próstata por agulha disponíveis para análise para determinação dos escores Gleason. Havia 1.517 indivíduos diagnosticados com câncer de próstata no estudo. A maioria dos cânceres de próstata detectáveis por biópsia em ambos os grupos de tratamento foi diagnosticada como de grau baixo (Gleason 5-6). Não houve diferença na incidência de cânceres com escore Gleason 7-10 (p=0,81).
Houve uma maior incidência de cânceres com escores Gleason 8-10 no grupo de dutasterida (substância ativa) (n=29; 0,9%), em comparação com o grupo de placebo (n=19; 0,6%) (p=0,15). No 1o e 2o anos, o número de pacientes com cânceres com escores Gleason 8-10 foi similar nos grupos de dutasterida (substância ativa) (n=17; 0,5%) e de placebo (n18; 0,5%). No 3° e 4° anos, um número maior de casos de câncer com escores Gleason 8-10 foi diagnosticado no grupo de dutasterida (substância ativa) (n12; 0,5%), em comparação com o grupo de placebo (n=1; < 0,1%) (p=0,0035). Não existem dados suficientes sobre o efeito de dutasterida (substância ativa), além de quatro anos, em homens sob risco de câncer de próstata.
A porcentagem de pacientes diagnosticados com câncer com escores Gleason 8-10 foi uniforme entre os períodos de tempo do estudo (1o-2o anos e 3o- 4o anos) no grupo de dutasterida (substância ativa) (0,5% em cada período de tempo), enquanto que no grupo de placebo a porcentagem de pacientes diagnosticados com câncer com escores Gleason 8-10 foi mais baixa durante os anos 3-4 do que nos anos 1-2 (< 0,1% vs. 0,5%, respectivamente).
Em um estudo com duração de 4 anos em HPB (CombAT), no qual não havia biópsias exigidas pelo protocolo e todos os diagnósticos de câncer de próstata basearam-se em biópsias solicitadas alguma causa, as taxas de câncer com escores de Gleason 8-10 foram (n = 8, 0,5%) para dutasterida (substância ativa), (n = 11, 0,7%) e para a tansulosina (n = 5, 0,3%) para a terapia de combinação (ver o item Advertências e Precauções).
Efeitos sobre o antígeno prostático específico (PSA) e detecção do câncer de próstata
Em comparação de quatro anos entre placebo e dutasterida (substância ativa) em 8.231 homens com idade entre 50 e 75 anos com biópsia anterior negativa de câncer de próstata e PSA basal entre 2,5 ng/mL e 10,0 ng/mL (estudo REDUCE), o tratamento com dutasterida (substância ativa) ocasionou redução média do PSA sérico de aproximadamente 50%, depois de seis meses de tratamento, com grande variabilidade (desvio padrão de 30%) entre os pacientes, o tratamento com dutasterida (substância ativa) causou uma redução no nível sérico médio de PSA de aproximadamente 50% depois de 6 meses de tratamento, com uma grande variabilidade (desvio padrão de 30%) entre os pacientes.
A supressão de PSA observada após seis meses foi similar em homens que desenvolveram ou não câncer de próstata detectável por biópsia durante o estudo (ver o item Advertências e Precauções).
Incidência de câncer de mama
Em um estudo clínico com 3.374 pacientes tratados com dutasterida (substância ativa) em monoterapia para HPB, houve 2 casos de câncer de mama relatados, um depois de 10 semanas e um depois de 11 meses de tratamento, além de 1 caso em um paciente que recebeu placebo.
Em um estudo clínico subsequente onde foi investigado a redução do risco de câncer de próstata em 8.231 homens com idades entre 50 a 75, com uma biópsia prévia negativa para câncer de próstata e PSA inicial entre 2,5 ng / mL e 10,0 ng / mL, com 17.489 pacientes-ano, tratados com dutasterida (substância ativa) e 5.027 pacientes-ano de tratados com a associação de dutasterida (substância ativa) e tansulosina, não houve casos adicionais de câncer de mama em nenhum dos grupos de tratamento. A relação entre o uso prolongado de dutasterida (substância ativa) e câncer de mama masculino é desconhecida.
Características farmacológicas
Propriedades farmacodinâmicas
A dutasterida (substância ativa) é um inibidor duplo da 5?-redutase. Inibe as duas isoenzimas da 5?-redutase, tipo 1 e tipo 2, responsáveis pela conversão de testosterona em 5?-di-hidrotestosterona (DHT), o principal androgênio responsável pela hiperplasia do tecido prostático glandular.
Efeitos sobre a DHT/testosterona
O efeito máximo de doses diárias de dutasterida (substância ativa) sobre a redução da DHT, dependente de dose, é observado em 1 ou 2 semanas. Após 1 semana de administração diária de dutasterida (substância ativa) 0,5 mg, as concentrações séricas medianas de DHT apresentaram redução de 85% e após 2 semanas, de 90%. Nos pacientes com HPB tratados diariamente com 0,5 mg de dutasterida (substância ativa), a redução mediana da DHT foi de 94% após 1 ano e de 93% após 2 anos. O aumento mediano dos níveis séricos de testosterona foi de 19% após 1 ou 2 anos. Essa é uma consequência esperada da inibição da 5?-redutase e não resultou em nenhum evento adverso conhecido.
Propriedades farmacocinéticas
Absorção
A dutasterida (substância ativa) é administrada por via oral, em solução, na forma de cápsulas gelatinosas moles. Após a administração de uma dose única de 0,5 mg, as concentrações séricas máximas da dutasterida (substância ativa) ocorrem entre 1 e 3 horas.
A biodisponibilidade absoluta da dutasterida (substância ativa) no homem é de aproximadamente 60% para uma infusão intravenosa de 2 horas. Os alimentos não afetam a biodisponibilidade desse medicamento.
Distribuição
Dados farmacocinéticos relativos a doses orais únicas e repetidas mostram que a dutasterida (substância ativa) tem grande volume de distribuição (300 a 500 litros). A dutasterida (substância ativa) exibe alta ligação a proteínas plasmáticas (>99,5%).
Após a administração diária, as concentrações séricas da dutasterida (substância ativa) atingem 65% da concentração do estado de equilíbrio em 1 mês e cerca de 90% em 3 meses. É possível atingir concentrações séricas no estado de equilíbrio (Css) de aproximadamente 40 ng/mL após 6 meses de administração diária de 0,5 mg. De maneira similar aos níveis séricos, as concentrações da dutasterida (substância ativa) no sêmen atingiram o estado de equilíbrio em 6 meses.
Depois de 52 semanas de tratamento, as concentrações da dutasterida (substância ativa) no sêmen foram em média de 3,4 ng/mL (variação de 0,4 a 14 ng/mL). O particionamento da dutasterida (substância ativa) do soro para o sêmen foi em média de 11,5%.
Metabolismo
A dutasterida (substância ativa) é metabolizada, in vitro, pelo citocromo P450 em dois metabólitos secundários monoidroxilados, mas não é metabolizada pelas enzimas CYP1A2, CYP2A6, CYP2E1, CYP2C8, CYP2C9, CYP2C19, CYP2B6 e CYP2D6 desse citocromo.
Detectaram-se no soro humano, após a administração e até o estado de equilíbrio, a dutasterida (substância ativa) inalterada, três metabólitos principais (4’-hidroxidutasterida (substância ativa), 1,2-di-hidrodutasterida (substância ativa) e 6- hidroxidutasterida (substância ativa)) e dois metabólitos secundários (6,4’-di-hidroxidutasterida (substância ativa) e 15-hidroxidutasterida (substância ativa)), conforme avaliação baseada na resposta espectrométrica de massa. Os cinco metabólitos séricos humanos da dutasterida (substância ativa) foram detectados no soro de ratos. No entanto, não se conhece a estereoquímica das adições de hidroxila nas posições 6 e 15 dos metabólitos de seres humanos e de ratos.
Eliminação
A dutasterida (substância ativa) é extensivamente metabolizada. Após administração oral (0,5 mg/dia) em seres humanos até o estado de equilíbrio, 1,0% a 15,4% (média de 5,4%) da dose ingerida. são eliminados como dutasterida (substância ativa) nas fezes. O restante é eliminado nas fezes como quatro metabólitos principais (cada um contém 39%, 21%, 7% e 7% do material relacionado à droga) e como seis metabólitos secundários (menos de 5% cada um).
Apenas quantidades residuais de dutasterida (substância ativa) inalterada (menos de 0,1% da dose) são detectadas na urina humana.
Em concentrações terapêuticas, a meia-vida terminal da dutasterida (substância ativa) de 3 a 5 semanas.
As concentrações séricas permanecem detectáveis (mais de 0,1 ng/mL) pelo período de 4 a 6 meses após a descontinuação do tratamento.
Linearidade/não linearidade
Pode-se descrever a farmacocinética da dutasterida (substância ativa) como um processo de absorção de primeira ordem e duas vias de eliminação paralelas, uma saturável (dependente da concentração) e uma não saturável (independente da concentração).
Nas concentrações séricas baixas (menos de 3 ng/mL), a dutasterida (substância ativa) é eliminada rapidamente por ambas as vias, a dependente e a independente da concentração. Doses únicas de 5 mg (ou menos) mostraram evidências de rápido clearance e meia-vida curta, de 3 a 9 dias.
Nas concentrações séricas superiores a 3 ng/mL, a eliminação da dutasterida (substância ativa) é lenta (0,35 a 0,58 L/h), ocorre principalmente de forma linear não saturável e tem meia-vida terminal de 3 a 5 semanas. Nas concentrações terapêuticas, após administração repetida de 0,5 mg/dia, o clearance mais lento predomina, e o clearance total é linear e independente da concentração.
Idosos
A farmacocinética e a farmacodinâmica da dutasterida (substância ativa) foram avaliadas em 36 indivíduos do sexo masculino, de 24 a 87 anos de idade, após a administração de uma dose única de 5 mg. A exposição à dutasterida (substância ativa), representada pelos valores de ASC e de Cmáx, não foi estatisticamente diferente na comparação entre os grupos etários.
A meia-vida também não se mostrou estatisticamente diferente na comparação do grupo de 50 a 69 anos de idade com o grupo de mais de 70 anos de idade, faixa etária da maioria dos homens com HPB. Não se observou nenhuma diferença no efeito da droga, medido pela redução da DHT, entre os grupos etários. Os resultados indicaram não ser necessário nenhum ajuste de dose da dutasterida (substância ativa) devido à idade.
Insuficiência renal
O efeito da insuficiência renal sobre a farmacocinética da dutasterida (substância ativa) não foi estudada. No entanto, menos de 0,1% de uma dose de 0,5 mg de dutasterida (substância ativa) em estado de equilíbrio é recuperável na urina humana; assim, nenhum ajuste de dose está previsto para pacientes com insuficiência renal.
Insuficiência hepática
O efeito sobre a farmacocinética de dutasterida (substância ativa) em insuficiência hepática não foi estudado (ver o item Advertências e Precauções).
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso