- Medicamentos
- Medicamentos Especiais
- Firmagon - 120 Mg Pó Liofilizado Injetável 2 Frasco-Ampola + 2 Diluente Seringa Preenchida 3 Ml + 2 Adap + 2 Agulha + 2 Êmbolos
Menor preço para Firmagon - 120 Mg Pó Liofilizado Injetável 2 Frasco-Ampola + 2 Diluente Seringa Preenchida 3 Ml + 2 Adap + 2 Agulha + 2 Êmbolos, você encontra no CliqueFarma
Firmagon - 120 Mg Pó Liofilizado Injetável 2 Frasco-Ampola + 2 Diluente Seringa Preenchida 3 Ml + 2 Adap + 2 Agulha + 2 Êmbolos

Menor Preço
R$ 1.090,22
- CATEGORIA: Medicamentos Especiais
- PRINCÍPIO ATIVO: Acetato De Degarelix
- FABRICANTE: FERRING
PARA QUE SERVE?
Para que serve Câncer de próstata avançado dependente de hormônios.
R
Referência
15
ofertasMelhores preços a partir de R$ 1.090,22 até R$ 1.709,50
Menor preço
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Menor preço
Preço Válido para compra em Boleto
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Câncer de próstata avançado dependente de hormônios.
Contraindicação
Hipersensibilidade à fórmula.
Como usar
COMO DEVO USAR ESTE MEDICAMENTO Este medicamento normalmente é administrado por um(a) farmacêutico(a), um(a) enfermeiro(a) ou um(a) médico(a) O Firmagon® deve ser injetado SOMENTE debaixo da pele (administração subcutânea) Firmagon® NÃO deve ser administrado pela veia (administração intravenosa) Precauções devem ser realizadas para evitar injeção acidental na veia O local de injeção deve variar na região abdominal As injeções devem ser administradas em áreas em que o paciente não será exposto a pressão, ou seja, não deve ser administrado na região em que é utilizado o cinto ou onde a calça é abotoada ou próximo às costelas Modo de preparo As instruções para reconstituição devem ser seguidas cuidadosamente Observação: os frascos não devem ser agitados Após a reconstituição, a solução deve ser utilizada imediatamente A embalagem de Firmagon® 120 mg contém 2 conjuntos de pó e diluente que devem ser preparados em separado para injeção subcutânea Portanto, as instruções abaixo devem ser repetidas uma segunda vez Diluente Pó 1 Remova a embalagem do adaptador de frascoampola Insira os adaptadores no frascoampola do diluente e no frascoampola do pó pressionando o adaptador para baixo até que o tampão de borracha seja rompido e o adaptador fique preso 2 Remova a embalagem da seringa Conectar e girar a seringa no adaptador do frascoampola do diluente 3 Vire o frascoampola de cabeça para baixo Para Firmagon 80 mg: Retire 4,2 ml do diluente com a seringa Para Firmagon 120 mg: Retire 3,0 ml do diluente com a seringa Certifique-se que a quantidade exata do diluente foi retirada, pois a quantidade de diluente afeta a reconstituição do produto Retirar a seringa do adaptador e descartar o frascoampola com a quantidade remanescente do diluente 4 Conectar a seringa ao adaptador do frascoampola do pó liofilizado Transferir o diluente para o frascoampola do pó Com a seringa conectada ao adaptador girar gentilmente até que o líquido fique transparente e sem pó ou partículas não dissolvidas Caso o pó se prenda ao frasco sobre a superfície líquida, o frasco pode ser levemente inclinado EVITE AGITAR PARA PREVENIR A FORMAÇÃO DE ESPUMA Um anel de pequenas bolhas de ar sobre a superfície do líquido é aceitável O procedimento de reconstituição pode demorar, em alguns casos, até 15 minutos, mas normalmente demora poucos minutos 5 Virar o frasco de cabeça para baixo e segurar na vertical Para Firmagon 80 mg: Retire 4,0 ml da solução com a seringa Para Firmagon 120 mg: Retire 3,0 ml da solução com a seringa Tenha sempre certeza de que o volume exato foi retirado Pode ser necessário que o frasco seja levemente inclinado 6 Desconectar a seringa do adaptador do frascoampola e conectar a agulha de segurança para administração subcutânea profunda Cuidadosamente remova quaisquer bolhas de ar Realizar a administração do produto imediatamente após a reconstituição 7 Aperte a pele do abdômen, eleve o tecido subcutâneo Realize uma injeção subcutânea profunda Para isso, insira a agulha profundamente em um ângulo de até 45 graus 8 Firmagon 120 mg: Repita o procedimento de reconstituição para a segunda dose Escolha um local diferente para a injeção e injete 3,0 ml A reconstituição deve ser feita utilizando o líquido diluente que acompanha a embalagem O volume final da solução reconstituída que será administrada de Firmagon® 120 mg é de 3,0 ml e após a reconstituição, cada ml possui 40 mg de degarelix O volume final da solução reconstituída que será administrada de Firmagon® 80 mg é de 4,0 ml e após a reconstituição, cada ml possui 20 mg de degarelix Posologia Firmagon® deve ser administrado pela via subcutânea Dose inicial Dose de manutenção – administração mensal 240 mg administrados com duas injeções subcutâneas de 120 mg cada 80 mg administrados com uma injeção subcutânea A primeira dose de manutenção deve ser dada um mês após a dose inicial A injeção do líquido forma um gel em seu organismo que libera continuamente o degarelix por um período de 1 (um) mês O médico irá avaliar o efeito terapêutico de degarelix através do monitoramento de parâmetros clínicos e níveis sanguíneos de antígeno específico de próstata (PSA) Estudos clínicos demonstraram que a supressão da testosterona (T) ocorre imediatamente após a administração da dose inicial com 96% dos pacientes com níveis de testosterona correspondentes a castração médica (T?0,5 ng/ml) após três dias e 100% após um mês O tratamento de longo prazo com a dose de manutenção de até 1 ano demonstra que 97% dos pacientes têm níveis de testosterona suprimidos mantidos (T?0,5 ng/ml) Caso a reação clínica do paciente pareça abaixo do ideal, deve-se confirmar se os níveis séricos de testosterona permanecem suficientemente suprimidos Como degarelix não induz a um aumento de testosterona, não é necessário adicionar um anti- andrógeno como proteção contra aumento no início da terapia Firmagon® é um medicamento que deve ser administrado mensalmente Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento Não interrompa o tratamento sem o conhecimento do seu médico 7 O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO Caso ocorra esquecimento de administração, entrar em contato com o médico Em caso de duvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista 8
Precauções
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO
Advertências e precauções Informar ao seu médico se você tem qualquer um dos seguintes problemas: - Problemas com o ritmo cardíaco (arritmia) ou está em tratamento com medicamentos para esta condição O risco de problemas com o ritmo cardíaco pode aumentar com o uso de Firmagon® - Diabetes mellitus Pode ocorrer a piora ou re-estabelecimento da diabetes, portanto se você tiver diabetes, deve ser feito o monitoramento da glicose sanguínea com maior frequência As seguintes condições podem ocorrer com o uso de Firmagon®: Hipersensibilidade: Firmagon® não foi estudado em pacientes que apresentem histórico de asma severa não tratada, reações anafiláticas (reação alérgica grave) ou urticária severa ou angioedema (inchaço por baixo da pele, principalmente na região dos lábios e olhos) Alterações na densidade óssea: A literatura médica reporta casos de diminuição da densidade óssea em homens que sofreram orquiectomia (remoção cirúrgica dos testículos) ou que foram tratados com agonistas de GnRH (hormônio liberador de gonadotropina) Pode-se dizer que tratamentos a longo prazo com supressores de testosterona em homens apresentarão efeitos na densidade dos ossos A densidade óssea não foi avaliada durante tratamento com degarelix Devido à ausência de estudos, não é conhecido o risco de fraturas durante o tratamento com degarelix Prolongamento do intervalo QT (intervalo específico observado em exames de eletrocardiograma): A terapia de supressão de andrógenos a longo prazo pode prolongar o intervalo QT Firmagon® não foi estudado em pacientes com histórico corrigido de intervalo QT acima de 450 mseg, em pacientes com histórico ou que apresentem fatores de risco de “torsades de pointes” (aceleração dos batimentos cardíacos ventriculares, acompanhados de intervalos QT ou QTU prolongados) e em pacientes que estejam recebendo tratamentos com outros medicamentos que possam prolongar o intervalo QT Portanto, nesses pacientes o médico irá avaliar a razão risco/benefício para o tratamento com Firmagon® Tolerância a glicose: Uma redução na tolerância a glicose foi observada em homens que tiveram orquiectomia (remoção cirúrgica dos testículos) ou que foram tratados com um agonista de GnRH (hormônio liberador de gonadotropina) Desenvolvimento ou agravamento da diabetes pode ocorrer; portanto, pacientes diabéticos podem exigir um monitoramento mais frequente de glicose sanguínea quando receberem terapia de privação do androgênio O efeito de degarelix sobre os níveis de insulina e glicose não foi estudado Cuidados e advertências para populações especiais Pacientes idosos, com comprometimento hepático ou renal: Não há necessidade de se ajustar a dose para idosos ou pacientes com comprometimento leve ou moderado da função hepática (do fígado) ou renal (do rim) Pacientes com comprometimento hepático ou renal grave não foram estudados, portanto aconselha-se ter cautela na utilização do produto Pacientes que apresentavam suspeita ou confirmação de problemas hepáticos não foram incluídos em estudos com degarelix É recomendado que o médico monitore a função hepática nesses pacientes durante o tratamento com Firmagon® Estudos demonstraram que o clearence (velocidade com que o organismo elimina o fármaco) de degarelix em pacientes com comprometimento renal leve a moderado é reduzido aproximadamente em 23% Portanto, o ajuste de doses nesses pacientes não é recomendado Dados sobre pacientes com comprometimento renal grave são escassos, sendo aconselhável ter-se cuidado com essa população de pacientes Já os pacientes com disfunção hepática grave não foram estudados, portanto o médico deve ter cautela com esse grupo Efeito na capacidade de dirigir veículos e operar máquinas Nenhum estudo foi realizado com Firmagon® para avaliar a se existe efeito na capacidade de dirigir veículos ou operar máquinas
Reações Adversas
Entretanto, como a ocorrência de cansaço e tonturas são reações adversas comuns associadas ao tratamento ou são resultantes da doença, estas podem influenciar a capacidade dirigir veículos e operar máquinas
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): rubores; dor no local da injeção e vermelhidão Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): anemia; aumento de peso; insônia; tonturas; dores de cabeça; diarreia; náusea; níveis elevados de algumas enzimas do fígado; suor excessivo (incluindo suor noturno); erupção cutânea; dor e desconforto muscular; ginecomastia (aumento das mamas); redução do tamanho dos testículos; disfunção erétil; calafrios; febre ou sintomas similares ao da gripe após a injeção Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): reação alérgica; aumento de açúcar no sangue/diabetes mellitus; aumento do colesterol; diminuição do peso; perda de apetite; alterações no cálcio sanguíneo; depressão; perda do desejo sexual; comprometimento mental; hipostasia; visão turva; arritmia (mudanças no ritmo cardíaco); palpitação (sensação de batimento cardíaco anormal); alterações no exame de eletrocardiograma; aumento da pressão arterial; reação vasovagal (conjunto de sintomas como náusea, dores no peito, dificuldade respiratória e medo de morrer) incluindo diminuição da pressão arterial; falta de ar; prisão de ventre; vômito; desconforto abdominal; boca seca; diminuição de bilirrubina; aumento de fosfato alcalino; urticária (alergia na pele); nódulo na pele; perda de cabelo; coceira; vermelhidão; osteoporose/osteopenia (diminuição da densidade óssea); dor nas articulações; fraqueza muscular; espasmos musculares; inchaço/endurecimento das articulações; vontade de urinar frequente e em pequenas quantidades; urgência ao urinar (passagem muito rápida da urina); dificuldade ou dor ao urinar; redução da função renal; incontinência urinária; dor testicular; dor no peito; dor pélvica; irritação genital; perda de ejaculação; indisposição (mal-estar); edema periférico Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos Nesse caso, informe seu médico ou cirurgião dentista 9 O QUE FAZER SE ALGUEM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO A administração de outras concentrações não é recomendada devido a formação do depósito de gel (formulação “depot”) Em caso de administração de quantidade superior a que foi prescrita pelo médico, entrar em contato com o médico imediatamente Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível Ligue para 0800 722 6001, se você precisar de mais orientações
Composição
COMPOSIÇÃO Cada frascoampola com pó liofilizado contém: Firmagon® 120 mg degarelix (na forma de acetato de degarelix) 128 mg Excipiente: manitol Firmagon® 80 mg degarelix (na forma de acetato de degarelix) 88,2 mg Excipiente: manitol Cada frascoampola com líquido diluente contém: água para injetáveis INFORMAÇÕES AO PACIENTE Solicitamos a gentileza de ler cuidadosamente as informações abaixo Caso não esteja seguro a respeito de determinado item, favor informar ao seu médico 1
Interação Medicamentosa
Nenhum estudo formal de interação medicamento-medicamento foi realizado.
Degarelix não é um substrato do sistema CYP450 humano e não demonstrou induzir ou inibir CYP1A2. CYP2C8. CYP2C9. CYP2D6. CYP2E1 ou CYP3A4/5 em grandes extensões in vitro. Também não houve interação de degarelix com nenhum dos transportadores de drogas de efluxo ou influxo testados. Portanto, interações farmacocinéticas clinicamente significativas medicamento-medicamento no metabolismo com relação a essas isoenzimas são improváveis.
Alterações em exames laboratoriais
O tratamento com Acetato de Degarelix (substância ativa) resulta na supressão do sistema pituitário gonadal. Os resultados dos testes das funções pituitárias e gonadais durante e após o tratamento com Acetato de Degarelix (substância ativa) podem ser alterados.
As alterações nos valores laboratoriais observadas durante um ano de tratamento estiveram na mesma faixa para degarelix e agonista de GnRH (leuprorrelina) usada como comparador. Valores acentuadamente anormais de transaminase hepática (>3X do Limite Superior Normal) (ALT, AST e GGT) foram observados em 2-6% dos pacientes com valores normais antes do tratamento, seguindo o tratamento com ambos os produtos medicinais. Uma redução acentuada nos valores hematológicos, hematócritos (?0,37) e hemoglobina (?115 g/l) foi observada em 40% e 13-15%, respectivamente, de pacientes com valores normais antes do tratamento, após o tratamento com ambos os medicamentos.
Não se sabe até onde essa redução dos valores hematológicos foi causada pelo câncer de próstata subjacente e até onde foi uma consequência da terapia de privação do androgênio. Valores acentuadamente anormais de potássio (?5,8 mmol/l), creatinina (?177 mcmol/l) e ureia (?180mg/dl) em pacientes com valores normais antes do tratamento, foram observados em 6%, 2% e 15% dos pacientes tratados com degarelix e 3%, 2% e 14% dos pacientes tratados com leuprorrelina, respectivamente.
Alterações nas medições de ECG
As alterações nas medições de ECG observadas durante um ano de tratamento estiveram na mesma faixa para degarelix e um agonista de GnRH (leuprorrelina) usado como comparador. Três (<1%) de 409 pacientes no grupo de degarelix e quatro (2%) de 201 pacientes no grupo de leuprorrelina 7,5 mg tiveram um QTcF ? 500 mseg. A partir da linha basal até o final do estudo, a alteração média no QTcF para degarelix foi de 12,0 mseg e para leuprorrelina de 16,7 mseg.
Efeito sobre intervalo de QT/QTc
A terapia de privação do androgênio de longo prazo pode prolongar o intervalo de QT. No estudo confirmatório que compara Acetato de Degarelix (substância ativa) com leuprorrelina periódica (mensal), foram realizados ECGs (Eletrocardiogramas); ambas as terapias apresentaram intervalos de QT/QTc que excediam 450 mseg em aproximadamente 20% dos pacientes e 500 mseg. Em 1% e 2% dos pacientes de degarelix e leuprorrelina, respectivamente.
Acetato de Degarelix (substância ativa) não foi estudado em pacientes com histórico de intervalo de QT corrigido em 450 mseg, em pacientes com histórico de fatores de risco para “I” e em pacientes que recebiam medicamentos concomitantes que poderiam prolongar o intervalo de QT. Portanto, nesses pacientes, a proporção risco/benefício de Acetato de Degarelix (substância ativa) deve ser rigorosamente avaliada.
Interação Alimentícia
Não há dados disponíveis até o momento sobre a interferência de Acetato de Degarelix (substância ativa) com alimentos e álcool.
Ação da Substância
Resultados de eficácia
A eficácia e a segurança de degarelix foram avaliadas em um estudo aberto, multicêntrico, randomizado, controlado por comparador ativo, de grupos paralelos. O estudo investigou a eficácia e a segurança de dois regimes mensais de degarelix com uma dose inicial de 240 mg (40 mg/mL) seguida de administração subcutânea de doses mensais de 160 mg (40 mg/mL) ou 80 mg (20 mg/mL), em comparação com administração intramuscular de 7,5 mg de leuprorrelina em pacientes com câncer de próstata com indicação de privação androgênica. No total, 620 pacientes foram randomizados a um dos três grupos de tratamento, dos quais 504 (81%) pacientes concluíram o estudo.
No grupo de tratamento de degarelix 240/80, 41 (20%) pacientes descontinuaram o estudo, em comparação com 32 (16%) pacientes no grupo de leuprorrelina. Dos pacientes tratados:
- 31% tinham câncer de próstata localizado;
- 29% tinham câncer de próstata localmente avançado;
- 20% tinham câncer de próstata metastático;
- 7% tinham uma condição metastática desconhecida;
- 13% tinham cirurgia de intenção curativa ou radiação anterior e PSA crescente.
A demografia basal foi semelhante entre os braços do estudo. O objetivo principal foi demonstrar que degarelix é eficaz para alcançar e manter a supressão de testosterona abaixo de 0,5 ng/mL, durante 12 meses de tratamento.
A menor dose de manutenção eficaz de 80 mg de degarelix foi escolhida.
Supressão de testosterona sérica (T) ? 0,5 ng/mL
Acetato de Degarelix (substância ativa) é eficaz para alcançar uma rápida supressão de testosterona.
Porcentagem de pacientes que obtém T ? 0,5 ng/mL após o início do tratamento:
|
Tempo |
Degarelix 240/80mg |
Leuprorrelina 7,5 mg |
|
Dia 1 |
52% |
0% |
|
Dia 3 |
99% |
0% |
|
Dia 7 |
99% |
0% |
|
Dia 14 |
100% |
18% |
|
Dia 28 |
100% |
100% |
Prevenção do aumento de testosterona
Nenhum dos pacientes tratados com Acetato de Degarelix (substância ativa) experimentou aumento de testosterona. Houve um decréscimo médio de 94% nos valores de testosterona no dia 3.
Dos pacientes tratados com leuprorrelina, a maioria experimentou aumento de testosterona. Houve um aumento médio de 65% na testosterona no dia 3. O aumento de testosterona foi definido como um excedente maior ou igual a 15% em relação ao nível basal de testosterona dentro das 2 primeiras semanas. Esta diferença foi estatisticamente significante (p < 0.001)
Porcentagem da mudança na testosterona do Dia 0 ao 28.
Figura 1: Alteração percentual de testosterona a partir do nível basal por grupo de tratamento até o dia 28 (média com faixas entre quartis):
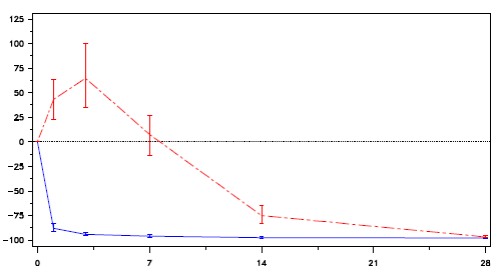
Reversibilidade da testosterona
Em um estudo envolvendo pacientes com um aumento de PSA após a terapia localizada (principalmente prostatectomia e radiação) foi administrado Acetato de Degarelix (substância ativa) por sete meses seguido de um período de sete meses de monitoramento. O tempo médio para a recuperação da testosterona (>0,5 ng/mL, acima do nível de castração) após a descontinuação do tratamento foi de 112 dias (contados a partir do início do período de monitoramento, ou seja, 28 dias após a administração da última injeção). O tempo médio para o aumento da concentração acima de 1,5 ng/mL (acima do limite mínimo da concentração normal de testosterona) foi de 168 dias.
Efeito de longo prazo
A reação bem-sucedida no estudo foi definida como a obtenção de castração médica no dia 28 e manutenção até o dia 364 em que nenhuma concentração de testosterona tenha sido maior do que 0,5 ng/ml.
Probabilidade cumulativa de testosterona ?0,5 ng/mL do Dia 28 ao Dia 364:
| Acetato de Degarelix (substância ativa) 240/80 mg N=207 |
Leuprorrelina 7,5 mg N=201 |
|
|
No de pacientes com resposta |
202 | 194 |
|
Taxa de resposta (intervalos de confiança)* |
97,2% (93,5; 98,8%) |
96,4% |
*Estimativas de Kaplan Meier dentro do grupo.
Redução de antígeno específico prostático (PSA)
O tamanho do tumor não foi medido diretamente durante o programa do estudo clínico, mas houve uma resposta benéfica indireta do tumor como demonstrado por uma redução de 95% após 12 meses no PSA médio para Acetato de Degarelix (substância ativa).
A média de PSA basal no estudo foi de:
- Para o grupo de tratamento de degarelix 240/80 mg, 19,8 ng/ml (faixa entre quartis: P25 9,4 ng/mL, P75 46,4 ng/mL);
- Para o grupo de tratamento de leuprorrelina 7,5 mg, 17,4 ng/ml (faixa entre quartis: P25 8,4 ng/mL, P75 56,5 ng/mL).
Figura 2: Alteração percentual no PSA basal por grupo de tratamento até o dia 56 (média com faixas entre quartis):
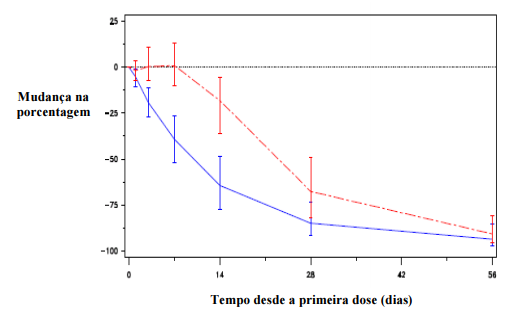
Essa diferença foi estatisticamente significativa (p<0,001) para a análise pré-especificada no dia 14 e no dia 28).
Os níveis do antígeno específico prostático (PSA) são reduzidos em 64% duas semanas após a administração de degarelix, 85% após um mês, 95% após três meses e permaneceram suprimidos (aproximadamente 97%) ao longo de um ano de tratamento.
Do dia 56 ao dia 364, não houve diferenças significativas entre Acetato de Degarelix (substância ativa) e o comparador na alteração de porcentagem a partir do nível basal.
Efeito no volume prostático
Três meses de terapia com degarelix (regime de dose de 240/80 mg) resultou em uma redução de 37% no volume prostático que foi medido por ultrassom transretal (TRUS) em pacientes que necessitavam de terapia hormonal anteriormente à radioterapia, ou em pacientes que eram candidatos à castração farmacológica. A diminuição no volume prostático foi similar ao obtido com gosserrelina com a proteção com antiandrogênio.
Efeito no intervalo QT/QTc
No estudo confirmatório que comparou Acetato de Degarelix (substância ativa) a leuprorrelina, foram realizados eletrocardiogramas periódicos. Ambas as terapias apresentaram intervalos de QT/QTc que excedia 450 mseg em aproximadamente 20% dos pacientes. A partir da linha basal até o fim do estudo, a alteração média para Acetato de Degarelix (substância ativa) foi de 12,3 mseg (3,2%) e para leuprorrelina, foi de 16,7 mseg (3,5%).
Um estudo minucioso do intervalo QT demonstrou que não há efeito intrínseco de degarelix sobre o intervalo QT/QTc. A falta de efeitos intrínsecos de degarelix na repolarização cardíaca (QTcF), frequência cardíaca, condução AV, despolarização cardíaca, onda T ou U, foi confirmada em homens saudáveis (N=80) que receberam infusão intravenosa de degarelix a cima de 60 minutos, alcançando uma Cmáx média de 222 ng/mL, aproximadamente 3-4 vezes a Cmáx obtida durante o tratamento do câncer prostático.
Anticorpos anti-degarelix
O desenvolvimento de anticorpos anti-degarelix foi observado em 10% dos pacientes após o tratamento com Acetato de Degarelix (substância ativa) por um ano e em 29% dos pacientes após 5,5 anos do tratamento com Acetato de Degarelix (substância ativa). Não há indicação de que a eficácia ou segurança do tratamento com Acetato de Degarelix (substância ativa) seja afetada por formação de anticorpos após 5,5 anos de tratamento.
Características Farmacológicas
Grupo farmacoterapêutico: Terapia endócrina, outros hormônios antagonistas e agentes relacionados.
Propriedades farmacodinâmicas
Mecanismo de ação
Degarelix é um antagonista (bloqueador) seletivo do receptor de GnRH se liga competitiva e reversivamente receptores de GnRH da hipófise, assim reduzindo rapidamente a liberação de gonadotrofinas e, consequentemente, de testosterona (T). O câncer de próstata é sensível à privação de testosterona, um princípio básico no tratamento de câncer de próstata sensível a hormônio. Diferente dos agonistas de GnRH, os bloqueadores de receptores de GnRH não induzem um aumento nas concentrações de hormônio luteinizante (LH) com aumento subsequente de testosterona/estimulação tumoral e potencial manifestação sintomática (flare) após o início do tratamento.
Uma dose individual de 240mg de Acetato de Degarelix (substância ativa), seguida pela dose de manutenção de 80mg, rapidamente causa uma queda nas concentrações de LH, hormônio folículo estimulante (FSH) e, subsequentemente, testosterona. A concentração plasmática de diidrotestoterona (DHT) cai de uma maneira similar à testosterona.
Acetato de Degarelix (substância ativa) é efetivo em atingir e manter a supressão de testosterona bem abaixo do nível médico de castração, de 0,5 ng/mL. A manutenção mensal de 80mg resultou em supressão de testosterona mantida em 97% dos pacientes por, pelo menos, 1 ano. A mediana dos níveis de testosterona após um ano de tratamento foi 0,087 ng/mL (faixa entre quartis de 0,06-0,15) N=167.)
Propriedades farmacocinéticas
A concentração da solução injetada fortemente influencia o comportamento farmacocinético. Portanto, nenhuma outra concentração por dose além da recomendada deve ser usada.
Absorção
Acetato de Degarelix (substância ativa) forma um depósito (“depot”) após administração subcutânea que libera o degarelix na circulação sanguínea. Os resultados farmacocinéticos do estudo realizado com pacientes com câncer de próstata estão apresentados na tabela abaixo.
A média da concentração de degarelix na fase de manutenção com 80 mg na concentração de 20 mg/mL foi de 10.9 ng/mL:
|
Parâmetro Farmacocinético |
Acetato de Degarelix (substância ativa) 240mg |
| Cmáx(ng/mL) |
53.4 |
| Tmáx(dias) |
1.4 |
| T½(dias) |
43 |
|
ASC (dia.ng/mL) |
1240 |
Após a administração subcutânea de 240 mg de degarelix em uma concentração de 40 mg/ml para pacientes com câncer de próstata, degarelix é eliminado bifasicamente com uma meia-vida média de aproximadamente 43 dias para a dose inicial de 240 mg (40 mg/mL) e 28 dias de dose de manutenção de 80 mg (20 mg/mL). A longa meia-vida após a administração subcutânea é consequência de uma liberação muito lenta do degarelix do depósito (“depot”) formado no local da injeção. O comportamento farmacocinético da droga é influenciado pela sua concentração na suspenção para injeção.
Distribuição
O volume de distribuição em homens idosos é aproximadamente 1 L/kg. A ligação de proteína plasmática é estimada em aproximadamente 90%.
Metabolismo
O degarelix está sujeito a degradação peptídica comum durante a passagem do sistema hepato-biliar e é excretado principalmente como fragmentos peptídicos nas fezes. Nenhum metabólito significativo foi detectado nas amostras de plasma após a administração subcutânea. Estudos in vitro demonstraram que degarelix não é um substrato para o sistema CYP450 humano.
Excreção
Em homens saudáveis, aproximadamente 20-30% de uma dose única administrada intravenosamente são excretados na urina, sugerindo que 70-80% são excretados por meio do sistema hepato-biliar. O “clearance” de degarelix em homens idosos saudáveis foi determinada em 35-50 mL/h/kg.
Tempo médio estimado para o início da ação terapêutica do medicamento
Estudos clínicos demonstraram que a supressão da testosterona (T) ocorre imediatamente após a administração da dose inicial com 96% dos pacientes tendo os níveis plasmáticos de testosterona correspondente a castração médica (T ? 0,5 ng/ml) após três dias e 100% após um mês.
Populações especiais
Pacientes com comprometimento renal
Nenhum estudo farmacocinético em pacientes com comprometimento renal foi conduzido. Apenas cerca de 20-30% de determinada dose de degarelix são excretados inalterados pelos rins.
Uma análise de farmacocinética de população dos dados do estudo de Fase III confirmatório demonstrou que o “clearance” de degarelix em pacientes com comprometimento renal leve a moderado é reduzida em aproximadamente 20 a 30%; portanto, o ajuste da dose em pacientes com comprometimento renal leve a moderado não é recomendado. Dados sobre pacientes com comprometimento renal grave são escassos, sendo, portanto, aconselhável ter-se cuidado com essa população de pacientes ao utilizar o degarelix.
Pacientes com comprometimento hepático
O degarelix foi investigado em um estudo farmacocinético em pacientes com comprometimento hepático leve a moderado. Nenhum sinal de aumento da exposição nos indivíduos hepaticamente comprometidos foi observado em comparação com indivíduos saudáveis. Nenhuma mudança nos testes de função hepática foram observadas 24 horas pós-dose comparada com os valores basais em pacientes com comprometimento hepático. O ajuste da dose não é necessário em pacientes com comprometimento hepático leve a moderado.
Pacientes com disfunção hepática grave não foram estudados, sendo, portanto, aconselhável ter-se cuidado com esse grupo.
Idosos
Os pacientes testados nos programas clínicos foi a típica população-alvo do câncer prostático. A idade média dos pacientes era de 74 anos (de 47 a 98 anos).
Dizeres Legais
DIZERES LEGAIS MS - 1 2876 0017 Farm Resp : Dra Helena Satie Komatsu – CRF/SP 19 714 Fabricado por: Rentschler Biotechnologie GmbH Erwin Rentschler Strasse, 21, D-88471 Laupheim - Alemanha Embalado por: Ferring International Center SA – FICSA Chemin de la Vergognausaz, 1162 - St Prex, Suíça Importado, comercializado e registrado por: Laboratórios Ferring Ltda Praça São Marcos, 624 05455-050 - São Paulo – SP CNPJ: 74 232 034/0001-48 SAC: 0800 772 4656 www ferring com br VENDA SOB PRESCRIÇÃO MÉDICA Esta bula foi aprovada pela Anvisa em 27/01/2011 SPC Dados da submissão eletrônica Dados da petição/notificação que altera a bula Dados das alterações de bulas Data do expediente Nº expediente Assunto Data do expediente Nº do expediente Assunto Data de aprovação Itens de bula Versões (VP/VPS)
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso