- Medicamentos
- Medicamentos de A-Z
- Myrbetric 50Mg C 30 Comprimidos Revestidos
Menor preço para Myrbetric 50Mg C 30 Comprimidos Revestidos, você encontra no CliqueFarma
Myrbetric 50Mg C 30 Comprimidos Revestidos

Menor Preço
R$ 230,00
- CATEGORIA: Medicamentos de A-Z
- PRINCÍPIO ATIVO: Mirabegrona
- FABRICANTE: ASTELLAS FARMA
PARA QUE SERVE?
Para que serve Myrbetric está indicado para o tratamento dos sintomas de bexiga hiperativa, tais como Necessidade repentina de esvaziar a bexiga (chamada de urgência); Precisar esvaziar a bexiga mais do que o habitual (chamado de aumento da frequência urinária); Não ser capaz de controlar quando esvaziar a bexiga (chamado de incontinência de urgência). Como Myrbetric funciona? A bexiga hiperativa ocorre quando você não consegue controlar as contrações da bexiga. Quando essas contrações musculares acontecem com muita frequência ou não podem ser controladas, você pode ter sintomas de bexiga hiperativa, que são: frequência urinária, urgência urinária e incontinência urinária (vazamentos).
R
Referência
18
ofertasMelhores preços a partir de R$ 230,00 até R$ 323,09
Menor preço
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Entregas para todo o Brasil. Clique e confira!
Enviamos para todo o Brasil. Clique e confira!
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
Para que serve
Myrbetric está indicado para o tratamento dos sintomas de bexiga hiperativa, tais como
- Necessidade repentina de esvaziar a bexiga (chamada de urgência);
- Precisar esvaziar a bexiga mais do que o habitual (chamado de aumento da frequência urinária);
- Não ser capaz de controlar quando esvaziar a bexiga (chamado de incontinência de urgência).
Como Myrbetric funciona?
A bexiga hiperativa ocorre quando você não consegue controlar as contrações da bexiga. Quando essas contrações musculares acontecem com muita frequência ou não podem ser controladas, você pode ter sintomas de bexiga hiperativa, que são: frequência urinária, urgência urinária e incontinência urinária (vazamentos).
Myrbetric age sobre os músculos da bexiga para ajudar a controlar suas contrações. Após a ingestão oral de mirabegrona, o tempo médio para o início da ação terapêutica é entre 3 e 4 horas.
Contraindicação
Não tome Myrbetric
- Se tiver alergia (hipersensibilidade) a mirabegrona ou qualquer um dos outros ingredientes de Myrbetric;
- Se estiver amamentando.
Myrbetric não foi estudado em crianças.
Este medicamento é contraindicado para uso por crianças ou adolescentes.
Este medicamento é contraindicado para menores de 18 anos.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação de um médico ou do cirurgião-dentista.
Como usar
Instruções para o uso adequado
Tome sempre Myrbetric exatamente como seu médico instruir.
Verifique com o seu médico ou farmacêutico se não tiver certeza de como tomar o remédio.
Posologia
Myrbetric 50 mg
A dose habitual é de um comprimido de Myrbetric por via oral uma vez ao dia.
Você deve tomar Myrbetric uma vez ao dia, pela manhã com um copo de água, com ou sem alimentos.
Insuficiência renal ou hepática
Se tiver problemas renais ou hepáticos, seu médico pode precisar reduzir a dose para um comprimido de 25 mg de Myrbetric por via oral uma vez ao dia.
Durante quanto tempo tomar Myrbetric
Não interrompa o tratamento com Myrbetric antes de indicado se não observar um efeito imediato. Sua bexiga pode precisar de algum tempo para se adaptar. Continue a tomar os comprimidos.
Não pare de tomá-los quando seu problema de bexiga melhorar.
A interrupção do tratamento pode causar o reaparecimento dos sintomas de bexiga hiperativa.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar Myrbetric?
Se você esquecer de tomar o medicamento, tome a dose esquecida assim que se lembrar, a não ser que isso aconteça 6 horas ou menos antes da sua próxima dose. Em seguida, continue a tomar Myrbetric no horário habitual.
Não tome uma dose dobrada para compensar uma dose que esqueceu de tomar. Se esquecer várias doses, informe o seu médico e siga o conselho que ele der.
Se parar de tomar Myrbetric
Não pare de tomar Myrbetric sem falar antes com o seu médico, porque os sintomas da bexiga hiperativa podem voltar.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Cuidados a serem observados antes de se tomar Myrbetric
Avise seu médico ou farmacêutico se você tiver algum destes sintomas abaixo. Pode ser necessário alterar a dose, ou tomar outras precauções, seguindo a orientação médica.
- Se tiver dificuldade para esvaziar a bexiga ou tiver um fluxo de urina fraco, ou se tomar outros medicamentos para o tratamento da bexiga hiperativa, tais como medicamentos anticolinérgicos (por exemplo, oxibutinina, tolterodina, solifenacina, darifenacina, fesoterodina);
- Se tiver problemas renais ou hepáticos, seu médico pode precisar reduzir a dose ou pode desaconselhar o uso de Myrbetric, especialmente se estiver em uso de outros medicamentos, como itraconazol, cetoconazol, ritonavir ou claritromicina. Informe seu médico a respeito dos medicamentos que foram prescritos;
- Se tiver pressão arterial muito alta não controlada, informe seu médico, pois ele pode desaconselhar o uso de mirabegrona neste caso;
- Também informe seu médico se tiver pressão alta, pois recomenda-se a monitoração regular da pressão arterial.
Se tiver uma anormalidade no ECG (exame de traçado cardíaco) conhecida como prolongamento do intervalo QT ou se tomar qualquer medicamento conhecido por causar esse problema, como
- Medicamentos usados para anormalidades no ritmo cardíaco, como quinidina, sotalol, procainamida, ibutilida, flecainida, dofetilida e amiodarona;
- Medicamentos usados para rinite alérgica;
- Medicamentos antipsicóticos (para doenças mentais), como tioridazina, mesoridazina, haloperidol e clorpromazina;
- Medicamentos anti-infecciosos como pentamidina, moxifloxacino, eritromicina e claritromicina.
Myrbetric pode causar reação alérgica com
Inchaço dos lábios, rosto, língua, garganta, com ou sem dificuldade respiratória. Neste caso, pare de usar Myrbetric e informe o seu médico imediatamente.
Recomenda-se que a pressão arterial seja medida regularmente, pois Myrbetric pode se associar a aumentos da pressão arterial. Informe seu médico se tiver aumento da pressão arterial.
Ao tomar outros medicamentos
Informe o seu médico ou farmacêutico se
- Estiver tomando ou tiver tomado recentemente outros medicamentos, incluindo medicamentos obtidos sem receita médica. Myrbetric pode afetar a forma como outros medicamentos funcionam, e outros medicamentos podem afetar a forma como Myrbetric funciona;
- Estiver tomando tioridizina (medicamento para doença mental), propafenona ou flecainida (medicamentos para ritmo cardíaco anormal), imipramina ou desipramina (medicamentos utilizados para depressão). Esses medicamentos específicos podem exigir ajuste da dose pelo médico;
- Tomar metoprolol para aumento da pressão arterial, pois este medicamento pode requerer ajuste de dose pelo seu médico;
- Tomar digoxina. Os níveis sanguíneos desse medicamento são medidos pelo médico. Se o nível no sangue ficar fora do intervalo desejado, ele pode ajustar a dose de digoxina;
- Tomar etexilato de dabigatran (um medicamento usado para reduzir o risco de obstrução de vasos no corpo ou no cérebro pela formação de um coágulo sanguíneo em pacientes adultos com batimento cardíaco anormal – fibrilação atrial – e fatores de risco adicionais). Este medicamento pode requerer ajuste de dose pelo seu médico.
Tomando Myrbetric com alimentos e bebidas
Myrbetric deve ser tomado uma vez ao dia, pela manhã com um copo de água, com ou sem alimentos.
Gestação e aleitamento
Pergunte ao seu médico ou farmacêutico antes de tomar qualquer medicamento.
Você não deve tomar Myrbetric se estiver grávida, porque os efeitos de Myrbetric sobre a gravidez e o feto não são conhecidos. Informe o seu médico se estiver grávida, se estiver desconfiada de que está grávida ou se planeja engravidar; nestes casos, de preferência não use Myrbetric.
É provável que Myrbetric passe para o leite materno. Você não deve tomar Myrbetric se estiver amamentando.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação de um médico ou do cirurgião-dentista.
Dirigir e operar máquinas
Não há informações que sugiram que Myrbetric afete sua capacidade de dirigir ou operar máquinas.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Como todos os medicamentos, Myrbetric pode causar reações adversas; embora, nem todos experimentem essas reações adversas.
Myrbetric pode causar
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento)
- Infecção do trato urinário;
- Aumento da frequência cardíaca (taquicardia);
- Náusea
- Tontura;
- Prisão de ventre;
- Diarreia;
- Dor de cabeça.
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
- Infecção da bexiga (cistite);
- Sentir o batimento cardíaco (palpitações);
- Batimento cardíaco irregular (fibrilação atrial);
- Coceira, erupção cutânea ou urticária (urticária, prurido, erupção macular ou papular, prurido);
- Infecção vaginal;
- Indigestão (dispepsia);
- Inflamação do estômago (gastrite);
- Inchaço das articulações;
- Coceira na vulva ou na vagina (prurido vulvovaginal);
- aumento da pressão arterial;
- Aumento das enzimas do fígado (aumento de GGT, AST, ALT).
Reações raras (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
- Inchaço da pálpebra (edema palpebral);
- Inchaço do lábio (edema de lábio);
- Inchaço da face, língua ou garganta que causa dificuldade em respirar (angioedema);
- Pequenas manchas roxas na pele (púrpura);
- Inflamação dos pequenos vasos sanguíneos, afetando principalmente a pele (vasculite leucocitoclástica);
- Uma condição que provoca o aumento da pressão dentro do globo ocular, causando a perda gradual de visão (glaucoma);
- Distensão abdominal;
- Inflamação do seio nasal (sinusite), inflamação da membrana mucosa do nariz, causada por uma infecção por vírus ou por uma reação alérgica (rinite);
- Aumento no sangue de uma enzima chamada LDH;
- Doença causada pela formação de pedras nos rins (nefrolitíase);
- Dor na bexiga.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Se alguma das reações adversas piorar ou se você detectar alguma reação adversa não mencionada nesta bula, informe o seu médico ou farmacêutico.
Atenção: Este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
Composição
Cada comprimido revestido de liberação prolongada de 25 mg contém:
25 mg de mirabegrona.
Excipientes: Macrogol, hiprolose, butil-hidroxitolueno, estearato de magnésio, Opadry (hipromelose, macrogol, óxido de ferro amarelo, óxido de ferro vermelho).
Cada comprimido revestido de liberação prolongada de 50 mg contém:
50 mg de mirabegrona.
Excipientes: Macrgol, hiprolose, butil-hidroxitolueno, estearato de magnésio, Opadry (hipromelose, macrogol, óxido de ferro amarelo).
Superdosagem
Os sintomas de superdose podem incluir
Batidas fortes do coração, aumento da frequência do pulso ou aumento da pressão arterial. Em caso de superdose, recomenda-se monitoramento de pulso, pressão arterial e ECG.
Em caso de uso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Dados in vitro
Mirabegrona (substância ativa) é transportada e metabolizada através de múltiplas vias. Mirabegrona (substância ativa) é um substrato para o citocromo P450 (CYP) 3A4, CYP2D6, butirilcolinesterase, uridina difosfato glucuronosiltransferases (UGT), o transportador de efluxo glicoproteína-P (P-gp) e os transportadores de cátions orgânicos (OCT) OCT1, OCT2 e OCT3. Estudos de Mirabegrona (substância ativa) usando microssomas hepáticos humanos e enzimas CYP humanas recombinantes mostraram que Mirabegrona (substância ativa) é um inibidor moderado e dependente do tempo de CYP2D6 e um inibidor fraco de CYP3A. Mirabegrona (substância ativa) inibiu o transporte da droga mediado pela P-gp em concentrações elevadas.
Dados in vivo
Polimorfismo de CYP2D6
O polimorfismo genético de CYP2D6 tem um impacto mínimo sobre a exposição plasmática média de Mirabegrona (substância ativa). Não se espera que haja interação de Mirabegrona (substância ativa) com um inibidor conhecido da CYP2D6, e isso não foi estudado. Não é necessário ajuste de dose para Mirabegrona (substância ativa) quando administrada com inibidores de CYP2D6 ou a pacientes que são metabolizadores fracos de CYP2D6.
Interações medicamentosas
O efeito de medicamentos coadministrados sobre a farmacocinética da Mirabegrona (substância ativa) e o efeito de Mirabegrona (substância ativa) sobre a farmacocinética de outros medicamentos foram examinados em estudos de dose única e doses múltiplas. A maioria das interações medicamentosas foram estudadas usando uma dose de 100 mg de Mirabegrona (substância ativa) administrada na forma de comprimidos orais. Os estudos de interação de Mirabegrona (substância ativa) com metoprolol e com metformina utilizaram Mirabegrona (substância ativa) de liberação imediata (IR) 160 mg.
Não são esperadas interações clinicamente relevantes entre Mirabegrona (substância ativa) e medicamentos que inibem, induzem ou são um substrato de uma das isozimas CYP ou transportadores, exceto para o efeito inibitório da Mirabegrona (substância ativa) sobre o metabolismo dos substratos de CYP2D6.
Efeito de inibidores de enzimas
A exposição a Mirabegrona (substância ativa) (AUC) foi aumentada em 1,8 vez na presença do inibidor forte de CYP3A/P-gp cetoconazol em voluntários saudáveis. Não é necessário ajuste de dose quando Mirabegrona (substância ativa) é combinada com inibidores de CYP3A e/ou P-gp. No entanto, em pacientes com insuficiência renal leve a moderada (TFG 30-89 mL/min/1,73 m2) ou insuficiência hepática leve (Child-Pugh Classe A) que utilizam concomitantemente inibidores fortes da CYP3A, tais como itraconazol, cetoconazol, ritonavir e claritromicina, a dose recomendada é de 25 mg uma vez por dia com ou sem alimentos. O uso de Mirabegrona (substância ativa) não é recomendado para pacientes com insuficiência renal grave (TFG 15-29 mL/min/1,73 m2) ou pacientes com insuficiência hepática moderada (Child-Pugh Classe B) que concomitantemente usam inibidores fortes da CYP3A.
A interação com os inibidores da CYP2D6 não foi testada clinicamente. Em indivíduos metabolizadores lentos para o CYP2D6, houve um efeito mínimo na exposição média plasmática à Mirabegrona (substância ativa). Não se recomenda ajuste de dose de Mirabegrona (substância ativa) na presença de inibidores de CYP2D6.
Efeito de indutores enzimáticos
Substâncias indutoras de CYP3A ou P-gp diminuem as concentrações plasmáticas de Mirabegrona (substância ativa). Não é necessário ajuste de dose para Mirabegrona (substância ativa) quando administrada com doses terapêuticas de rifampicina ou outros indutores de CYP3A ou P-gp.
Efeito de Mirabegrona (substância ativa) em substratos da CYP2D6
Em voluntários saudáveis, a potência inibitória da Mirabegrona (substância ativa) para CYP2D6 é moderada e a atividade de CYP2D6 se recupera dentro de 15 dias após a descontinuação de Mirabegrona (substância ativa). A administração de doses múltiplas uma vez por dia de Mirabegrona (substância ativa) de liberação imediata resultou em aumento de 90% da Cmáx e aumento de 229% da AUC de uma dose única de metoprolol. A administração de doses múltiplas uma vez por dia de Mirabegrona (substância ativa) resultou em aumento de 79% da Cmáx e aumento de 241% da AUC de uma dose única de desipramina.
Aconselha-se cautela se a Mirabegrona (substância ativa) for coadministrada com medicamentos com uma margem terapêutica estreita e significativamente metabolizados por CYP2D6, como tioridazina, antiarrítmicos Tipo 1C (p. ex. flecainida, propafenona) e antidepressivos tricíclicos (p. ex. imipramina, desipramina). Cautela também é aconselhada se a Mirabegrona (substância ativa) for coadministrada com substratos de CYP2D6 com doses tituladas individualmente.
Efeito de Mirabegrona (substância ativa) sobre transportadores
Mirabegrona (substância ativa) é um inibidor fraco da P-gp. Mirabegrona (substância ativa) aumentou a Cmáx e a AUC em 29% e 27%, respectivamente, do substrato de P-gp digoxina em voluntários saudáveis. Para pacientes que estão iniciando uma combinação de Mirabegrona (substância ativa) e digoxina, a dose mais baixa de digoxina deve ser inicialmente prescrita. As concentrações séricas de digoxina devem ser monitoradas e utilizadas para a titulação da dose de digoxina para obter o efeito clínico desejado. O potencial para a inibição da P-gp por Mirabegrona (substância ativa) deve ser levado em conta quando Mirabegrona (substância ativa) for combinada com substratos sensíveis de P-gp, como dabigatrana.
Digoxina
Em pacientes que iniciarão o uso da combinação de Mirabegrona (substância ativa) e digoxina, a menor dose de digoxina deverá ser prescrita inicialmente. As concentrações séricas de digoxina devem ser monitoradas e a titulação da digoxina será feita até a obtenção do efeito clínico desejado.
Outras interações
Nenhuma interação clinicamente relevante foi observada quando Mirabegrona (substância ativa) foi coadministrada com doses terapêuticas de solifenacina, tansulosina, varfarina, metformina ou um medicamento contraceptivo oral combinado contendo etinilestradiol e levonorgestrel. Não se recomenda o ajuste de dose.
Aumentos na exposição de Mirabegrona (substância ativa) devido a interações medicamentosas podem estar associados com aumentos do pulso.
Ação da Substância
Resultados de eficácia
Eficácia e segurança clínicas
A eficácia da Mirabegrona (substância ativa) foi avaliada em três estudos de Fase 3, duplo-cegos, controlados com placebo, randomizados, com duração de 12 semanas para tratamento da bexiga hiperativa com sintomas de urgência e frequência com ou sem incontinência. Foram incluídos mulheres (72%) e homens (28%) com idade média de 59 anos (intervalo 18 – 95 anos). A população do estudo foi composta por aproximadamente 48% de pacientes nunca tratados com antimuscarínicos, bem como cerca de 52% de pacientes previamente tratados com medicamentos antimuscarínicos. Em um estudo, 495 pacientes receberam um controle ativo (tolterodina em formulação de liberação prolongada).
Os desfechos de eficácia coprimários foram a alteração do número médio de episódios de incontinência por 24 horas, da linha de base até o final do tratamento, e a alteração do número médio de micções por 24 horas, da linha de base até o final do tratamento, ambos baseados em um diário miccional de 3 dias. A Mirabegrona (substância ativa) demonstrou melhora estatisticamente significativa em comparação ao placebo para os desfechos coprimários e desfechos secundários (ver Tabelas 1 e 2).
Tabela 1: Desfechos de eficácia coprimários e secundários selecionados ao final do tratamento para estudos agregados
|
Parâmetro |
Estudos agregados (046, 047, 074) |
|
|
Número médio de episódios de incontinência por 24 horas (FAS-I) (coprimário) |
Placebo |
Mirabegrona (substância ativa) 50mg |
| n | 878 |
862 |
|
Média da linha de base |
2,73 |
2,71 |
|
Alteração média em relação à linha de base† |
-1,10 |
-1,49 |
|
Diferença média em relação ao placebo† (IC de 95%) |
-- |
-0,40 (-0,58, -0,21) |
|
Número médio de micções por 24 horas (FAS) (coprimário) |
Placebo |
Mirabegrona (substância ativa) 50mg |
| n | 1.328 |
1.324 |
|
Média da linha de base |
11,58 |
11,70 |
|
Alteração média em relação à linha de base† |
-1,20 |
-1,75 |
|
Diferença média em relação ao placebo† (IC de 95%) |
-- |
-0,55 (-0,75, -0,36) |
|
Valor p |
-- |
< 0,001# |
|
Volume médio esvaziado (mL) por micção (FAS) (secundário) |
Placebo |
Mirabegrona (substância ativa) 50mg |
| n | 1.328 |
1.322 |
|
Média da linha de base |
159,2 |
159,0 |
|
Alteração média em relação à linha de base† |
9,4 |
21,4 |
|
Diferença média em relação ao placebo† (IC de 95%) |
-- |
11,9 (8,3, 15,5) |
| Valor p | -- |
< 0,001# |
|
Nível médio de urgência (FAS) (secundário) |
Placebo |
Mirabegrona (substância ativa) 50mg |
| n | 1.325 |
1.323 |
|
Média da linha de base |
2,39 | 2,42 |
|
Alteração média em relação à linha de base† |
-0,15 |
-0,26 |
|
Diferença média de placebo† (IC de 95%) |
-- |
-0,11 (-0,16, -0,07) |
|
Valor p |
-- |
< 0,001# |
|
Número médio de episódios de incontinência de urgência por cada 24 horas (FAS-I) (secundário) |
Placebo |
Mirabegrona (substância ativa) 50mg |
| n | 858 |
834 |
|
Média da linha de base |
2,42 | 2,42 |
|
Alteração média em relação à linha de base† |
-0,98 |
-1,38 |
|
Diferença média em relação ao placebo† (IC de 95%) |
-- |
-0,40 (-0,57, -0,23) |
|
Valor p |
-- |
< 0,001# |
|
Número médio de episódios com urgência de graus 3 ou 4 por 24 horas (FAS) (secundário) |
Placebo |
Mirabegrona (substância ativa) 50mg |
| n |
1.324 |
1.320 |
|
Média da linha de base |
5,61 |
5,80 |
|
Alteração média em relação à linha de base† |
-1,29 |
-1,93 |
|
Diferença média em relação ao placebo† (IC de 95%) |
-- |
-0,64 (-0,89, -0,39) |
|
Valor p |
-- |
< 0,001# |
|
Satisfação com o tratamento - Escala Visual Analógica (FAS) (secundário) |
Placebo |
Mirabegrona (substância ativa) 50mg |
| n | 1.195 | 1.189 |
|
Média da linha de base |
4,87 |
4,82 |
|
Alteração média em relação à linha de base† |
1,25 |
2,01 |
|
Diferença média em relação ao placebo† (IC de 95%) |
-- |
0,76 (0,52, 1,01) |
|
Valor p |
-- |
< 0,001* |
Estudos agregados compostos pelos estudos 046 (Europa/Austrália), 047 (América do Norte) e 074 (Europa/América do Norte).
†Médias dos quadrados mínimos ajustadas para valores iniciais, sexo e estudo.
*Superioridade estatisticamente significativa em comparação com o placebo, no nível de 0,05 sem ajuste de multiplicidade.
#Superioridade estatisticamente significativa em comparação com o placebo, no nível de 0,05 com ajuste de multiplicidade.
FAS: Conjunto de análise completa, todos os pacientes randomizados que receberam pelo menos uma dose do medicamento do estudo em esquema duplo-cego e que tinham uma medição de micção na linha de base e pelo menos um diário após a visita de linha de base com medição de micção.
FAS-I: Subconjunto de FAS que também tinha pelo menos um episódio de incontinência no diário de referência.
IC: Intervalo de confiança.
Tabela 2: Desfechos coprimários e secundários selecionados de eficácia ao final do tratamento para os estudos 046, 047 e 074
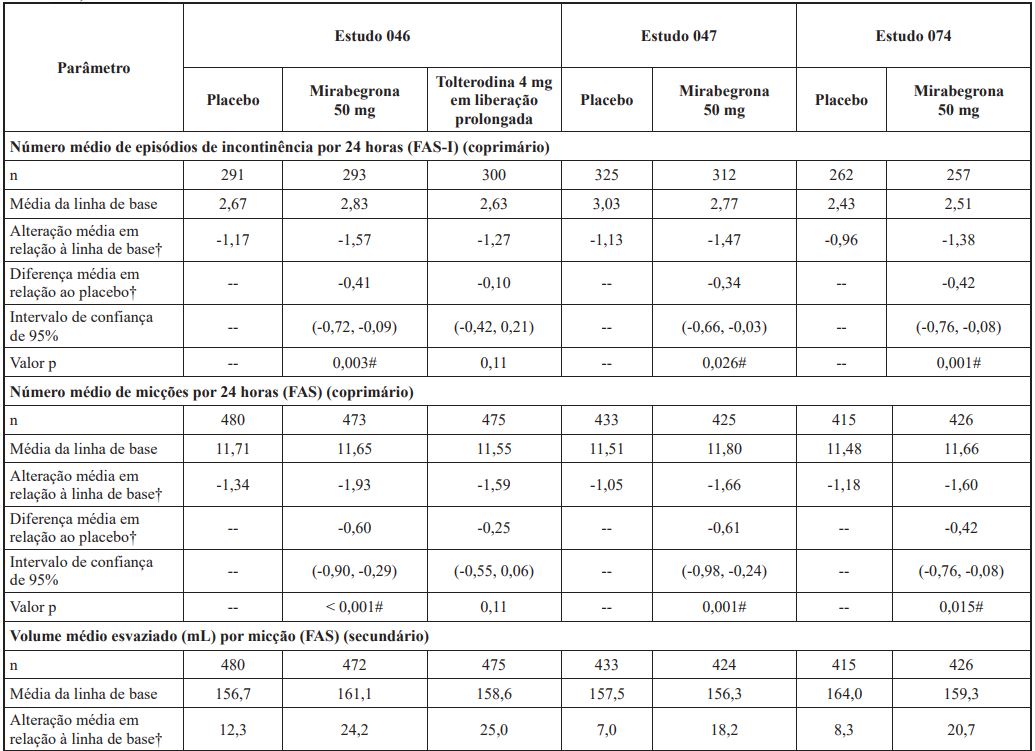
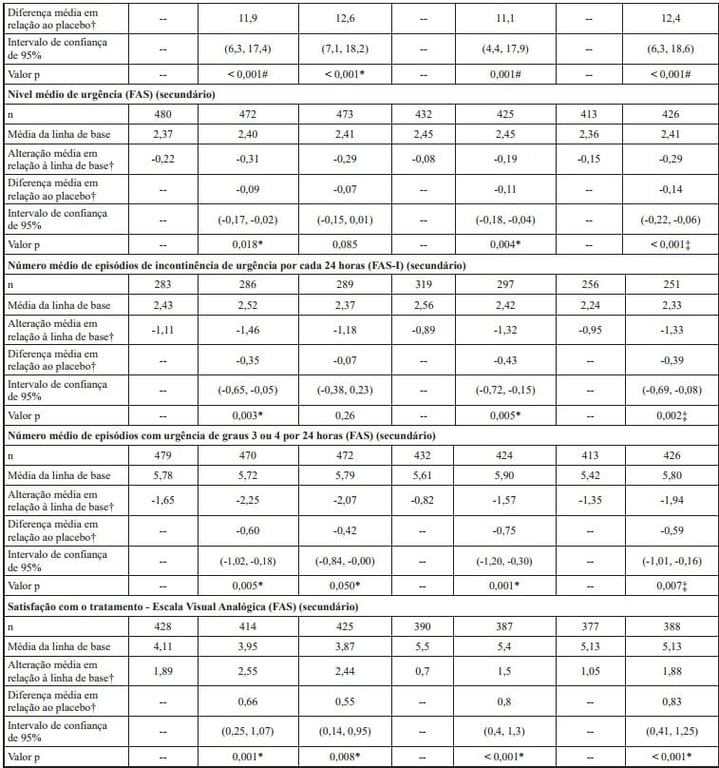
†Médias dos quadrados mínimos ajustadas para valores iniciais, sexo e região geográfica.
*Superioridade estatisticamente significativa em comparação com o placebo, no nível de 0,05 sem ajuste de multiplicidade.
#Superioridade estatisticamente significativa em comparação com o placebo, no nível de 0,05 com ajuste de multiplicidade.
‡Superioridade estatisticamente não significativa em comparação com o placebo, no nível de 0,05 com ajuste de multiplicidade.
FAS: Conjunto de análise completa, todos os pacientes randomizados que receberam pelo menos uma dose do medicamento do estudo em esquema duplo-cego e que tinham uma medição de micção na linha de base e pelo menos um diário após a visita de linha de base com medição de micção.
FAS-I: Subconjunto de FAS que também tinha pelo menos um episódio de incontinência no diário de referência.
Mirabegrona (substância ativa) uma vez por dia foi eficaz no primeiro ponto no tempo avaliado da semana 4, com a eficácia sendo mantida até o final do período de tratamento de 12 semanas. Um estudo randomizado, com controle ativo, de longo prazo, demonstrou que a eficácia foi mantida durante todo o período de tratamento de 1 ano.
Melhora subjetiva em medições da qualidade de vida relacionada à saúde
Nos três estudos de Fase 3 duplo-cegos, controlados com placebo e com duração de 12 semanas.
O tratamento dos sintomas da BH com Mirabegrona (substância ativa) uma vez por dia resultou em uma melhora estatisticamente significativa em relação ao placebo nas seguintes medidas da qualidade de vida relacionada à saúde
Satisfação com o tratamento e incômodo dos sintomas.
Eficácia em pacientes com ou sem terapia prévia com antimuscarínicos para BH
Foi demonstrada eficácia em pacientes com ou sem terapia prévia com antimuscarínicos para BH. Além disso, Mirabegrona (substância ativa) apresentou eficácia em pacientes que descontinuaram a terapia antimuscarínica prévia para BH devido a efeito insuficiente (ver Tabela 3).
Tabela 3: Desfechos coprimários de eficácia para pacientes com história de terapia antimuscarínica para BH
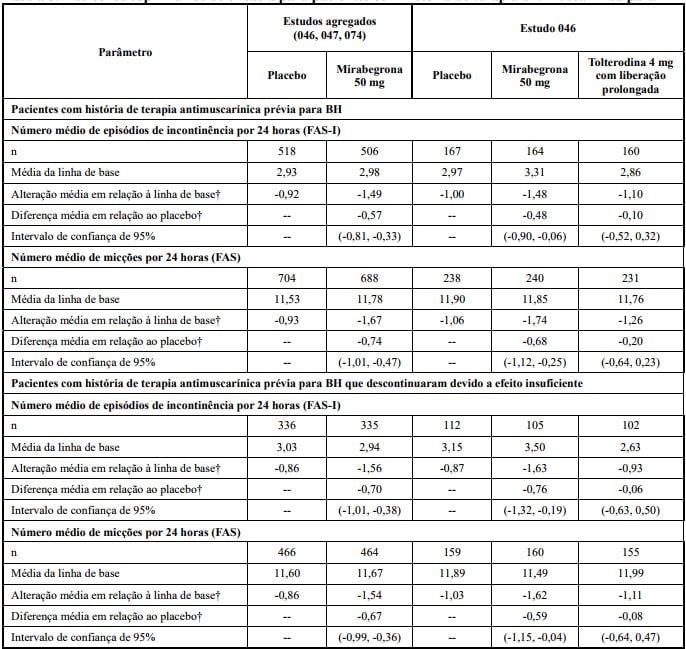
Estudos agregados compostos pelos estudos 046 (Europa/Austrália), 047 (América do Norte) e 074 (Europa/América do Norte).
†Médias dos quadrados mínimos ajustada para linha de base, sexo, estudo, subgrupo e subgrupo por interação de tratamento para estudos agregados e médias de quadrados mínimos ajustadas para linha de base, sexo, região geográfica, subgrupo e subgrupo pela interação tratamento para o Estudo 046.
FAS: Conjunto de análise completa, todos os pacientes randomizados que receberam pelo menos uma dose do medicamento do estudo em esquema duplo-cego e que tinham uma medição de micção na linha de base e pelo menos um diário após a visita de linha de base com medição de micção.
FAS-I: Subconjunto de FAS que também tinha pelo menos um episódio de incontinência no diário de referência.
Caracterísrticas farmacológicas
Mecanismo de Ação
Mirabegrona (substância ativa) é um agonista potente e seletivo dos receptores adrenérgicos beta 3. Mirabegrona (substância ativa) mostrou relaxamento do músculo liso da bexiga em tecidos de ratos e humanos isolados, aumentou as concentrações de cAMP no tecido da bexiga de ratos e mostrou efeito relaxante da bexiga em modelos urinário de função da bexiga em ratos. Mirabegrona (substância ativa) aumentou o volume médio esvaziado por micção e diminuiu a frequência das contrações sem esvaziamento, sem afetar a pressão de micção ou urina residual em modelos de bexiga hiperativa em ratos. Em um modelo em macacos, Mirabegrona (substância ativa) apresentou diminuição da frequência de micção. Esses resultados indicam que Mirabegrona (substância ativa) melhora a função de armazenamento da urina ao estimular receptores adrenérgicos beta 3 na bexiga.
Durante a fase de armazenamento da urina, enquanto a urina se acumula na bexiga, há um predomínio da estimulação do nervo simpático. A noradrenalina é liberada de terminações nervosas, levando à ativação predominantemente de beta adrenérgicos na musculatura da bexiga e, portanto, relaxamento da musculatura lisa da bexiga. Durante a fase de esvaziamento da urina, a bexiga está sob controle predominantemente do sistema nervoso parassimpático. A acetilcolina, liberada dos terminais nervosos pélvicos, estimula os receptores colinérgicos M2 e M3, induzindo a contração da bexiga. A ativação da via M2 também inibe aumentos de AMPc induzidos por adrenérgicos beta 3. Portanto, a estimulação de adrenérgicos beta 3 não deve interferir com o processo de esvaziamento. Isso foi confirmado em ratos com obstrução parcial da uretra, quando Mirabegrona (substância ativa) diminuiu a frequência das contrações sem esvaziamento, sem afetar o volume esvaziado por micção, a pressão de micção ou o volume de urina residual.
Efeitos farmacodinâmicos
Urodinâmica
Mirabegrona (substância ativa) em doses de 50 mg e 100 mg uma vez por dia durante 12 semanas em homens com sintomas do trato urinário inferior (STUI) e obstrução infravesical (OIV) não demonstrou qualquer efeito sobre os parâmetros de cistometria e foi segura e bem tolerada. Os efeitos da Mirabegrona (substância ativa) sobre a vazão máxima e a pressão do detrusor no fluxo máximo foram avaliados em um estudo urodinâmico com 200 pacientes do sexo masculino com STUI e OIV. A administração de Mirabegrona (substância ativa) em doses de 50 mg e 100 mg uma vez por dia durante 12 semanas não afetou negativamente o fluxo máximo ou a pressão do detrusor no fluxo máximo. Nesse estudo em pacientes do sexo masculino com STUI/OIV, a mudança na média ajustada (EP) do início até o final do tratamento no volume residual pós-miccional (mL) foi de 0,55 (10,702); 17,89 (10,190); 30,77 (10,598) para os grupos de tratamento com placebo, Mirabegrona (substância ativa) e Mirabegrona (substância ativa) 100 mg.
Efeito no intervalo QT
Mirabegrona (substância ativa) em doses de 50 mg ou 100 mg não teve qualquer efeito sobre o intervalo QT corrigido individualmente para frequência cardíaca (intervalo QTcI) quando avaliada tanto por sexo como pelo grupo como um todo.
Um estudo de QT minucioso (TQT) (n = 164 homens voluntários saudáveis e n = 153 mulheres voluntárias saudáveis, com idade média de 33 anos) avaliou o efeito da administração oral repetida de Mirabegrona (substância ativa) na dose indicada (50 mg uma vez por dia) e duas doses supraterapêuticas (100 e 200 mg uma vez por dia) sobre o intervalo QTcI. As doses supraterapêuticas representam cerca de 2,6 e 6,5 vezes a exposição da dose terapêutica, respectivamente. Uma dose única de 400 mg de moxifloxacino serviu como controle positivo. Cada nível de dose de Mirabegrona (substância ativa) e moxifloxacino foi avaliado em braços de tratamento separados, cada um incluindo controle com placebo (desenho paralelo cruzado).
Para homens e mulheres que receberam Mirabegrona (substância ativa) e 100 mg, o limite superior do intervalo de confiança unilateral de 95% não excedeu 10 ms em nenhum momento para a maior diferença em relação ao placebo, pareada para o tempo no intervalo QTcI. Em mulheres que receberam Mirabegrona (substância ativa) na dose de 50 mg, a diferença média em relação ao placebo no intervalo QTcI 5 horas após a dose foi de 3,67 ms (limite superior do IC unilateral de 95% 5,72 ms). Em homens, essa diferença foi de 2,89 ms (limite superior do IC unilateral de 95% 4,90 ms). Com uma dose de 200 mg de Mirabegrona (substância ativa), o intervalo QTcI não excedeu 10 ms em qualquer ponto no tempo em homens, enquanto nas mulheres o limite superior do intervalo de confiança unilateral de 95% foi superior a 10 ms entre 0,5 – 6 horas, com uma diferença máxima em relação ao placebo em 5 horas quando o efeito médio foi de 10,42 ms (limite superior do IC unilateral de 95% de 13,44 ms). Os resultados para QTcF e QTcIf foram condizentes com o QTcI.
Nesse estudo TQT, Mirabegrona (substância ativa) aumentou a frequência cardíaca no ECG de modo dependente da dose entre o intervalo de dose analisado, de 50 mg a 200 mg. A diferença média máxima em relação a placebo na frequência cardíaca variou de 6,7 bpm com Mirabegrona (substância ativa) até 17,3 bpm com Mirabegrona (substância ativa) 200 mg em indivíduos saudáveis.
Efeitos sobre o pulso e a pressão arterial em pacientes com BH
Em pacientes com BH (idade média 59 anos) em três estudos de Fase 3 duplo-cegos, controlados com placebo, com duração de 12 semanas, que receberam Mirabegrona (substância ativa) uma vez por dia, foi observado um aumento na diferença média de placebo de aproximadamente 1 bpm para o pulso e aproximadamente 1 mmHg ou menos na pressão arterial sistólica/pressão arterial diastólica (PAS/PAD). Mudanças no pulso e na pressão arterial são reversíveis com a descontinuação do tratamento.
Efeito sobre a pressão intraocular (PIO)
Mirabegrona (substância ativa) 100 mg uma vez por dia não aumentou a PIO em sujeitos saudáveis após 56 dias de tratamento. Num estudo de Fase 1 que avaliou o efeito de Mirabegrona (substância ativa) sobre a PIO utilizando tonometria de aplanação (Goldmann) em 310 sujeitos saudáveis, uma dose de 100 mg de Mirabegrona (substância ativa) não foi inferior a placebo para o desfecho primário de diferença de tratamento na alteração média da linha de base até o dia 56 na PIO média dos sujeitos; o limite superior do IC bicaudal de 95% da diferença de tratamento entre Mirabegrona (substância ativa) 100 mg e placebo foi de 0,3 mmHg.
Propriedades farmacocinéticas
Absorção
Após administração oral de Mirabegrona (substância ativa) em voluntários saudáveis, ela é absorvida até atingir as concentrações plasmáticas máximas (Cmáx) entre 3 e 4 horas. A biodisponibilidade absoluta aumentou de 29% com uma dose de 25 mg para 35% com uma dose de 50 mg. A Cmáx e a AUC médias aumentaram mais do que proporcionalmente à dose no intervalo de dose analisado. Na população total de homens e mulheres, dobrar a dosagem, de 50 mg para 100 mg de Mirabegrona (substância ativa) , aumentou a Cmáx e a AUCtau em cerca de 2,9 e 2,6 vezes, respectivamente, ao passo que um aumento de 4 vezes da dose, de 50 mg para 200 mg de Mirabegrona (substância ativa), aumentou a Cmáx e a AUCtau em aproximadamente 8,4 e 6,5 vezes. As concentrações de estado de equilíbrio são alcançadas no prazo de 7 dias com administração uma vez ao dia de Mirabegrona (substância ativa) . Após a administração uma vez por dia, a exposição plasmática a Mirabegrona (substância ativa) no estado de equilíbrio é de cerca do dobro daquela observada após uma única dose.
Efeito dos alimentos na absorção
A coadministração de um comprimido de 50 mg com uma refeição com teor de gordura elevado reduziu a Cmáx e a AUC de Mirabegrona (substância ativa) em 45% e 17%, respectivamente. Uma refeição com pouca gordura diminuiu a Cmáx e a AUC de Mirabegrona (substância ativa) em 75% e 51%, respectivamente. Nos estudos de Fase 3, Mirabegrona (substância ativa) foi administrada com ou sem alimentos e demonstrou segurança e eficácia. Portanto, Mirabegrona (substância ativa) pode ser ingerida com ou sem alimentos, na dose recomendada.
Distribuição
Mirabegrona (substância ativa) é extensivamente distribuída. O volume de distribuição no estado de equilíbrio (Vss) é de aproximadamente 1.670 L. Mirabegrona (substância ativa) se liga (aproximadamente 71%) às proteínas plasmáticas humanas, e mostra afinidade moderada a albumina e glicoproteína alfa-1 ácida. Mirabegrona (substância ativa) tem distribuição em eritrócitos. As concentrações de 14C-Mirabegrona (substância ativa) em eritrócitos in vitro foram cerca de 2 vezes maiores do que no plasma.
Biotransformação
Mirabegrona (substância ativa) é metabolizada através de múltiplas vias que envolvem desalquilação, oxidação, glucuronidação (direta) e hidrólise da amida. Mirabegrona (substância ativa) é o componente circulante principal após uma dose única de 14C-Mirabegrona (substância ativa) . Dois principais metabolitos foram observados no plasma humano; ambos são glucuronídeos de Fase 2 representando 16% e 11% da exposição total. Esses metabólitos não são farmacologicamente ativos.
Com base em estudos in vitro, é improvável que a Mirabegrona (substância ativa) iniba o metabolismo de medicamentos administrados concomitantemente metabolizados pelas seguintes enzimas do citocromo P450
CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 e CYP2E1 porque Mirabegrona (substância ativa) não inibiu a atividade dessas enzimas em concentrações clinicamente relevantes. Mirabegrona (substância ativa) não induziu CYP1A2 ou CYP3A. Prevê-se que Mirabegrona (substância ativa) não cause inibição clinicamente relevante do transporte de drogas mediado por OCT.
Embora os estudos in vitro sugiram que exista um papel para CYP2D6 e CYP3A4 no metabolismo oxidativo de Mirabegrona (substância ativa), resultados in vivo indicam que essas isoenzimas desempenham um papel limitado na eliminação geral. Estudos in vitro e ex vivo demonstraram o envolvimento da butirilcolinesterase, UGT e possivelmente álcool desidrogenase (ADH) no metabolismo de Mirabegrona (substância ativa) , além de CYP3A4 e CYP2D6.
Polimorfismo de CYP2D6
Em indivíduos saudáveis que genotipicamente são sujeitos metabolizadores fracos de substratos da CYP2D6, a Cmáx e AUCinf médias foram 14% e 19% maiores do que em metabolizadores extensivos para uma dose única de 160 mg de uma formulação de Mirabegrona (substância ativa) de liberação imediata, indicando que polimorfismos genéticos de CYP2D6 têm impacto mínimo sobre a exposição plasmática média da Mirabegrona (substância ativa). Não se espera que haja interação de Mirabegrona (substância ativa) com um inibidor conhecido da CYP2D6, e isso não foi estudado. Não é necessário ajuste de dose para Mirabegrona (substância ativa) quando administrada com inibidores de CYP2D6 ou em pacientes que são metabolizadores fracos de CYP2D6.
Eliminação
A depuração corporal total (CLtot) do plasma é de aproximadamente 57 L/h. A meia-vida de eliminação terminal (t½) é de aproximadamente 50 horas. A depuração renal (CLR) é de aproximadamente 13 L/h, o que corresponde a cerca de 25% da CLtot. A eliminação renal de Mirabegrona (substância ativa) ocorre principalmente através de secreção tubular ativa, juntamente com a filtração glomerular. A excreção urinária de Mirabegrona (substância ativa) inalterada é dependente da dose e varia de cerca de 6,0% depois de uma dose diária de 25 mg, a 12,2% depois de uma dose diária de 100 mg. Após a administração de 160 mg de 14C-Mirabegrona (substância ativa) a voluntários saudáveis, cerca de 55% do marcador radioativo foram recuperados na urina e 34% nas fezes. Mirabegrona (substância ativa) inalterada correspondeu a 45% da radioatividade urinária, indicando a presença de metabólitos. Mirabegrona (substância ativa)inalterada representou a maior parte da radioatividade nas fezes.
Idade
A Cmáx e a AUC da Mirabegrona (substância ativa) e seus metabólitos após doses múltiplas em voluntários idosos (? 65 anos) foram semelhantes às de voluntários mais jovens (18 – 45 anos).
Sexo
A Cmáx e a AUC são aproximadamente 40% a 50% maiores em mulheres do que em homens. As diferenças de sexo na Cmáx e na AUC são atribuídas a diferenças no peso corporal e biodisponibilidade.
Raça
A farmacocinética de Mirabegrona (substância ativa) não é influenciada pela raça.
Comprometimento renal
Após a administração de uma dose única de 100 mg de Mirabegrona (substância ativa) a voluntários com insuficiência renal leve (eTFG-MDRD 60-89 mL/min/1,73 m2), a Cmáx e a AUC médias de Mirabegrona (substância ativa) aumentaram 6% e 31% em relação a voluntários com função renal normal. Em voluntários com insuficiência renal moderada (eTFG-MDRD 30- 59 mL/min/1,73 m2), a Cmáx e a AUC aumentaram em 23% e 66%, respectivamente. Em voluntários com insuficiência renal grave (eTFG-MDRD 15-29 mL/min/1,73 m2), os valores médios de Cmáx e AUC aumentaram em 92% e 118%. Mirabegrona (substância ativa) não foi estudada em pacientes com doença renal em estágio terminal (TFG < 15 mL/min/1,73 m2 ou pacientes que necessitam de hemodiálise).
Comprometimento hepático
Após a administração de uma dose única de 100 mg de Mirabegrona (substância ativa) a voluntários com insuficiência hepática leve (Child-Pugh Classe A), a Cmáx e a AUC médias aumentaram 9% e 19% em relação a voluntários com função hepática normal. Em voluntários com insuficiência hepática moderada (Child-Pugh Classe B), os valores médios de Cmáx e AUC aumentaram em 175% e 65%. Mirabegrona (substância ativa) não foi estudada em pacientes com insuficiência hepática grave (Child-Pugh Classe C).
Dados de segurança pré-clínicos
Estudos pré-clínicos identificaram os órgãos-alvo de toxicidade, que condizem com as observações clínicas. Aumentos transitórios das enzimas hepáticas e alterações de hepatócitos (necrose e diminuição de partículas de glicogênio) foram observados em ratos. Observou-se um aumento da frequência cardíaca em ratos, coelhos, cães e macacos. Estudos de genotoxicidade e de carcinogenicidade não demonstraram potencial genotóxico ou carcinogênico in vivo.
Não foram observados efeitos sobre a fertilidade em doses sub-letais em estudos experimentais em ratos (a dose humana equivalente foi 19 vezes maior do que a dose máxima recomendada em seres humanos -DMRH). Os principais achados de estudos de desenvolvimento embriofetal em coelhos incluíram malformações cardíacas (aorta dilatada, cardiomegalia), com exposições sistêmicas 36 vezes maiores do que as observadas com a DMRH. Além disso, malformações pulmonares (ausência de lobo acessório do pulmão) e aumento de perda pósimplantação foram observados em coelhos com exposições 14 vezes superiores às observadas com a DMRH, enquanto em ratos foram notados efeitos reversíveis sobre a ossificação (costelas onduladas, atraso na ossificação, diminuição da ossificação das placas esternais, metacarpos ou metatarsos) em exposições sistêmicas 22 vezes maiores do que as observadas com a DMRH. A toxicidade embriofetal observada ocorreu em doses associadas com toxicidade materna. As malformações cardiovasculares observadas em coelhos demonstraram ser mediadas através da ativação de receptores adrenérgicos beta 1.
Estudos farmacocinéticos conduzidos com Mirabegrona (substância ativa) radiomarcada demonstraram que a substância original e/ou seus metabólitos são excretados no leite de ratos em níveis cerca de 1,7 vezes mais elevados do que os níveis plasmáticos 4 horas após a administração.
Cuidados de Armazenamento
Instruções para o uso adequadoMantenha o produto em temperatura ambiente (15 - 30°C).
O produto pode ser armazenado durante 36 meses a contar da data de fabricação.
Não utilize Myrbetric após o prazo de validade indicado na embalagem, blíster ou frasco depois das letras: VAL. O prazo de validade refere-se ao último dia do mês.
Os medicamentos não devem ser descartados no esgoto nem no lixo doméstico. Pergunte ao seu farmacêutico como descartar os medicamentos dos quais não precisa mais. Isso vai ajudar a proteger o ambiente.
Número do lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Todo o medicamento deve ser mantido fora do alcance das crianças.
Características organolépticas
Myrbetric 25 mg
É apresentado como um comprimido oval, revestido por uma película marrom e gravado com o logotipo da Astellas e “325”.
Myrbetric 50 mg
É apresentado como um comprimido oval, revestido por uma película marrom e gravado com o logotipo da Astellas e “355”.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais
Myrbetric é uma marca registrada da Astellas Pharma Inc.
Registro MS-1.7717.0009.
Farmacêutico responsável:
Sandra Winarski
CRF-SP nº 18.496.
Fabricado por:
Avara Pharmaceutical Technologies, Inc.,
Norman, Oklahoma
73072 EUA.
Embalado por:
Astellas Pharma Europe B.V.
Hogemaat 2, 7942 JG
Meppel, Holanda.
Registrado e importado por:
Astellas Farma Brasil Importação e Distribuição de Medicamentos Ltda.
Av. Guido Caloi, 1935, Bloco B 2º andar
Bairro Santo Amaro – São Paulo – SP
CEP: 05802-140
CNPJ 07.768.134/0001-04.
Venda sob prescrição médica.
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso