- Medicamentos
- Medicamentos de A-Z
- Succinato - De Sumatriptana 100Mg 2 Comprimidos Euro Biolab Genérico
Menor preço para Succinato - De Sumatriptana 100Mg 2 Comprimidos Euro Biolab Genérico, você encontra no CliqueFarma
Succinato - De Sumatriptana 100Mg 2 Comprimidos Euro Biolab Genérico

Menor Preço
R$ 31,85
- CATEGORIA: Medicamentos de A-Z
- PRINCÍPIO ATIVO: Succinato De Sumatriptana
- FABRICANTE: BIOLAB
PARA QUE SERVE?
Para que serve Succinato de Sumatriptana (substância ativa) é indicado para o tratamento agudo das crises de enxaqueca, com ou sem aura, em pacientes adultos. Succinato de Sumatriptana (substância ativa) não é indicado para a profilaxia das crises de enxaqueca.
G
Genérico
15
ofertasMelhores preços a partir de R$ 31,85 até R$ 51,80
Menor preço
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
FRETE REDUZIDO: para a todo o Brasil
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Succinato de Sumatriptana (substância ativa) é indicado para o tratamento agudo das crises de enxaqueca, com ou sem aura, em pacientes adultos. Succinato de Sumatriptana (substância ativa) não é indicado para a profilaxia das crises de enxaqueca.
Contraindicação
Succinato de Sumatriptana (substância ativa) é contraindicado em indivíduos com conhecida hipersensibilidade à Succinato de Sumatriptana (substância ativa) ou a qualquer componente da fórmula.
A Succinato de Sumatriptana (substância ativa) não deve ser utilizada em pacientes que tiveram infarto do miocárdio, doença cardíaca isquêmica (DCI), angina de Prinzmetal/vasoespasmo coronariano, doença vascular periférica ou em pacientes que apresentem sinais ou sintomas compatíveis com DCI.
A Succinato de Sumatriptana (substância ativa) é contraindicada a pacientes com histórico de acidente vascular cerebral (AVC), de ataque isquêmico transitório (AIT) ou de migrânea do tipo basilar e migrânea hemiplégica, uma vez que esses pacientes tem um maior risco de AVC.
A Succinato de Sumatriptana (substância ativa) é contraindicada a pacientes com doença isquêmica intestinal.
A utilização de Succinato de Sumatriptana (substância ativa) em pacientes com hipertensão descompensada é contraindicada.
A Succinato de Sumatriptana (substância ativa) não deve ser administrada em pacientes com insuficiência hepática grave.
O uso concomitante de ergotamina ou de derivados da ergotamina (incluindo a metisergida) é contraindicado.
A administração simultânea de inibidores da monoaminoxidase (IMAO) com a Succinato de Sumatriptana (substância ativa) é contraindicada.
Succinato de Sumatriptana (substância ativa) não deve ser usado por até duas semanas após a suspensão desses medicamentos.
O uso concomitante de Succinato de Sumatriptana (substância ativa) com outros medicamentos à base de triptanas ou agonistas do receptor 5-HT1 é contraindicado.
Este medicamento é contraindicado para uso por pacientes que tiveram infarto do miocárdio, doença cardíaca isquêmica (DCI), angina de Prinzmetal/vasoespasmo coronariano, doença vascular periférica ou que apresentem sinais ou sintomas compatíveis com DCI.
Este medicamento é contraindicado para uso por pacientes com histórico de acidente vascular cerebral (AVC), de ataque isquêmico transitório (AIT) ou de migrânea do tipo basilar e migrânea hemiplégica.
Este medicamento é contraindicado para uso por pacientes com hipertensão descompensada.
Este medicamento é contraindicado para uso por pacientes com insuficiência hepática grave.
Como usar
Uso oral.
Os comprimidos devem ser engolidos inteiros com água.
Succinato de Sumatriptana (substância ativa) comprimidos revestidos não deve ser utilizado para a profilaxia das crises de enxaqueca.
A dose recomendada de Succinato de Sumatriptana (substância ativa) não deve ser excedida.
Posologia
É aconselhável que Succinato de Sumatriptana (substância ativa) seja administrado, após o início de uma cefaleia tipo enxaqueca, tão logo seja possível. É igualmente efetivo quando administrado em qualquer fase das crises. A dose de Succinato de Sumatriptana (substância ativa) recomendada para adultos é de um único comprimido revestido de 50 mg administrado por via oral. Alguns pacientes podem necessitar de 100 mg.
Se um paciente não responde à primeira dose de Succinato de Sumatriptana (substância ativa), não se deve considerar a utilização de uma segunda dose para a mesma crise. Succinato de Sumatriptana (substância ativa) pode ser tomado para as crises subsequentes.
Se o paciente respondeu à primeira dose, mas os sintomas retornaram, uma segunda dose pode ser administrada, desde que haja um intervalo mínimo de duas horas entre as doses e não se exceda 200 mg em 24 horas.
Este medicamento não deve ser partido, aberto ou mastigado.
Precauções
Succinato de Sumatriptana (substância ativa) comprimidos revestidos só deve ser utilizado quando houver um diagnóstico claro de enxaqueca.
A Succinato de Sumatriptana (substância ativa) não é indicada no manejo da enxaqueca hemiplégica, basilar ou oftalmoplégica.
Antes do tratamento com Succinato de Sumatriptana (substância ativa) deve-se excluir condições neurológicas potencialmente graves (como AVC ou AIT), se o paciente apresentar sintomas atípicos ou se eles não receberam um diagnóstico apropriado para o uso de Succinato de Sumatriptana (substância ativa).
Após a administração, a Succinato de Sumatriptana (substância ativa) pode estar associada a sintomas transitórios, incluindo dor e tensão torácica, que podem ser intensas, e comprometer a garganta. Nas situações em que tais sintomas possam indicar doença cardíaca isquêmica, uma avaliação apropriada deverá ser realizada.
A Succinato de Sumatriptana (substância ativa) não deve ser administrada a pacientes nos quais é provável a ocorrência de uma doença cardíaca não reconhecida, sem uma avaliação anterior para doença cardiovascular subjacente.
Tais pacientes incluem mulheres após a menopausa, indivíduos do sexo masculino com mais de 40 anos de idade e pacientes com fatores de risco para doença da artéria coronária. Entretanto, essas avaliações podem não identificar todos os pacientes que têm doença cardíaca e, em casos muito raros, eventos cardíacos graves acontecem em pacientes sem doença cardiovascular subjacente.
O Succinato de Sumatriptana (substância ativa) deve ser administrada com precaução a pacientes com hipertensão controlada, pois foram observados, em uma proporção pequena de pacientes, aumentos transitórios na pressão sanguínea e na resistência vascular periférica.
Síndrome Serotoninérgica
Houve raros relatos pós-comercialização descrevendo pacientes com síndrome serotoninérgica (incluindo estado mental alterado, instabilidade autonômica e anormalidades neuromusculares) após a utilização de um inibidor seletivo de recaptação de serotonina (ISRS) e do Succinato de Sumatriptana (substância ativa).
A síndrome serotoninérgica também foi reportada após o tratamento concomitante com triptanas e Inibidores da Recaptação da Serotonina e Noradrenalina (IRSN).
Se o tratamento concomitante de Succinato de Sumatriptana (substância ativa) e IRSN/ ISRS for clinicamente necessário, recomenda-se a apropriada observação do paciente.
A administração concomitante de qualquer triptano/agonista do receptor 5-HT1 com Succinato de Sumatriptana (substância ativa) não é recomendada.
O Succinato de Sumatriptana (substância ativa) deve ser administrada com precaução em pacientes com condições que possam influenciar significativamente a absorção, o metabolismo ou a eliminação do medicamento, como, por exemplo, insuficiência da função hepática (Child Pugh A ou B) ou renal.
O Succinato de Sumatriptana (substância ativa) deve ser utilizada com precaução em pacientes com história de atividade epilética ou outros fatores de risco que reduzam seu limiar convulsivo.
Os pacientes com reconhecida hipersensibilidade às sulfonamidas podem desenvolver uma reação alérgica após a administração de Succinato de Sumatriptana (substância ativa). As reações podem variar de hipersensibilidade cutânea até anafilaxia. A evidência de sensibilidade cruzada é limitada. Contudo, deve-se tomar todas as precauções antes de se utilizar Succinato de Sumatriptana (substância ativa) nesses pacientes.
O uso excessivo de tratamentos para cefaleia aguda foi associado à exacerbação da dor de cabeça em pacientes suscetíveis. A interrupção do tratamento pode ser necessária.
Crianças e Adolescentes (abaixo de 18 anos)
A eficácia e a segurança de Succinato de Sumatriptana (substância ativa) não foram demonstradas nesta população. O uso de Succinato de Sumatriptana (substância ativa) em pacientes abaixo de 18 anos não é recomendado.
Idosos (acima de 65 anos)
A experiência com a utilização da Succinato de Sumatriptana (substância ativa) em pacientes maiores de 65 anos é limitada. A farmacocinética não difere, significativamente, daquela de uma população mais jovem, mas até que dados clínicos adicionais estejam disponíveis, o uso de sumatriptana em pacientes maiores de 65 anos não é recomendado.
Pacientes com insuficiência hepática
Após administração oral, em pacientes com insuficiência hepática, o clearance pré-sistêmico é reduzido, resultando em aumento das concentrações plasmáticas de Succinato de Sumatriptana (substância ativa). O Succinato de Sumatriptana (substância ativa) não deve ser administrada em pacientes com insuficiência hepática grave.
Efeitos na capacidade de dirigir veículos e operar máquinas
Pode ocorrer o desenvolvimento de sonolência como resultado da enxaqueca ou do tratamento com o Succinato de Sumatriptana (substância ativa). Recomenda-se precaução aos pacientes que realizam tarefas que exijam atenção, como dirigir veículos ou operar máquinas.
Gravidez e lactação
Succinato de Sumatriptana (substância ativa) deve ser usado com cautela na gravidez, considerando o benefício esperado para a mãe comparado à possibilidade de risco para o feto.
Dados pós-comercialização de registros de gravidez têm documentado que a gravidez ocorreu em 1.000 mulheres expostas ao Succinato de Sumatriptana (substância ativa). Embora as informações sejam insuficientes para fornecer uma conclusão definitiva, os achados não detectaram um aumento na frequência de malformações nos recém-natos, nem um padrão consistente das malformações nos bebês das mulheres expostas à sumatriptana em comparação com a população em geral.
Foi demonstrado que, após a administração subcutânea, ao Succinato de Sumatriptana (substância ativa) é eliminada pelo leite materno. A exposição do lactente pode ser minimizada evitando-se a amamentação por 12 horas depois do tratamento.
Categoria C de risco na gravidez.
Este medicamento não deve ser usado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Carcinogênese, mutagênese
Succinato de Sumatriptana (substância ativa) não demonstrou atividades genotóxicas nem cancerígenas em sistemas in vitro e em animais.
Toxicologia reprodutiva
Em um estudo de fertilidade em ratos, doses de Succinato de Sumatriptana (substância ativa) que resultaram em níveis plasmáticos aproximadamente 200 vezes superiores aos observados no homem após uma dose de 100 mg por via oral foram associadas com uma redução no sucesso da inseminação. Esse efeito não ocorreu durante um estudo de doses subcutâneas, no qual os níveis plasmáticos máximos atingidos foram cerca de 150 vezes superiores aos do homem por via oral.
Teratogenicidade
Nenhum efeito teratogênico foi observado em ratas e coelhas, e a Succinato de Sumatriptana (substância ativa) não teve nenhum efeito sobre o desenvolvimento pós-natal de ratos. Quando administrada a coelhas grávidas durante o período de organogênese, Succinato de Sumatriptana (substância ativa) ocasionalmente causou embrioletalidade em doses que foram suficientemente elevadas para produzir toxicidade materna.
Este medicamento contém lactose.
Reações Adversas
Os eventos adversos estão listados abaixo, pela classificação de frequência. Os dados de estudos clínicos são estimados. Deve-se notar que a taxa de eventos anteriores no grupo comparação não foi levada em consideração.
Dados pós-comercialização referem-se à frequência de notificação, em vez da frequência real.
Dados de estudos clínicos
Reações comuns (>1/100 e <1/10)
Vertigem, sonolência, distúrbios sensoriais, incluindo parestesia e hipoestesia; aumentos transitórios da pressão sanguínea aparecendo logo após o tratamento, rubor; dispneia; náuseas e vômitos*; sensação de pressão**; dor**, sensações de calor ou frio**, pressão** e aperto**; sensação de fraqueza*** e fadiga***.
*Esses sintomas ocorreram em alguns pacientes, mas a relação com a Succinato de Sumatriptana (substância ativa)sumatriptana não está clara.
**Esses sintomas são normalmente transitórios, e podem ser intensos, podendo ainda afetar qualquer parte do corpo, incluindo o tórax e a garganta.
***Esses sintomas são normalmente transitórios, e podem ser de intensidade leve a moderada.
Reações muito raras (<1/10.000)
Pequenas alterações nos testes de função hepática.
Dados pós-comercialização
Reações muito raras (<1/10.000)
- Reações de hipersensibilidade, variando de hipersensibilidade cutânea à anafilaxia;
- Convulsões, embora algumas ocorreram em pacientes com histórico de convulsões ou predisposição a convulsões concorrentes, relatadas em pacientes os quais os fatores de predisposição não são aparentes;
- Nistagmo, escotoma, tremor, distonia;
- Oscilação, diplopia, visão reduzida, perda da visão (normalmente transitória). Distúrbios visuais podem também ocorrer durante uma crise de enxaqueca por si só;
- Bradicardia, taquicardia, palpitações, arritmias cardíacas, alterações isquêmicas transitórias no ecg, vasoespasmo arterial coronariano, angina, infarto do miocárdio, hipotensão, síndrome de Raynauld;
- Colite isquêmica.
Em casos de eventos adversos, notifique-os ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou à Vigilância Sanitária Estadual ou Municipal.
Composição
Succinato de Sumatriptana
Medicamento genérico Lei no 9.787, de 1999
Apresentações
Embalagens com 2 comprimidos revestidos de 50 ou 100 mg.
USO ORAL
USO ADULTO
Composição
Cada comprimido revestido de 50 mg contém:
- succinato de sumatriptana - 70 mg* *equivalente a 50 mg de sumatriptana
- Excipientes: celulose microcristalina, croscarmelose sódica, estearato de magnésio, lactose.
Cada comprimido revestido de 100 mg contém:
- succinato de sumatriptana - 140 mg* *equivalente a 100 mg de sumatriptana
- Excipientes: celulose microcristalina, croscarmelose sódica, estearato de magnésio, lactose, óxido de ferro vermelho 30.
Interação Medicamentosa
Não existe nenhuma evidência de interações com propranolol, flunarizina, pizotifeno ou com álcool. Reações prolongadas vasoespásticas foram relatadas com a ergotamina. Como esses efeitos podem ser aditivos, deve-se esperar 24 horas antes que ao Succinato de Sumatriptana (substância ativa) possa ser utilizada após o uso de qualquer preparação contendo ergotamina.
Da mesma forma, preparações contendo ergotamina não devem ser utilizadas até seis horas após a administração do Succinato de Sumatriptana (substância ativa).
Pode ocorrer o desenvolvimento de uma interação entre o Succinato de Sumatriptana (substância ativa) e os IMAO. Assim, a administração concomitante é contraindicada.
Síndrome Serotoninérgica
Houve raros relatos pós-comercialização descrevendo pacientes com síndrome serotoninérgica (incluindo estado mental alterado, instabilidade autonômica e anormalidades neuromusculares) após o uso de ISRSs e do Succinato de Sumatriptana (substância ativa). Exemplos de IMAOs e ISRSs incluem citalopram, fluoxetina, fluvoxamina, paroxetina e sertralina.
A síndrome serotoninérgica foi também reportada após o tratamento concomitante com triptanas e IRSNs. Deve-se esperar 24 horas antes que o Succinato de Sumatriptana (substância ativa) possa ser utilizada após o uso de qualquer preparação contendo triptanas.
Ação da Substância
Resultados de eficácia
A eficácia dos comprimidos de Succinato de Sumatriptana (substância ativa) no tratamento agudo de enxaqueca foi demonstrada em 3 estudos randomizados, duplo-cegos, controlados por placebo. Os pacientes incluídos nestes 3 estudos eram predominantemente mulheres (87%) e caucasianos (97%), com uma idade média de 40 anos (intervalo de 18 a 65 anos). Os pacientes foram instruídos a tratar uma cefaleia moderada a grave. A resposta da cefaleia, definida como a redução na gravidade da cefaleia de dor moderada ou grave para dor leve ou sem dor, foi avaliada até 4 horas após a administração. Os sintomas associados, como náuseas, fotofobia e fonofobia também foram avaliados.
A manutenção da resposta foi avaliada por até 24 horas após a dose. Uma segunda dose de comprimidos de Succinato de Sumatriptana (substância ativa) ou outra medicação foi permitida 4 a 24 horas após o tratamento inicial para cefaleia recorrente.
Acetaminofeno foi oferecido aos pacientes nos Estudos 2 e 3 iniciando 2 horas após o tratamento inicial, se a dor da enxaqueca não tivesse melhorado ou tivesse piorado. Medicações adicionais foram permitidas 4 a 24 horas após o tratamento inicial para cefaleia recorrente ou como resgate em todos os 3 estudos. A frequência e tempo para uso destes tratamentos adicionais também foram determinados. Em todos os estudos, doses de 25, 50, e 100 mg foram comparadas com o placebo no tratamento de crises de enxaqueca. Em 1 estudo, doses de 25, 50, e 100 mg também foram comparadas entre si.
Em todos os 3 estudos, a porcentagem de pacientes que alcançaram resposta de cefaleia 2 e 4 horas após o tratamento foi significativamente maior entre os pacientes que receberam comprimidos de Succinato de Sumatriptana (substância ativa) em todas as doses, comparado com aqueles que receberam placebo.
Em 1 dos 3 estudos, houve uma porcentagem estatisticamente e significativamente maior de pacientes com resposta à cefaleia em 2 e 4 horas no grupo de 50 mg ou 100 mg quando comparado com os grupos de dose de 25 mg. Não foram observadas diferenças estatisticamente significativas entre os grupos de dose de 50 mg e 100 mg em nenhum dos estudos. Os resultados dos 3 estudos clínicos controlados estão resumidos na Tabela 1.
Tabela 1 – Porcentagem de pacientes com resposta de cefaleia (cefaleia leve ou sem cefaleia) 2 e 4 horas após o tratamento
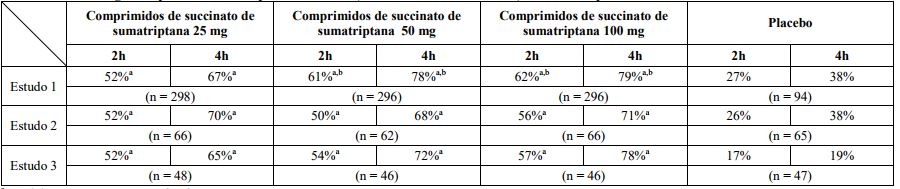
a p < 0,05 em comparação ao placebo.
b p < 0,05 em comparação a 25 mg.
A probabilidade estimada de alcançar uma resposta de cefaleia inicial ao longo de 4 horas após o tratamento nos Estudos 1, 2, e 3 agrupados é retratada na Figura 1.
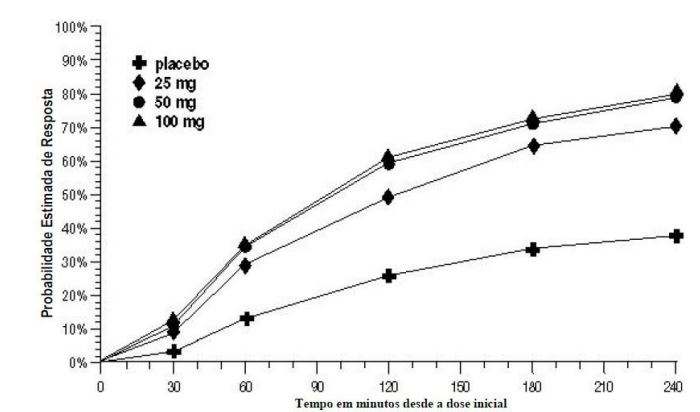
aA figura mostra a probabilidade ao longo do tempo de obter resposta de cefaleia (dor leve ou sem dor) após o tratamento com Succinato de Sumatriptana (substância ativa) oral. As médias apresentadas são baseadas nos dados agrupados dos 3 estudos clínicos controlados, fornecendo evidência de eficácia. O gráfico de Kaplan-Meier com os pacientes que não alcançaram resposta e/ou receberam resgate dentro de 240 minutos foi censurado para 240 minutos.
Para os pacientes com náuseas, fotofobia e/ou fonofobia associadas à enxaqueca no momento basal, foi observada uma menor incidência destes sintomas em 2 horas (Estudo 1) e em 4 horas (Estudos 1, 2, e 3) após a administração dos comprimidos de Succinato de Sumatriptana (substância ativa) comparado com o placebo.
Em 2 horas nos Estudos 2 e 3, ou em 4 horas no Estudo 1, durante as 24 horas após a dose inicial do tratamento do estudo, os pacientes puderam usar tratamento adicional para alívio da dor na forma de uma segunda dose do tratamento do estudo ou outra medicação. A probabilidade estimada de pacientes que receberam uma segunda dose ou outra medicação para enxaqueca ao longo de 24 horas após a dose inicial do tratamento do estudo é resumida na Figura 2.
Figura 2 – Probabilidade estimada de pacientes que receberam uma segunda dose de comprimidos de Succinato de Sumatriptana (substância ativa) ou outra medicação para tratar enxaqueca ao longo de 24 horas após a dose inicial do tratamento do estudo nos estudos 1, 2, e 3 agrupadosa
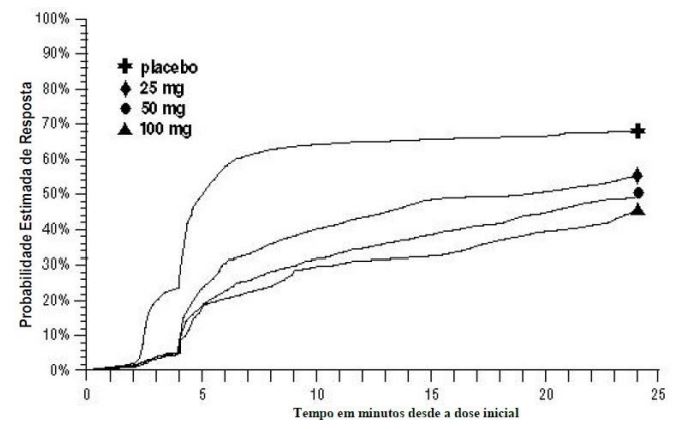
aO gráfico de Kaplan-Meier baseado nos dados obtidos nos 3 estudos clínicos controlados fornecendo evidência de eficácia com pacientes que não utilizaram tratamentos adicionais foi censurado para 24 horas. O gráfico também inclui os pacientes que não tiveram resposta à dose inicial. Não foi permitida nova medicação dentro de 2 horas após a dose.
Há evidência de que doses acima de 50 mg não oferecem um efeito superior a 50 mg. Não há evidência para sugerir que o tratamento com comprimidos de Succinato de Sumatriptana (substância ativa) estava associado com um aumento na gravidade de cefaleias recorrentes. A eficácia de comprimidos de Succinato de Sumatriptana (substância ativa) não foi afetada pela presença de aura; a duração da cefaleia antes do tratamento; gênero, idade, ou peso do indivíduo; relação com a menstruação; ou uso concomitante de medicamentos profiláticos comuns para enxaqueca (ex., betabloqueadores, bloqueadores do canal de cálcio, antidepressivos tricíclicos). Os dados foram insuficientes para avaliar o impacto da raça sobre a eficácia.
Características farmacológicas
Propriedades farmacodinâmicas
Demonstrou-se que a Succinato de Sumatriptana (substância ativa) é um agonista seletivo vascular do receptor 5-hidroxitriptamina-1- (5-HT1D), sem efeito em outros subtipos de receptores 5-HT (5- HT2-7). O receptor vascular 5 HT1D é encontrado predominantemente nos vasos sanguíneos cranianos e regulam a vasoconstrição.
Em animais, a Succinato de Sumatriptana (substância ativa) provoca constrição seletiva da circulação arterial da carótida, mas não altera o fluxo sanguíneo cerebral. A circulação arterial da carótida fornece sangue para os tecidos extracranianos e intracranianos, como as meninges. Presume-se que a dilatação e/ou a formação de edema nesses vasos esteja relacionada ao mecanismo subjacente de enxaqueca no ser humano.
Além disto, evidências experimentais sugerem que a Succinato de Sumatriptana (substância ativa) inibe a atividade do nervo trigêmeo. Essas ações podem contribuir para a ação antienxaqueca da Succinato de Sumatriptana (substância ativa) em humanos.
A resposta clínica tem início 10-15 minutos após uma injeção subcutânea com 6 mg, 15 minutos após uma dose de 20 mg fornecida por administração intranasal e aproximadamente 30 minutos após uma dose de 100 mg por via oral ou uma dose de 25 mg por via retal.
Embora a dose por via oral recomendada de Succinato de Sumatriptana (substância ativa) seja de 50 mg, as crises de enxaqueca variam em termos de gravidade num mesmo indivíduo como também entre indivíduos diferentes. As doses de 25 -100 mg mostraram uma eficácia maior do que o placebo em estudos clínicos, mas 25 mg foi menos eficaz em termos estatísticos do que 50 e 100 mg.
Propriedades farmacocinéticas
A farmacocinética da Succinato de Sumatriptana (substância ativa) não parece ser influenciada por crises de enxaqueca.
Absorção
Após administração por via oral, a Succinato de Sumatriptana (substância ativa) é rapidamente absorvida: 70% da concentração máxima é alcançada em 45 minutos. Após uma dose de 100 mg, a concentração plasmática média máxima é de 54 ng/mL.
A biodisponibilidade absoluta média por via oral é de 14%, devido, em parte, ao metabolismo pré-sistêmico e, em parte, a uma absorção incompleta.
Distribuição
A ligação às proteínas plasmáticas é baixa (14-21%). O volume total médio de distribuição é de 170 litros.
Metabolismo
O principal metabólito, o ácido indolacético, um análogo da Succinato de Sumatriptana (substância ativa), é principalmente eliminado na urina, onde está presente como ácido livre e como um conjugado glicurônico. Não possui atividade conhecida 5HT1 ou 5HT2. Não foram identificados metabólitos secundários.
Eliminação
A meia-vida de eliminação é de aproximadamente duas horas.
O clearance plasmático médio total é de aproximadamente 1.160 mL/min, e o clearance plasmático renal médio é de aproximadamente 260 mL/min. O clearance nãorenal é responsável por, aproximadamente, 80% do clearance total. A Succinato de Sumatriptana (substância ativa) é eliminada principalmente através do metabolismo oxidativo mediado pela monoaminoxidase A.
Pacientes com insuficiência hepática
Após administração oral, em pacientes com insuficiência hepática, o clearance pré-sistêmico é reduzido, resultando em aumento das concentrações plasmáticas da Succinato de Sumatriptana (substância ativa).
Dizeres Legais
Reg. MS n°. 1.0492.0160
Farm. Resp.: Luis Carlos de Oliveira - CRF-RJ n°. 7796
Fabricado por:
Arrow Pharm (Malta) Ltd.
HF 62, Hal Far Industrial Estate, Birzebbugia BBG 3000, Malta.
Importado e embalado por:
Actavis Farmacêutica Ltda.
Rua Barão de Petrópolis, 311 - Rio de Janeiro - RJ CEP 20.251-061 - CNPJ 33.150.764/0001-12
Indústria Brasileira
VENDA SOB PRESCRIÇÃO MÉDICA.
Comparar preços de remédios e medicamentos no CliqueFarma é rápido e simples.
O CliqueFarma, é uma ferramenta para comparativo de preços de produtos farmacêuticos. Não comercializamos, não indicamos, não receitamos, nenhum tipo de medicamento essa função cabe exclusivamente a médicos e farmacêuticos. Não consuma qualquer tipo de medicamento sem consultar seu médico.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. PROCURE UM MÉDICO E O FARMACÊUTICO. LEIA A BULA.
Conheça nossos Termos de Uso