para o que é indicado e para que serve?
Para que serve Este medicamento é indicado para o tratamento de pacientes adultos com: Colite Ulcerativa moderada a grave na fase ativa que apresentaram uma resposta inadequada, perda de resposta ou são intolerantes ao tratamento convencional ou ao tratamento com um antagonista de fator de necrose tumoral alfa (TNF-?).Continue lendo...
ofertas de
Entyvio - 300 Mg Pó Liofi...
ofertas de Entyvio - 300 Mg Pó Liofi...
R$ 19.380,00
R$ 19.692,46
R$ 19.915,00
R$ 20.000,00
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Este medicamento é indicado para o tratamento de pacientes adultos com:
- Colite Ulcerativa moderada a grave na fase ativa que apresentaram uma resposta inadequada, perda de resposta ou são intolerantes ao tratamento convencional ou ao tratamento com um antagonista de fator de necrose tumoral alfa (TNF-?).
- Doença de Crohn moderada a grave na fase ativa que apresentaram uma resposta inadequada, perda de resposta ou são intolerantes ao tratamento convencional ou a um antagonista de fator de necrose tumoral alfa (TNF-?).
Como Entyvio funciona?
Entyvio contém a substância ativa vedolizumabe, que pertence a um grupo de medicamentos biológicos denominados anticorpos monoclonais. O vedolizumabe bloqueia uma proteína presente na superfície dos glóbulos brancos do sangue que causa inflamação na Colite Ulcerativa e na Doença de Crohn e, dessa forma, reduz a inflamação.
A Colite Ulcerativa é uma doença inflamatória do intestino grosso que inicialmente é tratada com outros medicamentos. Se a sua resposta a estes tratamentos não for suficiente ou se você não tolerar estes medicamentos, o médico poderá prescrever Entyvio para reduzir os sinais e os sintomas da doença.
A Doença de Crohn é uma doença inflamatória do trato gastrointestinal que inicialmente é tratada com outros medicamentos. Se a sua resposta a estes tratamentos não for suficiente ou se você não tolerar estes medicamentos, o médico poderá prescrever Entyvio para reduzir os sinais e os sintomas da doença.
Contraindicação
Este medicamento é contraindicado para pessoas que são alérgicas ao vedolizumabe ou a qualquer um dos ingredientes da formula do produto.
Este medicamento é contraindicado para pessoas com infecção ativa grave, como por exemplo tuberculose, septicemia (infecção generalizada), inflamação gastrointestinal grave, infecção do sistema nervoso.
Como usar
O tratamento com Entyvio deve ser iniciado e supervisionado por profissionais da saúde experientes no diagnóstico e no tratamento da Colite Ulcerativa ou da Doença de Crohn.
Posologia
Entyvio deve ser administrado apenas por via intravenosa (infusão na veia), após ser reconstituído e diluído. A infusão intravenosa deve ser administrada à você, por seu médico ou enfermeira em um hospital ou uma clínica, por meio de um sistema de gotejamento em uma das veias do braço (infusão intravenosa) durante cerca de 30 minutos.
Não administrar por injeção intravenosa ou injeção em bolus. O pó liofilizado do vedolizumabe deve ser reconstituído em água estéril para injeção e diluído em 250 mL de solução injetável de 0,9% de cloreto de sódio antes da administração. Após a conclusão da infusão, lavar com 30 ml de 0,9% de solução injetável de cloreto de sódio. Os pacientes devem ser monitorados durante e após a infusão.
Para a aplicação das duas primeiras doses do medicamento, o médico ou a enfermeira irão acompanhar você de perto durante a infusão e por aproximadamente duas horas após o término da infusão. Para todas as doses subsequentes, você será acompanhado durante a infusão e por aproximadamente uma hora depois do término da infusão.
Após a reconstituição cada mL de Entyvio contém 60 mg de vedolizumabe.
Instruções para a reconstituição e a infusão
Entyvio deve estar a temperatura ambientes (20-25ºC) no momento da reconstituição.
- Usar técnicas de assepsia ao preparar a solução de Entyvio para a infusão intravenosa. Remover a tampa flip-off do frasco e passar um algodão embebido em álcool na tampa de borracha. Reconstituir o produto com 4,8 mL de água para injeção estéril, usando uma seringa com agulha de calibre 21-25.
- Inserir a agulha no centro do batoque e direcionar o jato de líquido para a parede do frasco a fim de evitar a formação excessiva de espuma.
- Girar o frasco cuidadosamente durante pelo menos 15 segundos. Não agitar vigorosamente ou inverter o frasco.
- Deixar o frasco em repouso por até 20 minutos a fim de permitir a reconstituição e deixar a espuma assentar. O frasco pode ser girado e inspecionado quanto à dissolução durante este tempo. Se a dissolução não estiver completa depois de 20 minutos, aguardar mais 10 minutos para dissolução. Não use se o medicamento não se dissolver dentro de 30 minutos.
- Inspecionar a solução reconstituída visualmente quanto à presença de material particulado e descoloração antes da administração. A solução deve ser límpida ou opalescente, incolor a amarelo claro e livre de partículas visíveis. A solução reconstituída com cor não característica ou contendo partículas não deve ser administrada.
- Antes de aspirar a solução reconstituída do frasco, inverter o frasco cuidadosamente três vezes.
- Aspirar 5 mL (300 mg) do Entyvio reconstituído usando uma seringa de calibre 21-25.
- Adicionar 5 mL (300 mg) do Entyvio reconstituído em bolsa de infusão contendo 250 mL de solução de cloreto de sódio a 0,9% estéril e misturar cuidadosamente. Não adicionar outros medicamentos à solução de infusão preparada ou ao equipo de infusão intravenosa. Administrar a solução para infusão durante 30 minutos.
Entyvio não contém conservantes. Uma vez reconstituído, a solução para infusão deve ser usada o quanto antes. No entanto, se necessário a solução para infusão pode ser armazenada por até 24 horas: este período pode incluir até 12 horas a 20ºC-25ºC; qualquer período adicional deve ser a 2ºC-8ºC. Não congelar a solução reconstituída ou diluída. Não guardar qualquer quantidade não utilizada da solução para infusão para reutilização.
Na ausência de estudos de compatibilidade, este medicamento não deve ser misturado com outros medicamentos.
Dose e frequência do tratamento
Pacientes pediátricos
A segurança e a eficácia do vedolizumabe não foram estabelecidas em crianças com idade de 0 a 17 anos. Não há dados disponíveis.
Uso em pacientes idosos
Não é necessário ajustar a dose para pacientes idosos.
Uso em pacientes com comprometimento dos rins ou do fígado
Entyvio não foi estudado nestas populações de pacientes e, portanto, não é possível recomendar uma dose.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Entyvio?
Se você se esquecer ou não puder comparecer à consulta para receber a infusão, marque outra consulta assim que possível.
Em caso de dúvidas, procure orientação do farmacêutico ou do seu médico ou cirurgião-dentista.
Precauções
O vedolizumabe deve ser administrado por profissionais de saúde preparados para gerenciar reações de hipersensibilidade incluindo anafilaxia, caso ocorra. Todos os pacientes devem ser observados continuamente durante a infusão. Para as duas primeiras infusões, eles devem ser observados para sinais e sintomas de reações de hipersensibilidade aguda por aproximadamente duas horas após o término da infusão. Para todas as infusões subsequentes, os pacientes devem ser observados por aproximadamente uma hora após o término da infusão.
Informe imediatamente ao médico ou à enfermeira se você apresentar os sintomas abaixo, durante a administração deste medicamento ou no período entre as aplicações de Entyvio:
- Visão turva, perda da visão ou visão dupla, dificuldade para falar, fraqueza no braço ou perna, alteração na sua forma de andar ou problemas com o equilíbrio, dormência persistente, redução da sensibilidade ou perda da sensibilidade, perda da memória ou confusão. Estes podem ser sintomas de uma condição grave e potencialmente fatal do cérebro, conhecida como leucoencefalopatia multifocal progressiva (LMP).
- Se você tiver uma infecção ou suspeitar que tem uma infecção, se você apresentar calafrios, arrepios, tosse persistente ou febre alta. Algumas infecções podem se tornar graves e possivelmente representar um risco de vida se não forem tratadas.
- Apresentar sinais e sintomas de uma reação alérgica ou outra reação à infusão, tais como respiração ruidosa, dificuldade para respirar, urticária, coceira, inchaço ou tontura, que podem ocorrer durante ou depois da infusão.
- For receber qualquer vacina ou tiver sido vacinado recentemente. Entyvio pode afetar a maneira com que o seu organismo responde à vacinação.
- O risco de câncer é maior em pacientes que possuem Colite Ulcerativa e Doença de Crohn. Como medicamentos imunomoduladores podem aumentar o risco de câncer, converse com seu médico. Ele decidirá se você pode receber Entyvio.
- Se você não estiver se sentindo melhor, pois em alguns pacientes com Doença de Crohn muito ativa pode demorar até 14 semanas para a melhora com o vedolizumabe ser observada.
Uso em crianças e adolescentes
Entyvio não é recomendado para crianças e adolescentes (com menos de 18 anos de idade) devido à falta de informações relacionadas ao uso deste medicamento neste grupo de idade.
Uso de outros medicamentos e Entyvio
Informe ao médico se você estiver tomando, tomou recentemente ou for iniciar outros medicamentos.
Entyvio não deve ser usado com outros medicamentos biológicos que suprimem o sistema imunológico, pois o efeito deste uso concomitante é desconhecido.
Se você tomou anteriormente um medicamento a base de natalizumabe (usado para tratar uma doença denominada esclerose múltipla) ou de rituximabe (usado para tratar determinados tipos de câncer e artrite reumatoide), informe ao médico. Ele decidirá se você pode receber Entyvio.
Se você tiver feito tratamento com natalizumabe, deve esperar normalmente 12 semanas, no mínimo, antes de iniciar o tratamento com Entyvio, exceto se seu médico preferir iniciar o tratamento antes, em virtude de sua condição clínica.
Uso durante a gravidez e a amamentação
O efeito deste medicamento em mulheres grávidas não é conhecido. Portanto, o seu uso não é recomendado durante a gravidez, exceto se você e seu médico decidirem que o benefício para você supera claramente o risco potencial para você e o seu bebê.
As mulheres em idade fértil devem utilizar métodos para evitar a gravidez durante o tratamento com Entyvio e por pelo menos 4,5 meses após o término do tratamento.
Informe ao médico se você estiver amamentando ou planejando amamentar. Não se sabe se Entyvio passa para o leite e, portanto, qual efeito isto pode ter no seu bebê.
Este medicamento não deve ser utilizado durante a gravidez sem orientação médica ou do cirurgião-dentista.
Efeito na capacidade de dirigir veículos e operar máquinas
Este medicamento pode ter uma influência mínima na sua capacidade de dirigir veículos e operar máquinas. Um número pequeno de pacientes pode sentir tontura depois de receber Entyvio. Se você sentir tontura, não dirija ou use ferramentas ou máquinas.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Como todos os medicamentos, Entyvio pode causar efeitos colaterais, mas não em todas as pessoas que são tratadas.
Os possíveis efeitos colaterais graves incluem reações à infusão ou reações alérgicas (podem afetar até 1 em 100 pessoas) e infecções (podem afetar 1 em 10 pessoas).
Informe ao médico imediatamente se você apresentar respiração ruidosa ou dificuldade para respirar, urticária, coceira na pele, inchaço, batimento rápido do coração, mal-estar, dor no local da infusão, vermelhidão da pele, calafrios ou arrepios, febre alta ou erupção cutânea.
Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
Resfriado comum, dor nas articulações, dor de cabeça.
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Dor nas extremidades, bronquite, inflamação gastrointestinal, infecção respiratória nas vias aéreas superiores (nariz e garganta), gripe, sinusite, dor de garganta, formigamento na pele, pressão alta, dor no fundo da boca, nariz entupido, tosse, infecção do ânus, úlcera no ânus, náusea, azia, prisão de ventre, inchaço abdominal, gases, hemorroidas, erupção e vermelhidão da pele, coceira e eczema na pele, suores noturnos, acne (espinhas), contração muscular involuntária, dor nas costas, fraqueza muscular, cansaço, febre.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
Infecção respiratória, vermelhidão e sensibilidade do folículo capilar, candidíase na boca e garganta, infecção vaginal, reações no local da injeção (incluindo dor e irritação local) e reações relacionadas à injeção (calafrios e sensação de frio).
Descrição de algumas reações adversas específicas:
Composição
Cada frasco-ampola contém:
Vedolizumabe - 300 mg.
Excipientes: Sacarose, histidina, cloridrato de histidina, cloridrato de arginina e polissorbato 80.
Após a reconstituição cada mL contém 60 mg de vedolizumabe.
Superdosagem
Doses de até 10 mg/kg (aproximadamente 2,5 vezes a dose recomendada) foram administradas em estudos clínicos. Nos estudos clínicos não foi observada toxicidade limitante da dose.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Não foram conduzidos estudos de interação.
O Vedolizumabe (substância ativa) foi estudado em pacientes adultos com Colite Ulcerativa e Doença de Crohn com administração concomitante de corticosteroides, imunomoduladores (azatioprina, 6-mercaptopurina e metotrexato) e aminosalicilatos.
As análises da farmacocinética da população sugerem que a administração concomitante de tais agentes não teve efeito clinicamente significativo na farmacocinética do Vedolizumabe (substância ativa).
O efeito do Vedolizumabe (substância ativa) na farmacocinética dos medicamentos comumente coadministrados não foi estudado.
Vacinações
As vacinas vivas, em particular vacinas vivas orais, devem ser usadas com cautela durante o tratamento com Vedolizumabe (substância ativa).
Ação da Substância
Resultados de Eficácia
Colite ulcerativa
A eficácia e a segurança do vedolizumabe para o tratamento de pacientes adultos com colite ulcerativa moderada a grave na fase ativa (escore de Mayo de 6 a 12, com subescore por endoscopia ?2) foram demonstradas em um estudo randomizado, duplo-cego, controlado por placebo, que avaliou desfechos de eficácia na Semana 6 e na Semana 52 (GEMINI I).
Os pacientes incluídos no estudo haviam falhado a pelo menos um tratamento convencional incluindo corticosteroides, imunomoduladores e/ou o antagonista de TNF-? infliximabe (incluindo pacientes sem resposta primária). Doses concomitantes estáveis de aminosalicilatos orais, corticosteroides e/ou imunomoduladores foram permitidas.
Para a avaliação dos desfechos na Semana 6, 374 pacientes foram randomizados em forma duplo-cega (3:2) para receber 300 mg de vedolizumabe ou placebo na Semana 0 e Semana 2. O desfecho primário foi a proporção de pacientes com resposta clínica (definida como redução ?3 pontos no escore completo de Mayo e ?30% em relação ao momento basal, com redução concomitante de ?1 ponto no subescore de hemorragia retal ou ?1 ponto no subescore absoluto de hemorragia retal) na Semana 6. A Tabela 1 mostra os resultados dos desfechos primário e secundário avaliados.
Tabela 1: Resultados de Eficácia do GEMINI I na Semana 6
| Desfecho | Placebo N=149 | Vedolizumabe N=225 |
| Resposta clínica | 26% | 47%* |
| Remissão clínica § | 5% | 17%† |
| Cicatrização da mucosa ¶ | 25% | 41%‡ |
*p<0,0001.
†p?0,001.
‡p<0,05.
§ Remissão clínica: Escore completo de Mayo ? 2 pontos e nenhum subescore individual >1 ponto .
¶ Cicatrização da mucosa: subescore de Mayo ? 1 ponto por endoscopia.
O efeito benéfico do vedolizumabe na resposta clínica, remissão e cicatrização da mucosa foi observado em pacientes sem exposição anterior a antagonista de TNF-?, assim como naqueles pacientes que haviam falhado ao tratamento anterior com antagonista de TNF-?.
No GEMINI I duas coortes de pacientes receberam vedolizumabe na semana 0 e semana 2: os pacientes da coorte 1 foram randomizados para receber tratamento duplo-cego com 300 mg de vedolizumabe ou placebo e os pacientes da coorte 2 foram tratados de forma aberta com 300 mg de vedolizumabe.
Para avaliar a eficácia na semana 52, 373 pacientes da coorte 1 e 2 que foram tratados com vedolizumabe e alcançaram resposta clínica na Semana 6 foram randomizados de forma duplo-cega (1:1:1) para um dos seguintes regimes, com início na Semana 6: 300 mg de vedolizumabe a cada oito semanas, 300 mg de vedolizumabe a cada quatro semanas ou placebo a cada quatro semanas.
Com início na Semana 6, os pacientes que haviam alcançado resposta clínica e estavam recebendo corticosteroides deveriam iniciar um regime de redução da dose do corticosteroide. O desfecho primário foi a proporção de pacientes em remissão clínica na semana 52. A Tabela 2 mostra os resultados dos desfechos primário e secundário avaliados.
Tabela 2: Resultados de Eficácia do GEMINI I na Semana 52
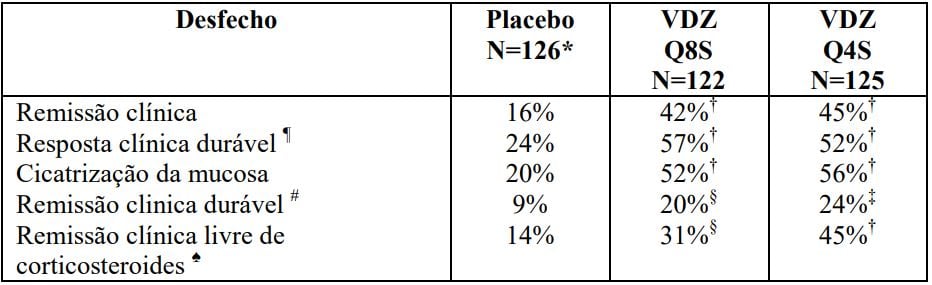
VDZ Q8S = vedolizumabe a cada 8 semanas; VDZ Q4S= vedolizumabe a cada 4 semanas.
*O grupo placebo inclui aqueles indivíduos que receberam vedolizumabe na Semana 0 e Semana 2, e foram randomizados para receber placebo da Semana 6 até a Semana 52.
†p<0,0001.
‡ p<0,001.
§ p<0,05.
¶ Resposta clínica durável: resposta clínica nas Semanas 6 e 52.
# Remissão clínica durável: remissão clínica nas Semanas 6 e 52.
? Remissão clínica livre de corticosteroide: pacientes que estavam usando corticosteroides orais no momento basal que haviam descontinuado os corticosteroides, com início na Semana 6, e estavam em remissão clínica na Semana 52. O número de pacientes foi 72 para placebo, 70 para vedolizumabe a cada oito semanas e 73 para vedolizumabe a cada quatro semanas.
Análises exploratórias fornecem dados adicionais das principais subpopulações estudadas. Aproximadamente um terço dos pacientes havia falhado ao tratamento anterior com antagonista de TNF-?.
Entre estes pacientes, 37% recebendo vedolizumabe a cada oito semanas, 35% recebendo vedolizumabe a cada quatro semanas e 5% recebendo placebo alcançaram remissão clínica na Semana 52. Melhoras na resposta clínica durável (47%, 43%, 16%), cicatrização da mucosa (42%, 48%, 8%), remissão clínica durável (21%, 13%, 3%) e remissão clínica livre de corticosteroide (23%, 32%, 4%) foram observadas na população com falha anterior a antagonista de TNF-? tratada com vedolizumabe a cada oito semanas, vedolizumabe a cada quatro semanas e placebo, respectivamente.
Os pacientes que falharam em demonstrar resposta na Semana 6 permaneceram no estudo e receberam vedolizumabe a cada quatro semanas. Resposta clínica, com base nos escores parciais de Mayo, foi alcançada na Semana 10 e Semana 14 por uma proporção maior de pacientes tratados com vedolizumabe (32% e 39%, respectivamente) comparados aos pacientes que receberam placebo (15% e 21%, respectivamente).
Os pacientes que apresentaram perda da resposta ao vedolizumabe quando tratados a cada oito semanas poderiam entrar em um estudo aberto de extensão e receber vedolizumabe a cada quatro semanas. Remissão clínica foi alcançada por 25% destes pacientes na Semana 28 e Semana 52.
Os pacientes que alcançaram uma resposta clínica depois de receber vedolizumabe na Semana 0 e Semana 2 e foram randomizados para placebo (por 6 a 52 semanas) e apresentaram perda da resposta poderiam entrar no estudo aberto de extensão e receber vedolizumabe a cada quatro semanas. Remissão clínica foi alcançada por 45% destes pacientes em 28 semanas e 36% em 52 semanas.
Neste estudo aberto de extensão, os benefícios do tratamento com vedolizumabe, avaliados pelos escore parcial de Mayo, remissão clínica e resposta clínica foram observados por até 124 semanas.
A qualidade de vida associada à saúde (HRQOL) foi avaliada pelo Questionário da Doença Inflamatória Intestinal (IBDQ), um instrumento específico de doença, e pelo SF-36 e EQ-5D, que são medidas gerais. A análise exploratória mostra que houve melhora clinicamente significativa para os grupos vedolizumabe e a melhora era significantemente maior, em comparação com o grupo placebo na Semana 6 e na Semana 52, nos escores do EQ-5D e EQ-5D VAS, todas subescalas do IBDQ (sintomas intestinais, função sistêmica, função emocional e função social) e em todas as subescalas do SF-36, incluindo o Resumo do Componente Físico (RCF) e o Resumo do Componente Mental (RCM).
Doença de Crohn
A eficácia e a segurança do vedolizumabe para o tratamento de pacientes adultos com Doença de Crohn moderadamente a gravemente ativa (escore do Índice de Atividade da doença de Crohn [IADC] de 220 a 450) foram avaliados em dois estudos (GEMINI II e III). Os pacientes incluídos haviam falhado a pelo menos um tratamento convencional, incluindo corticosteroides, imunomoduladores e/ou antagonistas de TNF-? (incluindo aqueles sem resposta primária). Doses concomitantes estáveis de corticosteroides orais, imunomoduladores e antibióticos eram permitidas.
O estudo GEMINI II era um estudo randomizado, duplo-cego, controlado por placebo de avaliação de desfechos de eficácia na Semana 6 e Semana 52. Os pacientes (n=368) foram randomizados de forma duplocega (3:2) para receber duas doses de 300 mg de vedolizumabe ou placebo, na Semana 0 e Semana 2.
Os dois desfechos primários eram a proporção de pacientes em remissão clínica (definida como escore do IADC ? 150 pontos) na Semana 6 e a proporção de pacientes com melhora da resposta clínica (definida como redução ?100 pontos no escore do IADC em relação ao momento basal) na Semana 6 (Tabela 3).
O estudo GEMINI II possuía duas coortes de pacientes que receberam vedolizumabe na semana 0 e 2: os pacientes da coorte 1 foram randomizados para receber 300 mg de vedolizumabe ou placebo de forma duplocega e os pacientes da coorte 2 foram tratados de forma aberta com 300 mg de vedolizumabe.
Para avaliar a eficácia na semana 52, 461 pacientes das coortes 1 e 2, que foram tratados com vedolizumabe e alcançaram resposta clínica (definida como redução ?70 pontos no escore do IADC em relação ao momento basal) na Semana 6, foram randomizados de forma duplo-cega (1:1:1) para um dos seguintes regimes, com início na Semana 6: 300 mg de vedolizumabe a cada oito semanas, 300 mg de vedolizumabe a cada quatro semanas ou placebo a cada quatro semanas. Os pacientes que apresentavam resposta clínica na Semana 6 deveriam iniciar a redução do corticosteroide. O desfecho primário foi a proporção de pacientes em remissão clínica na Semana 52 (Tabela 4).
O estudo GEMINI III foi um segundo estudo randomizado, duplo-cego, controlado por placebo que avaliou a eficácia na Semana 6 e Semana 10 no subgrupo de pacientes definidos como tendo falhado a pelo menos um tratamento convencional e falhado ao tratamento com antagonistas de TNF-? (incluindo aqueles sem resposta primária), assim como a população global, que também incluiu pacientes que falharam a pelo menos um tratamento convencional e eram virgens de tratamento com antagonistas de TNF-?.
Os pacientes (N=416), o que incluiu aproximadamente 75% dos pacientes com falhas a antagonistas de TNF-?, foram randomizados de forma duplo-cega (1:1) para receber 300 mg de vedolizumabe ou placebo nas Semanas 0, 2 e 6. O desfecho primário era a proporção de pacientes em remissão clínica na Semana 6 na subpopulação de falha a antagonistas de TNF-?. Como anotado na Tabela 3, embora o desfecho primário não fosse atingido, as análises exploratórias mostram que foram observados resultados clinicamente significativos.
Tabela 3: Resultados de Eficácia para os Estudos GEMINI II e III na Semana 6 e Semana 10
|
Desfecho do estudo | Placebo |
Vedolizumabe |
|
Estudo GEMINI II | ||
|
Remissão clínica, Semana 6 | ||
|
Global | 7% (n=148) |
15%* (n=220) |
|
Falha a antagonista(s) de TNF-? | 4% (n=70) |
11% (n=105) |
|
Virgem de antagonista de TNF-? | 9% (n=76) |
17% (n=109) |
|
Melhora da resposta clínica, Semana 6 | ||
|
Global | 26% (n=148) |
31%† (n=220) |
|
Falha a antagonista(s) de TNF-? | 23% (n=70) |
24% (n=105) |
|
Variação da CRP sérica do momento basal para a Semana 6, mediana (mcg/mL) | ||
|
Global‡ | 0,5 (n=147) |
- 0,9 (n=220) |
|
Estudo GEMINI III | ||
|
Remissão clínica, Semana 6 | ||
|
Global‡ | 12% (n=207) |
19%* (n=209) |
|
Falha a antagonista(s) de TNF-?¶ | 12% (n=157) |
15%§ (n=158) |
|
Virgem de antagonista(s) de TNF-? | 12% (n=50) |
31% (n=51) |
|
Remissão clínica, Semana 10 | ||
| Global | 13% (n=207) |
29% (n=209) |
|
Falha a antagonista de TNF-? ¶,‡ | 12% (n=157) |
27% (n=158) |
|
Remissão clínica sustentada #, ¶ | ||
|
Global | 8% (n=207) |
15% (n=209) |
|
Falha a antagonista(s) de TNF-? ¶,‡ | 8% (n=157) |
12% (n=158) |
|
Virgem de antagonista(s) de TNF-? | 8% (n=50) |
26% (n=51) |
|
Melhora da resposta clínica, Semana 6 | ||
|
Global | 23% (n=207) |
39% (n=209) |
|
Falha a antagonista(s) de TNF-?‡ | 22% (n=157) |
39% (n=158) |
|
Virgem de antagonista(s) de TNF-?^ | 24% (n=50) |
39% (n=51) |
* p<0,05.
† Não estatisticamente significante.
‡ Desfecho secundário a ser visto como exploratório pelo procedimento do teste estatístico pré-especificado.
§ Não estatisticamente significante. Portanto, os outros desfechos não foram testados estatisticamente.
¶ n=157 para placebo e n=158 para vedolizumabe.
# Remissão clínica sustentada: remissão clínica nas Semanas 6 e 10.
^ Desfecho exploratório.
Tabela 4: Resultados de Eficácia do GEMINI II na Semana 52
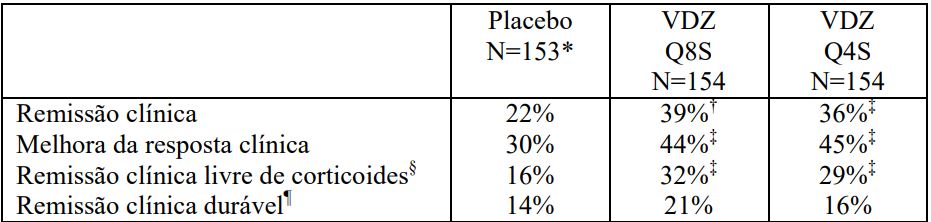
VDZ Q8S = vedolizumabe a cada 8 semanas; VDZ Q4S= vedolizumabe a cada 4 semanas.
*O grupo placebo inclui aqueles indivíduos que receberam vedolizumabe na Semana 0 e Semana 2, e foram randomizados para receber placebo da Semana 6 até a Semana 52.
† p<0.001 ‡ p<0.05.
§ Remissão clínica livre de corticosteroide: pacientes que estavam usando corticosteroides orais no momento basal que haviam descontinuado os corticosteroides, com início na Semana 6, e estavam em remissão clínica na Semana 52. O número de pacientes era: 82 para placebo, 82 para vedolizumabe a cada oito semanas e 80 para vedolizumabe a cada quatro semanas.
¶ Remissão clínica durável: remissão clínica em ?80% das visitas do estudo, incluindo a visita final (Semana 52).
As análises exploratórias examinaram os efeitos dos corticosteroides e imunomoduladores concomitantes na indução da remissão com o vedolizumabe. O tratamento combinado, mais notavelmente com corticosteroides concomitantes, pareceu ser mais efetivo na indução da remissão na Doença de Crohn do que o vedolizumabe isolado ou com imunomoduladores, que mostrou uma diferença pequena na taxa de remissão em relação ao placebo.
No GEMINI II, a taxa de remissão na Semana 6 foi de 10% (diferença de 2% em relação ao placebo, IC 95%: -6, 10), quando administrado sem corticosteroides comparada a 20% (diferença de 14% em relação ao placebo, IC 95%: -1, 29) quando administrado com corticosteroides concomitantes. No GEMINI III, as taxas de remissão clínica na Semana 6 e na Semana 10 foram 18% (diferença de 3% em relação ao placebo, IC 95%: -7, 13) e 22% (diferença de 8% em relação ao placebo, IC 95%: -3, 19) quando administrado sem corticosteroides comparado a 20% (diferença de 11% em relação ao placebo, IC 95%: 2, 20) e 35% (diferença de 23% em relação ao placebo, IC 95%: 12, 33) respectivamente, quando administrado com corticosteroides concomitantes.
Estes efeitos foram observados quer os imunomoduladores fossem ou não administrados concomitantemente.
As análises exploratórias fornecem dados adicionais das principais subpopulações estudadas. No GEMINI II, aproximadamente metade dos pacientes haviam falhado anteriormente ao tratamento com antagonistas de TNF- ?.
Entre estes pacientes, 28% que estavam recebendo vedolizumabe a cada oito semanas, 27% recebendo vedolizumabe a cada quatro semanas e 13% recebendo placebo alcançaram remissão clínica na Semana 52. Melhora da resposta clínica foi alcançada em 29%, 38% e 21%, respectivamente, e remissão clínica livre de corticosteroides foi alcançada em 24%, 16% e 0%, respectivamente.
No GEMINI II, os pacientes que falharam em demonstrar resposta na Semana 6 foram mantidos no estudo e receberam vedolizumabe a cada quatro semanas. Melhora da resposta clínica foi observada na Semana 10 e Semana 14 para proporções maiores de pacientes tratados com vedolizumabe (16% e 22%, respectivamente) comparado com os pacientes tratados com placebo (7% e 12%, respectivamente).
Não houve diferença clinicamente significativa na remissão clínica entre os grupos de tratamento nestes tempos. As análises da remissão clínica da Semana 52 em pacientes que não haviam respondido ao tratamento na Semana 6, mas que alcançaram resposta na Semana 10 ou Semana 14, indicam que os pacientes com doença de Crohn que não apresentam resposta podem se beneficiar de uma dose de vedolizumabe na Semana 10.
Os pacientes que apresentavam perda da resposta ao vedolizumabe quando tratados a cada oito semanas no GEMINI II, podiam entrar no estudo aberto de extensão e receberam vedolizumabe a cada quatro semanas. Nestes pacientes foi observada remissão clínica em 23% dos pacientes na Semana 28 e 32% dos pacientes na Semana 52.
Os pacientes que alcançaram resposta clínica depois de receber vedolizumabe na Semana 0 e 2 e que foram randomizados para placebo (por 6 a 52 semanas) e perderam a resposta podiam entrar no estudo aberto de extensão e receber vedolizumabe a cada quatro semanas. Nestes pacientes, remissão clínica foi alcançada em 46% dos pacientes em 28 semanas e 41% dos pacientes em 52 semanas. Neste estudo aberto de extensão, remissão clínica e resposta clínica foram observadas nos pacientes por até 124 semanas.
As análises exploratórias mostraram melhora clinicamente significativa para os grupos do vedolizumabe a cada quatro semanas e a cada oito semanas no GEMINI II e a melhora foi significantemente maior em comparação ao grupo placebo, do momento basal para a Semana 52, nos escores do EQ-5D e EQ-5D VAS, no escore total do IBDQ e nas subescalas do IBDQ de sintomas intestinais e função sistêmica.
Características Faramacológicas
Propriedades farmacodinâmicas
O vedolizumabe é um medicamento biológico imunossupressor seletivo para o intestino. É um anticorpo monoclonal humanizado que se liga especificamente à integrina ?4?7, a qual é expressada, de preferência, em linfócitos T auxiliares (T helper) alojados no intestino.
Ao se ligar à integrina ?4?7 em determinados linfócitos, o vedolizumabe inibe a adesão destas células à molécula-1 de adesão da célula de adressina da mucosa (MAdCAM-1), mas não à molécula-1 de adesão da célula vascular (VCAM-1). A MAdCAM-1 é expressada principalmente nas células endoteliais do intestino e representa um papel crítico no alojamento de linfócitos T nos tecidos do trato gastrointestinal.
O vedolizumabe não se liga nem inibe a função das integrinas ?4?1 e ?E?7.
A integrina ?4?7 é expressada em um subconjunto discreto de linfócitos T auxiliares de memória, os quais migram, de preferência, para o trato gastrointestinal e causam uma inflamação que é característica da Colite Ulcerativa e da Doença de Crohn, que são condições inflamatórias crônicas, imunologicamente mediadas, do trato gastrointestinal.
O vedolizumabe reduz a inflamação gastrointestinal em pacientes com Colite Ulcerativa. A inibição da interação da ?4?7 com a MAdCAM-1 pelo vedolizumabe impede a transmigração dos linfócitos T auxiliares de memória alojados no intestino através do endotélio vascular para o tecido do parênquima em primatas não humanos e induziu um aumento reversível de 3 vezes destas células no sangue periférico.
O precursor murino do vedolizumabe aliviou a inflamação gastrointestinal em sagui cabeça-de-algodão com colite, um modelo de Colite Ulcerativa.
Em indivíduos sadios, pacientes com Colite Ulcerativa ou pacientes com Doença de Crohn, o vedolizumabe não aumenta os neutrófilos, basófilos, eosinófilos, linfócitos B auxiliares (B helper) e linfócitos T citotóxicos, linfócitos T auxiliares de memória totais, monócitos ou células matadoras naturais (natural killer), no sangue periférico, sem observação de leucocitose.
O vedolizumabe não afetou a vigilância imunológica e a inflamação do sistema nervoso central em encefalomielite autoimune experimental em primatas não humanos, um modelo de esclerose múltipla.
O vedolizumabe não afetou as respostas imunológicas ao desafio antigênico na derme e no músculo. Por outro lado, o vedolizumabe inibiu uma resposta imunológica a um desafio antigênico gastrointestinal em voluntários humanos sadios.
Propriedades farmacocinéticas
A farmacocinética de dose única e doses múltiplas de vedolizumabe foi estudada em indivíduos sadios e em pacientes com Colite Ulcerativa e Doença de Crohn moderadamente a gravemente ativas.
Em pacientes que receberam 300 mg de vedolizumabe na forma de infusão intravenosa de 30 minutos nas Semana 0 e 2, as concentrações séricas mínimas na Semana 6 foram 27,9 mcg/mL (DP±15,51) em Colite Ulcerativa e 26,8 mcg/mL (DP±17,45) em Doença de Crohn. Com início na Semana 6, os pacientes receberam 300 mg de vedolizumabe a cada oito ou quatro semanas.
Em pacientes com Colite Ulcerativa, as concentrações séricas mínimas médias no estado de equilíbrio foram 11,2 mcg/mL (DP±7,24) e 38,3 mcg/mL (DP±24,43), respectivamente. Nos pacientes com Doença de Crohn as concentrações séricas mínimas médias no estado de equilíbrio foram 13,0 mcg/mL (DP±9,08) e 34,8 mcg/mL (DP±22,55), respectivamente.
Populações especiais
A idade não tem impacto na depuração do vedolizumabe em pacientes com Colite Ulcerativa e Doença de Crohn, com base nas análises da farmacocinética da população. Não foram conduzidos estudos formais para examinar os efeitos da insuficiência renal ou hepática na farmacocinética do vedolizumabe.
Dados pré-clínicos de segurança
Os dados não clínicos não revelam nenhum risco especial para os seres humanos com base em estudos convencionais de farmacologia de segurança, toxicidade de dose repetida, assim como em estudos da reprodução e de toxicologia do desenvolvimento.
Estudos a longo prazo do vedolizumabe em animais para avaliar o seu potencial carcinogênico não foram conduzidos pois não existem modelos farmacologicamente responsivos a anticorpos monoclonais. Em uma espécie farmacologicamente responsiva (macacos cynomolgus) não houve evidência de hiperplasia celular ou imunomodulação sistêmica que pudesse estar potencialmente associada com oncogênese em estudos de toxicologia de 13 semanas e 26 semanas. Além disso, não foram encontrados efeitos do vedolizumabe na taxa de proliferação ou citotoxicidade de uma linhagem de células tumorais humanas expressando a integrina ?4?7 in vitro.
Não foram realizados estudos específicos de fertilidade com o vedolizumabe em animais. Não é possível tirar conclusões definitivas dos órgãos reprodutores masculinos no estudo de toxicidade de dose repetida, mas considerando a falta de ligação do vedolizumabe ao tecido reprodutor masculino no macaco e no homem, e a fertilidade masculina intacta observada no camundongo com a integra ?7 desativada, não se espera que o vedolizumabe afete a fertilidade masculina.
A administração do vedolizumabe em macacas cynomolgus grávidas durante a maior parte da gestação não resultou em evidência de efeitos na teratogenicidade, no desenvolvimento pré-natal ou pós-natal nos filhotes até 6 meses de idade. Níveis baixos (<300 mcg/L) de vedolizumabe foram detectados 28 dias após o parto no leite de 3 de 11 macacas cynomolgus tratadas com 100 mg/kg de vedolizumabe, administrado a cada duas semanas e não nos animais que receberam 10 mg/kg. Não se sabe se o vedolizumabe é excretado no leite humano.
Cuidados de Armazenamento
Entyvio deve ser conservado sob refrigeração (temperatura de 2ºC a 8ºC), protegido da luz.
Este medicamento tem validade de 36 meses a partir da data de sua fabricação.
Número de lote e datas de fabricação e validade: Vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após o preparo, a solução reconstituída e diluída deve ser utilizada imediatamente. Se isto não for possível, a solução pode ser armazenada por até 24 horas incluindo até 12 horas em temperatura de 20-25ºC e o tempo restante em temperatura de 2ºC-8ºC. Não congelar a solução reconstituída ou diluída.
Característica física
Entyvio é um pó branco a quase branco para solução para infusão que deve ser reconstituído e diluído antes da administração.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS – 1.0639.0271
Farm. Resp.:
Carla A. Inpossinato CRF-SP nº 38.535
Fabricado e embalado (emb. primária) por:
Hospira Inc.
McPherson – EUA
Embalado (emb. secundária) por:
Takeda Italia S.P.A.
Cerano - Itália
Importado por:
Takeda Pharma Ltda.
Rodovia SP 340 S/N, Km 133,5 Jaguariúna - SP
CNPJ 60.397.775/0008-40
Sac: 0800-7710345
Venda sob prescrição médica.
informações complementares
| Fabricante |
| TAKEDA |
| Princípio ativo |
| Vedolizumabe |
| Categoria do medicamento |
| Medicamentos Especiais |
