para o que é indicado e para que serve?
Para que serve Erivedge está indicado para o tratamento de pacientes adultos com um tipo de câncer de pele denominado carcinoma basocelular avançado, quando o câncer se espalhou por outras partes do corpo (chamado carcinoma basocelular metastático) ou para áreas próximas (chamado carcinoma basocelular localmente avançado) e seu médico decidiu que o tratamento com cirurgia ou radioterapia seria inapropriado.Continue lendo...
ofertas de
Erivedge 150Mg 28 Cápsula...
ofertas de Erivedge 150Mg 28 Cápsula...
R$ 30.768,00
R$ 30.800,00
R$ 31.100,00
R$ 32.980,00
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Erivedge está indicado para o tratamento de pacientes adultos com um tipo de câncer de pele denominado carcinoma basocelular avançado, quando o câncer se espalhou por outras partes do corpo (chamado carcinoma basocelular metastático) ou para áreas próximas (chamado carcinoma basocelular localmente avançado) e seu médico decidiu que o tratamento com cirurgia ou radioterapia seria inapropriado.
Como Erivedge funciona?
Erivedge liga-se a uma proteína denominada Smoothened na membrana da célula, impedindo a transmissão de um sinal, chamado sinal de Hedgehog, que é importante no controle da multiplicação das células.
Contraindicação
Erivedge não deve ser utilizado por pacientes com hipersensibilidade conhecida a vismodegibe ou a qualquer excipiente contido na fórmula do medicamento.
Erivedge não deve ser utilizado por mulheres grávidas.
Se você estiver amamentando, não poderá usar este medicamento. Também não poderá amamentar por 24 meses depois de receber a última dose de Erivedge. Este medicamento pode provocar graves defeitos no desenvolvimento da criança.
O uso de Erivedge é contraindicado a mulheres com potencial para engravidar que não cumprem o programa de prevenção de gravidez de Erivedge.
O uso de Erivedge é contraindicado a homens que não cumprem o programa de prevenção de gravidez de Erivedge.
Erivedge não deve ser coadministrado com erva-de-são-joão (Hypericum perforatum).
Em estudo em animais e mulheres grávidas, o fármaco provocou anomalias fetais, e houve clara evidência de risco para o feto maior que qualquer benefício possível para a paciente.
Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
Este medicamento é contraindicado para uso por mulheres que estejam amamentando.
Como usar
A dose habitual de Erivedge é de 150 mg (uma cápsula) uma vez por dia. Erivedge deve ser administrado por via oral, com ou sem alimentos. Você deve ingerir as cápsulas inteiras. Não é permitido triturar nem abrir as cápsulas em hipótese alguma.
Você poderá tomar Erivedge até que a sua doença progrida ou até que você apresente um efeito colateral intolerável, a critério do seu médico.
Não é necessário ajustar a dose se você já tem mais de 65 anos de idade.
Se você tiver insuficiência dos rins ou do fígado, não é necessário nenhum ajuste de dose. Pacientes com insuficiência dos rins grave devem ser cuidadosamente monitorados para reações adversas.
Ainda não há resultados conclusivos sobre a eficácia e a segurança de Erivedge em crianças e adolescentes menores de 18 anos. Portanto, Erivedge não deve ser utilizado por pacientes nessa faixa etária.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando eu esquecer de usar Erivdge?
Se você perder uma dose, por esquecimento ou por qualquer intercorrência, não tente repor essa dose. Aguarde até o horário previsto da dose seguinte e tome normalmente.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Geral
Gravidez e lactação
Não existe nenhum estudo com gestantes que são tratadas com Erivedge. No entanto, foi demonstrado que o vismodegibe é tóxico para o embrião e provoca malformações em animais.
Um profissional de saúde deverá orientar os pacientes para que eles entendam e reconheçam as condições sobre a prevenção de gravidez durante o tratamento com Erivedge. Além disso, será fornecido material educativo para reforçar os potenciais riscos associados ao uso do medicamento.
Capacidade de Dirigir e Operar Máquinas
Não foram realizados estudos sobre os efeitos de Erivedge na capacidade de dirigir ou operar máquinas.
Uso pediátrico
Ainda não há resultados conclusivos sobre a eficácia e a segurança de Erivedge em crianças e adolescentes menores de 18 anos com carcinoma basocelular avançado. Portanto, Erivedge não deve ser utilizado por pacientes pediátricos por causa das preocupações de segurança.
A fusão prematura das epífises foi relatada em pacientes pediátricos expostos a Erivedge.
Uso em idosos
Não foi observada diferença na segurança e na eficácia de Erivedge em pacientes idosos com mais de 65 anos com relação aos pacientes mais jovens.
Insuficiência dos rins
Os resultados da análise farmacocinética na população não demonstraram nenhum impacto da insuficiência leve a moderada dos rins na farmacocinética de vismodegibe. Nenhum ajuste de dose é requerido em pacientes com insuficiência dos rins. Dados muito limitados estão disponíveis em pacientes com insuficiência renal grave.
Insuficiência do fígado
Os resultados de estudos clínicos demonstraram que não há impacto da insuficiência do fígado na farmacocinética de vismodegibe. Nenhum ajuste de dose é requerido em pacientes com insuficiência do fígado leve, moderada ou grave.
Até o momento, não existem informações de que o vismodegibe possa provocar doping.
Precauções adicionais
Você não deve compartilhar seu medicamento com outra pessoa. Quaisquer cápsulas não utilizadas ao final do tratamento devem ser imediatamente descartadas em local adequado.
Interações Medicamentosas
O vismodegibe é eliminado do corpo por diversas vias, incluindo metabolismo pelo fígado. No entanto, a sua concentração no sangue não é alterada por medicamentos que inibem enzimas hepáticas, como eritromicina (que é um antibiótico) ou fluconazol e itraconazol (antimicóticos) nem pelos medicamentos que ativam essas enzimas, como carbamazepina (usado no tratamento de convulsões), modafinila (medicamento usado para alguns distúrbios do sono), fenobarbital (usado no tratamento de convulsões). Não são esperadas interações entre vismodegibe e medicamentos que inibem uma proteína do corpo que transporta moléculas através da membrana celular, como o itraconazol.
Não são esperadas interações entre vismodegibe e medicamentos usados para alterar a acidez do estômago, como inibidores da bomba de prótons, por exemplo, o rabeprazol.
O uso de rosiglitazona (um medicamento antidiabético) e dos anticoncepcionais orais etinilestradiol e noretindrona não alteram a exposição a Erivedge. Não é possível descartar que o tratamento prolongado com Erivedge possa reduzir a eficácia de anticoncepcionais hormonais orais.
Dados in vitro indicam que vismodegibe é um inibidor do transportador BCRP (proteína de resistência de câncer de mama). No entanto, as concentrações in vitro, nas quais a inibição ocorreu, são maiores do que as concentrações de vismodegibe livre, quando observado em pacientes. Não é possível descartar que vismodegibe possa dar origem a um aumento da exposição de medicamentos transportados por essa proteína, como rosuvastatina, topotecana e sulfasalazina.
Administração concomitante deve ser realizada com cautela e um ajuste de dose pode ser necessário, conforme avaliação médica.
Não é possível descartar que vismodegibe possa aumentar a exposição a substratos de OATP1B1, um transportador de membrana que media a captação hepática de algumas drogas, como bosentana (medicamento para hipertensão arterial pulmonar), ezetimiba (medicamento para tratar colesterol elevado), glibenclamida (medicamento antidiabético), repaglinida (medicamento antidiabético), valsartana (medicamento para tratamento de pressão alta ou outras condições cardíacas) e estatinas (medicamento para tratar colesterol elevado). É necessário ter cautela se vismodegibe foi administrado com qualquer estatina.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
A segurança de Erivedge oi avaliada em mais de 2.300 pacientes e voluntários saudáveis em estudos clínicos. Os dados a seguir são referentes apacientes com carcinoma basocelular avançado tratados em estudos e que receberam pelo menos uma dose de Erivedge maior ou igual a 150 mg (dose habitual de Erivedge).
As reações muito comuns, que ocorreram em 10% ou mais dos pacientes que receberam Erivedge, estão resumidas na tabela a seguir:
Tabela 1 - Reações adversas muito comuns e comuns em pacientes tratados com Erivedge em estudos clínicos
|
Termo Preferido MedDRA |
Pacientes CBCa (n = 138) | |
|
Qualquer grau* (%) |
Frequência | |
|
Distúrbios gastrintestinais Náuseas |
48 (34,8%) |
Muito comum |
|
Distúrbios gerais e condições do local de administração Fadiga |
65 (47,1%) |
Muitocomum |
|
Exames complementares de diagnóstico Redução de peso |
69 (50,0%) |
Muito comum |
|
Distúrbios do metabolismo e nutrição Redução do apetite |
41 (29,7%) |
Muito comum |
|
Distúrbios musculoesqueléticos e do tecido conjuntivo Espasmos musculares (contrações fortes) Artralgia (dor nas articulações) |
103 (74,6%) |
Muito comum |
|
Distúrbios do sistema nervoso Disgeusia (alteração do paladar) |
81 (58,7%) |
Muito comum |
|
Distúrbios da pele e do tecido subcutâneo Alopecia (perda de pelos e cabelos) |
91 (65,9%) |
Muito comum |
|
Distúrbios reprodutivos e mamários Amenorreia (ausência ou sensação anormal da menstruação) |
3 (30%)** |
Muito comum |
|
Exames complementares de diagnóstico Aumento de enzimas hepáticas*** |
2 (1,4%) |
Comum |
MedDRA: Dicionário Médico para Atividades Regulatórias.
* NCI-CTCAE v3.0 (National Cancer Institute – Common Terminology Criteria for Adverse Events): critério comum de terminologia para reações adversas.
** Dos 138 pacientes com CBC avançado, 10 eram mulheres com possibilidade de engravidar. Dentre essas mulheres, observou-se amenorreia em 3 pacientes (30%).
*** O aumento de enzimas hepáticas inclui os seguintes termos preferíveis para os eventos adversos relatados: aumento de enzimas hepáticas, aumento de aspartato aminotransferase (AST), anormalidade no teste de função hepática, aumento de fosfatase alcalina no sangue, aumento de gama-glutamil transferase (GGT) e aumento de bilirrubina no sangue.
|
Exames complementares de diagnóstico Aumento de creatinofosfoquinase sérica**** |
60 (4,9%) |
Comum |
**** Baseado em um estudo de pós-aprovação com 1.215 pacientes.
Tabela 2 - Reações adversas de graus 3 e 4 em pacientes tratados com Erivedge em estudos clínicos
|
Termo Preferido MedDRA |
Pacientes CBCa (n = 138) | |
|
Grau 3* (%) |
Grau 4* (%) | |
|
Distúrbios gastrintestinais Diarreia |
3 (2,2%) |
0 |
|
Distúrbios gerais e condições do local de administração Fadiga |
8 (5,8%) |
1 (0,7%) |
|
Exames complementares de diagnóstico Redução de peso |
14 (10,1%) |
0 |
|
Distúrbios do metabolismo e nutrição Redução do apetite |
3 (2,2%) |
0 |
|
Distúrbios musculoesqueléticos e do tecido conjuntivo Espasmos musculares (contrações fortes) |
7 (5,1%) |
0 |
|
Distúrbios reprodutivos e mamários Amenorreia (ausência ou sensação anormal da menstruação) |
2 (20%)** |
0 |
* NCI-CTCAE v3.0.
** Dos 138 pacientes com CBC avançado, 10 eram mulheres com possibilidade de engravidar. Dentre essas mulheres, observou-se amenorreia grau 3 em 2 pacientes (20%).
|
Exames complementares de diagnóstico Aumento de creatinofosfoquinase sérica*** |
10 (0,8%) |
4 (0,3%) |
*** Baseado em um estudo de pós-aprovação com 1.215 pacientes.
Em geral, o perfil de segurança entre pacientes com carcinoma basocelular com metástases e localmente avançado foi compatível.
Alterações laboratoriais
Durante o uso de Erivedge, as alterações laboratoriais Grau 3 não foram comuns e não houve nenhuma alteração Grau 4 (a mais grave). Alterações laboratoriais que mudaram do valor inicial até o Grau 3 foram: redução do sódio (em 7 pacientes), redução do potássio (em 2 pacientes) e aumento da ureia (em 3 pacientes).
Experiência pós-comercialização
As seguintes reações adversas foram identificadas com a exposição à droga após a comercialização de Erivedge : Distúrbios Musculoesqueléticos e do Tecido Conjuntivo: fusão prematura das epífises.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
Composição
Cada cápsula contém:
150 mg de vismodegibe.
Excipientes: Celulose microcristalina, lactose monoidratada, laurilsulfato de sódio, povidona, amidoglicolato de sódio, talco, estearato de magnésio.
Cápsula: Óxido de ferro vermelho, dióxido de titânio, gelatina, tinta de impressão.
Superdosagem
Erivedge deve ser utilizado somente na dosagem recomendada por seu médico.
Erivedge já foi administrado em doses até 3,6 vezes superiores à dose diária recomendada, de 150 mg. Não foram observados aumentos do nível do medicamento no sangue nem aumento de toxicidade.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Drogas que Inibem ou Induzem Enzimas Metabolizadoras
A eliminação do vismodegibe envolve múltiplas vias. O vismodegibe é excretado predominantemente como fármaco inalterado. Vários metabólitos menores são produzidos por múltiplas enzimas CYP450.
Não são esperadas interações farmacocinéticas clinicamente significativas entre vismodegibe e inibidores de CYP450. Resultados do estudo clínico demonstraram que não há interação farmacocinética clinicamente significativa entre vismodegibe e fluconazol (um inibidor moderado de CYP2C9) ou itraconazol (um forte inibidor de CYP3A4) em voluntários saudáveis.
Não está previsto que indutores de CYP3A4 alterem a exposição sistêmica de vismodegibe porque concentrações plasmáticas similares de vismodegibe em estado de equilíbrio foram observadas em pacientes de estudos clínicos tratados concomitantemente com indutores de CYP3A4 (carbamazepina, modafinila, fenobarbital) e os tratados concomitantemente com inibidores de CYP3A4 (eritromicina, fluconazol).
Drogas que Inibem Sistemas de Transporte de Drogas
Não são esperadas interações farmacocinéticas clinicamente significativas entre vismodegibe e inibidores de glicoproteína-P. Resultados do estudo clínico demonstraram que não há interação farmacocinética clinicamente significativa entre vismodegibe e itraconazol (um forte inibidor de glicoproteína-P) em voluntários saudáveis.
Drogas que afetam o pH gástrico
Não são esperadas interações farmacocinéticas clinicamente significativas entre vismodegibe e agentes que aumentam o pH. Resultados do estudo clínico demonstraram que não há interação farmacocinética clinicamente significativa entre vismodegibe e rabeprazol (um inibidor de bomba de prótons) em voluntários saudáveis.
Efeitos do Vismodegibe sobre Outras Drogas
Não são esperadas interações farmacocinéticas clinicamente significativas entre vismodegibe e substratos de CYP450. Resultados do estudo de interação droga-droga conduzido em pacientes com câncer demonstraram que não há interação farmacocinética clinicamente significativa entre vismodegibe e rosiglitazona (um substrato de CYP2C8). Dessa forma, a inibição das enzimas CYP por vismodegibe pode ser excluída.
Resultados do estudo de interação droga-droga conduzido em pacientes com câncer demonstraram que não há interação farmacocinética clinicamente significativa entre vismodegibe e os contraceptivos orais etinilestradiol e noretindrona. No entanto, o estudo de interação teve apenas 7 dias de duração e não é possível descartar que o tratamento prolongado vismodegibe seja um indutor de enzimas que metabolizam contraceptivos esteroides. Esta indução pode levar a uma diminuição na exposição sistêmica do contraceptivo esteroide e, portanto, reduzir a eficácia contraceptiva.
Não são esperadas interações farmacocinéticas clinicamente significativas entre vismodegibe e substratos de BCRP (proteína de resistência de câncer de mama). Dados in vitro indicam que vismodegibe é um inibidor do transportador BCRP. No entanto, as concentrações in vitro, nas quais a inibição ocorreu, são significativamente maiores do que as concentrações de vismodegibe livre, quando observado em pacientes.
Dados de interação in vivo não estão disponíveis. Não é possível desconsiderar que vismodegibe possa originar um aumento na exposição de medicamentos transportados por essa proteína, como rosuvastatina, topotecana e sulfasalazina. Administração concomitante deve ser realizada com cautela e um ajuste de dose pode ser necessário.
In vitro, vismodegibe é um inibidor de OATP1B1. Não é possível descartar que vismodegibe possa aumentar a exposição a substratos de OATP1B1, como bosentana, ezetimiba, glibenclamida, repaglinida, valsartana e estatinas. É necessário ter cautela caso vismodegibe seja administrado em combinação com qualquer estatina.
Ação da Substância
Resultados de Eficácia
O estudo pivotal, internacional, de braço único, multicêntrico, aberto, com 2 coortes (SHH4476g) foi conduzido com 104 pacientes com carcinoma basocelular avançado (CBCa), incluindo carcinoma basocelular metastático (CBCm, n = 33) e carcinoma basocelular localmente avançado (CBCla, n = 71). CBCm foi definido como carcinoma basocelular que tivesse se disseminado além da pele para outras partes do corpo, incluindo linfonodos, pulmões, ossos e/ou órgãos internos. Pacientes com CBCla eram os que apresentavam lesões cutâneas não adequadas para cirurgia (inoperáveis, com doença com recorrências múltiplas para a qual a ressecção cirúrgica curativa fosse considerada improvável ou para os quais a cirurgia fosse resultar em deformidade substancial ou morbidade) e para os quais a radioterapia não fosse bem sucedida ou fosse contraindicada ou inapropriada.
Antes da inclusão no estudo, o diagnóstico de CBC foi confirmado por histologia. Pacientes com Síndrome de Gorlin, que apresentavam pelo menos uma lesão CBC avançada e atenderam aos critérios de inclusão, foram elegíveis para participar do estudo. Os pacientes foram tratados com uma dose diária deste medicamento 150 mg administrada por via oral.
A mediana de idade da população avaliada para eficácia foi de 62 anos para todos os pacientes, sendo que 45% deles tinham mais do que 65 anos. A maioria dos pacientes era do sexo masculino (61%) e caucasiana (100%); 32% dos pacientes apresentavam doença metastática (CBCm) e 68%, doença localmente avançada (CBCla). Para a coorte metastática, praticamente todos os pacientes haviam recebido terapias anteriores (97%), incluindo cirurgia (97%), radioterapia (58%) e terapias sistêmicas (30%). Para a coorte localmente avançada, praticamente todos os pacientes haviam sido submetidos a terapias prévias (94%), incluindo cirurgia (89%), radioterapia (27%) e terapias sistêmicas/tópicas (11%). A duração mediana de tratamento para todos os pacientes foi de 12,9 meses (intervalo de 0,7 a 47,8).
O desfecho primário foi a taxa de resposta objetiva (TRO), avaliada por um comitê independente de revisão (CIR). Os resultados da análise primária (9 meses após o recrutamento do último paciente) e do acompanhamento por mais 12 meses estão resumidos na Tabela 1.
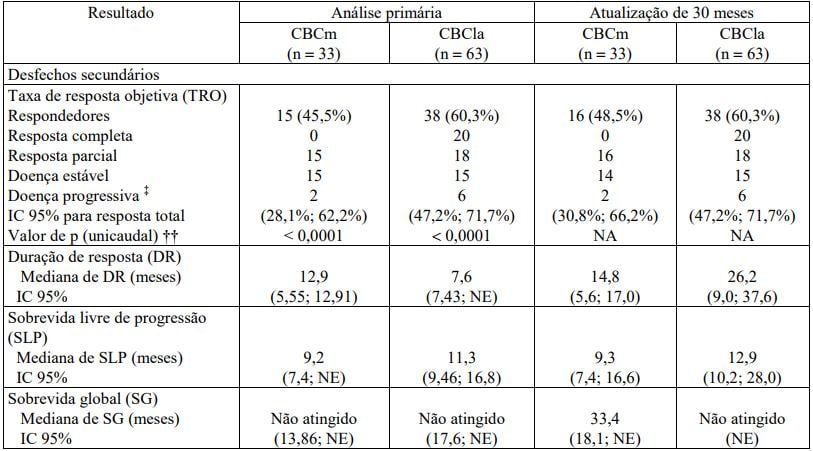
A avaliação do investigador para a TRO foi o desfecho secundário. Os resultados da análise primária (9 meses após o recrutamento do último paciente) e do acompanhamento por mais 30 meses estão resumidos na Tabela 2.
A resposta objetiva foi definida como resposta completa ou parcial, determinada em duas avaliações consecutivas, separadas por um intervalo de pelo menos 4 semanas. Na coorte CBCm, a resposta tumoral foi avaliada de acordo com os Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST), versão 1.0. Na coorte CBCla, a resposta tumoral foi avaliada com base em avaliação visual do tumor externo e ulceração, imagem tumoral (se pertinente) e biópsia do tumor.
Um paciente era considerado respondedor se pelo menos um dos seguintes critérios fosse atendido e o paciente não houvesse apresentado progressão: (1) ? 30% redução em tamanho da lesão [soma dos maiores diâmetros (SMD)], em relação ao valor inicial, em lesões alvo, por radiografia; (2) ? 30% redução em SMD em relação ao valor inicial em dimensão visível externamente de lesões alvo; (3) Resolução completa de ulceração em todas as lesões alvo.
Os desfechos secundários adicionais incluem a duração de resposta (DR), sobrevida livre de progressão (SLP), resposta histopatológica e sobrevida global (SG). Os resultados estão nas Tabelas 1 e 2.
Tabela 1 - Resumo de eficácia avaliada pelo CIR: Pacientes passíveis de avaliação para eficácia*,†
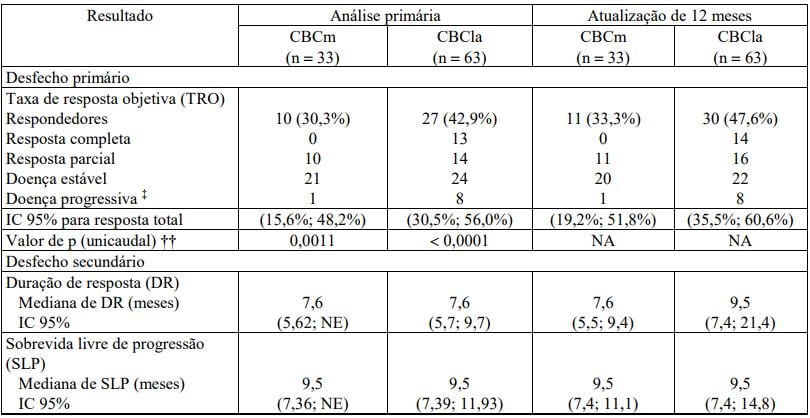
Tabela 2 - Resumo de eficácia avaliada pelo investigador: Pacientes passíveis de avaliação para eficácia*,†
NA: não se aplica.
NE: não estimável.
*População passível de avaliação para eficácia é definida como todos os pacientes incluídos que receberam qualquer quantidade da droga em estudo e para os quais a interpretação do patologista independente sobre tecido de arquivo ou biópsia do período inicial foi compatível com CBC.
† Dados não passíveis de avaliação/em branco incluíram 1 paciente CBCm e 4 CBCla.
‡ Progressão na coorte CBCla é definida como atingir qualquer um dos critérios a seguir: (1) ? 20% aumento na soma dos maiores diâmetros (SMD) em relação ao nadir em lesões alvo (por radiografia ou por dimensão externamente visível), (2) Nova ulceração de lesões alvo persistindo sem evidência de cicatrização durante pelo menos 2 semanas; (3) Novas lesões por radiografia ou exame físico; (4) Progressão de lesões não alvo por RECIST.
†† Baseado na análise primária conduzida 9 meses após o recrutamento do último paciente.
Os gráficos das Figuras 1 e 2 representam a avaliação do CIR para o acompanhamento de 12 meses através da demonstração de redução máxima no tamanho das lesões alvo para cada paciente. A maioria dos pacientes nas duas coortes apresentou redução de volume tumoral.
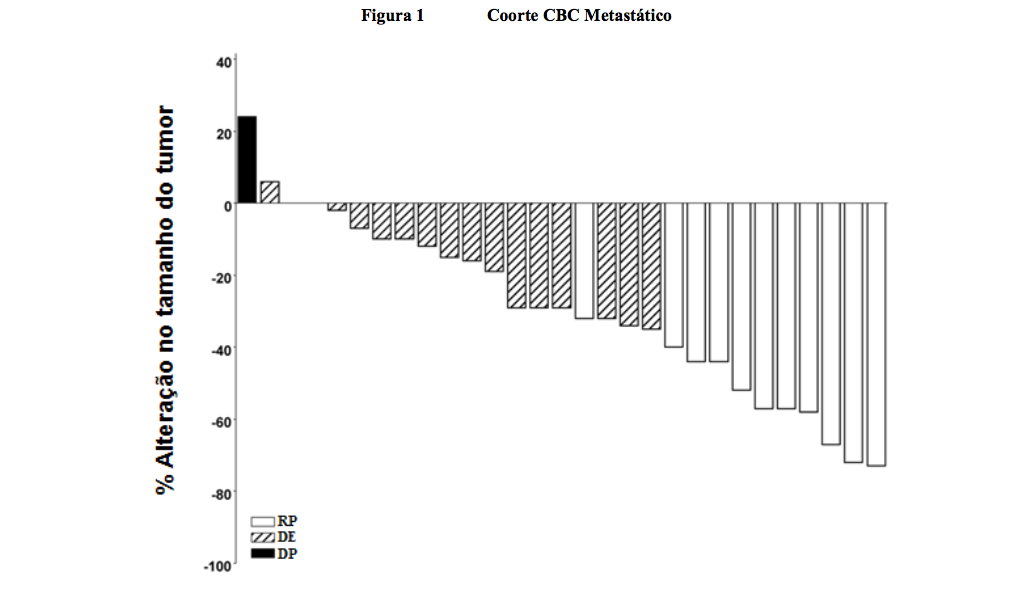
Nota: O tamanho do tumor é baseado na soma dos maiores diâmetros das lesões alvo. DP = doença progressiva, DE = doença estável, RP = resposta parcial. Três pacientes apresentaram uma melhor alteração percentual em tamanho tumoral de 0; estes são representados por barras positivas mínimas na figura. Quatro pacientes foram excluídos da figura: 3 três pacientes com doença estável foram avaliados apenas por lesões não-alvo e 1 paciente não foi passível de avaliação.
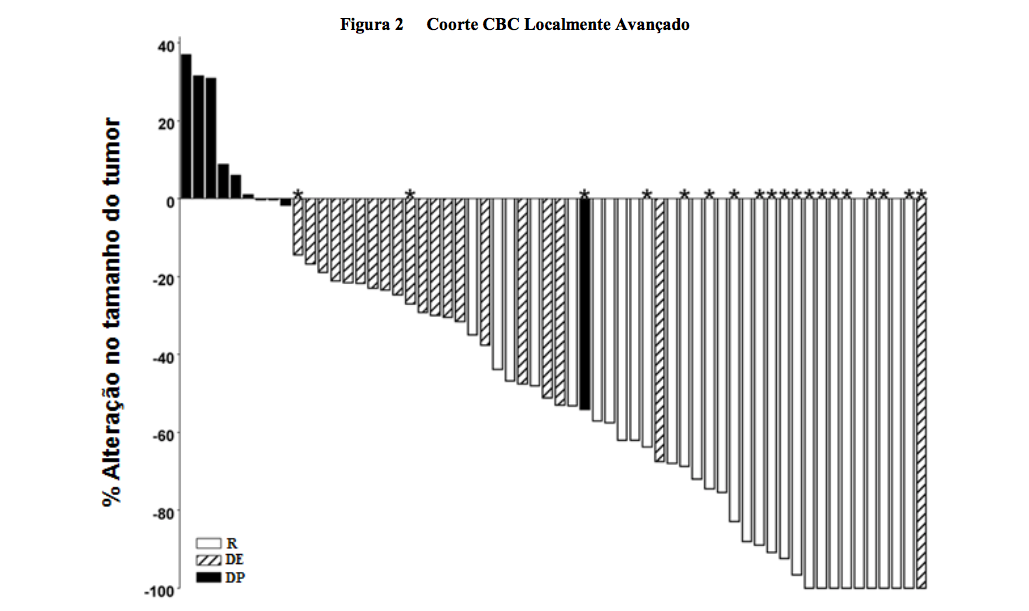
Nota: O tamanho do tumor é baseado na soma dos maiores diâmetros das lesões alvo. DP = doença progressiva, DE = doença estável, R = resposta, * = resolução completa de ulcerações. A avaliação de resposta foi baseada em um desfecho composto, definido conforme mencionado acima. Quatro pacientes não apresentavam medidas de lesão e não foram incluídos na figura.
No momento da análise primária, para CBCm, a maioria das respostas avaliadas pelo CIR (6 de 10 responsivos) ocorreu na semana 8 e respostas adicionais foram observadas em avaliações posteriores.
Para CBCla, a maioria das respostas avaliadas pelo CIR (14 de 27 responsivos) ocorreu na semana 8 e respostas adicionais foram observadas em avaliações posteriores. 54% dos pacientes CBCla (n = 63) apresentavam resposta histopatológica sem nenhuma evidência de CBC em 24 semanas.
Um estudo clínico fase II (MO25616), pós-aprovação, aberto, não comparativo e multicêntrico, foi conduzido com 1232 pacientes com carcinoma basocelular avançado (CBCa), incluindo pacientes passíveis de avaliação para eficácia e segurança com CBCla (n = 1119) ou CBCm (n = 96). CBCla foi definido como lesões cutâneas não adequadas para cirurgia (inoperáveis ou para os quais a cirurgia fosse resultar em deformidade substancial) e para os quais a radioterapia não fosse bem sucedida ou fosse contraindicada. CBCm foi definido como metástase distante, histologicamente confirmada. Antes da inclusão no estudo, o diagnóstico de CBC foi confirmado por histologia. Os pacientes foram tratados com uma dose diária deste medicamento 150mg, administrada por via oral.
A idade mediana da população avaliada foi de 72 anos para todos os pacientes. A maioria dos pacientes era do sexo masculino (57%), 8% apresentavam CBCm e 92% apresentavam CBCla. Para a coorte metastática, a maioria dos pacientes havia sido submetida a terapias prévias, incluindo cirurgia (91%), radioterapia (62%) e terapias sistêmicas (16%). Para a coorte localmente avançada, a maioria dos pacientes havia sido submetida a terapias prévias, incluindo cirurgia (85%), radioterapia (28%) e terapias sistêmicas (7%). A duração mediana de tratamento para todos os pacientes foi de 8.6 meses (intervalo de 0 a 44,1).
Entre os pacientes da população passível de avaliação para eficácia apresentando a doença mensurável e histologicamente confirmada, 68,5% e 36,9% responderam ao tratamento nas coortes CBCla e CBCm, respectivamente. Dos pacientes que apresentaram resposta confirmada (parcial ou completa), a mediana de Duração de Resposta foi de 23,0 meses (IC 95%: 20,4, 26,7) para a coorte CBCla e 13,9 meses (IC 95%: 9,2, NE ) para a coorte CBCm. Foi atingida resposta completa em 4,8% dos pacientes na coorte CBCm e 33,4% na coorte CBCla.
Características Farmacológicas
Propriedades Farmacodinâmicas
Propriedades Farmacocinéticas
Segurança Pré-Clínica
Outros
Efeitos neurológicos caracterizados como abalos ou tremores de membros ou do corpo foram observados com alta frequência em estudos de toxicidade em ratos com vismodegibe. Essas observações se resolveram completamente com a descontinuação da administração e não foram associadas com achados microscópicos. Não foi determinado se esses efeitos foram mediados central ou perifericamente; no entanto, em um estudo de auto-radiografia de corpo total em ratos, a penetração de vismodegibe nos tecidos do sistema nervoso central foi baixa. Não foram observados sinais clínicos correspondentes em cães.
Cuidados de Armazenamento
Erivedge em cápsulas duras deve ser conservado em temperatura ambiente entre 15 e 30ºC.
Mantenha o frasco bem fechado para proteger o medicamento da umidade.
Número de lote e datas de fabricação e validade: Vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Característica física
Erivedge é apresentado em cápsulas gelatinosas duras de 150mg, com um corpo róseo opaco com a inscrição “150 mg” impressa em preto e uma tampa cinzenta opaca com a inscrição “VISMO” impressa em preto, contendo 150 mg de vismodegibe.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS-1.0100.0664
Farm. Resp.:
Tatiana Tsiomis Díaz - CRF-RJ no 6942
Fabricado por:
Patheon Inc., Mississauga, Canadá
Embalado por:
F. Hoffmann-La Roche Ltd., Kaiseraugst, Suíça
Registrado, importado e distribuído no Brasil por:
Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2.020
CEP 22775-109 – Rio de Janeiro – RJ
CNPJ 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289
www.roche.com.br
Venda sob prescrição médica.
informações complementares
| Fabricante |
| ROCHE |
| Princípio ativo |
| Vismodegibe |
| Categoria do medicamento |
| Medicamentos Especiais |
