para o que é indicado e para que serve?
Para que serve Esbriet é utilizado para tratamento da fibrose pulmonar idiopática – FPI (doença que atinge os dois pulmões, caracterizada por aparecimento de fibrose, ou seja, tecido de cicatriz, que substitui o tecido pulmonar normal e provocando falta de ar).Continue lendo...
ofertas de
Esbriet 267Mg 270 Comprim...
ofertas de Esbriet 267Mg 270 Comprim...
R$ 13.290,00
R$ 14.099,20
R$ 14.100,00
R$ 14.586,70
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Esbriet é utilizado para tratamento da fibrose pulmonar idiopática – FPI (doença que atinge os dois pulmões, caracterizada por aparecimento de fibrose, ou seja, tecido de cicatriz, que substitui o tecido pulmonar normal e provocando falta de ar).
Como Esbriet funciona?
Ainda não se sabe detalhadamente como a pirfenidona funciona. Mas já se sabe que ela tem propriedades antiinflamatórias e antifibróticas e atua sobre os aspectos fibrótico crônico e inflamatório da fibrose pulmonar idiopática.
Esbriet reduz o acúmulo de células inflamatórias em resposta a vários estímulos. Também atenua a formação de fibroblastos (células de fibrose) e a produção de substâncias que promovem a inflamação.
Após a administração de uma única dose oral de 801 mg de Esbriet, a máxima concentração no sangue foi alcançada entre 30 minutos a 4 horas (tempo mediano de 0,5 hora).
Contraindicação
Você não pode tomar Esbriet se:
- Tiver alergia à pirfenidona, que é o componente ativo de Esbriet, ou a algum dos excipientes (outras substâncias contidas no medicamento);
- Histórico de angioedema devido ao uso de pirfenidona;
- Se tiver doença do fígado grave ou terminal;
- Se tiver doença do rim grave ou terminal que requer diálise;
- Se estiver fazendo uso de fluvoxamina, que é um medicamento utilizado no tratamento de depressão e de transtorno obsessivo compulsivo (TOC).
Como usar
Você deve tomar Esbriet com água, sem abrir, partir ou mastigar as cápsulas.
O ideal é que seja ingerido junto com uma refeição, para reduzir a possibilidade de náuseas e tontura aparecerem.
Posologia
Quando você for começar o tratamento, seu médico iniciará com uma dose baixa e o aumento será gradativo, até atingir a dose diária, de nove cápsulas por dia.
Dias 1 a 7:
Uma cápsula, três vezes por dia (801 mg/dia).
Dias 8 a 14:
Duas cápsulas, três vezes por dia (1602 mg/dia).
Dias 15 em diante:
Três cápsulas, três vezes por dia (2403 mg/dia).
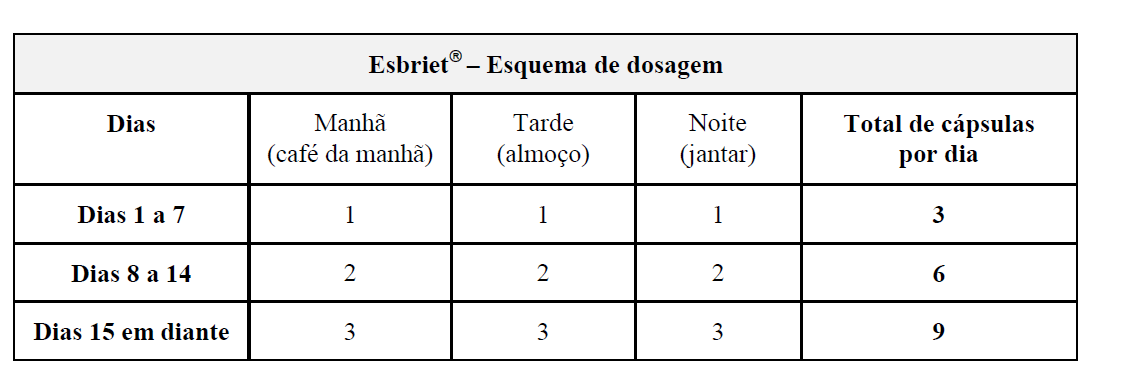
A dose diária recomendada de Esbriet para pacientes com FPI é de três cápsulas de 267 mg três vezes por dia, administradas junto com alimentos, até o total de 2403 mg/dia.
Doses acima de 2403 mg/dia não são recomendadas para nenhum paciente.
Ajustes de doses
Se você tiver intolerância ao medicamento por causa de reações adversas gastrintestinais, você deve lembrar-se de tomar Esbriet junto com alimentos. Se os sintomas continuarem, o médico poderá reduzir a dose do medicamento e depois aumentar gradualmente conforme sua tolerância.
Se mesmo assim você continuar com sintomas, pode ser necessário interromper o medicamento durante uma ou duas semanas até que os sintomas desapareçam.
Se você apresentar reação de fotossensibilidade leve a moderada, deve lembrar-se de usar o bloqueador solar diariamente e evitar a exposição ao sol. A dose de Esbriet poderá ser reduzida a critério médico. Se a erupção cutânea persistir depois de 7 dias, Esbriet deve ser interrompido durante 15 dias e depois ser introduzido gradualmente.
Se você apresentar reação de fotossensibilidade grave, deve suspender a medicação e procurar seu médico. Depois de resolvida a erupção, o médico poderá reintroduzir novamente o medicamento gradualmente.
Se você apresentar aumento significativo das enzimas hepáticas (substâncias dosadas no sangue para avaliar a função do fígado) pode ser necessário reduzir a dose, interromper a administração e verificar se você tomou algum outro medicamento que possa estar interferindo em seu tratamento. Seu médico saberá como ajustar Esbriet da melhor forma.
Se o valor dessas enzimas for mais de 5 vezes o limite superior do normal, Esbriet deverá ser descontinuado definitivamente, e você não poderá mais receber este medicamento.
Informe ao seu médico se você estiver tomando outros medicamentos, como fluvoxamina e ciprofloxacina, pois seu médico poderá precisar ajustar a dose de Esbriet.
Populações especiais
O que eu devo fazer quando eu me esquecer de usar Esbriet?
Se você esquecer de tomar uma dose de Esbriet, tome a próxima dose assim que se lembrar. Não tome duas doses ao mesmo tempo para compensar a dose esquecida.
Se você esquecer de tomar uma dose de Esbriet por 14 dias consecutivos ou mais, você deve reiniciar a terapia se submetendo ao esquema gradual da dose durante 2 semanas até a dose diária recomendada.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Alguns pacientes apresentam alterações nos exames de sangue que detectam alterações no fígado quando tomam Esbriet aspartato aminotransferase, alanina aminotransferase e bilirrubinas). Por isso, antes de começar a tomar Esbriet, você terá que fazer exames de sangue para verificar a dosagem dessas substâncias.
Depois de iniciado o tratamento, terá que refazer esses exames mensalmente nos 6 primeiros meses e depois a cada 3 meses. Se houver elevação significativa nesses exames, será preciso ajuste de dose de Esbriet ou até a sua suspensão, a critério do seu médico.
A exposição direta à luz do sol (ou mesmo bronzeamento artificial) deve ser evitada ou reduzida durante o tratamento com Esbriet.
Você deverá usar bloqueador solar eficaz diariamente, usar roupas que protejam contra a exposição solar e evitar outros medicamentos que também provoquem fotossensibilidade. Se você apresentar sintomas de fotossensibilidade (queimadura solar) ou erupções na pele, informe ao seu médico imediatamente, porque pode ser necessário interromper a medicação.
Há relatos de angioedema (alguns sérios) tais como inchaço da face, lábios e / ou língua, que podem ser associados com dificuldade em respirar ou respiração ofegante em associação com o uso de Esbriet.
Se você apresentar alguns desses sintomas, informe ao seu médico imediatamente, porque pode ser necessário interromper a medicação.
Esbriet pode causar tontura e cansaço, por isso, tenha cuidado se você precisar se envolver em atividades que requer atenção e coordenação.
Esbriet pode causar perda de peso e por isso seu médico monitorará o seu peso enquanto estiver tomando esse medicamento.
Distúrbios gastrintestinais como náusea, diarreia, dispepsia, vômito, refluxo e dor abdominal podem ocorrer com o uso de Esbriet. Se você apresentar alguns desses sintomas, informe ao seu médico imediatamente, porque pode ser necessário modificar a dose do medicamento.
Não foi feito nenhum estudo sobre a interferência no Esbriet na capacidade de dirigir ou operar máquinas. No entanto como o Esbriet pode provocar tontura e fadiga, isso poderia ter influência nessas atividades.
Portanto, recomenda-se cuidado.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Não existem dados sobre a utilização de Esbriet por gestantes. Em animais, ocorre potencial para acúmulo da substância ativa (pirfenidona) ou seus metabólitos no líquido amniótico. Em doses altas administradas a ratas prenhas, ocorreu prolongamento da gestação e diminuição da viabilidade dos fetos. Por isso, é preferível não utilizar Esbriet se você estiver grávida.
Em estudos com animais não foi identificada redução da fertilidade.
Não se sabe se o Esbriet é excretado no leite materno. Em animais, foi detectado potencial para acúmulo da substância ativa perfenidona e de seus metabólitos no leite. Como não é possível afastar um possível risco para a criança que está sendo amamentada, é preciso optar entre tomar Esbriet ou continuar com a amamentação.
A segurança e eficácia de Esbriet não foram estabelecidas em pacientes pediátricos.
Não é necessário ajuste da dose de Esbriet se você tem 65 anos de idade ou mais.
Esbriet deve ser utilizado com cautela em pacientes com insuficiência renal leve a moderada. Este medicamento não foi estudado em pessoas com insuficiência renal grave ou terminal que necessitam de diálise. Por isso, Esbriet não deve ser administrado a pessoas nessas condições.
Como os níveis deste medicamento podem aumentar em algumas pessoas com insuficiência hepática (comprometimento da função do fígado), é necessário monitorar por meio de exames de sangue. Esbriet não foi estudado em pessoas com insuficiência hepática grave ou doença hepática terminal e não deve ser administrado a pessoas nessas condições.
Até o momento, não há informações de que a pirfenidona possa causar doping. Em caso de dúvida, consulte o seu médico.
A pirfenidona, substância ativa de Esbriet, é transformada no fígado, por meio de algumas enzimas, para depois ser eliminada. Substâncias que alteram essas enzimas podem modificar a concentração de Esbriet no sangue e aumentar a chance de reações adversas ou diminuir o efeito do medicamento.
A fluvoxamina inibe a principal enzima transformadora de Esbriet. Por isso, há um acúmulo de 4 x na concentração de Esbriet. Dessa forma, é contraindicado tomar esses dois medicamentos concomitantemente. Para alguns outros medicamentos, o acúmulo não é tão grande, e o medicamento até pode ser administrado, mas a dose de Esbriet tem que ser reduzida. É o caso do ciprofloxacino, um antibiótico usado para infecções urinárias e outras infecções.
Informe sempre ao seu médico se estiver tomando qualquer tipo de medicamento.
Você precisa parar de fumar antes do tratamento com Esbriet. O fumo acelera a enzima que metaboliza Esbriet e reduz o efeito deste medicamento. O omeprazol (usado para problemas gástricos) e a rifampicina (antibiótico usado no tratamento de tuberculose) podem reduzir também os níveis de Esbriet no sangue e, consequentemente, o seu efeito terapêutico.
Por isso, o uso desses medicamentos deve ser interrompido sempre que possível.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
As informações sobre as reações adversas são baseadas na experiência em pacientes tratados em estudos clínicos (623 pacientes).
Infecções e infestações
Distúrbios do metabolismo e da nutrição
Distúrbios psiquiátricos
Muito comum:
Insônia.
Distúrbios do sistema nervoso
Distúrbios vasculares
Distúrbios respiratórios, torácicos e mediastinos
Distúrbios gastrintestinais
Distúrbios Hepatobiliares
Distúrbios da pele e tecido subcutâneo
Distúrbios músculo-esqueléticos e do tecido conectivo:
Distúrbios gerais e condições do local de administração
Dano por envenenamento e complicações de procedimento
Pós-comercialização
Além das reações adversas identificadas a partir de estudos clínicos, as seguintes reações adversas foram identificada durante o uso pós-aprovação de pirfenidona. Como essas reações podem ser reportadas voluntariamente a partir de uma população de tamanho incerto, nem sempre é possível estimar confiavelmente sua frequência.
Composição
Cada cápsula gelatinosa contém:
267 mg de pirfenidona.
Excipientes: Croscarmelose sódica, celulose microcristalina, povidona, estearato de magnésio e água purificada.
Cápsula: Dióxido de titânio e gelatina.
Superdosagem
Ainda não se tem muita informação sobre o que ocorre em uma ingestão maior que a recomendada de Esbriet.
Alguns voluntários adultos receberam doses totais de até 4806 mg por dia (6 cápsulas, 3 vezes ao dia). As reações foram leves, passageiras e compatíveis com as reações adversas mais frequentes de Esbriet.
Em caso de suspeita de overdose, assistência médica deve ser fornecida, incluindo o monitoramento dos sinais vitais e acompanhamento de perto do seu estado clínico.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
A Pirfenidona (substância ativa) é metabolizada principalmente através de CYP1A2, com mínimas contribuições de outras isoenzimas CYP, incluindo CYP2C9, 2C19, 2D6 e 2E1.
Fluvoxamina e inibidores da CYP1A2
Em um estudo Fase 1, a coadministração de Pirfenidona (substância ativa) e fluvoxamina (um potente inibidor de CYP1A2 com efeitos inibitórios sobre outras isoenzimas CYP [CYP2C9, 2C19 e 2D6]) resultou em um aumento de 4 vezes na exposição a Pirfenidona (substância ativa) em não fumantes.
Pirfenidona (substância ativa) é contraindicado em pacientes em uso concomitante de fluvoxamina. A fluvoxamina deve ser descontinuada antes do início da terapia com Pirfenidona (substância ativa) e evitada durante o tratamento, devido à depuração reduzida da Pirfenidona (substância ativa).
Extrapolações in vitro e in vivo indicam que inibidores potentes e seletivos de CYP1A2 têm o potencial para aumentar a exposição a Pirfenidona (substância ativa) em aproximadamente 2 a 4 vezes. Se o uso concomitante de Pirfenidona (substância ativa) com um inibidor potente e seletivo de CYP1A2 não puder ser evitado, a dose de Pirfenidona (substância ativa) deve ser reduzida para 801 mg por dia (uma cápsula, três vezes por dia). Os pacientes devem ser monitorados com cuidado em relação à emergência de reações adversas associadas com a terapia de Pirfenidona (substância ativa). Descontinue Pirfenidona (substância ativa), se necessário.
A coadministração de Pirfenidona (substância ativa) e ciprofloxacino 750 mg (inibidor moderado e seletivo de CYP1A2) aumentou a exposição a Pirfenidona (substância ativa) em 81%. Se o uso de ciprofloxacino 750 mg duas vezes por dia não puder ser evitado, a dose de Pirfenidona (substância ativa) deve ser reduzida para 1602 mg por dia (duas cápsulas, três vezes por dia). Pirfenidona (substância ativa) deve ser usado com cautela quando o ciprofloxacino for utilizado em dose de 250 mg ou 500 mg, uma ou duas vezes por dia.
Pirfenidona (substância ativa) deve ser utilizado com cautela em pacientes tratados com outros inibidores moderados de CYP1A2.
Agentes ou combinações de agentes que sejam inibidores moderados ou potentes de CYP1A2 e também uma ou mais das outras isoenzimas CYP envolvidas no metabolismo da Pirfenidona (substância ativa) (CYP2C9, 2C19, 2D6 e 2E1) devem ser evitadas durante o tratamento com Pirfenidona (substância ativa).
Uso de cigarro e indutores de CYP1A2
Um estudo Fase 1 de interação avaliou o efeito do cigarro (indutor CYP1A2) sobre a farmacocinética de Pirfenidona (substância ativa). A exposição a Pirfenidona (substância ativa) em tabagistas foi 50% da observada em não fumantes. O tabagismo tem o potencial para induzir a produção de enzimas hepáticas e por isso aumenta a depuração e reduz a exposição ao Pirfenidona (substância ativa). O uso concomitante de indutores potentes de CYP1A2, incluindo o fumo, deve ser evitado durante a terapia com Pirfenidona (substância ativa) com base na relação observada entre o uso de cigarro e seu potencial para induzir CYP1A2. Os pacientes devem ser estimulados a descontinuar o uso de indutores potentes de CYP1A2 e interromper o tabagismo antes e durante o tratamento com Pirfenidona (substância ativa).
No caso de indutores moderados de CYP1A2 (p.ex., omeprazol), o uso concomitante pode teoricamente resultar em redução dos níveis plasmáticos de Pirfenidona (substância ativa).
A coadministração de medicamentos que atuem como indutores potenciais tanto de CYP1A2 quanto de outras isoenzimas CYP envolvidas no metabolismo da Pirfenidona (substância ativa) (p.ex., rifampicina) pode resultar em redução significativa dos níveis plasmáticos de Pirfenidona (substância ativa). Esses medicamentos devem ser evitados sempre que possível.
Ação da Substância
Resultados de eficácia
A eficácia clínica de Pirfenidona (substância ativa) foi estudada em três estudos multinacionais, Fase 3, multicêntricos, randomizados, duplo-cegos, controlados por placebo em pacientes com FPI.
O PIPF-004 e o PIPF-006 compararam o tratamento com Pirfenidona (substância ativa) 2403 mg/dia com placebo.
Os critérios de inclusão do estudo foram
- Capacidade predita de CVF ? 50%;
- Capacidade predita de difusão de DLCO ? 35%;
- Porcentagem da capacidade predita de CVF ou porcentagem da capacidade predita de difusão DLCO ? 90%;
- Tempo desde o diagnóstico ? 48 meses;
- VEF1 /CVF ? 0,7 e teste de caminhada de 6 minutos (TC6) ? 150 m (e saturação do oxigênio ?83% com suplementação de oxigênio ?6 L/minuto durante o teste de caminhada de 6 minutos no processo de titulação do oxigênio na triagem dos pacientes.
Os estudos foram praticamente idênticos no desenho, com poucas exceções, incluindo um grupo com dose intermediária (1197 mg/dia) no PIPF-004. Nos dois estudos, o tratamento foi administrado três vezes por dia durante 72 semanas, no mínimo. O desfecho primário nos dois estudos foi a alteração em percentual de Capacidade Vital Forçada (CVF) prevista entre o período basal e a Semana 72.
No estudo PIPF-004, o declínio percentual previsto de CVF entre o período basal e a Semana 72 de tratamento foi significativamente reduzido em pacientes que receberam Pirfenidona (substância ativa) (N = 174) em comparação com pacientes recebendo placebo (N = 174; p = 0,001, classificação ANCOVA). O tratamento com Pirfenidona (substância ativa) também reduziu significativamente o declínio percentual previsto de CVF entre o período basal e as Semanas 24 (p = 0,014), 36 (p < 0,001), 48 (p < 0,001) e 60 (p < 0,001). Na Semana 72, um declínio percentual previsto de CVF ? 10% a partir do valor basal (um limiar indicativo do risco de mortalidade em FPI) foi observado em 20% dos pacientes que receberam Pirfenidona (substância ativa) em comparação com 35% dos que receberam placebo (Tabela 1).
Tabela 1: Avaliação por Categorias de Alteração entre o valor Basal e a Semana 72 em Percentual Previsto de CVF no Estudo PIPF-004
| Pirfenidona (substância ativa) 2403 mg/dia (N = 174) |
Placebo (N = 174) | |
|
Declínio > 10% ou óbito ou transplante de pulmão | 35 (20%) |
60 (34%) |
|
Declínio menor do que 10% | 97 (56%) |
90 (52%) |
|
Sem declínio (alteração de CVF > 0%) | 42 (24%) |
24 (14%) |
Embora não exista nenhuma diferença na alteração da distância caminhada durante um teste de caminhada de seis minutos (TC6) entre pacientes recebendo Pirfenidona (substância ativa) em comparação com placebo entre o valor basal e a Semana 72 pela classificação predeterminada de ANCOVA, em uma análise ad hoc 37% dos pacientes recebendo Pirfenidona (substância ativa) apresentaram um declínio de ? 50 m em distância TC6 em comparação com 47% dos pacientes que receberam placebo no PIPF-004.
No estudo PIPF-006, o tratamento com Pirfenidona (substância ativa) (N = 171) não reduziu o declínio percentual previsto de CVF entre o período basal e a Semana 72, em comparação com o placebo (N = 173; p = 0,501). No entanto, o tratamento com Pirfenidona (substância ativa) reduziu o declínio percentual previsto de CVF entre o valor basal e as Semanas 24 (p < 0,001), 36 (p = 0,011) e 48 (p = 0,005). Na Semana 72, um declínio ? 10% de CVF foi observado em 23% dos pacientes que receberam Pirfenidona (substância ativa) e 27% dos que receberam placebo (Tabela 2).
Tabela 2: Avaliação por Categoria de Alteração entre o Valor Basal e a Semana 72 em Percentual Previsto de CVF no Estudo PIPF-006
| Pirfenidona (substância ativa) 2403 mg/dia (N = 171) |
Placebo (N = 173) | |
|
Declínio > 10% ou óbito ou transplante de pulmão | 39 (23%) |
46 (27%) |
|
Declínio menor do que 10% | 88 (52%) |
89 (51%) |
|
Sem declínio (alteração de CVF > 0%) | 44 (26%) |
38 (22%) |
O declínio na distância TC6 entre o valor basal e a Semana 72 foi significativamente reduzido em comparação com o placebo no estudo PIPF-006 (p < 0,001, classificação ANCOVA). Além disso, em uma análise ad hoc, 33% dos pacientes que receberam Pirfenidona (substância ativa) apresentaram um declínio ? 50 m em distância TC6 em comparação com 47% dos pacientes recebendo placebo no PIPF-016.
Em uma análise agrupada de sobrevida no PIPF-004 e no PIPF-006, a taxa de mortalidade no grupo com Pirfenidona (substância ativa) 2403 mg/dia foi de 7,8% em comparação com 9,8% com placebo (HR 0,77 [IC 95%, 0,47-1,28]).
O estudo PIPF-016 comparou o tratamento com Pirfenidona (substância ativa) 2403 mg/dia com placebo. Os critérios de inclusão do estudo foram: porcentagem da capacidade predita de CVF ? 50% e ? 90%; porcentagem da capacidade predita de difusão DLCO ? 30% e ? 90%; tempo desde o diagnóstico ? 6 e ? 48 meses; VEF1 /CVF ? 0,8 e teste de caminhada de 6 minutos (TC6) ? 150 m. O tratamento foi administrado três vezes por dia diariamente durante 52 semanas. O desfecho primário foi a alteração em percentual previsto de CVF entre o valor basal e a Semana 52.
No estudo PIPF-016, o declínio em percentual previsto de CVF entre o valor basal e a Semana 52 de tratamento foi significativamente reduzido em pacientes que receberam Pirfenidona (substância ativa) (N = 278) em comparação com pacientes que receberam placebo (N = 277; p < 0,000001, classificação ANCOVA). O tratamento com Pirfenidona (substância ativa) também reduziu significativamente o declínio em percentual previsto de CVF entre o valor basal e as Semanas 13 (p < 0,000001), 26 (p < 0,000001) e 39 (p = 0,000002). Na Semana 52, foi observado declínio em relação ao valor basal em CVF percentual previsto ? 10% ou óbito em 17% dos pacientes que receberam Pirfenidona (substância ativa) em comparação com 32% dos que receberam placebo (Tabela 3)
Tabela 3: Avaliação por Categoria de Alteração entre o Valor Basal e a Semana 52 em Percentual Previsto de CVF no Estudo PIPF-016
| Pirfenidona (substância ativa) 2403 mg/dia (N = 278) |
Placebo (N = 277) | |
|
Declínio > 10% ou óbito ou transplante de pulmão |
46 (17%) |
88 (32%) |
|
Declínio menor do que 10% |
169 (61%) |
162 (58%) |
|
Sem declínio (alteração de CVF > 0%) |
63 (23%) |
27 (10%) |
O declínio em distância caminhada durante um TC6 entre o valor basal e a Semana 52 foi significativamente reduzido em pacientes que receberam Pirfenidona (substância ativa) em comparação com pacientes que receberam placebo no estudo PIPF-016 (p = 0,036, classificação ANCOVA); 26% dos pacientes que receberam Pirfenidona (substância ativa) apresentaram uma redução ? 50 m na distância TC6 em comparação com 36% dos pacientes recebendo placebo.
Características farmacológicas
Propriedades Farmacodinâmicas
Propriedades Farmacocinéticas
Farmacocinética em Populações Especiais
Segurança Pré-Clínica
Dados não clínicos não revelam nenhum risco especial para o ser humano com base em estudos convencionais de segurança farmacológica, toxicidade com doses repetidas, genotoxicidade e potencial carcinogênico.
Cuidados de Armazenamento
Esbriet cápsulas duras deve ser conservado em temperatura ambiente (entre 15 e 30°C).
Número de lote e datas de fabricação e validade: Vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto, e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Caracterísitica física
As cápsulas de Esbriet apresentam coloração branca, com a inscrição “PFD 267 mg”.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS-1.0100.0663
Farm. Resp.:
Tatiana Tsiomis Díaz - CRF-RJ nº 6942
Fabricado por:
Catalent Pharma Solutions, LLC - Winchester, Estados Unidos
Embalado por:
Packaging Coordinators Inc. - Filadélfia, Estados Unidos ou
AndersonBrecon (UK) Limited – Hay-on-Wye, Reino Unido
Importado por:
Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2020 CEP 22775-109 – Rio de Janeiro – RJ
CNPJ 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289
www.roche.com.br
Venda sob prescrição médica.
informações complementares
| Fabricante |
| ROCHE |
| Princípio ativo |
| Pirfenidona |
| Categoria do medicamento |
| Medicamentos Especiais |
