para o que é indicado e para que serve?
Para que serve Kadcyla foi desenvolvido para ser utilizado sozinho no tratamento de câncer de mama com receptores positivos para proteína HER2, quando existem metástases ou é avançado sem indicação de cirurgia.Continue lendo...
ofertas de
Kadcyla 160Mg
ofertas de Kadcyla 160Mg
R$ 12.988,00
R$ 15.300,00
R$ 15.849,60
R$ 15.870,00
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Kadcyla foi desenvolvido para ser utilizado sozinho no tratamento de câncer de mama com receptores positivos para proteína HER2, quando existem metástases ou é avançado sem indicação de cirurgia. Além disso, para receber este medicamento, você deve ter recebido antes tratamento com trastuzumabe e um taxano (que são outros medicamentos contra o câncer).
Como Kadcyla funciona?
Kadcyla é um medicamento que resulta da conjugação (associação) de trastuzumabe, um anticorpo (imunoglobulina que imita a IgG humana) contra a proteína HER2, com a entansina (DM1), um fármaco que inibe uma proteína fundamental para a multiplicação das células.
O anticorpo e o fármaco são ligados por um ligante que serve para limitar a liberação do conjugado para o resto do corpo, aumentando e direcionando a ação de DM1 nas células-alvo. Kadcyla tem os mecanismos de ação de trastuzumabe e de DM1.
Contraindicação
Não utilize Kadcyla se você tiver hipersensibilidade (alergia) a trastuzumabe entansina ou aos demais componentes da fórmula deste produto.
Como usar
Para evitar erros de medicação, é importante verificar os rótulos do frasco-ampola, para garantir que a droga que está sendo preparada e aplicada é Kadcyla (trastuzumabe entansina) e não trastuzumabe.
Kadcyla deve ser aplicado sob a supervisão de um profissional de saúde com experiência no tratamento de pacientes com câncer.
Pacientes tratados com Kadcyla devem apresentar tumor positivo para HER2, definido como um escore de 3+ por imuno-histoquímica (IHQ) ou uma razão > 2,0 por hibridização in situ (HIS) avaliados por teste validado.
Kadcyla precisa ser aplicado com técnica asséptica. Devem ser usados os procedimentos adequados para preparação de quimioterápicos.
O profissional da saúde saberá como preparar o medicamento.
Kadcyla precisa ser reconstituído e diluído por um profissional de saúde e administrado em infusão intravenosa (na veia). Não pode ser aplicado em injeção intravenosa direta ou em bolus.
Posologia
A dose recomendada de Kadcyla é de 3,6 mg/kg de peso, administrados em infusão intravenosa, a cada 3 semanas (ciclos de 21 dias), até a progressão da doença ou até que apareça uma toxicidade inaceitável.
A dose inicial é aplicada em infusão intravenosa durante 90 minutos.
Você precisará permanecer em observação durante a infusão e, por pelo menos, 90 minutos depois da dose inicial, para verificar se aparecem febre, calafrios ou outras reações relacionadas à infusão. O local onde o medicamento foi aplicado também deve ser examinado cuidadosamente, para verificar se houve infiltrado durante a infusão.
Se as primeiras infusões forem bem toleradas, as doses subsequentes de Kadcyla podem ser aplicadas em infusões durante 30 minutos, e você permanecerá em observação durante o tempo de infusão e, por pelo menos, 30 minutos depois do seu término.
A velocidade de infusão de Kadcyla deve ser diminuída ou a infusão deve ser interrompida, se você desenvolver sintomas relacionados à infusão. Se houver uma reação muito grave, Kadcyla precisará ser interrompido.
A dose máxima de Kadcyla a ser administrada é 3,6 mg/kg a cada 3 semanas. O medicamento não deve ser administrado em doses maiores que essa quantidade.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Modificações de dose:
Para o manejo dos eventos adversos que apresentem sintomas clínicos, pode ser necessário, temporariamente, interromper o tratamento com Kadcyla, reduzir a dose ou descontinuar o tratamento. Seu médico avaliará seu caso e o orientará sobre as modificações de dose.
A dose de Kadcyla não deve ser aumentada depois de ter sido feita uma redução da dose.
Orientações de dose para populações especiais:
O que devo fazer quando eu me esquecer de usar Kadcyla?
Se uma dose programada for perdida, esta deve ser administrada o mais brevemente possível: não aguarde até o próximo ciclo planejado. O esquema de administração deve ser ajustado para manter um intervalo de 3 semanas entre as doses. A velocidade de infusão pode ser a velocidade tolerada durante a última infusão.
Seu médico saberá quando deve ser aplicada a próxima dose de trastuzumabe entansina.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Antes de iniciar o tratamento com Kadcyla, é preciso confirmar que este medicamento é adequado ao seu caso, ou seja, confirmar que o tumor é HER2-positivo, o que pode ser feito por meio de exames que detectam a expressão exagerada da proteína HER2 ou por meio de amplificação genética.
Toxicidade pulmonar:
Em estudos clínicos com Kadcyla, foram encontrados casos de pneumopatia intersticial, que são alterações no tecido do pulmão que fica entre os alvéolos, ou pneumonite, que é inflamação do tecido pulmonar.
Alguns desses casos evoluíram de forma grave e até mesmo fatal.
Os sinais e sintomas podem ser falta de ar, tosse, fadiga e alterações pulmonares (infiltrados) na radiografia de tórax. Em casos de alterações desse tipo, Kadcyla precisa ser suspenso. Se você já tem falta de ar, mesmo quando está em repouso, por causa de complicações da sua doença ou de outras doenças, você pode ter maior risco de desenvolver toxicidade pulmonar provocado por Kadcyla.
Hepatotoxicidade:
As alterações do fígado podem aparecer principalmente na forma de aumentos de transaminases (enzimas produzidas pelo fígado) em exames de sangue, sem que apareçam sintomas. Em geral, esses aumentos foram transitórios e o fígado recupera-se quando o medicamento é suspenso.
Seu médico solicitará exames para controle das enzimas do fígado antes do início do tratamento e a cada dose de Kadcyla e poderá reduzir a dose ou mesmo suspender a medicação, de acordo com os níveis encontrados. Alterações graves nas funções do fígado, incluindo algumas fatais por causa lesões no fígado induzidas por medicamentos, e a hiperplasia nodular regenerativa (uma condição rara do fígado), foram observadas em pacientes tratados com Kadcyla em estudos clínicos.
A hiperplasia nodular regenerativa, caracterizada por uma transformação disseminada benigna do tecido do fígado em pequenos nódulos, pode levar à hipertensão portal (aumento de pressão na veia porta) sem cirrose.
O diagnóstico só pode ser feito por meio de biópsia (quando se retira uma pequena amostra do fígado através de uma agulha para exame no microscópio), e há suspeita quando o paciente apresenta sinais e sintomas de aumento da pressão da veia porta e/ou cirrose do tipo padrão observada na tomografia computadorizada (TC) do fígado, mas não outras manifestações de cirrose conjuntamente, nem alteração nas transaminases.
Nesses casos, o tratamento com Kadcyla precisa ser encerrado definitivamente.
Disfunção do ventrículo esquerdo:
O tratamento com Kadcyla aumenta o risco de desenvolver mau funcionamento do ventrículo esquerdo do coração. Quando o funcionamento fica muito prejudicado, existe o risco de aparecer insuficiência cardíaca congestiva.
Por isso, seu médico vai solicitar provas de função cardíaca como o ecocardiograma, com verificação da fração de ejeção de ventrículo esquerdo antes do início do tratamento e em intervalos regulares. Se houver alterações, serão seguidas as orientações para modificação da dose ou mesmo suspensão definitiva de Kadcyla.
Reações relacionadas à infusão:
Não foi estudado tratamento com Kadcyla em pacientes que precisaram suspender o tratamento anterior com trastuzumabe, devido às reações relacionadas à infusão, e não se recomenda iniciar o tratamento com Kadcyla nesses pacientes.
As reações relacionadas à infusão de Kadcyla são caracterizadas por um ou mais dos seguintes sintomas: rubor, calafrios, febre, falta de ar, queda da pressão arterial, chiado no peito, espasmo dos brônquios e pulso acelerado.
Em geral, esses sintomas não são intensos. Na maioria dos casos, as reações desaparecem depois de algumas horas ou dias depois da infusão. Se ocorrer reação grave, o tratamento com Kadcyla deve ser interrompido. Se a reação for potencialmente fatal, o tratamento deverá ser descontinuado definitivamente.
Reações de hipersensibilidade (alergia):
Você deverá permanecer em observação, especialmente durante a primeira infusão. Como foram observadas reações de alergia ou anafilaxia graves, medicamentos para tratar essas situações e também equipamento de emergência devem estar disponíveis para uso imediato.
Hemorragia:
Casos de eventos hemorrágicos foram reportados com Kadcyla. Alguns desses eventos hemorrágicos resultaram em óbito. Em alguns dos casos, os pacientes também estavam recebendo terapia anticoagulante ou tinham trombocitopenia (redução do número de plaquetas), em outros não havia fatores de risco adicionais conhecidos. Informe seu médico caso esteja fazendo uso de alguma dessas terapias.
Trombocitopenia:
A redução do número de plaquetas, também chamada de plaquetopenia ou trombocitopenia, foi descrita em estudos clínicos de Kadcyla.
A maioria dos pacientes ficou com plaquetas > 50.000/mm3, sendo que o mínimo ocorreu em torno do Dia 8 de tratamento e, geralmente, houve melhora a partir da dose seguinte. Por isso, seu médico solicitará exame de contagem de plaquetas antes de cada aplicação de Kadcyla.
Se as plaquetas caírem abaixo de 50.000/mm3, Kadcyla não será aplicado até que se recuperem para > 75.000/mm3. Kadcyla não foi estudado em pacientes que já tinham plaquetas < 100.000/mm3 antes do tratamento. Em caso de redução no número de plaquetas, serão seguidas as orientações para modificação da dose ou mesmo suspensão definitiva de Kadcyla.
Neurotoxicidade:
Foi reportada neuropatia periférica (alteração dos nervos das extremidades), principalmente leve e com mais sintomas de alteração de sensibilidade que de intensidade. Se ela for intensa, o tratamento com Kadcyla deve ser descontinuado temporariamente até que os sintomas melhorem ou desapareçam.
Extravasamento:
Em estudos clínicos com Kadcyla, foram observadas reações por extravasamento (quando uma parte do medicamento sai da veia e atinge os tecidos vizinhos). Essas reações foram geralmente leves, com vermelhidão, dolorimento, irritação da pele, dor ou inchaço no local da infusão. Essas reações foram observadas mais frequentemente dentro de 24 horas da infusão. O local da infusão deve ser monitorado cuidadosamente para verificar se está havendo infiltração durante a aplicação.
Capacidade para dirigir veículos e operar máquinas:
Estudos sobre os efeitos na capacidade de dirigir veículos e operar máquinas não foram realizados.
Gravidez e lactação:
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Kadcyla não deve ser usado durante a gravidez, porque pode provocar lesões ou mesmo o óbito do feto. Se você tem possibilidade de engravidar, deverá ser orientada sobre a melhor forma de evitar a gravidez enquanto estiver recebendo o tratamento com Kadcyla e até sete meses depois de terminado o tratamento.
Se você ficar grávida enquanto estiver recebendo Kadcyla, informe seu médico imediatamente. Se apesar de estar grávida você precisou receber Kadcyla, deverá ter acompanhamento especial, com profissionais de diversas áreas, para oferecer o melhor suporte ao seu caso.
Kadcyla não deve ser usado durante a amamentação, porque pode provocar reações graves à criança. Você precisa parar de amamentar antes de receber tratamento com Kadcyla. Se você já terminou o tratamento com Kadcyla há sete meses ou mais, pode amamentar normalmente, sem risco para a criança.
Uso pediátrico e em idosos:
A segurança e a eficácia de Kadcyla não foram estabelecidas em crianças abaixo de 18 anos, e os dados são insuficientes em pacientes com 75 anos ou mais.
Insuficiência dos rins:
A farmacocinética de Kadcyla em pacientes com comprometimento leve ou moderado do funcionamento dos rins foi similar à de pacientes com função normal dos rins. Dados em pacientes com comprometimento grave do funcionamento dos rins são limitados e, portanto, nenhuma recomendação de dose pode ser feita.
Insuficiência do fígado:
A farmacocinética de Kadcyla em pacientes com comprometimento leve ou moderado do funcionamento do fígado foi similar à de pacientes com função normal do fígado. Kadcyla não foi estudado em pacientes com comprometimento grave do funcionamento do fígado.
Atenção diabéticos: contém açúcar.
Até o momento, não há informações de que Kadcyla (trastuzumabe entansina) possa provocar doping. Em caso de dúvida, consulte o seu médico.
Interações medicamentosas:
Não foram feitos estudos formais em seres humanos de interação medicamentosa com Kadcyla. Os estudos feitos em laboratório sugerem que um dos componentes de Kadcyla, o DM1, é metabolizado principalmente pelas enzimas CYP3A4 e CYP3A5 e não induz nem inibe o metabolismo por P450 in vitro.
Essas enzimas do fígado são as mais importantes para eliminar diversos fármacos do organismo e, como o DM1 será metabolizado principalmente por uma delas, a enzima CYP3A, é preciso tomar cuidado quando for administrado com medicamentos que inibem de forma potente a CYP3A.
A substituição de Kadcyla por qualquer outro medicamento biológico exige o consentimento do médico prescritor.
Seu médico avaliará as possíveis interações entre Kadcyla e outros medicamentos que você utiliza.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
A segurança de Kadcyla foi avaliada em mais de 1.871 pacientes em estudos clínicos. A Tabela 1 resume as reações adversas à droga (RADs) que foram reportadas em associação com o uso de Kadcyla nos estudos clínicos.
Na tabela, foram usadas as seguintes categorias de frequência: reações muito comuns (ocorrem em 10% dos pacientes que utilizam este medicamento), reações comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento), reações incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento).
Tabela 1 Resumo de RADs ocorrendo em pacientes tratados com Kadcyla
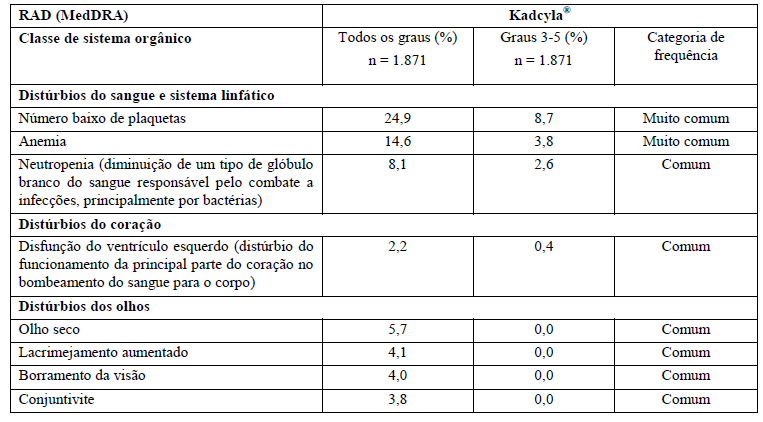
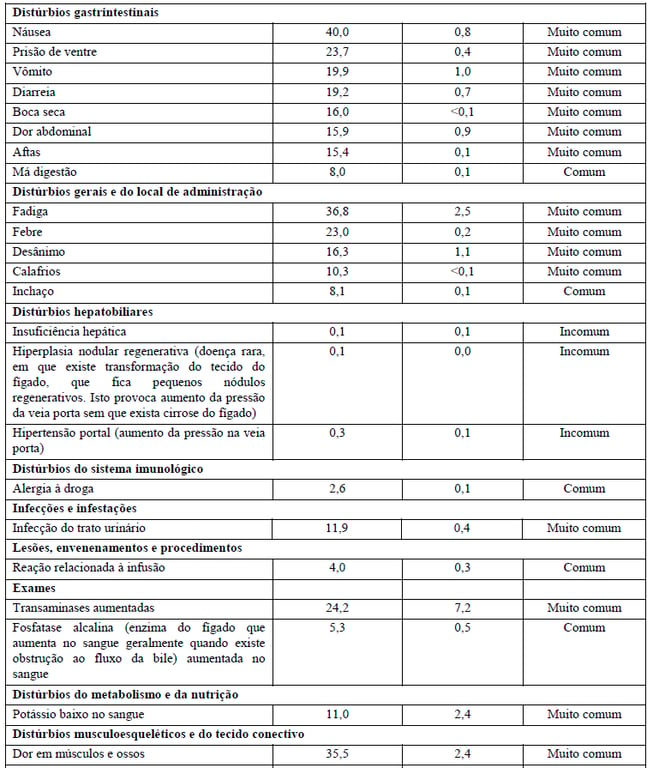
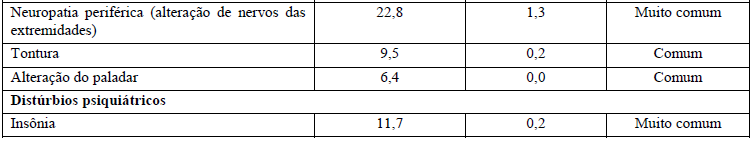
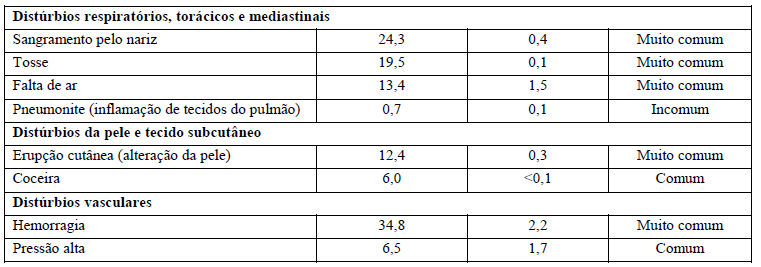
Alterações laboratoriais dos pacientes no estudo clínico TDM4370g/BO21977:
As alterações em exames laboratoriais encontradas no estudo clínico referem-se a alterações do figado (bilirrubina e transaminases aumentadas), de células sanguíneas (número baixo de plaquetas, hemoglobina e neutrófilos) e potássio diminuído. Seu médico avaliará as possíveis alterações laboratoriais.
Atenção: Este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
Composição
Cada frasco-ampola de uso único contém 100 mg:
Pó liofilizado de trastuzumabe entansina para solução injetável, destinado a veicular 5 mL (20 mg/mL).
Cada frasco-ampola de uso único contém 160 mg:
Pó liofilizado de trastuzumabe entansina para solução injetável, destinado a veicular 8 mL (20 mg/mL).
Excipientes: Sacarose, ácido succínico, hidróxido de sódio e polissorbato 20.
Superdosagem
Não existe um antídoto conhecido para uma dose excessiva de trastuzumabe entansina. Em caso de superdose, o monitoramento precisará ser rigoroso. Foram reportados casos de superdose em tratamento com trastuzumabe entansina, a maioria associada à redução do número de plaquetas, e houve um óbito.
No caso fatal, o paciente recebeu trastuzumabe entansina de forma incorreta na dose de 6 mg/kg, e morreu aproximadamente 3 semanas depois do ocorrido. A causa do óbito e a existência de relação com Kadcyla não foram estabelecidas.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Não foram conduzidos estudos formais em humanos sobre interação medicamentosa com trastuzumabe entansina. Estudos sobre metabolismo in vitro em microssomos hepáticos humanos sugerem que DM1, um componente do trastuzumabe entansina, é metabolizado principalmente pelo CYP3A4 e, em menor extensão, por CYP3A5. DM1 não induz nem inibe o metabolismo mediado por P450 in vitro. Deve-se tomar cuidado quando trastuzumabe entansina é coadministrado com inibidores potentes de CYP3A.
Recomenda-se sempre consultar a bula dos medicamentos utilizados concomitantemente pelo paciente, devido às potenciais interações medicamentosas.
Ação da Substância
Resultados de eficácia
Câncer de mama metastático
Um estudo clínico fase III, randomizado, multicêntrico, internacional, aberto (TDM4370g/BO21977) foi conduzido com pacientes com câncer de mama HER2-positivo metastático ou localmente avançado não ressecável que receberam terapia prévia à base de taxano e trastuzumabe, incluindo pacientes que receberam terapia prévia com trastuzumabe e um taxano como adjuvantes e que apresentaram recidiva dentro de seis meses após completarem a terapia adjuvante. Antes da inclusão, era necessário que amostras de tumor de mama fossem confirmadas como doença HER2-positivo, definida pelo escore de 3+ por IHQ (imuno-histoquímica) ou amplificação genética por ISH (hibridização in situ). Características basais dos pacientes e do tumor foram bem equilibradas entre os grupos de tratamento. Para pacientes randomizados para Trastuzumabe entansina (substância ativa), a idade mediana foi de 53 anos, a maioria dos pacientes era mulheres (99,8%), a maioria era branca (72%) e 57% apresentavam doença positiva para receptor de estrógeno e/ou progesterona. O estudo comparou a segurança e a eficácia de Trastuzumabe entansina (substância ativa) com a de lapatinibe mais capecitabina. No total, 991 pacientes foram randomizados para Trastuzumabe entansina (substância ativa) ou lapatinibe mais capecitabina como vemos a seguir:
- Braço Trastuzumabe entansina (substância ativa): 3,6 mg/kg via intravenosa (IV), em 30 a 90 minutos no Dia 1, de um ciclo de 21 dias,
- Braço controle (lapatinibe mais capecitabina): lapatinibe 1250 mg/dia via oral, uma vez por dia, de um ciclo de 21 dias, mais capecitabina 1000 mg/m2 via oral, duas vezes por dia, nos Dias 1 a 14 de um ciclo de 21 dias.
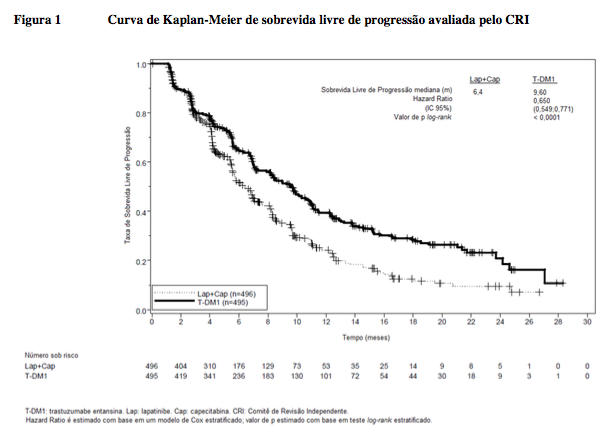
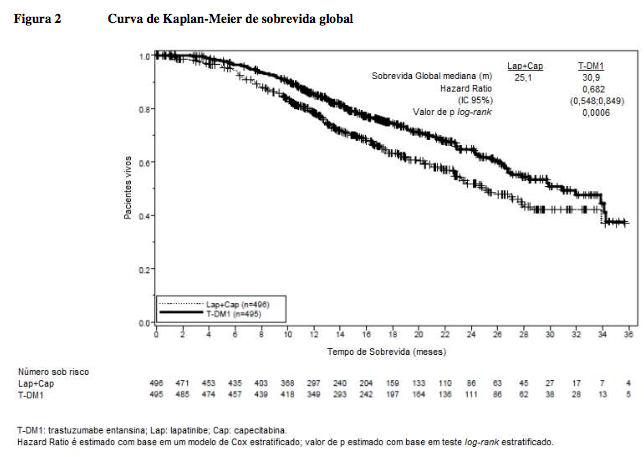
Os desfechos coprimários de eficácia do estudo foram sobrevida livre de progressão (SLP) avaliada por um comitê de revisão independente (CRI) e sobrevida global (SG) e porcentagens de sobrevida de referência (1 ano e 2 anos).
O tempo até progressão dos sintomas, definido por uma redução de 5 pontos no escore derivado do índice de evolução dos estudos – subescala mama (TOI-B) do questionário de Avaliação Funcional de Terapia de Câncer de Mama – Qualidade de Vida (FACT-B QoL) também foi avaliado durante o estudo clínico. Uma alteração de 5 pontos em TOI-B é considerada clinicamente significativa.
Tabela 1. Resumo de eficácia do estudo TDM4370g/BO21977 (EMILIA)
| Lapatinibe + capecitabina N = 496 |
Trastuzumabe entansina (substância ativa) | |
|
Desfechos primários | ||
|
SLP avaliada pelo CRI | ||
|
Número (%) de pacientes com evento | 304 (61,3%) |
265 (53,5%) |
|
Duração mediana de SLP (meses) | 6,4 |
9,6 |
|
Hazard ratio (estratificado*) | 0,650 | |
|
IC 95% para hazard ratio | (0,549, 0,771) | |
|
Valor de p (teste log-rank, estratificado*) | < 0,0001 | |
|
Sobrevida global (SG)** | ||
|
Número (%) de pacientes que foram a óbito | 182 (36,7%) |
149 (30,1%) |
|
Duração mediana de sobrevida (meses) | 25,1 |
30,9 |
|
Hazard ratio (estratificado*) | 0,682 | |
|
IC 95% para hazard ratio | (0,548, 0,849) | |
|
Valor de p (teste log-rank*) | 0,0006 | |
|
Taxa de sobrevida em 1 ano (IC 95%) | 78,4% (74,62, 82,26) |
85,2% |
|
Taxa de sobrevida em 2 anos (IC 95%) | 51,8% (45,92, 57,73) |
64,7% |
|
Desfechos-chave secundários | ||
|
SLP avaliada pelo investigador | ||
|
Número (%) de pacientes com evento | 335 (67,5%) |
287 (58,0%) |
|
Duração mediana de SLP (meses) | 5,8 |
9,4 |
|
HR (IC 95%) |
0,658 (0,560, 0,774) | |
|
Valor de p (teste log-rank*) | < 0,0001 | |
|
Taxa de resposta objetiva | ||
|
Pacientes com doença mensurável | 389 |
397 |
|
Número de pacientes com TRO (%) | 120 (30,8%) |
173 (43,6%) |
|
Diff, (IC 95%) | 12,7% (6,0%, 19,4%) | |
|
Valor de p (teste qui-quadrado Mantel-Haenszel*) | 0,0002 | |
|
Duração da resposta objetiva (meses) | ||
|
Número de pacientes com TRO | 120 |
173 |
|
IC 95% da mediana | 6,5 (5,45, 7,16) |
12,6 (8,38, 20,76) |
|
Tempo até a progressão do sintoma | ||
|
Número de pacientes passíveis de avaliação | 445 |
450 |
|
Número (%) de pacientes com evento | 257 (57,8%) |
246 (54,7%) |
|
Tempo mediano até o evento (meses) | 4,6 |
7,1 |
|
HR, IC 95% | 0,796 (0,667, 0,951) | |
|
Valor de p (teste log-rank*) | 0,0121 | |
SLP = sobrevida livre de progressão; TRO = taxa de resposta objetiva.
*Estratificado por região do mundo (Estados Unidos, Europa Ocidental, outra), número de esquemas quimioterápicos prévios para doença localmente avançada ou metastática (0-1 vs. > 1) e doença visceral vs. não visceral.
**A primeira análise interina de sobrevida global (SG) foi realizada durante a análise primária de SLP. Efeito terapêutico foi observado, mas o limite de eficácia pré-especificado ainda não havia sido ultrapassado. A segunda análise interina para SG foi conduzida quando 331 eventos de SG foram observados. Os resultados são apresentados nessa tabela.
O benefício do tratamento observado no subgrupo de pacientes que não haviam recebido, anteriormente, nenhuma terapia antineoplásica sistêmica no contexto metastático (n = 118), com hazard ratio para SLP de 0,51 (IC 95%: 0,30, 0,85) e para SG 0,61 (IC 95%: 0,32, 1,16). A mediana de SLP foi de 10,8 meses e de SG ainda não foi atingida para o grupo Trastuzumabe entansina (substância ativa), quando comparadas com os 5,7 e 27,9 meses, respectivamente, para o grupo lapatinibe e capecitabina.
Um estudo randomizado, multicêntrico, aberto, fase II (TDM4450g/BO21976) avaliou os efeitos de Trastuzumabe entansina (substância ativa) versus trastuzumabe mais docetaxel em pacientes com câncer de mama HER2-positivo metastático que não receberam quimioterapia prévia para doença metastática. Os pacientes foram randomizados para receber Trastuzumabe entansina (substância ativa) 3,6 mg/kg IV a cada 3 semanas (n = 67) ou trastuzumabe 8 mg/kg IV em dose de ataque seguida por 6 mg/kg IV a cada 3 semanas mais docetaxel 75-100 mg/m2 IV a cada 3 semanas (n = 70).
O desfecho primário foi SLP avaliada pelo investigador. A SLP mediana foi de 9,2 meses no braço trastuzumabe mais docetaxel e 14,2 meses no braço Trastuzumabe entansina (substância ativa) (hazard ratio, 0,59; p = 0,035), com acompanhamento mediano de, aproximadamente, 14 meses nos dois braços. A TRO (taxa de resposta objetiva) foi de 58,0%, com trastuzumabe mais docetaxel e 64,2% com Trastuzumabe entansina (substância ativa). A duração mediana de resposta no braço controle foi de 9,5 meses e ainda não foi atingida com trastuzumaabe entansina.
A queda dos escores FACT-B TOI foi menor no braço com Trastuzumabe entansina (substância ativa) em comparação com o braço controle (tempo mediano até a progressão dos sintomas foi de 7,5 meses no braço com Trastuzumabe entansina (substância ativa) e 3,5 meses no braço controle; hazard ratio, 0,58; p = 0,022).
Um estudo fase II, aberto, de braço único (TDM4374g) avaliou os efeitos de Trastuzumabe entansina (substância ativa) em pacientes com câncer de mama HER2-positivo localmente avançado não ressecável ou metastático. Todos os pacientes foram previamente tratados com terapias específicas para HER2 (trastuzumabe ou lapatinibe) e quimioterapia (antraciclina, taxano ou capecitabina) no contexto neoadjuvante, adjuvante, localmente avançado ou metastático. O número mediano de agentes antineoplásicos que os pacientes tinham recebido em qualquer contexto foi de 8,5 (intervalo de 5 a 19) e no contexto metastático foi de 7,0 (intervalo de 3 a 17), incluindo todos os agentes destinados ao tratamento do câncer de mama.
Os pacientes (n = 110) receberam 3,6 mg/kg de Trastuzumabe entansina (substância ativa) via intravenosa a cada 3 semanas até a progressão da doença ou toxicidade inaceitável.
As análises-chave de eficácia foram TRO baseada na revisão radiológica independente e duração de resposta objetiva. A TRO foi de 32,7% (IC 95%: 24,1, 42,1), n = 36 respondedores, de acordo com revisão do CRI e do investigador. A duração mediana de resposta de acordo com o CRI ainda não foi atingida (IC 95%, 4,6 meses até não estimável).
Imunogenicidade
Assim como em todas as proteínas para fins terapêuticos, existe o potencial para uma resposta imune ao Trastuzumabe entansina (substância ativa). Dos 836 pacientes de seis estudos clínicos testados em diversos momentos para a resposta de anticorpos antiterapêuticos (ATAs) para Trastuzumabe entansina (substância ativa), 44 pacientes (5,3%) apresentaram teste positivo para anticorpos anti-Trastuzumabe entansina (substância ativa) em um ou mais momentos após a infusão, sendo que 28 desses tiveram amostras de referência negativas. A significância clínica de anticorpos contra o Trastuzumabe entansina (substância ativa) é ainda desconhecida.
Os resultados dos ensaios de imunogenicidade são altamente dependentes de diversos fatores, incluindo a sensibilidade, especificidade e metodologia dos ensaios, o manuseio das amostras, o tempo de coleta das amostras, o uso concomitante de medicamentos e a doença subjacente. Por essas razões, a comparação da incidência de anticorpos contra Trastuzumabe entansina (substância ativa) com a de anticorpos contra outros produtos pode ser equivocada.
Características Farmacológicas
Propriedades farmacodinâmicas
Propriedades farmacocinéticas
Farmacocinética em populações especiais
A análise farmacocinética populacional de Trastuzumabe entansina (substância ativa) mostrou que a etnia não parece influenciar a farmacocinética de Trastuzumabe entansina (substância ativa). Como a maioria dos pacientes nos estudos clínicos de Trastuzumabe entansina (substância ativa) era mulheres, o efeito do sexo sobre a farmacocinética de Trastuzumabe entansina (substância ativa) não foi avaliado formalmente.
Segurança pré-clínica
Mutagenicidade
Não se observou nenhuma evidência de atividade mutagênica em um ensaio de mutação bacteriana reversa in vitro de DM1. Em um ensaio de micronúcleo in vivo de Trastuzumabe entansina (substância ativa) em macacos cynomolgus, não foi observada nenhuma evidência de dano cromossômico em células de medula óssea. No entanto, em ensaio de micronúcleo em medula óssea de rato, DM1 foi positivo para formação de micronúcleos depois de uma dose única baixa na faixa de concentração de DM1 medida em seres humanos que recebiam Trastuzumabe entansina (substância ativa), confirmando que Trastuzumabe entansina (substância ativa) é um aneugênio e/ou clastogênio.
Cuidados de Armazenamento
Os frascos-ampola fechados de Kadcyla devem ser armazenados sob refrigeração (temperatura entre 2 e 8ºC).
O profissional de saúde saberá como armazenar a solução reconstituída e a solução para infusão contendo Kadcyla reconstituído.
Número de lote e datas de fabricação e validade: Vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas
Kadcyla apresenta-se sob forma de pó branco a quase branco.
A solução reconstituída deve ser inspecionada visualmente. A cor da solução reconstituída varia de incolor a marrom-clara e deve estar livre de partículas visíveis, límpida a discretamente opalescente.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto e o descarte em lixo doméstico deve ser evitado.
Utilize o sistema de coleta local estabelecido, se disponível.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS - 1.0100.0659
Farm. Resp.:
Tatiana Tsiomis Díaz - CRF-RJ nº 6942
Fabricado para
F. Hoffmann-La Roche Ltd, Basileia, Suíça
Por Patheon Manufacturing Services, LLC, Greenville, Estados Unidos da América
ou
Por F. Hoffmann-La Roche Ltd, Kaiseraugst, Suíça
Embalado por
F. Hoffmann-La Roche Ltd, Kaiseraugst, Suíça
Registrado, importado e distribuído no Brasil por
Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2020 CEP 22775-109 - Rio de Janeiro - RJ
CNPJ 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289
www.roche.com.br
Uso restrito a hospitais.
Venda sob prescrição médica.
informações complementares
| Fabricante |
| ROCHE |
| Princípio ativo |
| Trastuzumabe Entansina |
| Categoria do medicamento |
| Medicamentos Especiais |
