para o que é indicado e para que serve?
Para que serve Tratamento adjuvante de mulheres na pós-menopausa com câncer de mama inicial receptor hormonal positivo.Continue lendo...
ofertas de
Letrozol - 2,5Mg C 30 Com...
ofertas de Letrozol - 2,5Mg C 30 Com...
R$ 63,50
R$ 78,00
R$ 82,35
R$ 82,35
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
- Tratamento adjuvante de mulheres na pós-menopausa com câncer de mama inicial receptor hormonal positivo.
- Tratamento adjuvante estendido de câncer de mama inicial em mulheres na pós-menopausa que tenham recebido terapia adjuvante padrão prévia com tamoxifeno por 5 anos.
- Tratamento de primeira linha no câncer de mama avançado hormônio dependente em mulheres na pós-menopausa.
- Tratamento de câncer de mama avançado em mulheres na pós-menopausa (natural ou artificialmente induzida), que tenham sido tratadas previamente com antiestrogênicos.
- Terapia pré-operatória em mulheres na pós-menopausa com câncer de mama localmente avançado receptor hormonal positivo, com a intenção de permitir cirurgia conservadora da mama para aquelas mulheres que não eram originalmente consideradas candidatas a este tipo de cirurgia. O tratamento pós-cirúrgico subsequente deve seguir o tratamento padrão.
Contraindicação
- Conhecida hipersensibilidade à substância ativa ou a qualquer excipiente.
- Estado endócrino pré-menopausa; gravidez, lactação.
Este medicamento pertence a categoria D de risco de gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Como usar
O letrozol deve ser tomado por via oral, e pode ser tomado com ou sem alimentos porque os alimentos não tem efeito sobre a extensão da absorção.
A dose perdida deve ser tomada assim que o paciente se lembrar. No entanto, se estiver quase na hora da dose seguinte, a dose perdida deve ser ignorada, e o paciente deve voltar ao seu esquema posológico regular. As doses não devem ser dobradas, pois com doses diárias acima da dose recomendada de 2,5 mg, foi observado excesso de proporcionalidade da exposição sistêmica.
Posologia
Adultos
A dose recomendada de letrozol é de 2,5 mg uma vez ao dia. No tratamento adjuvante e adjuvante estendido, o tratamento com letrozol deve continuar por 5 anos ou até a recorrência/recidiva da doença, ou o que ocorrer primeiro.
Em um grande estudo pivotal de letrozol versus tamoxifeno no tratamento adjuvante, nenhum benefício em eficácia e segurança foi obtido pela administração sequencial desses tratamentos comparados com letrozol administrado continuamente por 5 anos. Em pacientes com doença metastática, o tratamento com letrozol deve continuar até que a progressão do tumor seja evidente.
No cenário (pré-operatório) neoadjuvante, o tratamento com letrozol deve ser continuado durante 4 a 8 meses, a fim de estabelecer a redução ótima do tumor. Se a resposta não for adequada, o tratamento com letrozol deve ser interrompido, a cirurgia marcada e/ou outras opções terapêuticas discutidas com o paciente.
Posologia para populaçõ especial
Insuficiência hepática
Nenhum ajuste de dose de letrozol é necessário para pacientes com insuficiência hepática leve a moderada (escore Child-Pugh A ou B). Dados insuficientes estão disponíveis para pacientes com insuficiência hepática grave, porém os pacientes com insuficiência hepática grave (escore Child-Pugh C) devem ser mantidos sob estreita supervisão.
Insuficiência renal
Nenhum ajuste de dose de letrozol é necessário para pacientes com insuficiência renal com clearance (depuração) de creatinina (CLcr) ? 10 mL/min. Dados insuficientes estão disponíveis nos casos de insuficiência renal com CLcr<10 mL/min.
Crianças
O letrozol não é recomendado para uso em crianças e adolescentes. A segurança e eficácia de letrozol em crianças e adolescentes com idade até 17 anos não foram estabelecidas. Dados limitados estão disponíveis e nenhuma recomendação sobre posologia pode ser feita.
Idosos
Nenhum ajuste de dose é necessário para pacientes idosos.
Este medicamento não deve ser partido, aberto ou mastigado.
Precauções
Cuidados e orientações para pacientes com Insuficiência renal
O letrozol não foi investigado em pacientes com clearance (depuração) de creatinina < 10 mL/min. Deve-se considerar cuidadosamente o potencial de risco/benefício para tais pacientes antes da administração de letrozol.
Cuidados e orientações para pacientes com Insuficiência hepática
Em pacientes com insuficiência hepática grave (escore Child-Pugh C), a exposição sistêmica e a meia-vida terminal foram aproximadamente o dobro comparadas a voluntários sadios. Tais pacientes devem, portanto, ser mantidos sob cuidadosa supervisão.
Cuidados e orientações - Efeitos ósseos
Osteoporose e/ou fraturas ósseas foram reportadas com uso de letrozol. Portanto, é recomendado um monitoramento global da saúde óssea durante o tratamento.
Cuidados e orientações - Estado de menopausa
Em pacientes cujo estado de menopausa não é claro, os níveis de hormônio luteinizante (LH), hormônio folículo estimulante (FSH) e/ou estradiol devem ser medidos antes de se iniciar o tratamento com letrozol. Somente mulheres no estado endócrino pós-menopausa devem receber letrozol.
Cuidados e orientações - Fertilidade
A ação farmacológica do letrozol é reduzir a produção de estrógeno através da inibição da aromatase. Em mulheres na pré-menopausa, a inibição da síntese de estrógeno leva ao aumento do feedback (realimentação) nos níveis de gonadotropina (LH, FSH). Os níveis de FSH aumentados, por sua vez, estimulam o crescimento folicular, e podem induzir a ovulação.
Cuidados e orientações - Interações
A coadministração de letrozol com tamoxifeno, outros antiestrógenos ou terapias contendo estrógenos devem ser evitados uma vez que estas substâncias podem diminuir a ação farmacológica do letrozol. O mecanismo desta interação é desconhecido.
Cuidados e orientações - Efeitos sobre a habilidade de dirigir veículos e/ou operar máquinas
Uma vez que cansaço e tontura têm sido observados com o uso de letrozol e sonolência tem sido reportada incomumente, é recomendada cautela na condução de veículos e/ou operação de máquinas.
Cuidados e orientações - Gravidez, lactação e potencial reprodutivo (homens e mulheres)
Gravidez
Lactação
Potencial reprodutivo (homens e mulheres)
Reações Adversas
Resumo do perfil de segurança
O letrozol foi bem tolerado de forma geral em todos os estudos, tanto em primeira linha como em segunda linha no tratamento do câncer de mama avançado, bem como no tratamento adjuvante de câncer de mama inicial e no tratamento adjuvante estendido em mulheres que receberam terapia prévia padrão com tamoxifeno.
Aproximadamente um terço das pacientes tratadas com letrozol nos cenários metastático e neoadjuvante, aproximadamente 75% das pacientes no cenário adjuvante (tanto para os braços de letrozol e tamoxifeno com uma duração média de tratamento de 60 meses), e aproximadamente 80% dos pacientes no cenário adjuvante estendido (tanto para os braços de letrozol e placebo, numa duração média de tratamento de 60 meses) apresentaram reações adversas. Geralmente as reações adversas observadas são principalmente de natureza leve a moderada, sendo a maioria associada à privação de estrógeno.
Os relatos de reações adversas mais frequentes nos estudos clínicos foram: ondas de calor, artralgia, náuseas e fadiga.
Muitas das reações adversas podem ser atribuídas às consequências farmacológicas normais da privação de estrógeno (por ex. ondas de calor, alopécia e sangramento vaginal). As seguintes reações adversas ao medicamento, listadas na tabela 9, foram reportadas a partir de estudos clínicos e de experiências pós- comercialização com letrozol.
As reações adversas estão dispostas por ordem de frequência, onde as mais frequentes aparecem primeiro, usando a seguinte convenção:
- Muito comum (? 10%),
- Comum (? 1%, < 10%),
- Incomum (? 0,1%, < 1%),
- Rara (? 0,01%, <0,1%),
- Muito rara (< 0,01%), não conhecidas (não podem se estimadas a partir dos dados disponíveis).
Reações adversas ao medicamento
|
Infecções e infestações | |
|
Incomum |
Infecção do trato urinário |
|
Neoplasmas benignos, malignos e não especificados (incluindo cistos e pólipos) | |
|
Incomum |
Dor tumoral1 |
|
Distúrbios nos sistemas sanguíneo e linfático | |
|
Incomum |
Leucopenia |
|
Distúrbios no sistema imunológico | |
|
Desconhecida |
Reação anafilática |
|
Distúrbios metabólicos e nutricionais | |
|
Muito comum |
Hipercolesterolemia |
|
Comuns |
Anorexia, aumento do apetite |
|
Distúrbios psiquiátricos | |
|
Comum |
Depressão |
|
Incomuns |
Ansiedade (incluindo nervosismo), irritabilidade |
|
Distúrbios no sistema nervoso | |
|
Comuns |
Dor de cabeça, tontura |
|
Incomuns |
Sonolência, insônia, alterações de memória, disestesia (incluindo parestesia, hipoestesia), distúrbio no paladar, acidente cerebrovascular, síndrome do túnel do carpo |
|
Distúrbios oculares | |
|
Incomuns |
Catarata, irritação ocular, visão embaçada |
|
Distúrbios cardíacos | |
|
Incomuns |
Palpitações1, taquicardia, eventos isquêmicos cardíacos (incluindo nova angina ou agravamento de angina, angina exigindo cirurgia, infarto do miocárdio e isquemia do miocárdio) |
|
Distúrbios vasculares | |
|
Muito comum |
Ondas de calor |
|
Comum |
Hipertensão |
|
Incomum |
Tromboflebite (incluindo tromboflebite venosa superficial e profunda) |
|
Raras |
Embolia pulmonar, trombose arterial, infarto vascular cerebral |
|
Distúrbios respiratórios, torácicos e mediastinais | |
|
Incomuns |
Dispneia, tosse |
|
Distúrbios gastrintestinais | |
|
Comuns |
Náusea, vômito, dispepsia1, constipação, diarreia, dor abdominal |
|
Incomuns |
Estomatite, boca seca |
|
Distúrbios hepatobiliares | |
|
Incomuns |
Aumento das enzimas hepáticas |
|
Muito rara |
Hepatite |
|
Distúrbios na pele e tecido subcutâneo | |
|
Muito comum |
Aumento de sudorese |
|
Comuns |
Alopecia, pele seca, erupção cutânea (rash) (incluindo rash eritematoso, maculopapular, psoriaseforme e vesicular) |
|
Incomuns |
Prurido, urticária |
|
Desconhecidas |
Angioedema, necrólise epidérmica tóxica, eritema multiforme |
|
Distúrbios musculoesquelético e dos tecidos conjuntivos | |
|
Muito comum |
Artralgia |
|
Comuns |
Mialgia, dor óssea1, osteoporose, fraturas ósseas |
|
Incomum |
Artrite |
|
Desconhecida |
Dedo em gatilho |
|
Distúrbios urinários e renais | |
|
Incomum |
Aumento da frequência urinária |
|
Distúrbios do sistema reprodutivo e mamas | |
|
Comum |
Sangramento vaginal |
|
Incomuns |
Descarga vaginal, ressecamento vaginal e dor nas mamas |
|
Distúrbios gerais e condições no local de administração | |
|
Muito comum |
Fadiga (incluindo astenia, mal-estar) |
|
Comum |
Edema periférico |
|
Incomuns |
Edema geral, pirexia, ressecamento da mucosa, sede |
|
Laboratorial | |
|
Comum |
Aumento de peso |
|
Incomum |
Perda de peso |
1 Reações adversas reportadas somente em presença de metástases
Descrição das reações adversas ao medicamento selecionadas
Reações Adversas Cardíacas
No tratamento adjuvante, em adição aos dados apresentados na tabela, os seguintes eventos adversos foram relatados para letrozol e tamoxifeno, respectivamente (duração média do tratamento de 5 anos): angina requerendo cirurgia (1,0% versus 1,0%); insuficiência cardíaca (1,1% versus 0,6%), hipertensão (5,6% versus 5,7%), acidente vascular cerebral (AVC)/ataque isquêmico transitório (AIT) (2,1% versus 1,9%).
No tratamento adjuvante estendido para letrozol (duração média do tratamento de 5 anos) e placebo (duração média de tratamento de 3 anos), respectivamente: angina requerendo cirurgia (0,8% versus 0,6%), nova angina ou agravamento da angina (1,4% versus 1,0 %); infarto do miocárdio (1,0% versus 0,7%); evento tromboembólico* (0,9% versus 0,3%); AVC/ataque isquêmico transitório* (1,5% versus 0,8%) foram relatados.
Eventos marcados com * são estatisticamente significativamente diferentes nos dois braços de tratamento.
Reações adversas esqueléticas
No tratamento adjuvante estendido, significativamente mais pacientes tratados com letrozol apresentaram fraturas ósseas ou osteoporose (10,4% fraturas ósseas e 12,2% osteoporose) do que pacientes no braço placebo (5,8% e 6,4%, respectivamente). A duração média do tratamento foi 5 anos para letrozol, comparado com 3 anos para o placebo.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em http://www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.
Composição
Cada comprimido revestido contém:
?letrozol - 2,5 mg
excipientes*- q.s.p. 1 comprimido?
*Excipientes: lactose, celulose microcristalina, amidoglicolato de sódio, dióxido de silício, estearato de magnésio, hipromelose, macrogol, dióxido de titânio, óxido de férro amarelo, água deionizada.
Interação Medicamentosa
O letrozol é metabolizado principalmente no fígado e as enzimas do citocromo P450, CYP3A4 e CYP2A6 medeiam o clearance (depuração) metabólico do letrozol.
Portanto, a eliminação sistêmica de letrozol pode ser influenciada por fármacos conhecidos por afetarem a CYP3A4 e CYP2A6. O metabolismo do letrozol parece ter uma afinidade baixa para a enzima CYP3A4, porque a enzima não pode ser saturada em concentrações de mais de 150 vezes superiores às observadas no plasma para letrozol no estado de equilíbrio em situação clínica típica.
Fármacos que podem aumentar as concentrações séricas de letrozol
Inibidores das atividades da CYP3A4 e CYP2A6 podem diminuir o metabolismo de letrozol e, assim, aumentar a concentração plasmática de letrozol. A administração concomitante com medicamentos que inibem fortemente estas enzimas (inibidores fortes de CYP3A4: incluindo mas não limitado a cetoconazol, itraconazol, voriconazol, ritonavir, claritromicina e telitromicina; CYP2A6 (por exemplo, metoxisaleno) podem aumentar a exposição ao letrozol). Portanto, é recomendado precaução em pacientes para os quais os inibidores fortes de CYP3A4 e CYP2A6 são indicados.
Fármacos que podem diminuir as concentrações séricas de letrozol
Os indutores das atividades da CYP3A4 podem aumentar o metabolismo do letrozol e, assim, diminuir a concentração plasmática do letrozol. A administração concomitante de medicamentos que induzem a CYP3A4 (por exemplo, fenitoína, rifampicina, carbamazepina, fenobarbital e Erva de São João) pode reduzir a exposição ao letrozol. Portanto, é recomendado precaução em pacientes para os quais os indutores fortes de CYP3A4 são indicados. Nenhum medicamento indutor é conhecido para CYP2A6.
A coadministração de letrozol (2,5mg) e 20 mg diárias de tamoxifeno resultou em uma redução nos níveis plasmáticos de letrozol em média de 38%. A experiência clínica na segunda-linha dos ensaios de câncer de mama indica que nem o efeito terapêutico do tratamento com letrozol e nem a ocorrência de reações adversas aumentam se letrozol for administrado imediatamente após o tamoxifeno. O mecanismo desta interação é desconhecido.
Fármacos que podem ter suas concentrações séricas sistêmicas alteradas pelo letrozol
In vitro, o letrozol inibe as isoenzimas do citocromo P450 CYP2A6 e, moderadamente, CYP2C19, mas a relevância clínica é desconhecida. Portanto, precaução é indicada quando da administração de letrozol concomitantemente com medicamentos cuja eliminação depende principalmente de CYP2C19 e cujo índice terapêutico é estreito (por exemplo, fenitoína, clopidogrel). Nenhum substrato com índice terapêutico estreito é conhecido para CYP2A6.
Estudos clínicos de interação com cimetidina (um conhecido inibidor não-específico de CYP2C19 e CYP34A e varfarina (substrato sensível para CYP2C9 com uma estreita janela terapêutica e comumente usado como comedicação em população-alvo do letrozol) indicaram que a coadministração de letrozol com esses medicamentos não resultam em interações medicamentosas clinicamente significativas.
Uma revisão na base de dados de ensaios clínicos indicou nenhuma evidência de outras interações clinicamente relevantes com outros medicamentos comumente prescritos.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados da eficácia
Tratamento adjuvante
Estudo BIG 1-98
O BIG 1-98 foi um estudo multicêntrico, duplo-cego que randomizou mais de 8000 mulheres na pós-menopausa com câncer de mama inicial receptor positivo hormonal, para um dos seguintes tratamentos:
- Tamoxifeno por 5 anos;
- Letrozol por 5 anos;
- Tamoxifeno por 2 anos seguido de letrozol por 3 anos;
- Letrozol por 2 anos seguido de tamoxifeno por 3 anos.
O objetivo primário foi sobrevida livre de doença (SLD). Os objetivos secundários de eficácia foram tempo para ocorrência de metástases à distância (TMD); sobrevida livre de doença à distância (SLDD); sobrevida global (SG), sobrevida livre de doença sistêmica (SLDS); câncer de mama contralateral invasivo e o tempo para recorrência de câncer de mama.
Estudo CFEM345D2407
Estudo D2407 foi um estudo aberto, randomizado, multicêntrico, de segurança pós-autorização desenhado para comparar os efeitos do tratamento adjuvante com letrozol e tamoxifeno sobre a densidade mineral óssea (DMO) e perfil lipídico sérico. Em total, 263 pacientes foram atribuídos ao letrozol durante 5 anos (133 mulheres em pós menopausa) ou ao tamoxifeno por 2 anos seguidos por letrozol, durante 3 anos (130 pacientes). Todas as avaliações de DMO e lipídios séricos foram conduzidas sob tratamento cego em laboratórios centrais especializados. A análise primária de DMO e lipídios séricos ocorreu em 2 anos.
Houve uma diferença estatisticamente significativa entre os tratamentos em 2 anos no desfecho primário. ADMO de coluna lombar (L2-L4) apresentou uma redução mediana de 4,1% no braço letrozol em comparação com o braço tamoxifeno que apresentou um aumento mediano de 0,3%. Os resultados para a DMO total do quadril foram similares àqueles para a coluna lombar, mas menos pronunciados. Nenhuma paciente com a DMO normal no início do estudo tornou-se osteoporótica durante 5 anos de tratamento. Apenas 1 paciente com osteopenia no exame de base (T escore de 1,9) desenvolveu osteoporose durante o período de tratamento (avaliação por revisão central).
Apesar das diferenças de tratamento ao final de 5 anos terem sido atenuadas de tal modo que não houve diferença estatisticamente significativa entre os tratamentos nas alterações de DMO gerais clinicamente relevantes definidas no protocolo, permaneceram diferenças substanciais nos efeitos dos dois tratamentos na DMO e eventos no esqueleto. Em pacientes com um T-escore normal no exame de base, significativamente mais pacientes no braço de letrozol do que no braço de tratamento sequencial tiveram reduções de pelo menos 6% na DMO da coluna lombar dentro de um ano ou reduções cumulativas de pelo menos 8% ao longo de todo o período de tratamento. Embora não tenha ocorrido diferença significativa global entre os braços de tratamento em fraturas clínicas, três quartos das fraturas no braço de tratamento sequencial ocorreram após a mudança para o letrozol. No entanto, ambas as fraturas clínicas e fraturas iminentes tendem a ocorrer em pacientes cujo estado esquelético estava comprometido, por exemplo, pacientes com baixo T-escore no exame de base da DMO, e os pacientes com histórico de fraturas.
Os níveis de colesterol total (em jejum) diminuíram uma mediana de 16% no braço tamoxifeno aos 6 meses, e permaneceram assim durante a terapia com tamoxifeno. No braço de letrozol, os níveis de colesterol total foram relativamente estáveis ao longo do tratamento. Os níveis de colesterol LDL diminuíram no braço de tamoxifeno, mas permaneceram estáveis no braço de letrozol. Consequentemente, houve diferença estatisticamente significativa a favor do tamoxifeno no colesterol total, colesterol LDL e HDL: a taxa de LDL durante os primeiros 2 anos de estudo. Não houve diferença significativa entre os tratamentos em triglicerídeos.
Tratamento adjuvante estendido
Estudo (MA-17) (CFEM345MA17)
Em um estudo multicêntrico, duplo-cego, randomizado, placebo controlado (MA-17), mais de 5100 mulheres na pós-menopausa com câncer de mama receptor positivo ou primário desconhecido que tinham completado o tratamento adjuvante com tamoxifeno (4,5 a 6 anos), foram randomizadas para letrozol ou placebo por 5 anos.
O desfecho primário foi sobrevida livre de doença, definido como o intervalo entre a randomização e a primeira ocorrência de loco-regional recorrente, metástases à distância, ou câncer de mama contralateral.
A primeira análise interina planejada com um acompanhamento médio de cerca de 28 meses (com 25% das pacientes sendo acompanhadas por até 38 meses) demonstrou que letrozol reduziu significativamente o risco de recorrência do câncer de mama em 42% comparado com placebo (taxa de risco 0,58; 95% IC 0,45; 0,76; P = 0,00003).
O benefício em favor do letrozol foi observado independentemente do estado nodal. Não houve diferença significativa na sobrevida global: (letrozol 51 óbitos; placebo 62; TR 0,82; 95% IC 0,56; 1,19). Consequentemente, após a primeira análise interina o estudo foi desocultado e continuou em uma forma de modo aberto e os pacientes do braço placebo foram autorizados a mudar para o letrozol para até 5 anos. Mais de 60% dos pacientes elegíveis (livre de doença na desocultação) optou por mudar para letrozol.
A análise final incluiu 1.551 mulheres que mudaram de placebo para letrozol em uma média de 31 meses (faixa de 12 a 106 meses) após a conclusão da terapia adjuvante de tamoxifeno. Duração média para letrozol após troca foi de 40 meses.
A análise final realizada em um acompanhamento médio de 62 meses confirmou uma significativa redução do risco de recorrência do câncer de mama com o letrozol.
Tabela 7 - Sobrevida livre da doença e sobrevida global (População ITT modificada)
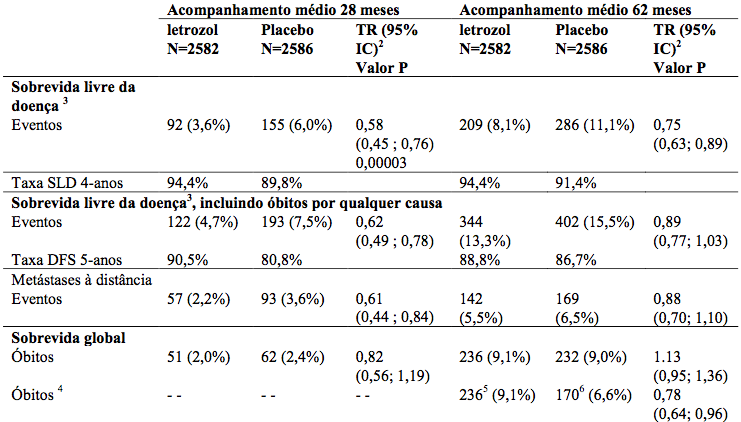
TR= taxa de risco.
IC = intervalo de confiança.
1 Quando o estudo foi não-cego em 2003, 1551 pacientes no braço randomizado de placebo (60% dos elegíveis para alternar – por exemplo, quem era livre da doença) mudaram para letrozol em média 31 meses após a randomização. A análise apresentada aqui ignora o cruzamento seletivo.
2 Estratificado pelo estado receptor, estado nodal e quimioterapia prévia adjuvante.
3 Definição de protocolo de eventos de sobrevidas livre da doença: recorrência loco-regional, metástase à distância ou câncer de mama contralateral.
4 Análise exploratória, acompanhamento censurando o período na data de mudança (se ocorrida) no braço do placebo.
5 Acompanhamento médio de 62 meses.
6 Acompanhamento médio até a mudança (se ocorrida) de 37 meses.
No subestudo ósseo MA-17 no qual foram administrados cálcio e vitamina D concomitantemente, os maiores decréscimos na DMO em comparação à linha de base ocorreram com letrozol comparado com o placebo. A única diferença estatisticamente significante ocorreu em 2 anos e estava na DMO total do quadril (redução média de letrozol de 3,8% vs redução média do placebo de 2,0%).
No subestudo lipídio MA-17 não ocorreram diferenças significativas entre letrozol e placebo no colesterol total ou em qualquer fração lipídica.
Na atualização do subestudo da qualidade de vida não houve diferenças significativas entre os tratamentos no escore resumido do componente físico ou no escore resumido do componente mental, ou em qualquer escore do domínio na escala SF-36. Na escala MENQOL, significativamente mais mulheres ficaram mais incomodadas (geralmente no primeiro ano de tratamento) no braço letrozol do que no braço placebo por esses sintomas decorrentes da privação de estrogênio - ondas de calor e secura vaginal.
O sintoma que incomodou mais pacientes em ambos os braços de tratamento foram dores musculares, com uma diferença estatisticamente significante em favor do placebo.
Tratamento Neoadjuvante
Estudo CFEM345E P024
Um estudo duplo-cego (P024) foi realizado em 337 pacientes com câncer de mama na pós-menopausa aleatoriamente alocadas para letrozol 2,5 mg por 4 meses ou tamoxifeno por 4 meses. No início do estudo (baseline) todas as pacientes tinham tumores estágio T2-T4c, N0-2, M0, ER e/ou PgR positivo e nenhuma das pacientes foram elegíveis para a cirurgia conservadora da mama. Com base na avaliação clínica houve 55% respostas objetivas no braço letrozol versus 36% para o braço tamoxifeno (P <0,001).
Este achado foi consistentemente confirmado por ultrassom (letrozol 35% vs tamoxifeno 25%, P = 0,04) e mamografia (letrozol 34% vs tamoxifeno 16%, P <0,001). No total, 45% das pacientes no grupo letrozol versus 35% das pacientes no grupo tamoxifeno (P = 0,02) foram submetidas a terapia conservadora da mama. Durante o período de tratamento pré-operatório de 4 meses, 12% das pacientes tratadas com letrozol e 17% das pacientes tratadas com tamoxifeno tiveram a progressão da doença em avaliação clínica.
Tratamento de primeira linha
Estudo CFEM345C P025
Um estudo duplo-cego controlado foi realizado comparando letrozol 2,5 mg ao tamoxifeno 20 mg como tratamento de primeira linha em mulheres pós-menopausa com câncer de mama avançado. Em 907 mulheres, o letrozol foi superior ao tamoxifeno no tempo para progressão (desfecho primário), e em resposta objetiva global, tempo para falha do tratamento e benefício clínico.
Os resultados estão resumidos na Tabela 8:
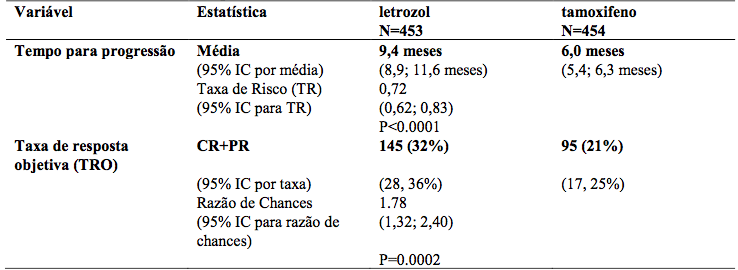
O tempo de progressão foi significativamente maior, e a taxa de resposta significativamente mais elevada para o letrozol independentemente se a terapia antiestrogênio adjuvante foi dada ou não. O tempo de progressão foi significativamente maior para o letrozol independentemente do local dominante da doença.
O tempo médio de progressão foi de 12,1 meses para letrozol e 6,4 meses para o tamoxifeno em pacientes com doença somente do tecido mole e média 8,3meses para letrozol e 4,6 meses para tamoxifeno em pacientes com metástases viscerais. O desenho do estudo permitiu às pacientes passarem após progressão para a outra terapia ou descontinuar a partir do estudo.
Aproximadamente 50% das pacientes passaram para o braço de tratamento oposto e o cruzamento do estudo estava praticamente concluído em 36 meses. O tempo médio de cruzamento do estudo foi de 17 meses (letrozol para tamoxifeno) e 13 meses (tamoxifeno para letrozol).
O tratamento com letrozol no tratamento de primeira linha de câncer de mama avançado resultou em uma média de sobrevida global de 34 meses, em comparação com 30 meses para o tamoxifeno (teste logrank P = 0,53, não significativo). A ausência de uma vantagem para letrozol na sobrevida global poderia ser explicada pelo desenho cruzado do estudo.
Tratamento de segunda linha
Dois ensaios clínicos bem controlados foram realizados comparando duas doses letrozol (0,5 mg e 2,5 mg) para acetato de megestrol e para aminoglutetimida, respectivamente, em mulheres na pós-menopausa com câncer da mama avançado, previamente tratadas com antiestrogênios.
Estudo AR/BC2
Diferenças estatisticamente significativas foram observadas em favor do letrozol 2,5 mg, em comparação ao acetato de megestrol na taxa de resposta tumoral objetiva global (24% vs 16%, P = 0,04), e em tempo para falha do tratamento (P= 0,04). Sobrevida global e o tempo de progressão não foram significativamente diferentes entre os dois braços (P = 0,2 e P= 0,07, respectivamente).
Estudo AR/BC3
O letrozol 2,5 mg foi estatisticamente superior à aminoglutetimida 250mg, duas vezes ao dia, para o tempo de progressão (P = 0,008), tempo para falha do tratamento (P = 0,003) e sobrevida global (P = 0,002). Neste estudo, a taxa de resposta não teve diferença significativa entre letrozol 2,5mg e aminoglutetimida (P=0,06).
Características Farmacológicas
Grupo farmacoterapêutico: Inibidor não-esteroidal da aromatase (inibidor da biossíntese de estrógenos).
Agente antineoplásico: código ATC: L02B G04.
Mecanismo de Ação
A eliminação do efeito estimulante mediado pelo estrógeno é um pré-requisito para uma resposta do tumor, nos casos em que o crescimento do tecido tumoral depende da presença de estrógenos. Em mulheres na pós- menopausa, os estrógenos são derivados principalmente da ação da enzima aromatase que converte andrógenos adrenais, sobretudo a androstenediona e a testosterona, à estrona (E1) e estradiol (E2).
A supressão da biossíntese de estrógenos nos tecidos periféricos e no próprio tecido neoplásico pode, portanto, ser conseguida pela inibição específica da enzima aromatase.
O letrozol é um inibidor não-esteroidal da aromatase. Ele inibe a enzima aromatase por se ligar competitivamente à porção heme da subunidade do citocromo P450 da enzima, resultando em uma redução da biossíntese de estrógenos em todos os tecidos.
Farmacodinâmica
Em mulheres sadias na pós-menopausa, doses únicas de 0,1 mg, 0,5 mg e 2,5 mg de letrozol suprimem a estrona e o estradiol sérico em 75 a 78% e em 78%, respectivamente, em relação aos valores basais. A supressão máxima é atingida em 48 a 78 horas.
Em pacientes na pós-menopausa com câncer de mama avançado, doses diárias de 0,1 a 5 mg suprimiram a concentração plasmática de estradiol, estrona e sulfato de estrona em 75 a 95% em relação aos valores basais, em todas as pacientes tratadas. Com doses de 0,5 mg e superiores, muitos valores de estrona e sulfato de estrona estão abaixo do limite de detecção nas análises, indicando que uma supressão maior do estrógeno é alcançada com essas doses. A supressão do estrógeno foi mantida durante o tratamento em todas essas pacientes.
O letrozol é um inibidor altamente específico da atividade da aromatase. Não tem sido observada disfunção da esteroidogênese adrenal. Em pacientes na pós-menopausa tratadas com doses diárias de letrozol de 0,1 a 5 mg, não foi observada qualquer alteração clinicamente significativa nas concentrações plasmáticas de cortisol, aldosterona, 11-desoxicortisol, 17-hidroxiprogesterona e ACTH ou na atividade da renina plasmática.
O teste de estimulação de ACTH realizado após 6 e 12 semanas de tratamento com doses diárias de 0,1 mg, 0,25 mg, 0,5 mg, 1 mg, 2,5 mg e 5 mg não indicou qualquer atenuação na produção de aldosterona ou de cortisol. Portanto, a suplementação de glicocorticoides e mineralocorticoides não é necessária.
Não foi observada qualquer alteração nas concentrações plasmáticas de androgênios (androstenediona e testosterona) em mulheres sadias na pós-menopausa após a administração de doses únicas de 0,1 mg, 0,5 mg e 2,5 mg de letrozol ou nas concentrações plasmáticas de androstenediona entre pacientes na pós-menopausa tratadas com doses diárias de 0,1mg a 5 mg, indicando que o bloqueio da biossíntese de estrógenos não leva ao acúmulo de precursores androgênicos.
Os níveis plasmáticos de LH e FSH das pacientes não são afetados pelo letrozol nem a função tireoidiana, como avaliado pela captação de TSH, T4 e T3.
Farmacocinética
Absorção
O letrozol é rápido e completamente absorvido no trato gastrintestinal (biodisponibilidade absoluta média: 99,9%). A alimentação diminui levemente a taxa de absorção (mediana tmáx: 1 hora em jejum versus 2 horas após alimentação; e média Cmáx: 129 ± 20,3 nmol/L em jejum versus 98,7 ± 18,6 nmol/L após a alimentação), mas a extensão de absorção (ASC) não é alterada. O efeito de pouca importância sobre a taxa de absorção não é considerado clinicamente relevante e, portanto, o letrozol pode ser administrado sem se considerar o horário das refeições.
Distribuição
A taxa de ligação do letrozol às proteínas plasmáticas é de aproximadamente 60%, principalmente à albumina (55%). A concentração de letrozol nos eritrócitos é algo em torno de 80% da concentração plasmática. Após a administração de 2,5 mg de letrozol marcado com 14C, aproximadamente 82% da radioatividade no plasma corresponderam ao composto inalterado. Portanto, a exposição sistêmica aos metabólitos é baixa. O letrozol é rápido e extensivamente distribuído aos tecidos. Seu volume aparente de distribuição no estado de equilíbrio é em torno de 1,87 ± 0,47 L/kg.
Biotransformação/metabolismo
O clearance (depuração) metabólico para um metabólito farmacologicamente inativo, o carbinol, é a principal via de eliminação do letrozol (CLm = 2,1 L/h), mas é relativamente lento quando comparado ao fluxo sanguíneo hepático (em torno de 90 L/h). Descobriu-se que as isoenzimas 3A4 e 2A6 do citocromo P450 são capazes de converter o letrozol a este metabólito.
A formação de metabólitos de pouca importância não identificados e a excreção renal e fecal direta desempenham um papel de pouca importância na eliminação total do letrozol. Em um período de 2 semanas, após a administração de 2,5 mg de letrozol marcado com 14C em voluntárias sadias na pós-menopausa, 88,2 ± 7,6% da radioatividade foi recuperada na urina e 3,8 ± 0,9% nas fezes.
No mínimo, 75% da radioatividade recuperada na urina em até 216 horas (84,7 ± 7,8% da dose) foi atribuída ao glucuronídeo do metabólito carbinol, em torno de 9% a 2 metabólitos não identificados e 6% ao letrozol inalterado.
Eliminação
A meia-vida de eliminação terminal aparente no plasma é em torno de 2 a 4 dias. Após a administração diária de 2,5 mg, os níveis de steady-state (estado de equilíbrio) são atingidos em 2 a 6 semanas.
As concentrações plasmáticas no steady-state (estado de equilíbrio) são aproximadamente 7 vezes maiores que as concentrações medidas após a administração de dose única de 2,5 mg, e são 1,5 a 2 vezes maiores que os valores de steady- state (estado de equilíbrio) previstos, a partir das concentrações medidas após dose única, indicando uma leve não linearidade na farmacocinética do letrozol em administrações diárias de 2,5 mg.
Uma vez que os níveis de steady-state (estado de equilíbrio) são mantidos ao longo do tempo, pode-se concluir que não ocorre acúmulo contínuo de letrozol.
Linearidade/não-linearidade
A farmacocinética do letrozol foi proporcional a dose após doses orais únicas de até 10 mg (variação de dose: 0,01 a 30 mg) e após doses diárias de até 1,0 mg (variação de dose: 0,1 a 5 mg). Após uma dose oral única de 30 mg ocorreu um ligeiro aumento mais proporcional no valor ASC. Com doses diárias de 2,5 e 5 mg os valores da ASC aumentaram cerca de 3,8 e 12 vezes ao invés de 2,5 e 5 vezes, respectivamente, quando comparado com a dose de 1,0 mg/dia.
A dose recomendada de 2,5 mg/dia pode, assim, ser uma dose limite, onde um início de um excesso de proporcionalidade torna-se aparente, enquanto que a 5 mg/dia, o excesso de proporcionalidade é mais pronunciado. É provável que a dose de excesso de proporcionalidade seja o resultado de uma saturação dos processos de eliminação metabólica. Níveis estáveis foram alcançados após 1 a 2 meses, em todos os regimes de dosagem testados (0,1-5,0 mg por dia).
Populações especiais
Idosos
A idade não tem efeito na farmacocinética do letrozol.
Insuficiência Renal
Em um estudo que envolveu 16 voluntárias na pós-menopausa com graus variados de função renal [clearance (depuração) de creatinina em 24 horas de 9 a 116 mL/min], não se detectou qualquer efeito sobre a exposição sistêmica farmacocinética do letrozol após uma dose única de 2,5 mg.
Em adição ao estudo, avaliando a influência da insuficiência renal no letrozol, foi realizada uma análise de covariância sobre os dados de dois estudos principais (Estudo AR/BC2 e Estudo AR/BC3). O clearance (depuração) de creatinina (CLcr) calculado [intervalo Estudo AR/BC2: 19 a 187 mL/min; intervalo Estudo AR/BC3: 10 a 180 mL/min] não mostrou associação estatisticamente significativa entre os níveis mínimos de letrozol plasmático no estado de equilíbrio (Cmin). Além disso, os dados do Estudo AR/BC2 e Estudo AR/BC3 na segunda linha do câncer de mama metastático não mostraram nenhuma evidência de reação adversa de letrozol no CLcr ou um prejuízo da função renal.
Portanto, nenhum ajuste de dose é necessário para pacientes com insuficiência renal (CLcr ? 10 mL/min). Há pouca informação disponível em pacientes com insuficiência grave da função renal (CLcr <10 mL / min).
Insuficiência Hepática
Em um estudo similar que envolveu indivíduos com graus variados de função hepática, a média dos valores da ASC das voluntárias com insuficiência hepática moderada (escore Child-Pugh B) foi 37% maior do que a de pacientes normais, mas ainda dentro da faixa observada em indivíduos sem a função prejudicada.
Em um estudo comparando a farmacocinética do letrozol após uma única dose oral em oito pacientes com cirrose hepática e insuficiência hepática grave (escore Child-Pugh C) com aquelas administradas em voluntárias sadias (n = 8), observou-se ASC e t1/2 aumentados para 95 e 187%, respectivamente. Portanto, espera-se que pacientes com câncer de mama e insuficiência hepática grave estejam mais expostos a níveis elevados de letrozol que pacientes sem disfunção hepática grave.
Entretanto, uma vez que para pacientes tratados com 5 ou 10 mg/dia nenhum aumento na toxicidade foi observado, uma redução da dose em pacientes com insuficiência hepática grave parece não ser justificada, contudo tais pacientes devem ser mantidos sob cuidadosa supervisão.
Além disso, em dois estudos bem controlados envolvendo 359 pacientes com câncer de mama avançado, não se observou qualquer efeito de insuficiência renal [clearance (depuração) de creatinina calculado: 20 - 50 mL/min] ou disfunção hepática foi encontrada com tal concentração de letrozol.
Dados de segurança pré-clínicos
Em uma variedade de estudos de segurança pré-clínicos conduzidos em animais de espécies-padrão, não houve evidência de toxicidade sistêmica ou no órgão-alvo.
O letrozol demonstrou um baixo grau de toxicidade aguda em roedores expostos a até 2000 mg/kg. Em cães, o letrozol causou sinais de toxicidade moderada com 100 mg/kg.
Em estudos de toxicidade de dose repetida em ratos e cães por até 12 meses, os principais achados podem ser atribuídos à ação farmacológica do composto. Em ambas as espécies, o nível sem reação adversa foi de 0,3 mg/kg.
A administração oral de letrozol em ratas, resultou em reduções no acasalamento e índices de gravidez e aumento da perda pré-implantação.
Em um estudo com ratos jovens, os efeitos farmacológicos de letrozol resultaram em achados esqueléticos, neuroendócrinos e reprodutivos. Crescimento ósseo e maturação foram diminuídos na dose mais baixa (0,003 mg/kg/dia) em machos e aumentados na dose mais baixa (0,003 mg/kg) em fêmeas. A densidade mineral óssea (DMO) também diminuiu nesta dose em fêmeas. No mesmo estudo, a fertilidade diminuída em todas as doses foi acompanhada por hipertrofia da hipófise, alterações testiculares que incluíram degeneração do epitélio tubular seminífero e atrofia do trato reprodutivo feminino. Com exceção do tamanho ósseo em fêmeas e alterações morfológicas nos testículos, todos os efeitos foram pelo menos parcialmente reversíveis.
Ambas as investigações, in vivo e in vitro, sobre o potencial mutagênico do letrozol não revelaram qualquer indicação de genotoxicidade.
Em um estudo de carcinogenicidade em ratos de 104 semanas, não se observaram tumores relacionados ao tratamento em ratos machos. Em ratas fêmeas, observou-se uma redução na incidência de tumores mamários benignos e malignos, com todas as doses de letrozol.
Em um estudo de carcinogenicidade em camundongos de 104 semanas, tumores não relacionados com o tratamento foram observados em camundongos machos.
Em camundongos fêmeas, em geral, um aumento relacionado com a dose na incidência de tumores ovarianos benignos de células da teca granulosa foi observado em todas as doses testadas do letrozol. Estes tumores foram considerados estar relacionados com a inibição farmacológica da síntese de estrogênio e pode ser devido a um aumento de LH resultante da diminuição de estrogênio circulante.
A administração oral de letrozol em ratas prenhas Sprague-Dawley resultou em um leve aumento na incidência de malformação fetal (cabeça redonda e fusão dos centros vertebrais) entre os animais tratados. Malformações semelhantes não foram observadas em coelhos brancos da Nova Zelândia. Entretanto, não foi possível mostrar se isto foi uma consequência indireta das propriedades farmacológicas (inibição da biossíntese de estrógeno), ou um efeito direto do letrozol por si só.
Observações pré-clínicas foram restritas àquelas associadas à ação farmacológica reconhecida, que é a única referência de segurança para uso humano derivada dos estudos em animais.
Cuidados de Armazenamento
Conservar em temperatura ambiente (entre 15 e 30C).
Número de lote e datas de fabricação e validade: vide embalagem.
?
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características do produto: Comprimido ocre, revestido, circular, biconvexo, sem vinco.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para
saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
M.S.: 1.0043.0953
Farm. Resp.: Dra. Sônia Albano Badaró – CRF-SP 19.258
EUROFARMA LABORATÓRIOS S.A.
Av. Vereador José Diniz, 3.465 - São Paulo - SP CNPJ: 61.190.096/0001-92
?Indústria Brasileira
informações complementares
| Fabricante |
| EUROFARMA |
| Princípio ativo |
| Letrozol |
| Categoria do medicamento |
| Medicamentos Especiais |
