para o que é indicado e para que serve?
Para que serve Pemetrexede dissódico pode ser utilizado para o tratamento dos seguintes tipos de câncer: Mesotelioma pleural maligno que não pode ser retirado por cirurgia; para o tratamento do mesotelioma, pemetrexede dissódico deve ser utilizado em combinação com uma platina.Continue lendo...
ofertas de
Pemetrexede Dissódico 100...
ofertas de Pemetrexede Dissódico 100...
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Pemetrexede dissódico pode ser utilizado para o tratamento dos seguintes tipos de câncer:
- Mesotelioma pleural maligno que não pode ser retirado por cirurgia; para o tratamento do mesotelioma, pemetrexede dissódico deve ser utilizado em combinação com uma platina.
- Câncer de pulmão (do tipo chamado de “Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas”), como quimioterapia inicial; para tal tratamento, pemetrexede dissódico deve ser utilizado em combinação com cisplatina.
- Câncer de pulmão (do tipo chamado de “Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas” localmente avançado ou metastático), cuja doença não progrediu após 4 ciclos de quimioterapia a base de platina; para tal tratamento, pemetrexede dissódico deve ser utilizado como agente isolado.
- Câncer de pulmão (do tipo chamado de “Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas”), após quimioterapia prévia; para tal tratamento, pemetrexede dissódico deve ser utilizado como agente isolado.
Como Pemetrexede Dissódico Glenmark funciona?
Pemetrexede dissódico é um medicamento utilizado para tentar bloquear o crescimento das células do tumor, fazendo com que o tumor diminua ou pare de crescer.
Baseado em dados in vitro, espera-se o início de ação do medicamento dentro de horas após a aplicação; entretanto, a eficácia terapêutica é observada ao longo do tempo.
Contraindicação
Pemetrexede dissódico não deve ser usado em pacientes alérgicos ao pemetrexede ou a qualquer um dos componentes da fórmula do medicamento.
Este medicamento é contraindicado para menores de 18 anos.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Como usar
Pemetrexede dissódico deve ser administrado exclusivamente pela via intravenosa (aplicado na veia).
O tratamento com Pemetrexede dissódico deve ser continuado até a progressão da doença de base.
Posologia
Mesotelioma Pleural Maligno
Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas localmente avançado ou metastático
Regime pré-medicação
Pacientes idosos
Nenhuma redução de dose, diferente daquelas recomendadas para todos os pacientes adultos, é especialmente recomendada para pacientes com 65 anos de idade ou mais.
Considerações importantes
Pemetrexede dissódico deve ser administrado mediante a supervisão de um médico qualificado e experiente no uso de medicamentos para o tratamento do câncer.
O manuseio e preparação de pemetrexede dissódico para infusão na veia devem ser feitos com precaução. O uso de luvas é recomendado.
Se a solução de pemetrexede dissódico entrar em contato com a pele, lavar o local imediatamente e completamente com água e sabão. Se pemetrexede dissódico entrar em contato com as mucosas, enxaguá-las abundantemente com água.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Pemtrexede Dissódico Glenmark?
A aplicação de pemetrexede dissódico deve ser efetuada exclusivamente por profissionais da área de saúde devidamente habilitados e em estabelecimentos de saúde.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico.
Precauções
Aplicar a dose de pemetrexede dissódico por um período maior que o recomendado na bula ou em intervalos menores que o recomendado na bula pode fazer com que ocorram mais efeitos. Antes de cada dose de pemetrexede dissódico, deve-se avaliar se existe alteração do número das células do sangue, devido a possibilidade do tratamento com pemetrexede dissódico causar a diminuição destas células.
Durante os estudos clínicos, quando pemetrexede dissódico foi administrado com o uso concomitante de ácido fólico e vitamina B12, observou-se menor taxa de efeitos colaterais.
Antes de cada dose de pemetrexede dissódico, deve-se também verificar, através do exame de sangue, se os rins e o fígado estão funcionando normalmente.
Pemetrexede dissódico não é recomendado para crianças, pois a eficácia e a segurança do seu uso nesta população não foram estabelecidas.
Em pacientes com alteração grave da função do fígado e dos rins, o uso de pemetrexede dissódico deve ser feito com cautela. Em idosos, a dose de pemetrexede dissódico é a mesma utilizada para os demais pacientes adultos.
Interações medicamentosas
Deve-se ter cuidado ao se administrar AINES (anti-inflamatórios não esteroidais) concomitante ao tratamento com pemetrexede dissódico em pacientes com alteração no funcionamento dos rins.
Recomenda-se que estes pacientes não utilizem AINES a partir de 2 dias antes da dose de pemetrexede dissódico e até 2 dias após.
Não há dados/estudos disponíveis sobre a interação entre pemetrexede dissódico e álcool, nicotina, exames laboratoriais e não laboratoriais.
Uma vez que pemetrexede dissódico é administrado na veia, a interação com comida é improvável.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
São conhecidos os seguintes efeitos colaterais decorrentes do tratamento com pemetrexede dissódico durante os estudos clínicos
Dados pós-comercialização
População Especial
Grávidez e Amamentação
O uso de pemetrexede dissódico deve ser evitado em mulheres grávidas, devido ao risco de causar alterações no bebê. Em mulheres que estejam amamentando, recomenda-se que a amamentação seja
interrompida caso a mãe tenha indicação de receber tratamento com pemetrexede dissódico.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Efeitos na capacidade de dirigir e operar máquinas
Não foram realizados estudos para avaliar o efeito do pemetrexede na capacidade de dirigir e operar máquinas. Entretanto, foi reportado que pemetrexede pode causar cansaço. Portanto, pacientes que estiverem sob tratamento com pemetrexede dissódico devem ter cuidado ao operar máquinas perigosas, incluindo automóveis.
Composição
Apresentações
Pó liofilizado para solução injetável 100 mg: 1 frasco-ampola com 15 mL.
Pó liofilizado para solução injetável 500 mg: 1 frasco-ampola com 30 mL.
Exclusivamente para administração intravenosa.
Uso adulto acima de 18 anos.
Composição
Superdosagem
Caso ocorra a administração de uma dose alta de pemetrexede dissódico, medidas gerais de suporte dos sintomas devem ser instituídas, a critério médico. O tratamento deve levar em consideração o uso de leucovorin ou timidina.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
O Pemetrexede Dissódico (substância ativa) é eliminado primariamente pelos rins na forma inalterada, como resultado da filtração glomerular e secreção tubular. Estudos in vitro indicam que pemetrexede é ativamente secretado pela OAT3 (transportador de ânion orgânico 3).
A administração concomitante de drogas e/ou substâncias nefrotóxicas secretadas pelos túbulos poderia resultar no retardo do clearance de pemetrexede.
Os resultados de estudos in vitro com microssomos hepáticos humanos sugerem que Pemetrexede Dissódico (substância ativa) não causaria interações clinicamente significantes com drogas metabolizadas pelas isoenzimas CYP3A, CYP2D6, CYP2C9 e CYP1A2.
A farmacocinética de pemetrexede não é influenciada pela suplementação de ácido fólico oral ou vitamina B12 intramuscular ou pela administração concomitante de cisplatina. O clearance total de platina não é afetado pela administração de Pemetrexede Dissódico (substância ativa).
Embora anti-inflamatórios não esteroidais (AINES) em doses moderadas possam ser administrados concomitantemente com Pemetrexede Dissódico (substância ativa) em pacientes com função renal normal (clearance de creatinina >80 mL/min), deve-se ter cuidado quando se administrar AINES concomitantemente com Pemetrexede Dissódico (substância ativa) em pacientes com insuficiência renal leve a moderada (clearance de creatinina de 45 a 79 mL/min). Recomenda-se que pacientes com insuficiência renal leve a moderada evitem tomar AINES com meia-vida de eliminação curta por um período de 2 dias anteriores, no dia e 2 dias seguintes à administração de Pemetrexede Dissódico (substância ativa).
Na ausência de dados sobre a potencial interação entre Pemetrexede Dissódico (substância ativa) e AINES com meia-vida longa, em pacientes com insuficiência renal leve a moderada, pacientes com este tipo de insuficiência e que estiverem sob tratamento com AINES, devem interromper a dose por pelo menos 5 dias anteriores ao tratamento, no dia, e 2 dias após a administração de Pemetrexede Dissódico (substância ativa). Se a administração concomitante de AINES for necessária, os pacientes devem ser monitorados de perto quanto à toxicidade, especialmente mielossupressão e toxicidade gastrointestinal.
Aspirina administrada em doses baixas a moderadas (325 mg a cada 6 horas) não afeta a farmacocinética de pemetrexede. O efeito de doses maiores de Aspirina sobre a farmacocinética de pemetrexede é desconhecido.
Não há dados/estudos disponíveis sobre a interação entre Pemetrexede Dissódico (substância ativa) e álcool, nicotina, exames laboratoriais e não laboratoriais.
Uma vez que Pemetrexede Dissódico (substância ativa) é de administração intravenosa, a interação com alimento é improvável.
Ação da Substância
Resultados de eficácia
O Pemetrexede Dissódico (substância ativa) no tratamento de Mesotelioma Pleural Maligno
A segurança e eficácia de Pemetrexede Dissódico (substância ativa), em combinação com a cisplatina, foram avaliadas em pacientes com Mesotelioma Pleural Maligno (MPM) que não receberam quimioterapia prévia.
Estudo randomizado
Um estudo multicêntrico, randomizado, simples-cego, em 448 pacientes com MPM que não receberam quimioterapia prévia, comparou a sobrevida de pacientes tratados com Pemetrexede Dissódico (substância ativa) em combinação à cisplatina com a sobrevida de pacientes recebendo cisplatina isolada. O Pemetrexede Dissódico (substância ativa) foi administrado por via intravenosa em até 10 minutos na dose de 500 mg/m2 e a cisplatina foi administrada por via intravenosa em até 2 horas na dose de 75 mg/m2, iniciando-se aproximadamente 30 minutos após o término da administração de Pemetrexede Dissódico (substância ativa). Ambas as drogas foram dadas no Dia 1 de cada ciclo de 21 dias. Após tratamento de 117 pacientes, a toxicidade de células brancas e gastrointestinal (GI) conduziu a uma alteração no protocolo, a fim de se fazer a suplementação de ácido fólico e vitamina B12 a todos os pacientes.
A análise primária desse estudo foi realizada na população de todos os pacientes aleatoriamente designados para um dos tratamentos do estudo (randomizados e tratados). Uma análise também foi realizada nos pacientes que receberam suplementação de ácido fólico e vitamina B12, conforme é recomendado para o tratamento com Pemetrexede Dissódico (substância ativa).
Os resultados de eficácia foram semelhantes entre o grupo total de pacientes e o grupo que recebeu suplementação durante todo o tratamento. Os dados demográficos são apresentados na Tabela 1.
Tabela 1: Resumo das Características dos Pacientes do estudo com Mesotelioma Pleural Maligno:
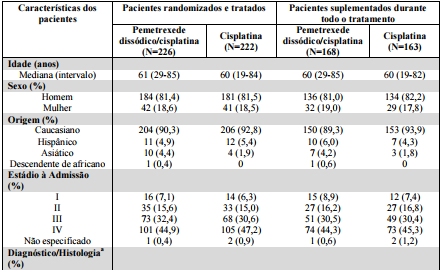
 aApenas 67% dos pacientes tiveram diagnóstico histológico de mesotelioma maligno confirmado por revisão independente.
aApenas 67% dos pacientes tiveram diagnóstico histológico de mesotelioma maligno confirmado por revisão independente.
b Escala de Performance Status de Karnofsky.
A Tabela 2 resume os resultados de sobrevida de todos os pacientes tratados e randomizados, independentemente da suplementação com vitaminas e aqueles pacientes que receberam a suplementação desde a admissão no estudo.
Tabela 2: Eficácia de Pemetrexede Dissódico (substância ativa) mais cisplatina vs. cisplatina para Mesotelioma Pleural Maligno:
 *Valor de p refere-se à comparação entre os braços.
*Valor de p refere-se à comparação entre os braços.
Resultados semelhantes foram vistos na análise dos pacientes (N=303) com diagnóstico histológico confirmado de MPM. As análises demográficas exploratórias não apresentaram diferença aparente no que se refere à faixa etária. O pequeno número de pacientes não brancos não permitiu a avaliação de diferenças étnicas. O efeito em mulheres (sobrevida mediana de 15,7 meses com a combinação versus 7,5 meses com cisplatina isolada), entretanto, foi maior do que o efeito em homens (sobrevida mediana de 11 versus 9,4; respectivamente). Como em qualquer análise exploratória, não está claro se essa diferença é real ou se é um achado ao acaso.
A resposta tumoral objetiva do MPM é difícil de ser mensurada pelos exames convencionais de imagem e os critérios de resposta não são um consenso universal. Entretanto, baseada nos critérios prospectivamente definidos, a taxa de resposta tumoral objetiva com Pemetrexede Dissódico (substância ativa) mais cisplatina foi maior do que a taxa obtida com a cisplatina isolada. Houve também melhora da função pulmonar no grupo de Pemetrexede Dissódico (substância ativa) mais cisplatina comparado ao grupo controle.
Os pacientes que receberam suplementação com ácido fólico e vitamina B12 durante todo o estudo receberam em média 6 e 4 ciclos de tratamento com Pemetrexede Dissódico (substância ativa)/cisplatina (N=168) e cisplatina (N=163), respectivamente. Os pacientes que nunca receberam ácido fólico e vitamina B12 receberam em média 2 ciclos em ambos os grupos de tratamento (N=32 e N=38 para os grupos de Pemetrexede Dissódico (substância ativa)/cisplatina e cisplatina, respectivamente).
Pacientes recebendo Pemetrexede Dissódico (substância ativa) no grupo suplementado durante todo o estudo receberam uma intensidade de dose relativa de 93% da especificada no protocolo; pacientes tratados com cisplatina (no mesmo braço de Pemetrexede Dissódico (substância ativa)) receberam 94% da intensidade da dose planejada. Pacientes tratados com cisplatina isolada receberam intensidade de dose de 96%.
Pemetrexede Dissódico (substância ativa) em combinação com cisplatina no tratamento de Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas localmente avançado ou metastático
A segurança e a eficácia de Pemetrexede Dissódico (substância ativa), em combinação com cisplatina, foram avaliadas em pacientes com Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas localmente avançado ou metastático (estádios IIIb e IV), como quimioterapia inicial. Estudo randomizado: um estudo multicêntrico, randomizado, aberto, em 1.725 pacientes que não receberam quimioterapia prévia com estádio IIIb/IV de Câncer de Pulmão de Células Não Pequenas (CPCNP) foi conduzido para comparar a sobrevida global de pacientes tratados com Pemetrexede Dissódico (substância ativa) em combinação com cisplatina (AC) versus gencitabina mais cisplatina (GC). Pemetrexede Dissódico (substância ativa) foi administrado por via intravenosa em até 10 minutos na dose de 500 mg/m2 e a cisplatina foi administrada por via intravenosa na dose de 75 mg/m2 após a administração de Pemetrexede Dissódico (substância ativa) no Dia 1 de cada ciclo de 21 dias. A gencitabina foi administrada na dose de 1.250 mg/m2 no Dia 1 e Dia 8 e a cisplatina foi administrada por via intravenosa na dose de 75 mg/m2 após administração de gencitabina, no Dia 1 de cada ciclo de 21 dias. O tratamento foi administrado por um total de até 6 ciclos e os pacientes em ambos os grupos de tratamento receberam ácido fólico, vitamina B12 e dexametasona.
As características demográficas dos pacientes da população intenção de tratamento (ITT) estão naTabela 3. As características demográficas e das doenças foram bem equilibradas.
Tabela 3: Resumo das Características dos Pacientes do Estudo de CPCNP – Combinação com cisplatina:
|
Característica do paciente | Pemetrexede Dissódico (substância ativa) mais cisplatina (AC) (N=862) |
Gencitabina mais cisplatina |
|
Idade (anos) | ||
|
Mediana (intervalo) | 61,1 (28,8-83,2) |
61,0 (26,4-79,4) |
|
Sexo (%) | ||
|
Homem/Mulher | 70,2%/29,8% |
70,2%/29,8% |
|
Origem (%) | ||
|
Caucasiano |
669 (77,6%) |
680 (78,8%) |
|
Hispânico | 27 (3,1%) |
23 (2,7%) |
|
Asiático | 146 (16,9%) |
141 (16,3%) |
|
Descendente de africano | 18 (2,1%) |
18 (2,1%) |
|
Estádio à admissão | ||
|
IIIb/IV | 23,8%/76,2% |
24,3%/75,7% |
|
Histologia | ||
|
CNPC não escamosasa | 23,8%/76,2% |
24,3%/75,7% |
|
Adenocarcinoma | 436 (50,6) |
411 (47,6) |
|
Células grandes | 76 (8,8%) |
77 (8,9%) |
|
Outrob | 106 (12,3%) |
146 (16,9%) |
|
Escamosas | 244 (28,3%) |
229 (26,5%) |
|
ECOG PSc,d | ||
|
0/1 | 35,4%/64,6% |
35,6%/64,3% |
|
Histórico de tabagismoe | ||
|
Sempre/nunca foi fumante | 83,1%/16,9% |
83,9%/16,1% |
aInclui adenocarcinoma, células grandes e outras histologias exceto as com tipo células escamosas.
bO subgrupo “outro” representa pacientes com diagnóstico primário de CPCNP nos quais a doença não foi claramente qualificada como adenocarcinoma, carcinoma de células escamosas ou carcinoma de células grandes.
cEastern Cooperative Oncology Group Performance Status.
dNão foi reportado ECOG PS para todos os pacientes randomizados. As porcentagens são representativas de um N=861 para o braço de Pemetrexede Dissódico (substância ativa) mais cisplatina e N=861 para o braço de gencitabina mais cisplatina.
eO histórico de tabagismo foi coletado de 88% dos pacientes randomizados (N=757 para o braço de Pemetrexede Dissódico (substância ativa) mais cisplatina e N=759 para o braço de gencitabina mais cisplatina).
Os pacientes receberam uma mediana de 5 ciclos de tratamento em ambos os grupos de estudo. Os pacientes tratados com Pemetrexede Dissódico (substância ativa) mais cisplatina receberam 94,8% da intensidade da dose relativa de Pemetrexede Dissódico (substância ativa) especificada no protocolo e 95% da intensidade da dose relativa de cisplatina especificada no protocolo. Pacientes tratados com gencitabina mais cisplatina receberam 85,8% da intensidade da dose relativa de gencitabina especificada no protocolo e 93,5% da intensidade da dose relativa de cisplatina especificada no protocolo.
O desfecho primário desse estudo foi a sobrevida global. A sobrevida mediana foi de 10,3 meses no grupo de Pemetrexede Dissódico (substância ativa) mais cisplatina e de 10,3 meses no grupo da gencitabina mais cisplatina, com coeficiente de risco ajustado de 0,94.
Tabela 4: Eficácia de Pemetrexede Dissódico (substância ativa) mais cisplatina vs. gencitabina mais cisplatina no Tratamento de Primeira Linha para CPCNP – População ITT:
| Pemetrexede Dissódico (substância ativa) mais cisplatina (N=862) |
Gencitabina mais cisplatina | |
|
Sobrevida Global Mediana (95% IC) | 10,3 meses (9,8-11,2) |
10,3 meses (9,6-10,9) |
|
Coeficiente de risco ajustado (HR)a,b (95% IC) | 0,94 (0,84-1,05) | |
|
Sobrevida Mediana Livre de Progressão (95% IC) | 4,8 meses (4,6-5,3) |
5,1 meses (4,6-5,5) |
|
Coeficiente de Risco Ajustado (HR)a,b (95% IC) | 1,04 (0,94-1,15 | |
|
Taxa de Resposta Global (95% IC) | 27,1% (24,2-30,1) |
24,7% (21,8-27,6) |
a Ajustado para sexo, estadio, base de diagnóstico e Performance Status.
b Um HR menor que 1,0 indica que a sobrevida é melhor no braço Pemetrexede Dissódico (substância ativa) mais cisplatina (AC) do que no braço gencitabina mais cisplatina (GC). Em contrapartida, um HR maior que 1,0 indica que a sobrevida é melhor no braço GC do que no braço AC.
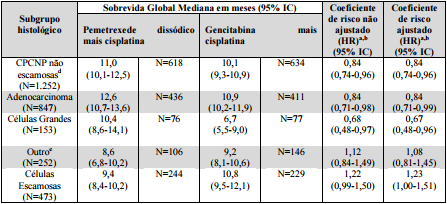
Uma análise pré-determinada do impacto da histologia do CPCNP na sobrevida global foi realizada. Foram observadas diferenças clinicamente relevantes na sobrevida com base na histologia, conforme demonstrado na Tabela 5. No tratamento com Pemetrexede Dissódico (substância ativa), agente isolado para segunda linha e estudo de manutenção, estas diferenças nos efeitos com base na histologia também foram observadas.
Tabela 5: Sobrevida Global com Pemetrexede Dissódico (substância ativa) mais cisplatina vs. gencitabina mais cisplatina para CPCNP – Subgrupos Histológicos:
 a Um HR menor que 1,0 indica que a sobrevida é melhor no braço Pemetrexede Dissódico (substância ativa) mais cisplatina (AC) do que no braço gencitabina mais cisplatina (GC). Em contrapartida, um HR maior que 1,0 indica que a sobrevida é melhor no braço GC do que no braço AC.
a Um HR menor que 1,0 indica que a sobrevida é melhor no braço Pemetrexede Dissódico (substância ativa) mais cisplatina (AC) do que no braço gencitabina mais cisplatina (GC). Em contrapartida, um HR maior que 1,0 indica que a sobrevida é melhor no braço GC do que no braço AC.
b Não ajustado para múltiplas comparações.
c HRs ajustados por ECOG PS, sexo, estadio da doença e base para diagnóstico patológico (histopatológico/citopatológico).
d Inclui adenocarcinoma, células grandes e outras histologias exceto as com o tipo células escamosas.
e O subgrupo “outro” representa pacientes com diagnóstico primário de CPCNP nos quais a doença não foi claramente qualificada como adenocarcinoma, carcinoma de células escamosas ou carcinoma de células grandes.
Pemetrexede Dissódico (substância ativa) no tratamento de Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas localmente avançado ou metastático, cuja doença não progrediu após 4 ciclos de quimioterapia a base de platina
A segurança e a eficácia de Pemetrexede Dissódico (substância ativa) foram avaliadas em pacientes com Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas estádio IIIb/IV em que não houve progressão da doença após 4 ciclos de quimioterapia a base de platina.
Estudo randomizado: um estudo multicêntrico, randomizado, duplo-cego, placebo-controlado foi conduzido com 663 pacientes com CPCNP estádio IIIb/IV em que não houve progressão da doença após 4 ciclos de quimioterapia a base de platina. Pacientes cuja doença não progrediu foram randomizados na forma 2:1 para receber Pemetrexede Dissódico (substância ativa) ou placebo imediatamente após a quimioterapia a base de platina. Pemetrexede Dissódico (substância ativa) foi administrado por via intravenosa em 10 minutos na dose de 500 mg/m2 no Dia 1 em cada ciclo de 21 dias até a progressão da doença. Os pacientes em ambos os braços do estudo receberam ácido fólico, vitamina B12 e dexametasona.
O estudo foi desenhado para demonstrar a superioridade da sobrevida livre de progressão (SLP) e da sobrevida global de Pemetrexede Dissódico (substância ativa) em relação ao placebo. A SLP foi avaliada em uma revisão independente. As características dos pacientes da população intenção de tratar são apresentadas na Tabela 6. As características demográficas e da doença no momento em que os pacientes entraram no estudo foram bem balanceadas entre os braços do estudo.
Tabela 6: Tratamento de Manutenção – Resumo das Características dos Pacientes no estudo de CPCNP:
|
Característica do paciente | Pemetrexede Dissódico (substância ativa) (N=441) |
Placebo (N=222) |
|
Idade (anos) | ||
|
Mediana (intervalo) | 60,0 (25,6-82,6) |
60,4 (35,4-78,5) |
|
Sexo | ||
|
Homem/Mulher | 73,0%/27,0% |
72,5%/27,5% |
|
Origem étnica | ||
|
Caucasiano | 279 (63,3%) |
149 (67,1%) |
|
Asiático | 104 (23,6%) |
50 (22,5%) |
|
Descendente de africano | 58 (13,2%) |
23 (10,4%) |
|
Estádio à admissãoa | ||
|
IIIb/IV | 18,0%/82,0% |
21,2%/78,8% |
|
Histologia (%) | ||
|
CNPC não escamosasb | 325 (73,7%) |
156 (70,3%) |
|
Adenocarcinoma | 222 (50,3%) |
106 (47,7%) |
|
Células grandes | 10 (2,3%) |
10 (4,5%) |
|
Outroc | 93 (21,1%) |
40 (18,0%) |
|
Células escamosas | 116 (26,3%) |
66 (29,7%) |
|
ECOG PSd | ||
|
0/1 | 40,1%/59,9% |
38,3%/61,7% |
|
Histórico de tabagismoe | ||
|
Sempre/nunca foi fumante | 74,1%/25,9% |
71,5%/28,5% |
|
Tempo entre o início da introdução do tratamento e a randomização do estudo (meses) | ||
|
Mediana (intervalo) | 3,25 (1,6-4,8) |
3,29 (2,7-5,1) |
a O estadio à admissão não foi relatado para todos os pacientes randomizados. As porcentagens são representativas de um N=440 para o braço Pemetrexede Dissódico (substância ativa) e N=222 para o braço placebo.
b Inclui pacientes com adenocarcinoma, células grandes e outros diagnósticos de histologias.
c O subgrupo “outro” representa pacientes com diagnóstico primário de CPCNP nos quais a doença não foi claramente qualificada como adenocarcinoma, carcinoma de células grandes ou carcinoma de células escamosas.
d Eastern Cooperative Oncology Group Performance Status (ECOG PS) não foi reportado para todos os pacientes randomizados. As porcentagens são representativas de um N=439 para o braço de Pemetrexede Dissódico (substância ativa) e N=222 para o braço placebo.
e O histórico de tabagismo não foi relatado para todos os pacientes randomizados. As porcentagens são representativas de um N=437 para o braço Pemetrexede Dissódico (substância ativa) e N=221 para o braço placebo.
Os pacientes receberam uma mediana de 5 ciclos de Pemetrexede Dissódico (substância ativa) e 3,5 ciclos de placebo. Os pacientes tratados com Pemetrexede Dissódico (substância ativa) receberam 95,7% da intensidade da dose relativa de Pemetrexede Dissódico (substância ativa). Um total de 213 pacientes (48,3%) completaram ? 6 ciclos e um total de 98 pacientes (22,6%) completaram ? 10 ciclos do tratamento com Pemetrexede Dissódico (substância ativa).
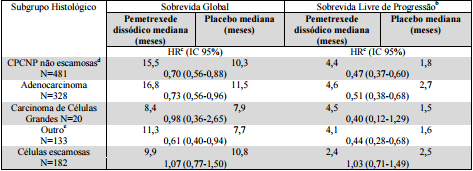
Na população global do estudo, Pemetrexede Dissódico (substância ativa) foi estatisticamente superior ao placebo em termos de sobrevida global (SG) [mediana de 13,4 meses versus 10,6 meses, HR=0,79 (IC 95%: 0,65-0,95), valor de p=0,012] e SLP [mediana de 4,0 meses versus 2,0 meses, HR=0,60 (IC 95%: 0,49-0,73), valor de p < 0,00001].
Foi observada uma diferença nos resultados dos tratamentos de acordo com a classificação histológica. Para a população de pacientes com CPCNP não escamosas Pemetrexede Dissódico (substância ativa) foi superior ao placebo para SG [mediana de 15,5 meses versus 10,3 meses, HR=0,70 (IC 95%: 0,56-0,88)] e SLP [mediana de 4,4 meses versus 1,8 meses, HR=0,47 (IC 95%: 0,37-0,60)].
Para a população de pacientes com CPCNP escamosas, Pemetrexede Dissódico (substância ativa) não melhorou a SG em comparação com o placebo [mediana 9,9 meses versus 10,8 meses, HR=1,07 (IC 95%: 0,77-1,50)] ou SLP [mediana de 2,4 meses versus 2,5 meses, HR=1,03 (IC 95%: 0,71-1,49)]. Esta diferença no efeito do tratamento para Pemetrexede Dissódico (substância ativa) baseado na histologia demonstrando falta de benefício em histologia de células escamosas foi também observada nos estudos de primeira e segunda linha.
Os resultados de eficácia para a população global de pacientes são apresentados na Tabela 7 e os resultados de eficácia pelos subgrupos histológicos pré-especificados são apresentados na Tabela 8.
Tabela 7: Tratamento de Manutenção – Eficácia de Pemetrexede Dissódico (substância ativa) vs. Placebo em CPCNP – População ITT:
|
Parâmetro de eficáciaa,b | Pemetrexede Dissódico (substância ativa) (N=441) |
Placebo (N=222) |
|
Sobrevida Global Medianac (95% IC) | 13,4 meses (11,9-15,9) |
10,6 meses (8,7-12,0) |
|
Coeficiente de risco c (HR) (95% IC) | 0,79 (0,65-0,95) | |
|
Valor de p | p=0,012 | |
|
Sobrevida Mediana Livre de Progressão (95% IC) | 4,0 meses (3,1-4,4) |
2,0 meses (1,5-2,8) |
|
Coeficiente de risco c (HR) (95% IC) | 0,60 (0,49-0,73) | |
|
Valor de p | p < 0,00001 | |
a SLP e SG foram calculadas no período de randomização, após ter sido completado os 4 ciclos de quimioterapia a base de platina.
b Os valores fornecidos para SLP, baseados em revisão independente (Pemetrexede Dissódico (substância ativa) N=387, Placebo N=194).
c São fornecidos os coeficientes de risco (HR) não ajustados: um HR < 1,0 indica que o resultado é melhor no braço Pemetrexede Dissódico (substância ativa) do que no braço placebo do estudo.
Tabela 8: Tratamento de Manutenção Eficácia em CPCNP por Subgrupos Histológicosa:
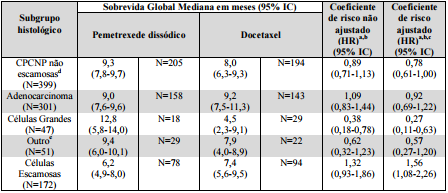 a SLP e SG foram calculadas no período de randomização, após ter sido completado os 4 ciclos de quimioterapia a base de platina. Todos os resultados não ajustados para múltiplas comparações.
a SLP e SG foram calculadas no período de randomização, após ter sido completado os 4 ciclos de quimioterapia a base de platina. Todos os resultados não ajustados para múltiplas comparações.
b Os valores fornecidos para SLP, baseados em revisão independente (Pemetrexede Dissódico (substância ativa) N=387, Placebo N=194).
c São fornecidos coeficientes de risco (HR) não ajustados. Um HR < 1,0 indica que o resultado é melhor no braço pemetrexede dissódico do que no braço placebo do estudo. Um HR > 1,0 indica que o resultado é melhor no braço placebo do queno braço Pemetrexede Dissódico (substância ativa) do estudo.
d Inclui pacientes com adenocarcinoma, carcinoma de células grandes e outras histologias.
e O subgrupo “outro” representa pacientes com diagnóstico primário de CPCNP nos quais a doença não foi claramente qualificada como adenocarcinoma, carcinoma de células grandes ou carcinoma de células escamosas.
Pemetrexede Dissódico (substância ativa) como agente isolado após quimioterapia prévia no tratamento para Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas localmente avançado ou metastático: a segurança e a eficácia de Pemetrexede Dissódico (substância ativa) como agente isolado foram avaliadas em pacientes com Câncer de Pulmão de Células Não Pequenas com Histologia de Células Não Escamosas localmente avançado ou metastático (estadios III ou IV), após um esquema de quimioterapia prévia.
Características Farmacológicas
Descrição
Pemetrexede Dissódico (substância ativa) é um agente antineoplásico antifolato que exerce sua ação através do rompimento de processos metabólicos folato-dependentes, essenciais para a replicação da célula. O Pemetrexede Dissódico (substância ativa) hemipentaidratado tem a denominação química de sal dissódico de N-[4-[2-(2-amino-4,7-diidro-4-oxo-1H-pirrolo[2,3-d]pirimidina-5-il)etil]benzoil]-L-ácido glutâmico hemipentaidratado. É um sólido branco a quase branco, com fórmula molecular C20H19N5Na2O6.2,5H2O e peso molecular de 516,42.
Propriedades farmacodinâmicas
Estudos in vitro demonstraram que pemetrexede atua como um antifolato de múltiplos alvos, através da inibição da timidilatosintetase (TS), da diidrofolatoredutase (DHFR) e da ribonucleotídeo glicinamida formiltransferase (GARFT), que são enzimas-chave folato-dependentes para a biossíntese de novo dos nucleotídeos de timidina e purina. Após a administração intravenosa, pemetrexede é transportado para dentro das células por ambos os sistemas de transporte de folato, ligado às proteínas de membrana e de carreadores de folato reduzidos. Uma vez na célula, pemetrexede é convertido nas formas de poliglutamato pela enzima folil poliglutamato sintetase.
Baseado em dados in vitro, a ação farmacológica é esperada iniciar dentro de horas após a aplicação, entretanto a eficácia terapêutica é observada ao longo do tempo. As formas de poliglutamato são retidas nas células e são inibidoras ainda mais potentes de TS e GARFT. A poliglutamação é um processo dependente do tempo e da concentração e ocorre nas células tumorais e, em menor extensão, nos tecidos normais. Os metabólitos poliglutamatados têm maior meia-vida intracelular, resultando na ação prolongada da droga nas células malignas.
Estudos com linhagem de células MSTO-211H de mesotelioma mostraram efeitos sinérgicos quando pemetrexede foi combinado com a cisplatina.
Propriedades farmacocinéticas
Pemetrexede Dissódico (substância ativa) deve ser administrado somente por via intravenosa, tendo um volume de distribuição no estado de equilíbrio de 16,1 litros. Estudos in vitro indicam que pemetrexede está aproximadamente 81% ligado às proteínas plasmáticas. A ligação não é afetada pelo grau de insuficiência renal. Pemetrexede tem metabolismo hepático limitado. Pemetrexede é eliminado primariamente na urina, com 70% a 90% da dose recuperada inalterada dentro das primeiras 24 horas após a administração. O clearance plasmático total de pemetrexede é de 92 mL/min e a meia-vida de eliminação no plasma é de 3,5 horas em pacientes com função renal normal (clearance de creatinina de 90 mL/min).
A exposição sistêmica total de pemetrexede (AUC) e a concentração plasmática máxima (Cmáx) aumentam proporcionalmente com a dose. A farmacocinética do pemetrexede é consistente por múltiplos ciclos de tratamento.
Cuidados de Armazenamento
Pemetrexede dissódico deve ser armazenado em temperatura ambiente (entre 15° C a 30º C). Proteger da luz e da umidade.
A estabilidade química e física das soluções reconstituídas e de infusão de pemetrexede dissódico foidemonstrada por até 48 horas após a reconstituição inicial, quando armazenadas sob refrigeração (2 a 8ºC). Descartar qualquer porção não usada.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características Físicas
Pemetrexede dissódico é apresentado em frascos de vidro incolor.
Pemetrexede dissódico é um pó estéril liofilizado, de cor branca a amarelada.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS 1.1013.0270
Farmacêutica Responsável:
Valéria Medeiros Miqueloti CRF/SP nº 51.263
Fabricado por:
Glenmark Generics S.A.
Pilar, Parque Industrial - Buenos Aires - Argentina
Importado por:
Glenmark Farmacêutica Ltda.
Rua Frei Liberato de Gries, 548, São Paulo, Brasil.
CNPJ 44.363.661/0001-57
Sac: 0800 773 0130
Venda sob prescrição médica.
Uso restrito a hospitais.
informações complementares
| Fabricante |
| GLENMARK |
| Princípio ativo |
| Pemetrexede Dissódico |
| Categoria do medicamento |
| Medicamentos Especiais |
