para o que é indicado e para que serve?
Para que serve O Sprycel é um medicamento de prescrição médica usado para tratar adultos com: Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+) na fase crônica recém-diagnosticada; Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+), que não estão mais se beneficiando com, ou têm intolerância à terapia anterior incluindo mesilato de imatinibe; Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+), que não estão mais se beneficiando com, ou têm intolerância à terapia anterior.Continue lendo...
ofertas de
Sprycel 100Mg 30 Comprimi...
ofertas de Sprycel 100Mg 30 Comprimi...
R$ 10.805,04
R$ 11.139,22
R$ 13.044,00
R$ 14.258,70
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
O Sprycel é um medicamento de prescrição médica usado para tratar adultos com:
- Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+) na fase crônica recém-diagnosticada;
- Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+), que não estão mais se beneficiando com, ou têm intolerância à terapia anterior incluindo mesilato de imatinibe;
- Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+), que não estão mais se beneficiando com, ou têm intolerância à terapia anterior.
Como Sprycel funciona?
O princípio ativo do Sprycel é o dasatinibe. O dasatinibe age reduzindo a atividade das proteínas dentro das células leucêmicas de pacientes adultos com Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+) ou Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+). Essas proteínas são responsáveis pelo crescimento descontrolado das células da leucemia. Ao inibir essas proteínas, o Sprycel mata as células leucêmicas na medula óssea e permite que a produção normal de células vermelhas, brancas e plaquetas seja retomada.
As pessoas respondem de forma diferente ao tratamento e a sua resposta ao tratamento com Sprycel poderá depender de diversos fatores, incluindo a fase da doença e tratamentos anteriores. Os objetivos gerais de tratamento para pacientes tratados com Sprycel incluem a redução do número de células de leucemia e melhora da contagem de células sanguíneas.
Durante o tratamento com Sprycel, seu médico irá monitorar o progresso realizando exames laboratoriais de rotina para avaliar sua contagem de células sanguíneas.
Contraindicação
Sprycel é contraindicado em pacientes com hipersensibilidade ao dasatinibe ou a qualquer outro componente da formulação.
Como usar
É muito importante que você tome Sprycel exatamente como seu médico indicar.
A dose usual para fase crônica da Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+) é de 100 mg administrada oralmente uma vez ao dia.
A dose usual para a fase acelerada ou crise blástica da LMC Ph+ ou Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+) é de 140 mg administrada oralmente uma vez ao dia.
Sprycel pode ser tomado junto ou não com a alimentação, pela manhã ou pela noite. Procure tomar o Sprycel na mesma hora todos os dias.
Dependendo da resposta ao tratamento e dos efeitos colaterais que você apresentar, seu médico poderá ajustar a dose do Sprycel aumentando-a ou reduzindo-a ou poderá suspender temporariamente o tratamento com Sprycel.
Você não deve mudar a dose ou parar de tomar Sprycel sem antes conversar com o seu médico.
Instruções de uso
Engula o comprimido de Sprycel inteiro, com água. Não quebre, corte ou esmague os comprimidos.
Manuseio e Descarte
Procedimentos para o manuseio correto e descarte de medicamentos contra o câncer devem ser considerados.
Foram publicadas diversas diretrizes sobre o assunto.
Sprycel (dasatinibe) comprimidos consiste de um comprimido central (contendo a substância ativa), revestido por uma camada de filme para impedir a exposição à substância ativa. Mulheres grávidas devem evitar a exposição aos comprimidos amassados e/ou quebrados.
Risco de uso por via de administração não recomendada.
Para segurança e eficácia desta apresentação, Sprycel não deve ser administrado por vias não recomendadas. A administração deve ser somente pela via oral.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não pode ser partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar Sprycel?
Se você se esquecer de tomar uma dose de Sprycel, tome a próxima dose no horário marcado. Não tome duas doses ao mesmo tempo.
Ligue para o seu médico se não tiver certeza do que deve fazer.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Informe seu médico sobre todas as suas condições de saúde, inclusive se você tiver algum problema no fígado, coração ou pulmão, for intolerante à lactose ou se tiver vida sexual ativa. Informe também se já teve hepatite B, ou se esteve exposto a alguma forma de contágio, como: contato com o sangue, ou com secreções corporais de indivíduos contaminados com o vírus da hepatite B. Aconselha-se o uso de métodos contraceptivos durante o tratamento para homens e mulheres em idade fértil.
Uso Pediátrico
A segurança e eficácia do Sprycel em pacientes com menos de 18 anos de idade não foram estabelecidas.
Uso em Idosos
Dos 2712 pacientes nos estudos clínicos de Sprycel, 617 (23%) tinham 65 anos de idade ou mais e 123 (5%) tinham 75 anos ou mais. Nenhuma diferença na eficácia foi observada entre a população de pacientes mais velhos e mais jovens. O perfil de segurança de Sprycel na população geriátrica foi similar à população mais jovem, entretanto pacientes com 65 anos de idade ou mais foram mais propensos a apresentar eventos adversos, incluindo eventos de retenção de líquidos e dispneia (falta de ar).
Gravidez
Sprycel pode causar danos ao feto quando administrado a mulheres gestantes. As mulheres devem evitar a gravidez durante o tratamento com Sprycel.
Informe seu médico imediatamente se ficar grávida ou planejar engravidar durante o tratamento com Sprycel.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Informe imediatamente seu médico em caso de suspeita de gravidez.
Amamentação
Não se sabe se o Sprycel é excretado pelo leite materno e se pode prejudicar seu bebê. Dado que muitas drogas são excretadas no leite materno e dado o potencial de efeitos colaterais sérios de Sprycel em lactentes, discuta com seu médico para decidir se interrompe a amamentação ou descontinua o medicamento, levando em consideração a importância do medicamento para a sua saúde. Não amamente se você estiver tomando Sprycel.
Capacidade de dirigir veículos e operar máquinas
Nenhum estudo sobre o efeito na capacidade de dirigir e operar máquinas foi realizado. Recomenda-se cautela na condução de veículos ou operação de máquinas.
Interações Medicamentosas
Informe seu médico sobre todos os demais medicamentos que estiver tomando, incluindo medicamentos de venda sob prescrição médica e os sem exigência de prescrição médica, vitaminas, antiácidos e suplementos com ervas.
Sprycel é eliminado do seu corpo através do fígado. O uso simultâneo do Sprycel com certos medicamentos pode alterar os níveis do Sprycel na corrente sanguínea. Da mesma forma, os níveis de outros medicamentos na corrente sanguínea podem ser afetados pelo Sprcel. Grandes alterações nos níveis desses medicamentos na sua corrente sanguínea podem estar associadas com um aumento dos efeitos colaterais ou uma redução da atividade dos medicamentos que você está tomando, inclusive do próprio Sprycel.
Exemplos de medicamentos que aumentam os níveis do Sprycel na sua corrente sanguínea são cetoconazol, itraconazol, eritromicina, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina e voriconazol.
Exemplos de medicamentos que diminuem os níveis do Sprycel na sua corrente sanguínea são dexametazona, fenitoína, carbamazepina, rifampicina, rifabutina e fenobarbital. A Erva de São João também pode diminuir os níveis de Sprycel, seu uso deve ser evitado.
Medicamentos cujos níveis podem ser alterados pelo Sprycel são alfentanil, astemizil, terfenadina, cisaprida, ciclosporina, fentanil, pimozida, quinidina, sirolimus, tacrolimus e alcalóides de ergot.
A absorção do Sprycel para a corrente sanguínea é melhor atingida na presença de um estômago ácido.
Você deve evitar tomar medicamentos que reduzam a acidez estomacal, tais como cimetidina, famotidina, ranitidina, omeprazol, pantoprazol sódico, esomeprazol, rabeprazol e lansoprazol durante o tratamento com Sprycel. Medicamentos que neutralizam a acidez estomacal, como hidróxido de alumínio/ hidróxido de magnésio, carbonato de cálcio ou carbonato de cálcio e magnésio, podem ser tomados até duas horas antes ou duas horas depois do Sprycel.
Uma vez que a terapia com Sprycel pode estar associada com sangramento, informe seu médico se você estiver fazendo uso regular de agentes que interferem com a coagulação, deixando o sangue mais fluido (fino), incluindo medicamentos como a varfarina sódica ou ácido acetilsalicílico.
Interações Medicamento-Alimento
Suco de toranja (grapefruit) pode aumentar a concentração plasmática de dasatinibe e deve ser evitado.
A Erva de São João pode diminuir as concentrações plasmáticas de dasatinibe de maneira imprevisível e deve ser evitada.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamentos sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
As informações a seguir descrevem os efeitos colaterais mais importantes dos quais você deve estar ciente.
Você deve informar seu médico de todos os sintomas não esperados.
Diminuição do número de Células Sanguíneas:
O tratamento com Sprycel pode estar associado com baixas contagens de células vermelhas (anemia), células brancas (neutropenia) ou plaquetas (trombocitopenia).
Seu médico irá checar as contagens das células sanguíneas regularmente durante o tratamento com Sprycel e poderá ajustar sua dose de Sprycel ou suspender temporariamente o medicamento caso as contagens estejam baixas demais. Se você apresentar febre quando estiver tomando Sprycel, procure seu médico imediatamente.
Sangramento:
O tratamento com Sprycel pode estar associado com sangramento. Os sangramentos mais graves observados em estudos clínicos incluíram sangramento cerebral, levando à morte 1% dos pacientes nos estudos clínicos, e sangramento gastrointestinal. As hemorragias menos graves incluíram sangramentos pelo nariz, das gengivas, hematomas na pele e sangramento menstrual excessivo. Você deverá informar seu médico imediatamente caso apresente sangramentos ou manchas roxas de qualquer gravidade, que surjam espontaneamente ou sejam decorrentes de traumas leves, enquanto estiver tomando Sprycel.
Retenção de Líquidos:
O tratamento com Sprycel pode estar associado com retenção de líquidos nas pernas e ao redor dos olhos. Nos casos mais graves, pode haver acúmulo de líquido nos pulmões, membrana que reveste o coração (derrame pleural) ou cavidade abdominal. Se você apresentar inchaço, ganho de peso ou falta de ar, isso pode ser o resultado de retenção de líquidos e você deve informar tais sintomas imediatamente para o seu médico.
Problemas pulmonares:
Sprycel pode causar alterações nos vasos sanguíneos que irrigam os pulmões.
Informe seu médico se você sentir falta de ar ou fadiga após o início do tratamento com Sprycel.
Reações adversas cardíacas:
As reações adversas cardíacas de falência cardíaca congestiva/ disfunção cardíaca, derrame pleural, arritmias, palpitações, prolongamento do intervalo QT e infarto do miocárdio (incluindo fatal) foram reportadas em pacientes tomando Sprycel. Eventos cardíacos adversos foram mais frequentes em pacientes com fatores de risco ou com histórica médica prévia de doença cardíaca. Pacientes com fatores de risco ou história de doença cardíaca devem ser monitorados cuidadosamente para sinais e sintomas consistentes com disfunção cardíaca e deve ser avaliado e tratado apropriadamente.
Reações Dermatológicas Graves:
Casos individuais de reações dermatológicas mucocutâneas graves, incluindo síndrome de Stevens-Johnson e eritema multiforme, foram reportados com o uso de Sprycel.
Sprycel deve ser descontinuado permanentemente em pacientes com experiência de reação mucocutânea grave durante o tratamento se nenhuma outra etiologia for identificada.
Outros efeitos colaterais comuns do tratamento com Sprycel incluem diarreia, dor de cabeça, falta de ar, cansaço e dor muscular. Você deverá informar seu médico caso apresente um destes sintomas.
Outros efeitos colaterais são:
Retenção de líquidos, pneumonia, febre, infecção e insuficiência cardíaca.
A maioria dos pacientes tratados com Sprycel apresentou algum tipo de efeito colateral em algum momento.
O medicamento foi suspenso em decorrência de efeitos colaterais em 15% dos pacientes com LMC na fase crônica, 16% em LMC Ph+ na fase acelerada, 15% em LMC na fase mieloide blástica e 8% em LMC em fase linfoide blástica, e 8% em LLA Ph+.
Os seguintes efeitos colaterais foram relatados em pacientes nos estudos clínicos com Sprycel em uma frequência muito comum (?10%), comum (1% - <10%), incomum (0,1% - <1%) ou raro (<0,1%).
Estes eventos são incluídos com base na relevância clínica.
|
Distúrbios gastrointestinais | |
|
Muito comum |
Diarreia, náusea, vômito, dor abdominal |
|
Comum |
Sangramento gastrointestinal, inflamação das mucosas (incluindo mucosite/estomatite), |
|
Incomum |
Ascite (acúmulos de líquidos livre no abdome), disfagia (dificuldade para engolir |
|
Raro |
Gastroenteropatia perdedora de proteínas (dificuldade de absorção de proteínas), íleo |
|
Distúrbios gerais e condições no local de administração | |
|
Muito comum |
Cansaço, febre, edema periférico, edema facial |
|
Comum |
Astenia (fraqueza), dor, dor no peito, edema generalizado, arrepios |
|
Incomum |
Mal-estar, outro edema superficial |
|
Raro |
Alteração de marcha |
|
Distúrbios da pele e tecidos subcutâneos | |
|
Muito comum |
Vermelhidão |
|
Comum |
Prurido (coceira), alopecia (queda de cabelo), acne, pele seca, hiper-hidrose (excesso |
|
Incomum |
Distúrbio de pigmentação (alteração da coloração da pele), úlcera da pele, condições |
|
Raro |
Vasculite leucocitoclástica (inflamação alérgica nos vasos), fibrose cutânea |
|
Desconhecido |
Síndrome de Stevens-Johnsonb |
|
Distúrbios respiratórios, torácicos e do mediastino | |
|
Muito comum |
Derrame pleural, dispneia (falta de ar) |
|
Comum |
Edema pulmonar, infiltração pulmonar, pneumonite (inflamação do pulmão), |
|
Incomum |
Asma, broncoespasmo (estreitamento da luz do brônquio que provoca falta de ar e |
|
Raro |
Síndrome da angústia respiratória aguda, embolismo pulmonar (bloqueio da artéria |
|
Desconhecido |
Doença pulmonar intersticial |
|
Muito comum |
Cefaleia |
|
Comum |
Neuropatia (disfunção dos nervos) |
|
Incomum |
Sangramento no sistema nervoso central, amnésia, tremor, síncope (desmaio), distúrbio |
|
Raro |
Convulsões, acidente vascular cerebral, ataque isquêmico transitório, neurite óptica |
|
Distúrbios do sangue e sistema linfático | |
|
Muito comum |
Mielosupressão (diminuição do número de células sanguíneas, incluindo anemia, |
|
Comum |
Neutropenia febril |
|
Incomum |
Linfoadenopatia (alteração nos gânglios linfáticos), linfopenia (diminuição do número |
|
Raro |
Aplasia pura de células vermelhas |
|
Muito comum |
Dor músculo-esquelética |
|
Comum |
Artralgia (dor em articulações), mialgia (dor muscular), fraqueza muscular, rigidez |
|
Incomum |
Rabdomiólise (ruptura do músculo esquelético), tendinite (inflamação nos tendões), |
|
Investigações | |
|
Comum |
Aumento do peso, diminuição do peso |
|
Incomum |
Aumento da enzima creatino-fosfoquinase sanguínea, aumento da enzima gama-glutamiltransferase |
|
Muito comum |
Infecção (incluindo bacteriana, viral, fúngica e não específica) |
|
Comum |
Pneumonia (incluindo bacteriana, viral e fúngica), infecções/ inflamação do trato |
|
Desconhecido |
Reativação da hepatite B |
|
Comum |
Distúrbios do apetite, hiperuricemia (aumento do ácido úrico no sangue) |
|
Incomum |
Hipoalbuminemia, síndrome da lise tumoral (complicações metabólicas causadas pela |
|
Raro |
Diabetes mellitus |
|
Distúrbios cardíacos | |
|
Comum |
Derrame pericárdico, insuficiência cardíaca congestiva/ disfunção cardíaca, arritmias |
|
Incomum |
Angina pectoris (dor no peito), cardiomegalia (aumento do tamanho do coração), |
|
Raro |
Cor pulmonale, miocardite (inflamação do músculo cardíaco), síndrome coronariana |
|
Desconhecido |
Fibrilação atrial / flutter atriala |
|
Distúrbios oculares | |
|
Comum |
Distúrbio visual (incluindo perturbação visual, visão obscurecida, e acuidade visual |
|
Incomum |
Conjuntivite, deficiência visual, fotofobia (sensibilidade excessiva à luz), aumento do |
|
Distúrbios vasculares | |
|
Muito comum |
Sangramento |
|
Comum |
Rubores, hipertensão (pressão alta) |
|
Incomum |
Hipotensão (pressão baixa), tromboflebite (inflamação na veia) |
|
Raro |
Livedo reticulares, trombose venosa profunda, embolismo |
|
Distúrbios psiquiátricos | |
|
Comum |
Insônia, depressão |
|
Incomum |
Ansiedade, instabilidade emocional, confusão, redução da libido |
|
Gravidez, Puerpério e Condições pré-natais | |
|
Raro |
Aborto |
|
Distúrbios do sistema reprodutivo e mamas | |
|
Incomum |
Ginecomastia (crescimento das mamas nos homens), desordem menstrual |
|
Lesões, intoxicações e complicações do procedimento | |
|
Comum |
Contusão |
|
Distúrbios do ouvido e labirinto | |
|
Comum |
Tinitus (zumbido) |
|
Incomum |
Vertigem (tontura), perda da audição |
|
Distúrbios hepatobiliares | |
|
Incomum |
Colestase, colecistite (inflamação na vesícula), hepatite |
|
Distúrbios renais e urinários | |
|
Incomum |
Frequência urinária, insuficiência renal, proteinúria (excreção de proteínas pelos rins) |
|
Raro |
Falência renal |
|
Desconhecido |
Síndrome nefrítica |
|
Distúrbios imunológicos | |
|
Incomum |
Hipersensibilidade (incluindo eritema nodoso) |
|
Distúrbios endócrinos | |
|
Incomum |
Hipotireoidismo (diminuição dos hormônios da tireoide) |
|
Raro |
Hipertireoidismo (aumento dos hormônios da tireoide), tireoidite (inflamação da glândula tireoide) |
aTipicamente reportado em pacientes idosos ou em pacientes com fatores de confusão, incluindo significantes distúrbios cardiovasculares ou cardíacos simultâneos ou subjacentes, ou outras comorbidades significantes (por ex.: infecção grave / sepse, anormalidades eletrolíticas).
bNo período pós-comercialização foram relatados casos individuais de síndrome de Stevens-Johnson. Não foi possível determinar se estas reações mucocutâneas adversas estavam diretamente relacionadas a Sprycel ou a medicações concomitantes.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Atenção: este produto é um medicamento que possui nova indicação terapêutica e nova concentração no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e
utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidas. Neste caso, informe seu médico.
Composição
Cada comprimido de Sprycel contém:
20 mg, 50 mg ou 100 mg de dasatinibe.
Superdosagem
Avise imediatamente seu médico se você acidentalmente tomou uma dose superior à dose recomendada de Sprycel.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Drogas que podem aumentar a concentração plasmática do Dasatinibe (substância ativa)
Drogas que podem diminuir a concentração plasmática do Dasatinibe (substância ativa)
Drogas que podem ter suas concentrações plasmáticas alteradas pelo Dasatinibe (substância ativa)
Interação Alimentícia
Suco de toranja (grapefruit) pode aumentar a concentração plasmática de Dasatinibe (substância ativa) e deve ser evitado.
A Erva de São João pode diminuir as concentrações plasmáticas de Dasatinibe (substância ativa) de maneira imprevisível e deve ser evitada.
Ação da Substância
Resultados de eficácia
A eficácia e a segurança do Dasatinibe (substância ativa) foram investigadas em pacientes adultos com LMC Ph+ ou LLA Ph+, resistentes ou intolerantes ao imatinibe: 1158 pacientes tinham LMC Ph+ na fase crônica, 858 pacientes tinham LMC Ph+ na fase acelerada, fase mieloide blástica, ou fase linfoide blástica, e 130 pacientes tinham LLA Ph+.
Em um estudo clínico de LMC Ph+ na fase crônica, a resistência ao imatinibe incluiu falha ao atingir a resposta hematológica completa (RHC; depois de 3 meses), resposta citogenética maior (RCM; depois de 6 meses), ou resposta citogenética completa (RCC; depois de 12 meses); ou perda de uma resposta molecular prévia (com aumento concomitante ? 10% em metáfases de Ph+), resposta citogenética, ou resposta hematológica. A intolerância ao imatinibe incluiu a incapacidade para tolerar 400 mg ou mais de imatinibe por dia ou a descontinuação do imatinibe devido à toxicidade.
Os resultados descritos abaixo são baseados em um mínimo de 2 anos de acompanhamento após o início do tratamento com Dasatinibe (substância ativa) em pacientes com uma média de tempo desde o início do diagnóstico de aproximadamente 5 anos. Em todos os estudos, 48% dos paciente eram mulheres, 81% eram brancos, 15% negros ou asiáticos, 25% tinham 65 anos de idade ou mais, e 5% tinham 75 anos de idade ou mais.
A maioria dos pacientes possuía um longo histórico da doença com tratamentos anteriores extensos, incluindo imatinibe, quimioterapia citotóxica, interferon, e transplante de medula óssea. Em geral, 80% dos pacientes eram resistentes ao imatinibe e 20% eram intolerantes ao imatinibe. A dose máxima de imatinibe havia sido de 400- 600 mg/dia em aproximadamente 60% dos pacientes e > 600 mg/dia em 40% dos pacientes.
O objetivo principal de eficácia na fase crônica da LMC Ph+ foi a resposta citogenética maior ( RCM), definida como eliminação (resposta citogenética completa, RCC) ou diminuição substancial (de pelo menos 65%, resposta citogenética parcial) das células hematopoiéticas Ph+. O objetivo principal de eficácia na fase acelerada, fase mieloide blástica, fase linfoide blástica da LMC Ph+, e na LLA Ph+ foi a resposta hematológica maior (RHM), definida como uma resposta hematológica completa (RHC), ou como nenhuma evidência de leucemia (NEL).
LMC Ph+ em fase crônica recém-diagnosticada
Um estudo Fase 3, aberto, multicêntrico, internacional, randomizado foi realizado em pacientes adultos com LMC Ph+ fase crônica recém-diagnosticada. Os pacientes foram randomizados para receber Dasatinibe (substância ativa) 100 mg uma vez ao dia ou imatinibe 400 mg uma vez ao dia. O desfecho primário foi a taxa de resposta citogenética completa confirmada (RCCc) em 12 meses. Os desfechos secundários incluem o tempo em RCCc (medida da duração da resposta), tempo para RCCc, taxa de resposta molecular maior (RMM), tempo para RMM, sobrevida livre de progressão (SLP) e sobrevida global (SG). Outros resultados de eficácia relevantes incluem RCC e taxa de resposta molecular completa (RMC)
Um total de 519 pacientes foram randomizados em um grupo de tratamento: 259 para Dasatinibe (substância ativa) e 260 para imatinibe. As características basais foram bem balanceadas entre os dois grupos de tratamento com respeito à idade (a mediana foi de 46 anos para o grupo de Dasatinibe (substância ativa) e 49 anos para o grupo de imatinibe com 10% e 11% dos pacientes com 65 anos de idade ou mais, respectivamente), gênero (44% e 37% de mulheres, respectivamente) e raça (51% e 55% de caucasianos, 42% e 36% de asiáticos, respectivamente).
O tempo mediano do diagnóstico inicial de LMC Ph+ até a randomização foi 1 mês (0,03 - 9,72) para Dasatinibe (substância ativa) e 1 mês (0,10 - 8,02) para imatinibe. Pacientes com história de doença cardíaca grave foram incluídos neste estudo, exceto aqueles que tiveram infarto do miocárdio nos últimos 6 meses, insuficiência cardíaca congestiva ou angina descontrolada nos últimos 3 meses, arritmias significantes ou prolongamento do intervalo QT.
Na base, a distribuição dos escores de Hasford foi similar nos grupos de tratamento com Dasatinibe (substância ativa) e imatinibe (baixo risco: 33% e 34%, risco intermediário: 48% e 47% e alto risco: 19% e 19%, respectivamente). O status de Performance (ECOG) foi também similar nos grupos de tratamento com Dasatinibe (substância ativa) e imatinibe (ECOG 0 = 82% e 79%, ECOG 1 = 18% e 20% e ECOG 2 = 0 e 1%, respectivamente).
Com 12 meses de acompanhamento mínimo, 85% dos pacientes randomizados para o grupo de Dasatinibe (substância ativa) e 81% dos pacientes randomizados no grupo do imatinibe ainda estavam recebendo tratamento em primeira linha. A descontinuação devido a progressão da doença ocorreu em 3% dos pacientes tratados com Dasatinibe (substância ativa) e 5% dos pacientes tratados com imatinibe.
Com acompanhamento mínimo de 60 meses, 61% dos pacientes randomizados para o tratamento com Dasatinibe (substância ativa) e 63% dos pacientes randomizados para o tratamento com o imatinibe ainda estavam recebendo tratamento em primeira linha.
A descontinuação devido a progressão da doença ocorreu em 7% dos pacientes tratados com Dasatinibe (substância ativa) e 9% em pacientes tratados com imatinibe. Descontinuação devido à falha ao tratamento ocorreu em 4% dos pacientes tratados com Dasatinibe (substância ativa) e 5% dos pacientes tratados com imatinibe. Descontinuação devido à intolerância ao tratamento ocorreu em 16% dos pacientes tratados com Dasatinibe (substância ativa) e 7% dos pacientes tratados com imatinibe.
Os resultados de eficácia estão apresentados na Tabela 1. Uma proporção maior de paciente estatisticamente significativa no grupo de Dasatinibe (substância ativa) alcançou a RCCc comparado com pacientes no grupo de imatinibe dentro dos primeiros 12 meses de tratamento. A eficácia de Dasatinibe (substância ativa) foi consistentemente demonstrada entre os diferentes subgrupos, incluindo idade, gênero e escores basais de Hasford.
Tabela 1: Resultados de Eficácia em um Estudo Fase 3 de Pacientes com LMC Ph+ na Fase Crônica Recém-diagnosticados:
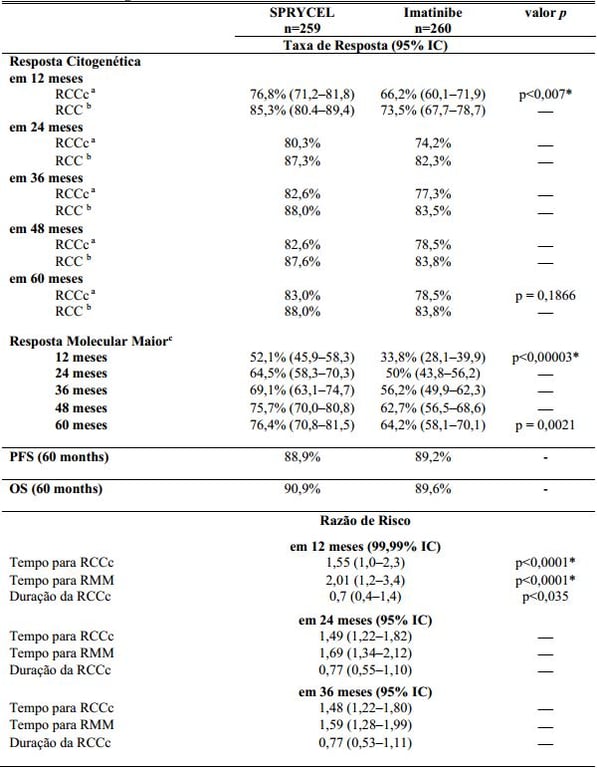
a Resposta citogenética completa confirmada (RCCc) é definida como a resposta notada em duas ocasiões consecutivas (em no mínimo 28 dias de distância).
b Resposta citogenética Completa (RCC) não confirmada é baseada em uma única avaliação citogenética da medula óssea.
c Resposta molecular maior (RMM) (a qualquer momento) é definida como taxas de BCR-ABL ?0.1% por RQ-PCR em amostra simples de sangue periférico padronizada na escala internacional. Essas taxas cumulativas representam o acompanhamento mínimo para o prazo especificado.
*Ajustado para o índice de risco Hasford e significância estatística indicada em um nível nominal de significância pré-determinado.
IC = Intervalo de Confiança.
O traço na coluna valor p significa dado não calculado.
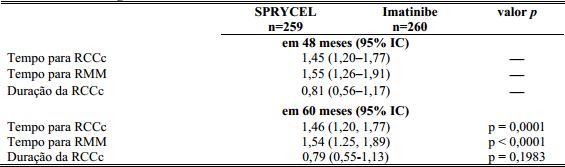
A progressão da doença foi definida como o aumento das células brancas do sangue apesar de manejo terapêutico apropriado, perda de RHC, perda de RCM, progressão para fase acelerada ou fase blástica, ou morte. Com um mínimo de 60 meses de acompanhamento, transformação para fase blástica ou acelerada ocorreu menos frequentemente com Dasatinibe (substância ativa) (n=8, 3,1%) do que com imatinibe (n=15, 5,8%).
Após 60 meses de acompanhamento, o tempo médio para RCCc foi 3,1 meses em 214 respondentes ao Dasatinibe (substância ativa) e 5,8 meses em 204 respondentes ao imatinibe. O tempo médio para RMM após 60 meses de acompanhamento foi 9,3 meses em 196 respondentes ao Dasatinibe (substância ativa) e 15,0 meses em 163 respondentes ao imatinibe.
O tempo para RMM foi consistentemente menor com pacientes tratados com Dasatinibe (substância ativa) comparado com pacientes tratados com imatinibe. Com um acompanhamento mínimo de 60 meses, a taxa de RMC (isto é, ao menos uma redução de 4,5-log a partir do valor base padronizado de relação BCR-ABL ?0.0032%) a qualquer momento foi 44% e 34% no grupo tratado com Dasatinibe (substância ativa) e com imatinibe, respectivamente.
A taxa de RMM a qualquer momento, em cada grupo de risco determinado pelo escore de Hasford, foi maior no grupo de Dasatinibe (substância ativa) comparada ao grupo de imatinibe (baixo risco: 90% e 69%; risco intermediário: 71% e 65%; alto risco: 67% e 54%, respectivamente).
A taxa de SLP foi consistentemente maior em pacientes tratados com Dasatinibe (substância ativa) que atingiram o nível de BCR-ABL ?10% em 3 meses dos que não atingiram.
A taxa de SG foi consistentemente maior em pacientes tratados com Dasatinibe (substância ativa) que atingiram nível de BCR- ABL?10% do que aqueles que não atingiram.
Taxas de RMM foram consistentemente maiores nos pacientes tratados com Dasatinibe (substância ativa) comparado com os pacientes tratados com imatinibe.
A taxa estimada de SLP de 60 meses foi de 88,9% (IC: 84,0%-92,4%) e 89,2% (IC: 84,3%-92,7%) para o grupo de tratamento com o Dasatinibe (substância ativa) e com o imatinibe, respectivamente. As taxas estimadas de sobrevida de 60 meses para os pacientes tratados com Dasatinibe (substância ativa) e imatinibe foram 90,9% (IC: 86,6%-93,8%) e 89,6% (IC: 85,2%-92,8%), respectivamente. No acompanhamento mínimo de 60 meses, não houve diferença entre Dasatinibe (substância ativa) e imatinibe na SG (HR 1,01, 95% IC: 0,58-1,73, p=0,9800) ou SLP (HR 1,00, 95% IC 0,58-1,72, p=0,9998).
O número de pacientes no grupo Dasatinibe (substância ativa) e imatinibe que apresentaram progressão/falha ao tratamento foi 34 (13,1%) e 39 (15%) pacientes, respectivamente.
Após 5 anos de acompanhamento, menos pacientes tratados com Dasatinibe (substância ativa) transformaram para fase acelerada ou blástica comparado aos pacientes tratados com imatinibe. Após 12, 24, 36, 48 e 60 meses de tratamento, transformação foi reportada em um total de 5 (1,9%), 6 (2,3%), 8 (3,1%), 8 (3,1%) e 8 (3,1%) pacientes tratados com Dasatinibe (substância ativa) comparado com 9 (3,5%), 13 (5,0%), 13 (5,0%), 14(5,4%) e 15 (5,8%) pacientes tratados com imatinibe, respectivamente. Notavelmente, não houve transformação adicional após 36 meses no grupo com Dasatinibe (substância ativa), 2 pacientes adicionais apresentaram transformação no grupo com imatinibe após 36 meses (ambos entre o Ano 4 e 5).
O Tempo até o Benefício Clínico Máximo (TBCM) avalia as razões cumulativas para a descontinuação do tratamento. No estudo CA180056, TBCM foi definido como o tempo desde a randomização até o último dia de medicação no estudo para os pacientes que descontinuaram devido à toxicidade, ou a primeira data na qual o critério para falha ao tratamento foi atingido.
Com um período de acompanhamento mínimo de 5 anos, um maior número de indivíduos foi descontinuado do estudo por causa de progressão, falha do tratamento ou intolerância no grupo de Dasatinibe (substância ativa) em comparação com o grupo de imatinibe (74 vs. 55, respectivamente).
Tal diferença do tratamento não se manifestou até depois de 2 anos, momento no qual as curvas de Kaplan-Meier começaram a se separar resultando em um risco maior de eventos de progressão, falha do tratamento ou intolerância ao medicamento para o grupo Dasatinibe (substância ativa) em comparação ao grupo imatinibe [HR (IC de 95%): 1,35 (0,95-1,91)].
No estudo de Fase 3 de LMC Ph+ na fase crônica recém-dignosticada, o sequenciamento de BCR-ABL foi realizado em amostras de sangue de pacientes que descontinuaram a terapia com Dasatinibe (substância ativa) e imatinibe. Entre os pacientes tratados com Dasatinibe (substância ativa), as mutações detectadas foram T315I (4%), F317I/L (2%) e V299L (3%).
Dasatinibe (substância ativa), imatinibe e nilotinibe não parecem ser ativos contra a mutação T315I, baseado em dados in vitro.
Adicionalmente, mais pacientes tratados com Dasatinibe (substância ativa) (84%) atingiram a resposta molecular precoce (definida como níveis de BCR-ABL ?10% em 3 meses) comparado com os sujeitos tratados com imatinibe (64%). Os pacientes que atingiram resposta molecular precoce em ambos os grupos tiveram menor risco de transformação, maior taxa de sobrevida livre de progressão (SLP) e maior taxa de sobrevida global (SG), como demonstrado nas Tabelas 2 e 3.
Tabela 2: Pacientes tratados com Dasatinibe (substância ativa) com BCR-ABL ?10% e >10% em 3 Meses:
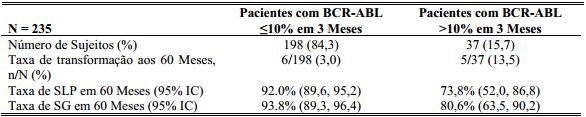
Tabela 3: Pacientes tratados com imatinibe com BCR-ABL ?10% e >10% em 3 Meses:

 Outros estudos de longo prazo com pacientes com leucemia mieloide crônica recém diagnosticados estão em andamento.
Outros estudos de longo prazo com pacientes com leucemia mieloide crônica recém diagnosticados estão em andamento.
LMC Ph+ fase crônica
LMC Ph+ fase avançada e LLA Ph+
LMC Ph+ fase avançada e LLA Ph+
Estudo de otimização da dose: Um estudo Fase 3 randomizado, aberto, foi conduzido em pacientes com LMC Ph+ em fase avançada (LMC Ph+ na fase acelerada, LMC Ph+ na fase mieloide blástica, ou LMC Ph+ na fase linfoide blástica) ou LLA Ph+ para avaliar a eficácia e segurança de Dasatinibe (substância ativa) administrado uma vez ao dia comparado com Dasatinibe (substância ativa) administrado duas vezes ao dia.
O objetivo principal de eficácia foi resposta hematológica maior (RHM). Um total de 611 pacientes foram randomizados nos grupos de 140 mg de Dasatinibe (substância ativa) uma vez ao dia ou de 70 mg de Dasatinibe (substância ativa) duas vezes ao dia. A média da duração do tratamento foi de aproximadamente 6 meses para os dois grupos de tratamento (faixa de <1-31 meses). O grupo tratado com Dasatinibe (substância ativa) uma vez ao dia demonstrou eficácia comparável (não inferioridade) ao tratamento com Dasatinibe (substância ativa) duas vezes ao dia para o objetivo principal de eficácia, entretanto, o regime de 140 mg uma vez ao dia demonstrou segurança e tolerabilidade melhorada.
As taxas de resposta para pacientes no grupo de 140 mg uma vez ao dia estão apresentadas na Tabela 6.
Tabela 6: Eficácia de Dasatinibe (substância ativa) em LMC Ph+ na fase avançada e em LLA Ph+ (Resultados de 2 Anos):
![]()
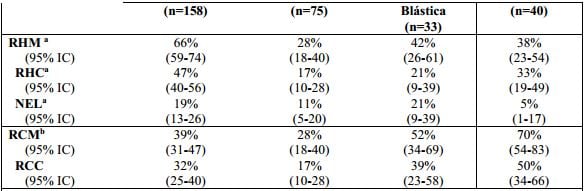
Em paciente com LMC Ph+ na fase acelerada tratados com o regime de 140 mg uma vez ao dia, a duração média da RHM e a sobrevida global (SG) média não foi atingida; a sobrevida livre de progressão (SLP) média foi de 25 meses. Em pacientes com LMC Ph+ na fase blástica mileóide tratados com o regime de 140 mg uma vez ao dia, a duração média da RHM foi 8 meses, a média da SLP foi 4 meses e a média de sobrevida global foi 8 meses. Em pacientes com LMC Ph+ na fase blástica linfóide, a duração média da RHM foi 5 meses, a média da SLP foi 5 meses e a sobrevida global média foi 11 meses. Em pacientes com LLA Ph+ tratados com o regime de 140 mg uma vez ao dia, a duração da RHM foi 5 meses, a média de SLP foi 4 meses e a média de sobrevida global foi 7 meses.
Características farmacológicas
Dasatinibe (substância ativa) (Dasatinibe (substância ativa)) é inibidor de quinase. O nome químico do Dasatinibe (substância ativa) é N-(2-cloro-6-metilfenil)-2-[[6- [4-(2-hidroxietil)-1-piperazinil]-2-metil-4-pirimidinil]amino]-5-tiazolecarboxamida, monoidratado. A fórmula molecular é C22H26ClN7O2S • H2O, o que corresponde a um peso de 506,02 (monoidratado). A base anidra livre possui um peso molecular de 488,01. O Dasatinibe (substância ativa) possui a seguinte estrutura química:
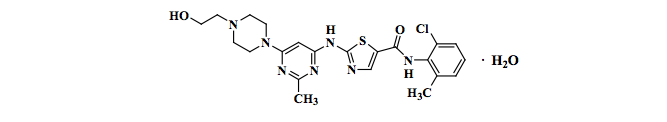
O Dasatinibe (substância ativa) é um pó branco a quase branco. O fármaco é insolúvel em água e levemente solúvel em etanol e metanol.
Mecanismo de Ação
O Dasatinibe (substância ativa), em concentrações nanomolares, inibe as seguintes quinases: BCR-ABL, família SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2, e PDGFR?. Com base em estudos modelo, o Dasatinibe (substância ativa) previsivelmente liga-se a conformações múltiplas da quinase ABL.
In vitro, o Dasatinibe (substância ativa) é ativo em linhagens celulares leucêmicas representando variações da doença sensível e resistente ao mesilato de imatinibe. O Dasatinibe (substância ativa) inibiu o crescimento de linhagens celulares de Leucemia Mieloide Crônica (LMC) e Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+) com superexpressão de BCR-ABL. Sob as condições dos ensaios, o Dasatinibe (substância ativa) foi capaz de superar a resistência ao imatinibe resultante das mutações no domínio da quinase do BCR-ABL, ativação das etapas de sinalização alternativas envolvendo as quinases da família SRC (LYN, HCK) e a superexpressão do gene de resistência a múltiplos medicamentos.
Farmacocinética
Cuidados de Armazenamento
Os comprimidos de Sprycel (dasatinibe) devem ser armazenados à temperatura ambiente, entre 15ºC e 30°C.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
Dizeres Legais
Reg. MS – 1.0180.0392
Responsável Técnico:
Dra. Elizabeth M. Oliveira - CRF-SP n° 12.529
Fabricado por:
AstraZeneca Pharmaceuticals LP
4601 Highway 62 East
Mount Vernon – Indiana – EUA
Importado por:
Bristol-Myers Squibb Farmacêutica LTDA.
Rua Verbo Divino, 1711 – Chácara Santo Antônio - São Paulo - SP
CNPJ 56.998.982/0001-07
Venda sob prescrição médica
informações complementares
| Fabricante |
| BRISTOL-MYERS SQUIBB |
| Princípio ativo |
| Dasatinibe Monoidratado |
| Categoria do medicamento |
| Medicamentos Especiais |
