para o que é indicado e para que serve?
Para que serve Tacrolil é recomendado depois de você ser submetido a um transplante de rim ou fígado para evitar que o seu sistema imunológico rejeite o órgão transplantado.Continue lendo...
ofertas de
Tacrolil - 1 Mg 100 Cápsu...
ofertas de Tacrolil - 1 Mg 100 Cápsu...
R$ 497,70
R$ 497,70
R$ 497,80
R$ 497,85
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Tacrolil é recomendado depois de você ser submetido a um transplante de rim ou fígado para evitar que o seu sistema imunológico rejeite o órgão transplantado. É recomendado que Tacrolil seja utilizado concomitantemente com corticosteroides.
COMO ESTE MEDICAMENTO FUNCIONA?
Tacrolil é um medicamento que reduz a resposta do seu sistema imunológico, e atua como medicamento anti-rejeição, evitando que o seu organismo rejeite o órgão que você recebeu.
Contraindicação
Você não deve tomar Tacrolil se for alérgico ao tacrolimo (ingrediente ativo) ou a qualquer componente da fórmula do medicamento.
Como usar
Sempre tome Tacrolil exatamente como o seu médico lhe orientou. Você deve verificar com o seu médico ou farmacêutico caso não tenha certeza de alguma orientação recebida. Este medicamento só deve ser prescrito por um médico com experiência no tratamento de pacientes transplantados.
Modo de administração
As cápsulas de tacrolimo devem ser tomadas duas vezes ao dia (por exemplo, de manhã e à noite), com intervalos de 12 horas, por via oral.
As cápsulas de tacrolimo devem ser tomadas imediatamente após a remoção do blister. As cápsulas devem ser ingeridas com líquido (de preferência água) e com o estômago vazio ou, pelo menos, 1 hora antes das refeições ou de 2 a 3 horas após as refeições, para conseguir uma máxima absorção do medicamento.
O tacrolimo pode ser administrado por via intravenosa ou oral. De forma geral, a administração pode iniciar-se por via oral; se necessário, através da administração do conteúdo da cápsula em suspensão em água, por entubação nasogástrica.
Tacrolimo não é compatível com o plástico PVC. Tubos, seringas e outros equipamentos usados para preparar ou administrar a suspensão do conteúdo das cápsulas de tacrolimo, não devem conter PVC em sua composição.
Dosagem
A dosagem inicial é estabelecida pelo médico, de acordo com seu peso e com o órgão que você recebeu.
Resumo das recomendações de dose oral inicial e as concentrações no sangue total
LEIA A BULA EM PDF PARA VISUALIZAR A TABELA.
Transplante hepático
Se possível, o tratamento será iniciado com tacrolimo cápsulas. Caso a terapia intravenosa seja necessária, a mudança de tacrolimo solução injetável para cápsulas é recomendada assim que a terapia oral puder ser tolerada. Isso usualmente ocorre em 2-3 dias. A dose inicial de tacrolimo não deve ser administrada antes de 6 horas depois do transplante. Se você estiver recebendo infusão intravenosa, a primeira dose da terapia oral deve ser administrada de 8 – 12 horas depois da descontinuação da infusão intravenosa.
A dose oral inicial de tacrolimo cápsulas é de 0,10 – 0,15 mg/dia, dividida em duas doses, com intervalo de 12 horas.
Em pacientes receptores de transplante hepático, a administração concomitante com suco de toranja (grapefruit) aumenta as concentrações mínimas de tacrolimo no sangue. Seu médico irá ajustar a dose com base na avaliação clínica de rejeição e tolerabilidade. Doses menores de tacrolimo podem ser suficientes como terapia de manutenção. Uma terapia conjunta com corticosteroides adrenais é recomendada logo após o transplante.
Transplante de Rim
No transplante de rim, a dose oral inicial recomendada de tacrolimo cápsulas é de 0,2 mg/kg/dia administrada a cada 12 horas, em duas doses. A dose inicial de tacrolimo pode ser administrada 24 horas após o transplante, mas deve ser adiada até a recuperação da função renal (conforme indicado, por exemplo, por creatinina sérica ? 4 mg/dL). Pacientes negros podem precisar de doses mais elevadas para alcançar concentrações sanguíneas comparáveis.
Pacientes pediátricos
Crianças que receberam um transplante de fígado e que não apresentavam função renal ou hepática prejudicada antes da cirurgia precisam e toleram receber doses mais elevadas do que adultos para atingirem concentrações semelhantes no sangue. Portanto, recomenda-se que a terapia seja iniciada em crianças com uma dose intravenosa inicial de 0,03 – 0,05 mg/kg/dia ou uma dose oral inicial de 0,15 – 0,20 mg/kg/dia. Ajustes na dose podem ser necessários. A experiência em pacientes pediátricos receptores de transplante de rim é limitada.
Pacientes com disfunção renal ou hepática
Devido ao potencial de toxicidade aos rins, pacientes com função renal ou hepática prejudicada devem receber doses mais baixas no intervalo de dose intravenosa e oral recomendado. Reduções adicionais na dose abaixo dessas faixas podem ser necessárias. Em geral, a terapia com tacrolimo deve ser adiada por até 48 horas ou mais se você apresentar redução na frequência de micção após a cirurgia (oligúria pós operatória).
Conversão de um tratamento imunossupressor para outro
O tacrolimo não deve ser usado simultaneamente com ciclosporina.
O tacrolimo ou ciclosporina devem ser descontinuados no mínimo 24 horas antes de iniciar o outro medicamento. Na presença de concentrações elevadas de tacrolimo ou ciclosporina, a administração do medicamento deve, em geral, ser adiada.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Se você esquecer de tomar Tacrolil o, tome a dose recomendada assim que se lembrar. Se estiver muito próximo da próxima tomada, pule a dose esquecida e tome a próxima dose na hora recomendada. Não tome o dobro da dose para compensar a dose esquecida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Gerenciamento da imunossupressão (redução da atividade ou da eficiência do sistema imune)
Somente médicos com experiência em terapia imunossupressora e tratamento de pacientes com transplante de órgãos devem prescrever Tacrolil. Pacientes que usam o medicamento devem ser monitorados em instituições com recursos médicos e laboratoriais adequados. O médico responsável pela terapia de manutenção deve ter todas as informações necessárias para monitorar o paciente.
Monitoramento de rotina
Você deve manter contato regular com seu médico. Ocasionalmente, seu médico pode precisar de exames de sangue, urina, do coração ou dos olhos, para definir a dose certa de Tacrolil.
Informe o seu médico se alguma das seguintes situações se aplicarem a você:
- Se você tem ou já teve problemas de fígado;
- Se tiver diarreia por mais de um dia;
- Se você se sentir forte dor abdominal acompanhada ou não de outros sintomas, tais como calafrios, febre, náuseas ou vômitos;
- Se você tem uma alteração de atividade elétrica do coração chamado de "prolongamento do intervalo QT”.
Uma vez que tacrolimo pode causar alterações no funcionamento do rim ou do fígado, seu médico solicitará exames de sangue com frequência.
Durante o período inicial após o transplante, os seguintes parâmetros devem ser monitorados de forma rotineira pelo seu médico:
• pressão arterial para possível hipertensão (aumento da pressão sanguínea);
• exames do coração, como eletrocardiograma (ECG);
• estado neurológico e visual;
• níveis de glicose no sangue (glicemia em jejum), para investigação de possível aumento de
glicose sanguínea (hiperglicemia) ou de diabetes mellitus;
• níveis de eletrólitos no sangue (particularmente do potássio, para investigação de possível
aumento dos níveis de potássio no sangue - hiperpotassemia);
• testes de função do fígado e dos rins;
• parâmetros hematológicos;
• valores de coagulação e proteínas presentes no plasma do sangue;
Se alterações clinicamente relevantes forem observadas, deve-se considerar o ajuste do esquema imunossupressor.
Os níveis de tacrolimo no sangue podem variar significativamente durante episódios de diarreia. Por essa razão, recomenda-se monitoramento extra da concentração de tacrolimo no sangue durante esses episódios.
Erros de Medicações
Erros de medicação, incluindo a substituição inadvertida, não intencional ou não supervisionada de formulações de tacrolimo com liberação imediata ou prolongada foram observados. Isso resultou em reações adversas graves, incluindo rejeição do órgão transplantado, ou outras reações adversas que poderiam ocorrer como consequência da exposição insuficiente ou excessiva ao tacrolimo. Os pacientes devem ser mantidos sob uma única formulação de tacrolimo com o regime de dose diário correspondente. Alterações na formulação ou no regime de dose devem ser feitas somente sob a supervisão atenta de um médico especialista em transplante.
Hipertrofia do Miocárdio (aumento do coração)
Hipertrofia ventricular ou hipertrofia do septo, tipos de doenças cardíacas caracterizadas pelo aumento do coração, têm sido observadas em raras ocasiões com o uso de tacrolimo. A maioria dos casos foi reversível, ocorrendo principalmente em crianças com concentrações sanguíneas mínimas de tacrolimo muito superiores aos níveis máximos recomendados.
Portanto, os pacientes de alto risco, principalmente crianças que receberam imunossupressão substancial, devem ser monitorados utilizando procedimentos como ecocardiografia ou eletrocardiograma (ECG) pré e pós-transplante (por exemplo, inicialmente aos três meses e, então, aos 9-12 meses).
Se você tiver aumento do coração durante o tratamento com tacrolimo, seu médico poderá reduzir a dose ou interromper o tratamento.
Hipertensão (aumento da pressão sanguínea)
Aumento da pressão sanguínea (hipertensão arterial) é um efeito adverso comum inerente à terapia com tacrolimo e você pode necessitar de tratamento anti-hipertensivo.
O controle da pressão sanguínea pode ser obtido com o uso de qualquer agente anti-hipertensivo comum, embora se deva ter cautela ao usar determinados agentes anti-hipertensivos associados ao aumento dos níveis de potássio no sangue.
Caso você apresente aumento da pressão sanguínea durante o tratamento com tacrolimo, seu médico poderá receitar medicamentos anti-hipertensivos.
Prolongamento do intervalo QT (alterações na atividade elétrica do coração)
O tacrolimo pode causar arritmias (irregularidades nas batidas do coração), como alterações no exame de eletrocardiograma (alterações na atividade elétrica do coração, como prolongamento do intervalo QT e torsade de pointes). Assim, o seu médico irá lhe informar sobre as precauções a serem tomadas caso você utilize tacrolimo e tenha tais situações clínicas.
Em pacientes com insuficiência cardíaca congestiva, diminuição da frequência cardíaca (bradiarritmia), aqueles que tomam certos medicamentos que alteram a atividade elétrica do coração, e aqueles com diminuição dos níveis sanguíneos de potássio, cálcio ou magnésio, deve-se considerar a realização de eletrocardiograma e monitoramento de eletrólitos (magnésio, potássio, cálcio) periodicamente durante o tratamento com tacrolimo.
Infecções Graves
O tratamento com tacrolimo diminuirá a sua imunidade e você estará mais sujeito a contrair infecções por bactérias, vírus, fungos ou protozoários. Por isso, é importante avisar seu médico se você tiver febre.
Este medicamento pode aumentar o risco de infecções. Informe ao seu médico qualquer alteração no seu estado de saúde.
Medicamentos imunossupressores, como tacrolimo, podem ativar focos primários de tuberculose. Os médicos que monitoram pacientes imunossuprimidos devem estar alertas quanto à possibilidade de surgimento de doença ativa e devem, portanto, tomar todas as precauções cabíveis para o diagnóstico e o
tratamento precoce. Este medicamento pode aumentar o risco de infecção. Informe seu médico sobre qualquer mudança na sua condição de saúde.
Este medicamento pode aumentar o risco de sangramento em caso de dengue.
Diabetes mellitus pós-transplante (DMPT)
Nos pacientes submetidos a transplante de rim e fígado, o tratamento com tacrolimo pode provocar o aparecimento de diabetes, que se manifesta por um aumento da frequência de micção, aumento da sede ou do apetite. Portanto, avise seu médico se apresentar algum desses sintomas.
Nefrotoxicidade (toxicidade dos rins)
Deve-se tomar cuidado ao utilizar tacrolimo com outros medicamentos nefrotóxicos (que causam danos aos rins). Em especial, para evitar nefrotoxicidade excessiva, tacrolimo não deve ser usado simultaneamente com a ciclosporina ou outros medicamentos com efeitos nefrotóxicos conhecidos.
O uso de tacrolimo pode resultar em comprometimento da função renal em pacientes transplantados. O comprometimento renal é geralmente reversível, podendo resultar no aumento dos níveis sanguíneos de creatinina, potássio e ácido úrico e na diminuição da secreção de ureia.
Pacientes com comprometimento renal devem ser monitorados atentamente, já que pode ser necessária a redução da dose de tacrolimo ou a suspensão temporária do tratamento.
Neurotoxicidade (toxicidade do sistema nervoso)
O tacrolimo pode causar neurotoxicidade (alteração da atividade normal do sistema nervoso, causando dano ao tecido nervoso) especialmente quando usado em doses elevadas.
A maioria das neurotoxicidades graves incluem encefalopatia posterior reversível (PRES) doenças que afetam o sistema nervoso, por exemplo, delírio e coma.
Caso os pacientes que estejam tomando tacrolimo apresentem sintomas indicativos de PRES, tais como dor de cabeça, alteração do estado mental, convulsões e distúrbios visuais, um exame radiológico (por exemplo, ressonância magnética) deve ser realizado. Caso seja diagnosticado PRES, aconselha-se o controle adequado da pressão arterial e a suspensão imediata do tacrolimo. A maioria dos pacientes recupera-se completamente após serem tomadas medidas adequadas.
Convulsões ocorreram em pacientes adultos e pediátricos que receberam tacrolimo.
Neurotoxicidades menos graves, por exemplo, tremores, parestesias, dor de cabeça e outras alterações na função motora, estado mental e função sensorial. Tremor e dor de cabeça foram associados à altas concentrações de tacrolimo no sangue e podem responder ao ajuste de dose
Se você apresentar tremores, dor de cabeça e alteração dos movimentos durante o tratamento com tacrolimo, informe seu médico, pois poderá ser necessário ajustar a dose que você está tomando.
Hiperpotassemia (aumento do nível de potássio na corrente sanguínea)
Hiperpotassemia (aumento do nível de potássio na corrente sanguínea) foi relatada com o uso de tacrolimo. Assim, o nível de potássio no sangue deve ser monitorado. O uso de diuréticos poupadores de potássio ou o alto consumo de potássio deve ser evitado durante o tratamento com tacrolimo.
Distúrbios linfoproliferativos (alguns tipos de câncer do sistema linfático) e outras malignidades
Como resultado da imunossupressão, a suscetibilidade à infecções e possível desenvolvimento de linfoma e outras neoplasias malignas (alguns tipos de câncer) em indivíduos tratados com tacrolimo pode ser maior que na população sadia normal.
Um distúrbio linfoproliferativo relacionado à infecção por um vírus chamado Epstein-Barr (EBV) foi relatado em receptores de órgãos transplantados imunossuprimidos. O risco de distúrbios linfoproliferativos é maior em crianças menores que estão sob o risco da infecção primária por EBV enquanto estão imunossuprimidas ou que passam a receber tacrolimo após um longo período de terapia de imunossupressão. Foi relatado que a redução ou descontinuação da imunossupressão pode levar à regressão das lesões.
O aumento da incidência de neoplasias malignas (alguns tipos de câncer) é uma complicação reconhecida da imunossupressão em receptores de transplante de órgãos. As formas mais comuns de neoplasia são linfomas não-Hodgkin e doenças malignas de pele. Portanto, a exposição ao sol e à luz ultravioleta deve ser limitada através do uso de roupas protetoras e um protetor solar com alto fator de proteção.
Imunizações
Algumas vacinas são contraindicadas para quem está tomando medicamentos imunossupressores. Antes de tomar qualquer vacina, informe ao profissional de saúde que você está tomando medicamento imunossupressor.
Durante o tratamento com tacrolimo, você não deve tomar nenhuma vacina sem antes consultar um médico, pois a vacina pode não funcionar como deveria ou pode provocar efeitos colaterais.
Aplasia pura da série vermelha (interrupção na produção de células vermelhas do sangue)
Casos de um tipo de anemia conhecida como aplasia pura da série vermelha (PCRA) foram relatados em pacientes tratados com tacrolimo. Todos os pacientes apresentavam fatores de risco para PRCA, tais como infecção por parvovírus B19, doença de base ou medicamentos concomitantes associados com PRCA.
Se a PRCA for diagnosticada, deve-se considerar a interrupção do tratamento com tacrolimo.
Perfuração gastrointestinal
Casos de perfuração gastrointestinal foram relatados em pacientes tratados com tacrolimo.
Uma vez que a perfuração gastrointestinal é um evento clinicamente importante que pode resultar em doença grave ou ameaça à vida, se você apresentar qualquer sintoma contate seu médico imediatamente para que tratamentos adequados, incluindo cirurgia, sejam considerados.
Excipientes
O tacrolimo contém lactose (açúcar do leite). Caso você tenha intolerância a alguns açúcares, entre em contato com o seu médico antes de tomar esse medicamento.
Cápsula de tacrolimo de 1 mg:
Aviso: Este produto contém 167,598 mg de lactose monoidratada por cápsula; portanto, deve ser usado com cautela por pessoas com diabetes.
Cápsula de tacrolimo de 5 mg:
Aviso: Este produto contém 163,510 mg de lactose monoidratada por cápsula; portanto, deve ser usado com cautela por pessoas com diabetes.
Conversão de ciclosporina para tacrolimo
O tacrolimo não deve ser usado simultaneamente com ciclosporina. O uso de tacrolimo ou ciclosporina deve ser interrompido pelo menos 24 horas antes do início do uso do outro medicamento. Em situações de concentrações elevadas de tacrolimo ou de ciclosporina, o uso do outro medicamento deve ser adiado.
A administração concomitante de ciclosporina e tacrolimo não é recomendada.
Efeito sobre a capacidade de dirigir e operar máquinas
O tacrolimo pode causar distúrbios visuais e neurológicos. Esse efeito pode ser acentuado se o tacrolimo for administrado em associação com álcool.
Reações Adversas
Como qualquer medicamento, tacrolimo pode provocar reações adversas, embora nem todas as pessoas os manifestem.
O tacrolimo reduz o mecanismo de defesa (sistema imune) do seu corpo, que ficará prejudicado para o combate a infecções. Por isso, você pode estar mais propenso a infecções enquanto estiver tomando tacrolimo.
Podem ocorrer efeitos graves, incluindo reações alérgicas e anafiláticas. Foram relatados casos de tumores benignos e malignos após o tratamento com tacrolimo.
Foram relatados casos de aplasia eritrocítica pura (uma redução muito grave na contagem de glóbulos vermelhos), agranulocitose (uma contagem muito baixa de glóbulos brancos) e anemia hemolítica (número reduzido de glóbulos vermelhos devido a uma quebra anormal).
Reações adversas muito comuns (ocorrem em mais de 10% dos pacientes que utilizam este medicamento):
- Glicemia elevada.
- Diabetes mellitus insulino dependente e não insulino dependente. - Nível elevado de potássio no sangue.
- Dificuldade para dormir.
- Tremor, dor de cabeça.
- Pressão arterial alta.
- Testes de função hepática anormais.
- Diarreia, náusea.
- Problemas renais.
Reações adversas comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento):
- Redução na contagem de glóbulos no sangue (plaquetas, glóbulos vermelhos ou brancos), elevação na contagem de glóbulos brancos, alterações na contagem de glóbulos vermelhos (observadas em exames de sangue).
- Nível reduzido de magnésio, fosfato, potássio, cálcio ou sódio no sangue, consumo excessivo de líquidos, elevação de ácido úrico ou lipídios no sangue, apetite reduzido, acidez elevada do sangue, outras alterações nos sais do sangue (observadas em exames de sangue).
- Sintomas de ansiedade, confusão e desorientação, depressão, alterações do humor, pesadelo, alucinação, distúrbios mentais.
- Ataques, distúrbios de consciência, formigamento e dormência (às vezes dolorosa) nas mão e nos pés, tontura, capacidade de escrita comprometida, distúrbios do sistema nervoso.
- Visão turva, sensibilidade elevada à luz, distúrbios nos olhos.
- Zumbido nos ouvidos.
- Fluxo sanguíneo reduzido nos vasos do coração, batidas mais rápidas do coração.
- Sangramento, bloqueio parcial ou completo dos vasos sanguíneos, pressão arterial baixa.
- Falta de ar, distúrbios dos tecidos respiratórios do pulmão, acúmulo de líquidos ao redor do pulmão, inflamação da faringe, tosse, sintomas semelhantes à gripe.
- Problemas estomacais, como inflamação ou úlcera causando dor abdominal ou diarreia, sangramento no estômago, inflamação ou úlcera na boca, acúmulo de líquidos no abdômen, vômito, dor abdominal, indigestão, prisão de ventre, flatulência, inchaço, fezes moles.
- Distúrbios no duto biliar, amarelamento da pele por problemas hepáticos, dano no tecido hepático e inflamação do fígado.
- Coceira, erupção cutânea, queda de cabelo, acne, sudorese elevada.
- Dor nas articulações, membros ou lombar, cãibras musculares e espasmos musculares.
- Função renal insuficiente, produção reduzida de urina, micção comprometida ou dolorosa.
- Fraqueza geral, febre, acúmulo de líquidos no corpo, dor e desconforto, aumento da enzima fosfatase alcalina no sangue, ganho de peso, sensação de temperatura desregulada.
- Função insuficiente do órgão transplantado.
- Percepção perturbada da temperatura corporal.
Reações adversas incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Alterações na coagulação do sangue, redução do número de todos os tipos de células sanguíneas (observadas em exames de sangue).
- Desidratação, incapacidade de urinar.
- Exames de sangue anormais: proteínas ou açúcar reduzidos, fosfato elevado, aumento da enzima lactato desidrogenase.
- Coma, sangramento no cérebro, acidente vascular cerebral, paralisia, distúrbio cerebral, anormalidades da fala e linguagem, problemas de memória.
- Turvamento do cristalino (olho), audição comprometida.
- Batimentos cardíacos irregulares, parada dos batimentos cardíacos, desempenho reduzido do coração, distúrbio do músculo cardíaco, alargamento do músculo cardíaco, batimento cardíaco mais forte, ECG anormal, frequência cardíaca e pulsação anormais.
- Coágulo na veia de um membro, choque.
- Dificuldades para respirar, distúrbios do trato respiratório, asma.
- Obstrução intestinal, nível elevado da enzima amilase, refluxo do conteúdo estomacal até a garganta, esvaziamento retardado do estômago.
- Inflamação da pele, sensação de queimação quando sob a luz solar.
- Distúrbios nas articulações.
- Menstruação dolorosa e sangramento menstrual anormal.
- Insuficiência de múltiplos órgãos, doença semelhante a gripe, sensibilidade elevada ao calor e ao frio, sensação de pressão no peito, agitação ou sensação anormal, perda de peso.
Reações adversas raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Pequenos sangramentos na pele devido a coágulos sanguíneos. - Maior rigidez muscular.
- Cegueira, surdez.
- Acúmulo de líquido ao redor do coração.
- Falta de ar súbita.
- Formação de cisto no pâncreas.
- Problemas no fluxo sanguíneo do fígado.
- Doença grave com formação de bolhas na pele, boca, olhos e genitais; aumento dos pelos. - Sede, quedas, sensação de pressão no peito, mobilidade reduzida, úlcera.
- Hepatite granulomatosa.
- Plexopatia braquial.
- Lesão do nervo periférico. - Mudismo.
Reações adversas muito raras (ocorrem em menos de 0,01% dos pacientes que utilizam este medicamento):
- Fraqueza muscular.
- Exame cardíaco anormal.
- Insuficiência do fígado.
- Micção dolorosa com sangue na urina. - Aumento do tecido gorduroso.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
População Especial
Pacientes com função renal e hepática prejudicada
Se você recebeu um transplante de fígado e não está bem, o uso de tacrolimo pode estar associado a um maior risco para desenvolvimento de insuficiência renal relacionada aos níveis elevados de tacrolimo no sangue total. Nesse caso, o médico fará o monitoramento atento da situação até o final do tratamento e, se necessário, fará ajustes à dose de tacrolimo.
Pacientes pediátricos
Pacientes pediátricos, geralmente, requerem doses maiores de tacrolimo para manter concentrações sanguíneas similares as de adultos.
Raça
A comparação retrospectiva dos pacientes negros e caucasianos submetidos ao transplante de rim indicou que os pacientes negros necessitavam de doses mais elevadas de tacrolimo para atingirem concentrações mínimas semelhantes.
Não foram observadas diferenças gerais na segurança ou eficácia entre pacientes idosos e mais jovens, mas a sensibilidade maior de alguns pacientes mais idosos não pode ser descartada. Em geral, recomenda-se cautela quanto à seleção de dose para pacientes geriátricos, refletindo a maior frequência de redução nas funções hepática e renal e de doenças concomitantes ou uso de outros medicamentos.
Gravidez
Não existem estudos adequados e bem controlados em mulheres grávidas. O tacrolimo é transferido através da placenta. O tacrolimo deverá ser usado durante a gravidez somente se o benefício para a mãe justificar o risco potencial ao feto.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação de um médico ou um cirurgião-dentista.
Lactação
Uma vez que o tacrolimo é excretado no leite humano, a amamentação deve ser interrompida durante o tratamento.
Durante o período de aleitamento materno ou doação de leite humano, só utilize medicamentos com o conhecimento do seu médico ou cirurgião-dentista, pois alguns medicamentos podem ser excretados no leite humano, causando reações indesejáveis no bebê.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Composição
Cada cápsula de 1 mg contém:
tacrolimo (na forma monoidratada) -1 mg
Excipientes* qsp - 1 cáp *hipromelose, lactose monoidratada, croscarmelose sódica, estearato de magnésio, cloreto de metileno e álcool etílico.
Cada cápsula de 5 mg contém:
tacrolimo (na forma monoidratada) - 5 mg
Excipientes* qsp - 1 cáp *hipromelose, lactose monoidratada, croscarmelose sódica, estearato de magnésio, cloreto de metileno e álcool etílico.
Superdosagem
Se você ingerir acidentalmente uma quantidade maior de tacrolimo, poderá apresentar as reações adversas mencionadas no item QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR. Se isso acontecer, avise seu médico e ele recomendará o tratamento adequado.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800-722-6001, se você precisar de mais orientações.
Interação Medicamentosa
O uso concomitante de tacrolimo com medicamentos cujo efeito nefrotóxico ou neurotóxico é conhecido pode aumentar o nível de toxicidade. Já que o tratamento com tacrolimo pode ser associado com hiperpotassemia ou pode aumentar a hiperpotassemia preexistente, deve-se evitar o consumo elevado de potássio ou diuréticos poupadores de potássio.
Devido ao potencial para insuficiência renal aditiva ou sinérgica, é preciso cautela ao administrar tacrolimo com medicamentos que possam estar relacionados com disfunção renal. Esses medicamentos incluem, mas não estão limitados a, aminoglicosídeos, anfotericina B ou ibuprofeno e cisplatina.
Experimentos clínicos iniciais com a coadministração de tacrolimo e ciclosporina resultaram em nefrotoxicidade aditiva/sinérgica. Os pacientes que trocarem o tratamento com ciclosporina por tacrolimo só devem receber a primeira dose de tacrolimo 24 horas após a última dose de ciclosporina. A administração de tacrolimo deve ser adiada na presença de níveis elevados de ciclosporina.
Medicamentos que podem alterar as concentrações de tacrolimo
A terapia sistêmica com tacrolimo exige monitoramento atento quando coadministrada com medicamentos com interação potencial e, quando necessário, deve-se interromper ou ajustar a dose de tacrolimo.
Como tacrolimo é metabolizado principalmente pelo sistema enzimático CYP3A, substâncias que inibem estas enzimas podem reduzir o metabolismo ou aumentar a biodisponibilidade de tacrolimo, resultando em aumento nas concentrações plasmáticas ou no sangue total. Os fármacos que induzem estes sistemas enzimáticos podem aumentar o metabolismo ou diminuir a biodisponibilidade de tacrolimo, resultando em redução das concentrações no sangue total ou plasma. Monitoramento das concentrações sanguíneas e ajustes de dose são essenciais quando tais drogas são usadas concomitantemente:
Fármacos que podem aumentar as concentrações de tacrolimo no sangue
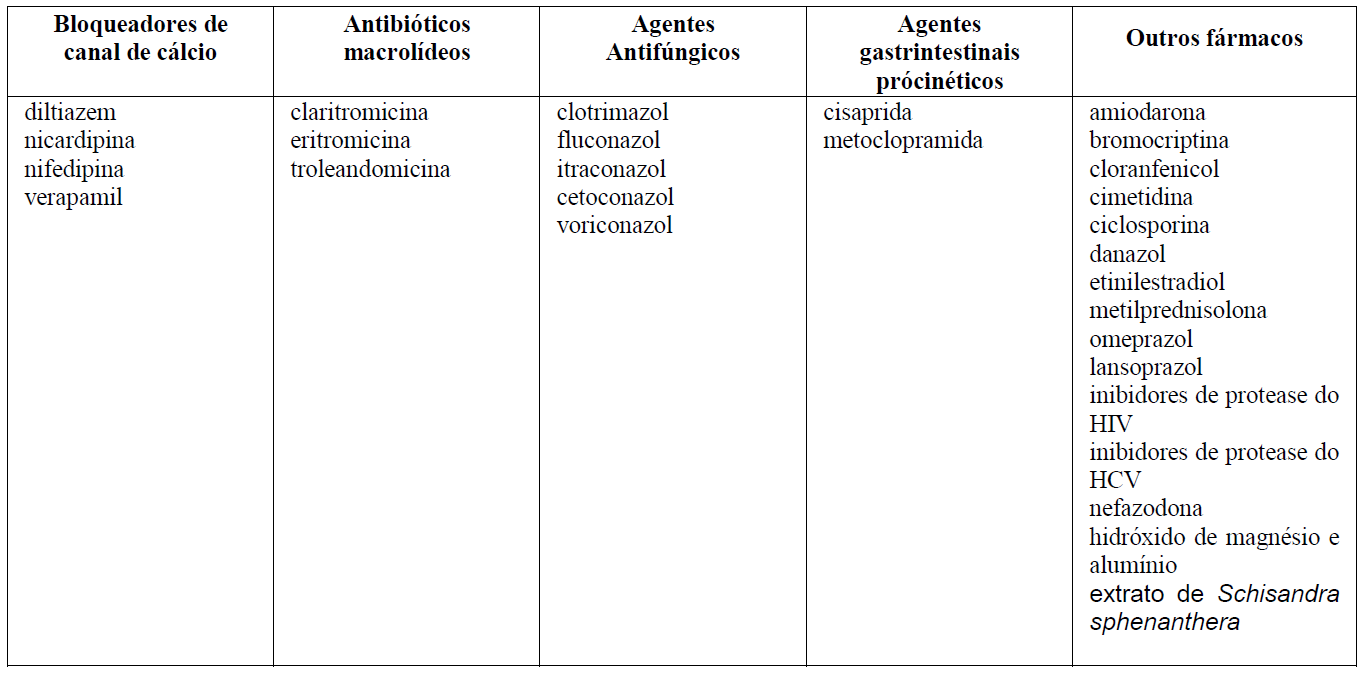
O tacrolimo também demonstrou efeito inibidor amplo e forte sobre o metabolismo dependente de CYP3A4. Assim, o uso concomitante de tacrolimo com fármacos conhecidamente metabolizados por vias dependentes de CYP3A4 pode afetar o metabolismo desses fármacos. O tacrolimo se liga de forma extensa à proteínas plasmáticas. Possíveis interações com outros fármacos com alta afinidade conhecida para proteínas plasmáticas devem ser consideradas.
O suco de toranja (grapefruit) afeta o metabolismo mediado por CPY3A, resultando em aumento da concentração de tacrolimo no sangue; portanto, deve ser evitado.
Reduções significativas da dose de tacrolimo e o prolongamento do intervalo de administração podem ser necessários quando coadministrado com fortes inibidores de CYP3A4, especialmente telaprevir. O monitoramento atento dos níveis de tacrolimo no sangue, além do monitoramento do prolongamento do intervalo QT com ECG, função renal e outros efeitos colaterais são fortemente recomendados.
O lansoprazol e omeprazol (CYP2C19, substrato de CYP3A4) tem o potencial de inibir o metabolismo do tacrolimo mediado por CYP3A4 e, portanto, aumentar consideravelmente as concentrações de tacrolimo no sangue total, especialmente em pacientes transplantados que são metabolizadores deficientes ou intermediários de CYP2C19, em comparação aos pacientes que metabolizam CYP2C19 de forma eficiente.
A cimetidina também pode inibir o metabolismo do CYP3A4 de tacrolimo e, assim, aumentar substancialmente as concentrações de tacrolimo no sangue total.
A maioria dos inibidores de protease inibe as enzimas de CYP3A e pode aumentar as concentrações de tacrolimo no sangue total. Recomenda-se evitar o uso concomitante de tacrolimo com nelfinavir, a menos que os benefícios justifiquem os riscos. As concentrações de tacrolimo no sangue total são acentuadamente elevadas quando há coadministração de telaprevir ou boceprevir.
Recomenda-se o monitoramento das concentrações de tacrolimo no sangue total e das reações adversas associadas ao tacrolimo, além de ajustes adequados no esquema de dose de tacrolimo quando tacrolimo e inibidores de protease (por exemplo, ritonavir, telaprevir, boceprevir) são usados concomitantemente.
Telaprevir:
Em um estudo de dose única com 9 voluntários saudáveis, a coadministração de tacrolimo (dose única de 0,5 mg) com telaprevir (750 mg três vezes por dia por 13 dias) elevou a Cmáx de tacrolimo normalizado por dose em 9,3 vezes e a AUC em 70 vezes em comparação ao tacrolimo isolado.
Boceprevir:
Em um estudo de dose única com 12 sujeitos de estudo, a coadministração de tacrolimo (dose única de 0,5 mg) com boceprevir (800 mg três vezes por dia por 11 dias) elevou a Cmáx de tacrolimo em 9,9 vezes e a AUC em 17 vezes em comparação ao tacrolimo em monoterapia.
Nelfinavir:
Com base em um estudo clínico com 5 receptores de transplante hepático, a coadministração de tacrolimo e nelfinavir aumentou as concentrações de tacrolimo no sangue de forma significativa e, como resultado, uma redução de 16 vezes, em média, da dose de tacrolimo foi necessária para manter as concentrações médias de vale de tacrolimo de 9,7 ng/mL. Recomenda-se evitar o uso concomitante de tacrolimo com nelfinavir, a menos que os benefícios justifiquem os riscos.
Hidróxido de Alumínio/Magnésio:
Em um estudo cruzado de dose única em pacientes sadios com coadministração oral de tacrolimo e hidróxido de alumínio e magnésio resultou em um aumento de 21% na AUC média do tacrolimo, e numa redução de 10% na Cmáx média de tacrolimo com relação a sua administração oral isolado.
Fármacos que podem diminuir a concentração do tacrolimo no sangue

A Erva de São João (Hypericum perforatum) induz o citocromo CYP3A4 e a glicoproteína P. Uma vez que o tacrolimo é substrato para o citocromo CYP3A4, há um potencial de que o uso da Erva de São João em pacientes recebendo tacrolimo possa resultar na redução dos níveis de tacrolimo.
Rifampicina:
Em um estudo com 6 voluntários normais observou-se uma significante redução na biodisponibilidade oral de tacrolimo (de 14 ± 6% para 7 ± 3%) quando administrado concomitantemente com rifampicina (600 mg). Além disso, houve um aumento significante da depuração do tacrolimo (de 0,036 ± 0,008 L/h/kg para 0,053 ± 0,010 L/h/kg) em administração concomitante com rifampicina.
O suco de toranja (grapefruit) afeta o metabolismo mediado por CPY3A, resultando em aumento da concentração de tacrolimo no sangue, portanto deve ser evitado.
Após a administração concomitante de tacrolimo e sirolimo (2 ou 5 mg/dia) em pacientes receptores de transplante renal estáveis, a AUC0-12 média e a Cmín reduziram em aproximadamente 30% com relação ao tacrolimo administrado isoladamente. Após a administração concomitante de tacrolimo e 1 mg/dia de sirolimo, a AUC0-12 média e a Cmín reduziram em aproximadamente 3% e 11%, respectivamente. A segurança e eficácia do uso do tacrolimo em combinação com o sirolimo para prevenção da rejeição a enxerto não foram estabelecidas, e seu uso não é recomendado.
Outras Interações Medicamentosas
Os imunossupressores podem afetar a vacinação. Portanto, durante o tratamento com tacrolimo, a vacinação pode ser menos eficaz. O uso de vacinas vivas deve ser evitado; vacinas vivas incluem, mas não são limitadas a vacina intranasal contra gripe, sarampo, caxumba, rubéola, poliomielite, BCG, febre amarela, varicela e tifoide TY21a.
Informe a seu paciente que, durante tratamento, o uso de vacinas exige avaliação do profissional de saúde.
Interação Alimentícia
A presença de alimentos afeta a absorção de tacrolimo. A taxa e a extensão da absorção de tacrolimo são maiores em condições de jejum.
A presença e a composição do alimento diminuíram tanto a taxa como a extensão da absorção de tacrolimo quando administrado em 15 voluntários sadios.
O efeito foi mais pronunciado com uma refeição rica em lipídios (848 kcal, 46% de lipídios): a AUC e a Cmáx médias diminuíram 37% e 77%, respectivamente; o Tmáx se prolongou 5 vezes.
Uma refeição rica em carboidratos (668 kcal, 85% de carboidratos) fez com que a AUC e a Cmáx médias fossem diminuídas em 28% e 65%, respectivamente.
Em voluntários sadios (n=16), o tempo da refeição também afetou a biodisponibilidade de tacrolimo. Quando administrado imediatamente após a refeição, a Cmáx média foi reduzida em 71% e a AUC média foi reduzida em 39% em relação às condições de jejum. Quando administrado 1,5 horas após a refeição, a Cmáx média foi reduzida em 63% e a AUC média foi reduzida em 39% em relação às condições de jejum.
Em 11 pacientes receptores de transplante hepático, tacrolimo administrado 15 minutos após um café da manhã rico em lipídios (400 kcal, 34% de lipídios), resultou em decréscimo da AUC (27 ± 18%) e da Cmáx (50 ± 19%), quando comparado às condições de jejum.
Ação da Substância
Resultados de eficácia
Transplante Hepático
A segurança e eficácia da imunossupressão baseada em tacrolimo após transplante ortotópico de fígado foram avaliadas em dois estudos prospectivos, multicêntricos, abertos e randomizados. O grupo controle ativo foi tratado com regime de imunossupressão baseado em ciclosporina. Ambos os estudos utilizaram concomitantemente corticosteroides adrenais como parte do regime imunossupressor. Tais estudos foram desenhados com o objetivo de avaliar se os regimes imunossupressores eram equivalentes, tendo como desfecho primário a sobrevida de 12 meses após o transplante do paciente e do enxerto. A terapia de imunossupressão baseada em tacrolimo se mostrou equivalente ao regime imunossupressor baseado em ciclosporina.
Em um ensaio envolvendo 529 pacientes em 12 centros nos Estados Unidos, antes da cirurgia 263 pacientes foram randomizados para o tratamento baseado em tacrolimo, enquanto 266 para o regime imunossupressor baseado em ciclosporina (CBIR). Em 10 dos 12 centros o mesmo protocolo de CBIR foi utilizado, enquanto 2 centros utilizaram protocolos diferentes. Este ensaio clínico excluiu pacientes com disfunção renal, falência hepática fulminante com encefalopatia estágio IV e câncer. Foi permitida a inclusão de pacientes pediátricos (idade ?12 anos).
Em um segundo ensaio clínico, 545 pacientes foram incluídos em 8 centros na Europa, antes da cirurgia 270 pacientes foram randomizados para o tratamento baseado em tacrolimo, enquanto 275 para CBIR. Neste estudo cada centro utilizou o próprio protocolo padrão de CBIR no braço controle-ativo. Não foram incluídos pacientes pediátricos, mas permitia a inclusão de indivíduos com disfunção renal, falência hepática fulminante com encefalopatia estágio IV e outros cânceres com metástases além do primário hepático.
As sobrevidas do paciente e do enxerto após 1 ano do transplante no grupo com regime imunossupressor baseado em tacrolimo são equivalentes àquelas observadas nos grupos tratados com CBIR em ambos os estudos. A sobrevida geral do paciente (grupos recebendo regime imunossupressor baseado em tacrolimo e CBIR combinados) foi de 88% no estudo americano e 78% no estudo europeu.
A sobrevida geral do enxerto após 1 ano do transplante (grupos recebendo regime imunossupressor baseado em tacrolimo e CBIR combinados) foi de 81% no estudo americano e 73% no estudo europeu. Nos dois estudos a mediana de tempo de conversão da via de administração do tacrolimo de IV para oral foi de 2 dias.
Devido a natureza e desenho dos estudos, a comparação de desfechos secundários, como incidência de rejeição aguda, rejeição refratária ou uso de OKT3 para rejeição esteroide-resistente, não pôde ser realizada adequadamente.
Transplante Renal
Foi realizado um estudo clínico de fase III, prospectivo, randomizado, aberto, multicêntrico, com imunossupressão baseada em tacrolimo após transplante renal. Foram incluídos 412 pacientes receptores de transplante renal em 19 centros de estudo nos Estados Unidos. A terapia iniciou-se assim que a função renal foi estabelecida, como indicado pela creatinina sérica < 4 mg/dL (mediana de 4 dias após o transplante, intervalo de 1 a 14 dias). Pacientes com menos de 6 anos de idade foram excluídos do ensaio.
Neste estudo foram incluídos 205 pacientes no grupo que recebeu imunossupressão baseada em tacrolimo, enquanto 207 pacientes foram randomizados para o grupo recebendo regime de imunossupressão com ciclosporina. Todos os pacientes receberam terapia de indução profilática, composta de uma preparação de anticorpos antilinfócito, corticosteroides e azatioprina.
As sobrevidas gerais de 1 ano dos pacientes e do enxerto foi de 96,1% e 89,6%, respectivamente, e foi equivalentes entre os dois tratamentos do estudo.
Devido a natureza do desenho dos estudos, a comparação de desfechos secundários, como incidência de rejeição aguda, rejeição refratária ou uso de OKT-3 para rejeição esteroide-resistente, não pôde ser realizada adequadamente.
Características farmacológicas
Propriedades Farmacodinâmicas
O tacrolimo prolonga a sobrevivência do hospedeiro e órgãos transplantados em modelos animais de transplantes de fígado, rins, coração, medula óssea, intestino delgado e pâncreas, pulmão e traqueia, pele, córnea e membros.
Em animais, demonstrou-se que tacrolimo causa supressão da imunidade humoral e, com maior extensão, as reações mediadas por células tais como a rejeição alográfica, hipersensibilidade do tipo tardia, artrite induzida por colágeno, encefalomielite alérgica experimental e doença do enxerto contra hospedeiro.
Mecanismo de ação
À nível molecular, os efeitos do tacrolimo parecem ser mediados através da ligação à uma proteína citosólica (FKBP12), responsável pelo acúmulo intracelular do composto. O complexo FKBP12-tacrolimo liga-se especificamente competitivamente à calcineurina inibindo-alevando a uma inibição dependente de cálcio das vias de transdução de sinal das células Ta transcrição de um conjunto distinto de genes de citocinae. Dessa forma, evita-se. a transcrição de um conjunto distinto de genes de citocina.
Tacrolimo é um agente imunossupressor altamente potente e que demonstra sua atividade tanto in vitro quanto in vivo.
Em particular, o tacrolimo inibe a formação de linfócitos citotóxicos que são principalmente responsáveis pela rejeição do enxerto.
O tacrolimo suprime a ativação das células T, a proliferação de células T-helper dependentes de células B, bem como a formação de linfoquinas (tais como interleucinas-2, -3 e e a expressão do receptor de interleucina-2. interferon gama) e a expressão do receptor de interleucina-2.
Propriedades Farmacocinéticas
A atividade do tacrolimo é devida, principalmente, ao fármaco-mãe. Os parâmetros farmacocinéticos do tacrolimo foram determinados após administração intravenosa e oral em voluntários sadios, em pacientes receptores de transplante renal e em pacientes receptores de transplante hepático.
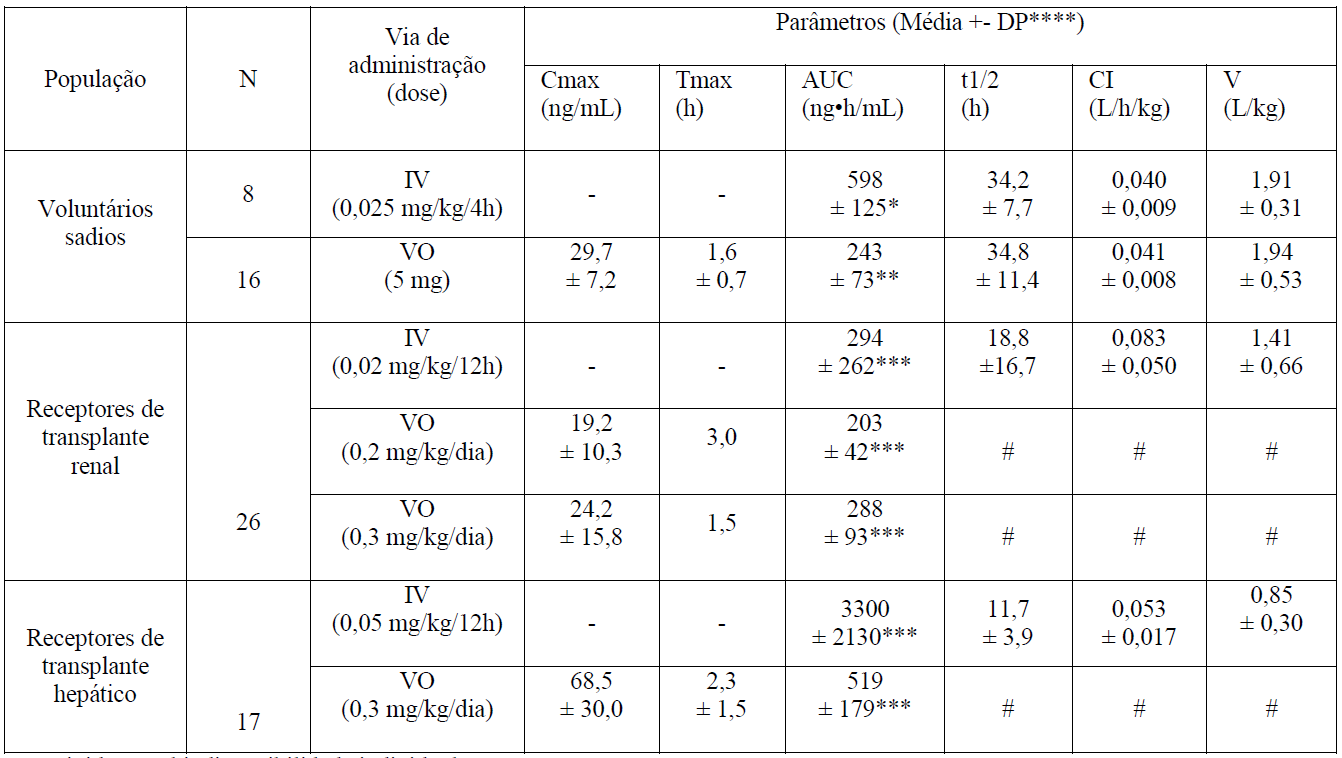
Corrigido para biodisponibilidade individual.
*AUC0-120.
**AUC0-72.
***AUC0-inf.
****DP = Desvio Padrão.
- Não aplicável.
#Dado indisponível.
Devido à variabilidade inter-sujeitos na farmacocinética do tacrolimo, é necessária a individualização da posologia para a otimização da terapia. Os dados farmacocinéticos indicam que as concentrações no sangue total, e não as concentrações plasmáticas, representam o compartimento de amostragem mais apropriado para descrever a farmacocinética do tacrolimo.
Absorção
No homem, o tacrolimo demonstrou ser absorvido ao longo do trato gastrointestinal.
Após a administração oral de tacrolimo cápsulas, as concentrações máximas (Cmáx) de tacrolimo no sangue são atingidas em cerca de 1 - 3 horas. Em alguns pacientes, o tacrolimo parece ser absorvido continuamente durante um período prolongado, originando um perfil de absorção relativamente estável. A biodisponibilidade oral média do tacrolimo varia entre 20% - 25%.
Após a administração oral (0,30 mg/kg/dia) em pacientes submetidos à transplante de fígado, as concentrações de estado equilíbrio de tacrolimo foram atingidas dentro de 3 dias na maioria dos pacientes.
Em voluntários sadios, as cápsulas tacrolimo 0,5 mg, tacrolimo 1 mg e tacrolimo 5 mg mostraram-se bioequivalentes, quando administradas em doses equivalentes.
A taxa e extensão da absorção de tacrolimo é maior sob condições de jejum. A presença de alimentos diminui a taxa e a extensão da absorção do tacrolimo, o efeito é mais pronunciado após uma refeição rica em lipídios. O efeito de uma refeição rica em carboidratos é menos pronunciado.
Em pacientes estáveis submetidos ao transplante de fígado, a biodisponibilidade oral de tacrolimo foi reduzida quando administrado após uma refeição com uma quantidade moderada de lipídios (34% de calorias). Diminuições da AUC (27%) e da Cmáx (50%) e um aumento do Tmáx (173%) no sangue total foram evidentes.
Em um estudo com pacientes estáveis submetidos ao transplante renal e que receberam tacrolimo imediatamente após um café da manhã habitual, o efeito na biodisponibilidade oral foi menos pronunciado. Diminuições da AUC (2 a 12%) e da Cmáx (15 a 38%), e um aumento do Tmáx (38 a 80%) no sangue total foram evidentes.
O fluxo biliar não influencia a absorção de tacrolimo.
Existe forte correlação entre a AUC e os níveis mínimos no sangue total no estado de equilíbrio. Monitoramento dos níveis no sangue total fornece uma boa estimativa da exposição sistêmica.
Distribuição e eliminação
No homem, a distribuição de tacrolimo após infusão intravenosa pode ser descrita como bifásica.
Na circulação sistêmica, o tacrolimo liga-se fortemente aos eritrócitos, resultando em uma proporção de distribuição das concentrações de sangue total / plasma de aproximadamente 20:1.
No plasma, o tacrolimo é altamente ligado às proteínas plasmáticas (> 98,8%), principalmente à albumina sérica e à ?-1-glicoproteína ácida.
O tacrolimo é amplamente distribuído no organismo. O volume de distribuição no estado de equilíbrio, com base nas concentrações plasmáticas, é de aproximadamente 1.300 L (indivíduos sadios). Dados correspondentes derivados do sangue total foram em média de 47,6 L.
O tacrolimo é uma substância com baixa depuração. Em indivíduos sadios, a média da depuração corporal total, estimada a partir de concentrações no sangue total, foi de 2,25 L/h. Em pacientes adultos submetidos ao transplante de fígado, rim e de coração, foram observados os valores de 4,1 L/h, 6,7 L/h e 3,9 L/h, respectivamente.
Receptores pediátricos de transplante de fígado apresentaram uma depuração corporal total aproximadamente duas vezes maior que aquela apresentada por pacientes adultos submetidos ao transplante de fígado. Fatores como baixos níveis de hematócrito e de proteínas, que resultam em um aumento na fração não ligada de tacrolimo, ou aumento do metabolismo induzido por corticosteroides, são considerados como responsáveis pelas taxas de depuração superiores observadas após o transplante.
A meia-vida do tacrolimo é longa e variável. Em indivíduos saudáveis, a meia-vida média no sangue total é de aproximadamente 43 horas. Em pacientes adultos e pediátricos submetidos ao transplante de fígado, a média foi de 11,7 horas e de 12,4 horas, respectivamente, em comparação com 15,6 horas em receptores adultos de transplante renal. As taxas de depuração aumentadas contribuem para a meia-vida mais curta observada em receptores de transplantes.
Metabolismo e Biotransformação
O tacrolimo é extensivamente metabolizado no fígado, principalmente pelo citocromo P450-3A4. O tacrolimo é também consideravelmente metabolizado na parede intestinal. Existem vários metabólitos identificados. Apenas um deles demonstrou ter atividade imunossupressora in vitro semelhante ao tacrolimo. Os outros metabólitos têm apenas fraca ou nenhuma atividade imunossupressora. Na circulação sistêmica, apenas um dos metabólitos inativos está presente em baixas concentrações. Portanto, os metabólitos não contribuem para a atividade farmacológica do tacrolimo.
Excreção
Após a administração intravenosa e oral de tacrolimo marcado com 14C, a maior parte da radioatividade foi eliminada nas fezes.
Aproximadamente 2% da radioatividade foi eliminada na urina. Menos de 1% de tacrolimo inalterado foi detectado na urina e nas fezes, indicando que o tacrolimo é quase que completamente metabolizado antes da eliminação: a bile foi a principal via de eliminação.
Dados Pré-clínicos de Segurança
Os rins e o pâncreas foram os principais órgãos afetados nos estudos de toxicidade realizados em ratos e babuínos. Em ratos, o tacrolimo causou efeitos tóxicos para o sistema nervoso e olhos. Efeitos cardiotóxicos reversíveis foram observados em coelhos após a administração intravenosa de tacrolimo.
Toxicidade embriofetal foi observada em ratos e coelhos e esteve limitada à doses que causaram toxicidade significativa nas progenitoras. Em ratos, a função reprodutora feminina, incluindo o nascimento, foi debilitada em doses tóxicas e a prole apresentou peso, viabilidade e crescimento reduzidos ao nascimento.
Foi observado um efeito negativo do tacrolimo na fertilidade masculina em ratos, sob a forma de contagem reduzida e da motilidade dos espermatozoides.
Populações especiais
Pacientes Pediátricos
A farmacocinética do tacrolimo, foi estudada em pacientes receptores de transplante hepático, com idades entre 0,7 e 13,2 anos. Após administração via intravenosa de uma dose de 0,037 mg/kg/dia em 12 pacientes pediátricos, a meia-vida terminal média, o volume de distribuição médio e a depuração média foram de 11,5 ± 3,8 horas, 2,6 ± 2,1 L/kg e 0,138 ± 0,071 L/h/kg, respectivamente.
Após administração oral em 9 pacientes, a AUC e a Cmáx médias foram 337 ± 167 ng•h/mL e 43,4 ± 27,9 ng/mL, respectivamente. A biodisponibilidade absoluta foi 31 ± 21%.
Após a administração de tacrolimo, as concentrações mínimas no sangue total de 31 pacientes com menos de 12 anos de idade mostraram que pacientes pediátricos necessitam de doses mais elevadas que os adultos para alcançar uma concentração mínima similar de tacrolimo.
A farmacocinética de tacrolimo também foi estudada em pacientes submetidos ao transplante de rim, com idade de 8,2 ± 2,4 anos.
Após administração via intravenosa de uma dose de 0,06 mg/kg/dia (variação de 0,06 – 0,09) em 12 pacientes pediátricos (8 do sexo masculino e 4 do sexo feminino), a meia-vida terminal média e a depuração média foram de 10,2 ± 5,0 horas (variação de 3,4 – 25) e de 0,12 ± 0,04 L/h/kg (variação de 0,06 – 0,17), respectivamente. Após a administração oral aos mesmos pacientes, a AUC e Cmáx médias foram de 181 ± 65 ng•h/mL (variação de 81 – 300) e 30 ± 11 ng/mL (variação de 14 – 49), respectivamente. A biodisponibilidade absoluta foi de 19 ± 14 % (variação de 5,2 – 56).
Pacientes com Insuficiência Hepática e Renal
As médias dos parâmetros farmacocinéticos do tacrolimo, após administração única em pacientes com insuficiência hepática e renal, são dadas na tabela abaixo.
Farmacocinética em Pacientes com Insuficiência Renal e Hepática
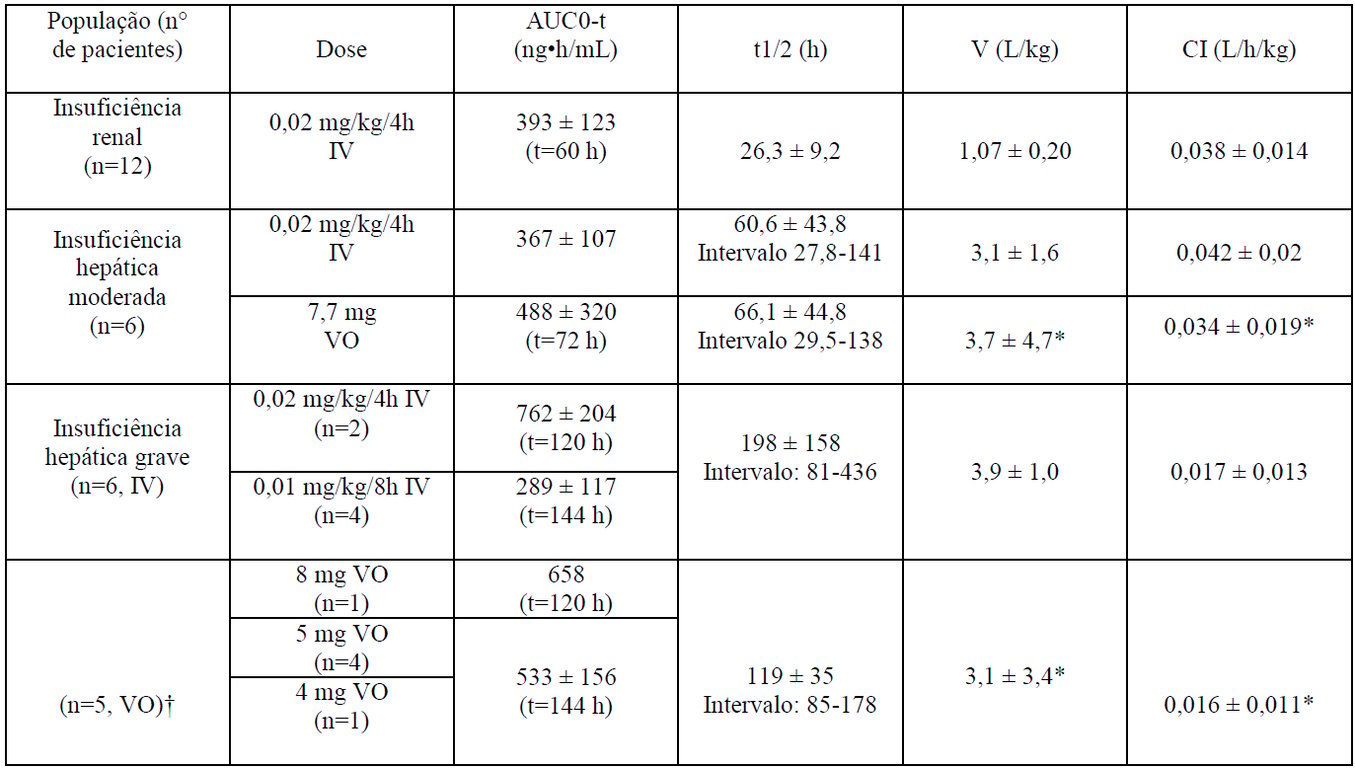
*Corrigida para biodisponibilidade.
†1 paciente não recebeu a dose por via oral.
IV: intravenosa VO: via oral.
Pacientes com Insuficiência Renal
A farmacocinética do tacrolimo após a administração de dose única intravenosa foi determinada em 12 pacientes (7 não estavam em diálise e 5 em diálise, creatinina sérica de 3,9±1,6 e 12,0±2,4 mg/dL, respectivamente) anteriormente ao transplante renal. Os parâmetros farmacocinéticos obtidos foram similares em ambos os grupos.
A depuração média de tacrolimo em pacientes com disfunção renal foi similar a de voluntários normais.
Pacientes com Insuficiência Hepática
A farmacocinética do tacrolimo foi determinada em 6 pacientes com disfunção hepática leve (média do escore de Pugh: 6,2) após administrações de dose única via oral e intravenosa. A depuração média de tacrolimo em pacientes com disfunção hepática leve não foi substancialmente diferente da depuração de voluntários normais.
A farmacocinética do tacrolimo foi estudada em 6 pacientes com disfunção hepática grave (média do escore de Pugh: > 10). A depuração média foi substancialmente menor nos pacientes com disfunção hepática grave, independentemente da via de administração.
Raça
A farmacocinética do tacrolimo foi estudada após uma única administração intravenosa e oral de tacrolimo aos seguintes voluntários sadios: 10 negros, 12 latino-americanos e 10 caucasianos.
Não houve diferenças farmacocinéticas significativas entre os três grupos étnicos após uma infusão IV de 0,015 mg / kg por 4 horas. Entretanto, após uma única administração oral de 5 mg, a Cmáx ± DP de tacrolimo em negros (± 12,1 ng / mL) foi significativamente menor que em caucasianos (40,2 ± 12,6 ng / mL) e em latinoamericanos (36,2 ± 15,8 ng / mL)( p< 0,01).
A AUC0-inf média tendeu a ser menor em negros (203 ± 115 ng •h / mL) que em caucasianos (344 ± 186 ng • h / mL) e latinoamericanos (274 ± 150 ng •h / mL).
A média da biodisponibilidade oral absoluta (F) (± DP) em negros (12 ± 4,5%) e latino-americanos (14 ± 7,4%) foi significativamente menor que em caucasianos (19 ± 5,8%, p = 0,011).
Não houve diferença significativa na média do T½ terminal entre os três grupos étnicos (variação de aproximadamente 25 a 30 horas).
A comparação retrospectiva dos pacientes negros e caucasianos submetidos ao transplante de rim indicou que os pacientes negros necessitavam de doses mais elevadas de tacrolimo para atingirem concentrações mínimas semelhantes.
Sexo
Não foi conduzido estudo formal para avaliar o efeito do sexo na farmacocinética de tacrolimo. No entanto, não se observa diferença na dosagem por sexo nos estudos clínicos envolvendo transplante renal. Uma comparação retrospectiva da farmacocinética em voluntários sadios, pacientes receptores de transplante renal e pacientes receptores de transplante hepático indicam que não há diferenças relacionadas ao sexo.
Cuidados de Armazenamento
Conserve as cápsulas de Tacrolil em temperatura ambiente (entre 15°C e 30°C), protegidas da umidade. Este medicamento tem validade de 24 meses a partir da data de fabricação
Número do lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Aspecto físico:
- O tacrolimo 1 mg: apresenta-se na forma de cápsula de gelatina dura, de cor branca no corpo e na tampa, contendo granulado na cor branca.
- O tacrolimo 5 mg: apresenta-se na forma de cápsula de gelatina dura, de cor branca no corpo a azul na tampa, contendo granulado na cor branca.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Mensagens de Alerta
Este medicamento pode aumentar o risco de sangramento em caso de dengue.
Dizeres Legais
Registro M.S. no 1.0235.1030
Farm. Resp.: Dr. Ronoel Caza de Dio CRF-SP no 19.710
Registrado por: EMS S.A.
Rod. Jornalista Francisco Aguirre Proença, KM 08 Bairro Chácara Assay – Hortolândia/SP
CEP: 13186-901
CNPJ: 57.507.378/0003-65
INDÚSTRIA BRASILEIRA
Fabricado por: EMS S.A.
Hortolândia/SP SAC 0800 – 191914
www.ems.com.br
VENDA SOB PRESCRIÇÃO MÉDICA.
informações complementares
| Fabricante |
| EMS |
| Princípio ativo |
| Tacrolimo |
| Categoria do medicamento |
| Medicamentos Especiais |
