para o que é indicado e para que serve?
Para que serve PARA QUE ESTE MEDICAMENTO É INDICADO TEVAGRASTIM® (filgrastim) foi prescrito para ajudar seu corpo a fabricar mais leucócitos (glóbulos brancos do sangue) Seu médico irá explicar porque você está sendo tratado com TEVAGRASTIM® TEVAGRASTIM® é utilizado para diversas condições, tais como: - Quimioterapia; - Transplante de medula óssea; - Neutropenia crônica grave (número reduzido de leucócitos); - Mobilização de células progenitoras do sangue periférico (células-tronco) 2Continue lendo...
sem ofertas para Tevagrastim 300 Mcg Solução In...

Parece que não há ofertas disponíveis para o produto no momento.
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
PARA QUE ESTE MEDICAMENTO É INDICADO TEVAGRASTIM® (filgrastim) foi prescrito para ajudar seu corpo a fabricar mais leucócitos (glóbulos brancos do sangue) Seu médico irá explicar porque você está sendo tratado com TEVAGRASTIM® TEVAGRASTIM® é utilizado para diversas condições, tais como: - Quimioterapia; - Transplante de medula óssea; - Neutropenia crônica grave (número reduzido de leucócitos); - Mobilização de células progenitoras do sangue periférico (células-tronco) 2
INDICAÇÕES
Contraindicação
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO TEVAGRASTIM® (filgrastim) é contraindicado para pacientes com hipersensibilidade (alergia) conhecida ao filgrastim ou a qualquer componente da formulação TEVAGRASTIM® não deve ser utilizado para o aumento da dose de quimioterapia citotóxica (terapia tóxica para as células, para tratamento de malignidades) além dos regimes de dose estabelecidos, e em pacientes com neutropenia congênita grave (síndrome de Kostmann) com citogenética anormal (células anormais) 4
CONTRAINDICAÇÕES
Como usar
COMO DEVO USAR ESTE MEDICAMENTO Sempre utilize TEVAGRASTIM® (filgrastim) exatamente conforme seu médico orientar Você deve consultar seu médico em caso de dúvidas Posologia A dose recomendada de TEVAGRASTIM® depende da condição para a qual está realizando tratamento, assim como do seu peso corporal O seu médico irá informá-lo quando parar de realizar o tratamento com TEVAGRASTIM® É normal realizar diversos ciclos de tratamento com TEVAGRASTIM® TEVAGRASTIM® e quimioterapia A dose usual é 0,5 MIU (5 mcg)/kg por dia Por exemplo, caso você pese 60 kg, sua dose diária será 30 MIU (300 mcg) Geralmente você receberá a primeira dose de TEVAGRASTIM® ao menos 24 horas após a sua quimioterapia Seu tratamento geralmente irá durar 14 dias No entanto, em alguns tipos de doença, um tratamento mais longo, durante até 1 mês, pode ser necessário TEVAGRASTIM® e transplante de medula óssea A dose inicial usual é 1 MIU (10 mcg)/kg por dia Por exemplo, caso você pese 60 kg, sua dose diária será 60 MIU (600 mcg) Geralmente você receberá a primeira dose de TEVAGRASTIM® ao menos 24 horas após a sua quimioterapia, e dentro de 24 horas da transfusão de medula óssea Seu médico irá testar 3 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL seu sangue diariamente para verificar a eficácia do seu tratamento, e para determinar a dose adequada para seu tratamento O tratamento será descontinuado quando seus leucócitos atingirem nível determinado TEVAGRASTIM® e neutropenia crônica grave A dose inicial usual é entre 0,5 MIU (5 mcg) e 1,2 MIU (12 mcg)/kg por dia, em única dose ou múltiplas doses O seu médico irá testar seu sangue para verificar a eficácia do seu tratamento, e para determinar a dose adequada para seu tratamento Tratamento de longo prazo com TEVAGRASTIM® é necessário para tratamento de neutropenia crônica grave TEVAGRASTIM® e mobilização de células progenitoras do sangue periférico Caso você esteja realizando mobilização de células progenitoras do sangue periférico para você mesmo, a dose usual é entre 0,5 MIU (5 mcg) e 1 MIU (10 mcg)/kg por dia O tratamento com TEVAGRASTIM® irá durar por até 2 semanas, e em caso excepcionais pode ser mais longo Seu médico irá monitorar seu sangue para determinar o melhor momento para coletar as células progenitoras do sangue periférico Caso você esteja doando células tronco para outra pessoa, a dose usual é 1 MIU (10 mcg)/kg por dia O tratamento com TEVAGRASTIM® será realizado por 4 a 5 dias Modo de usar TEVAGRASTIM® é administrado através de injeção, por infusão intravenosa (IV) ou injeção subcutânea (SC) (administração no tecido logo abaixo da pele) Caso você receba este medicamento por injeção subcutânea, seu médico pode sugerir a autoadministração de TEVAGRASTIM® Seu médico ou enfermeiro irão instruí-lo a realizar a autoaplicação Não tente administrar TEVAGRASTIM® em você mesmo sem o devido treinamento por profissional experiente No entanto, o tratamento adequado da sua doença requer acompanhamento próximo e constante pelo seu médico Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento Não interrompa o tratamento sem o conhecimento do seu médico Instruções para a autoadministração de TEVAGRASTIM® Esta subseção contém informações de como autoadministrar a injeção de TEVAGRASTIM® por via subcutânea (sob a pele) É importante que você não tente aplicar a injeção em você mesmo sem que tenha recebido treinamento especial do seu médico ou enfermeiro Se você não estiver seguro de aplicar a injeção em você mesmo ou tiver dúvidas, peça ajuda ao seu médico Como usar TEVAGRASTIM® Você deverá aplicar a injeção no tecido imediatamente abaixo da pele, que é conhecida como injeção subcutânea Você deverá realizar a aplicação todos os dias no mesmo horário Equipamento necessário Para a autoaplicação no tecido subcutâneo você precisará: ? seringa preenchida de TEVAGRASTIM® ? lenço com álcool ou similar O que fazer antes da aplicação subcutânea de TEVAGRASTIM® 1 Administre o TEVAGRASTIM® aproximadamente no mesmo horário todos os dias 2 Retire a seringa preenchida de TEVAGRASTIM® do refrigerador 3 Verifique a data de vencimento no rótulo da seringa preenchida Não utilize se a data ultrapassar o último dia do mês indicado 4 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL 4 Verifique a aparência de TEVAGRASTIM® A solução deve estar límpida, incolor e isenta de partículas 5 Para mais conforto durante a injeção, deixe a seringa preenchida por 30 minutos à temperatura ambiente ou segure cuidadosamente a seringa por alguns minutos Não aqueça o medicamento de nenhuma outra maneira 6 Não retire a tampa da seringa até que esteja pronto para realizar a aplicação 7 Lave bem suas mãos antes da aplicação 8 Encontre um lugar confortável e bem iluminado, e coloque tudo o que você precisa para a aplicação ao seu alcance Como preparar a injeção de TEVAGRASTIM® Antes de realizar a aplicação de TEVAGRASTIM® você deve fazer o seguinte: 1 Segure a seringa e cuidadosamente retire a tampa da seringa sem girar Puxe em linha reta, conforme mostrado nas figuras 1 e 2 Não toque na agulha ou empurre o êmbolo da seringa 2 Você pode notar pequenas bolhas de ar na seringa preenchida Se houver a presença de bolhas de ar, bater levemente na seringa com a ponta dos dedos até que todas as bolhas de ar subam para o topo da seringa Com a seringa direcionada para cima, expelir todo o ar da seringa empurrando lentamente o êmbolo para cima 3 O corpo da seringa possui uma escala Empurre o êmbolo até o número (mL) referente à dose de TEVAGRASTIM® prescrita pelo seu médico 4 Verifique novamente para garantir que a dose correta de TEVAGRASTIM® 5 Agora você pode aplicar a seringa preenchida de TEVAGRASTIM® Onde realizar a aplicação de TEVAGRASTIM® Os locais mais adequados para a aplicação TEVAGRASTIM® são: ? Porção superior das coxas ? Abdômen, evitando a região próxima ao umbigo (vide áreas cinzas da figura 3) 5 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL Caso outra pessoa realize a aplicação em você, esta também pode ser realizada na região posterior e lateral dos braços (vide áreas cinzas da figura 4) O ideal é alterar o local de aplicação todos os dias, a fim de evitar o risco de dor em algum local Como realizar a autoaplicação 1 Desinfetar a pele no local da aplicação com o lenço umedecido com álcool e pinçar a pele entre o dedão e o indicador, sem comprimi-la (vide figura 5) 2 Inserir a agulha inteiramente dentro da pele, conforme mostrado por seu médico ou enfermeira (vide figura 6) 3 Puxar levemente o êmbolo para verificar se não foi perfurado nenhum vaso sanguíneo Se for observado sangue no interior da seringa, remover a agulha e inseri-la novamente em outro local 4 Injetar o líquido no tecido lenta e constantemente, sempre mantendo a pele pinçada Empurre o êmbolo até que toda a dose tenha sido aplicada e não seja mais possível empurrar o êmbolo Não parar de pressionar o êmbolo 5 Injete apenas dose prescrita pelo seu médico 6 Após injetar todo o líquido, retire a agulha da pele enquanto mantém o êmbolo pressionado 7 Após retirar a agulha da pele, soltar o êmbolo O dispositivo de segurança será acionado imediatamente, e a agulha será totalmente retraída para o interior da seringa (vide figura 7) 6 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL Caso você tenha qualquer problema, contatar seu médio para ajuda ou instruções 7
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO Se você se esquecer de utilizar TEVAGRASTIM® (filgrastim), contate o seu médico que irá informá-lo quando você deverá aplicar a próxima dose Não dobre a dose para compensar a dose esquecida Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista 8
POSOLOGIA E MODO DE USAR
Precauções
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO
Advertências e Precauções Informe ao seu médico, farmacêutico ou enfermeiro, antes de iniciar o tratamento com TEVAGRASTIM® (filgrastim), caso apresente alguma das condições a seguir: - Tosse, febre ou dificuldade para respirar Estes sinais podem ser consequência de distúrbios pulmonares (vide Seção 8
ADVERTÊNCIAS E PRECAUÇÕES VP - BU_09 VPS - BU_09 x 1 e x 5 seringas preenchidas com dispositivo de segurança TEVA FARMACÊUTICA LTDA - BRASIL Dados da submissão eletrônica Dados da petição / notificação que altera bula Dados das alterações de bulas Data do expediente N° expediente Assunto Data do expediente N° expediente Assunto Data da aprovação Itens de bula
Reações Adversas
Quais os males que este medicamento pode me causar ) - Anemia falciforme (doença hereditária, caracterizada pela má formação das hemácias, que assumem forma semelhante a foices) - Dor na porção esquerda superior do abdômen ou dor no ombro esquerdo Estes sinais podem ser consequência de ruptura biliar (vide Seção 8
Quais os males que este medicamento pode me causar ) - Distúrbios sanguíneos específicos (por ex , Síndrome de Kostmann, síndrome mielodisplásica, diferentes tipos de leucemia) - Osteoporose O seu médico deve verificar sua densidade óssea regularmente - Outras doenças, especialmente se você acredita que possa estar com alguma infecção Informe ao seu médico ou enfermeiro que está sendo tratado com TEVAGRASTIM® caso seja submetido a algum exame de imagem óssea Durante o tratamento com TEVAGRASTIM® você poderá ser submetido a exames sanguíneos regulamente, a fim de verificar sua contagem de neutrófilos e outros glóbulos brancos Estes exames permitirão que o seu médico verifique a eficácia do tratamento, assim como a necessidade de continuação do tratamento Interação com outros medicamentos Informe ao seu médico ou farmacêutico se você está utilizando, utilizou recentemente ou irá utilizar outros medicamentos Não utilize TEVAGRASTIM® nas 24 horas antes e nas 24 horas após a quimioterapia Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento Não use medicamento sem o conhecimento do seu médico Pode ser perigoso para a saúde Gravidez e Lactação Se você está grávida ou amamentando, acredita que esteja grávida ou está planejando engravidar, informe ao seu médico antes de utilizar este medicamento TEVAGRASTIM® não foi estudado em mulheres grávidas Sendo assim, o seu médico irá decidir se você deve ou não ser tratada com este medicamento É desconhecido se o filgrastim é excretado no leite humano Sendo assim, o seu médico irá decidir se você deve ou não utilizar este medicamento caso você esteja amamentando 2 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL Efeitos sobre a capacidade de dirigir e operar máquinas Caso você apresente fadiga, não dirija ou opere máquinas TEVAGRASTIM® contém sorbitol e sódio em sua formulação Caso seu médico o tenha informado que você apresenta intolerância a alguns açúcares, contate o seu médico antes de utilizar este medicamento TEVAGRASTIM® contém menos de 1 mmol de sódio (23 mg) por seringa preenchida, sendo assim é essencialmente livre de sódio 5
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR Como todos os medicamentos, TEVAGRASTIM® (filgrastim) pode causar reações adversas, embora nem todas as pessoas as apresentem
Reações adversas importantes: - Reações alérgicas tais como rash cutâneo (reação na pele), coceira em áreas inchadas e anafilaxia (reações alérgicas graves), com sintomas de fraqueza, hipotensão (queda da pressão sanguínea), dispneia (dificuldade para respirar) e inchaço da face foram relatadas Se você apresentar qualquer destas reações, pare de usar TEVAGRASTIM® e contate seu médico imediatamente - Esplenomegalia (aumento do tamanho do baço) e casos de ruptura esplênica (ruptura do baço) foram relatadas Alguns casos de ruptura esplênica (ruptura do baço) foram fatais É importante contatar o seu médico imediatamente se você apresentar dor na porção superior esquerda do abdômen ou dor no ombro esquerdo, que podem ser sintomas relacionados a distúrbios do baço - Tosse, febre e dificuldade ou dor ao respirar podem ser sinais de reações adversas pulmonares, tais como pneumonia e síndrome do desconforto respiratório agudo, que podem ser fatais Se você apresentar febre ou qualquer destes sintomas, contate seu médico imediatamente 7 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL - É importante que você informe o seu médico imediatamente caso apresente algum ou combinação das seguintes reações: inchaço ou edemaciamento, dificuldade para respirar, inchaço abdominal e sensação de estômago cheio, e sensação de cansaço Tais sintomas geralmente se desenvolvem rapidamente e são sintomas de condição incomum (pode afetar até 1 em cada 100 pessoas) conhecida como “síndrome de extravasamento capilar”, que causa o vazamento do sangue de pequenas veias sanguíneas para o corpo, e requer tratamento médico urgente - Se você possui anemia falciforme, garanta que seu médico seja informado antes do início do tratamento com TEVAGRASTIM® Crise falciforme ocorreu em alguns pacientes com anemia falciforme que receberam filgrastim - Dor musculoesquelética (dor muscular e óssea) são reações adversas muito comum (pode afetar mais de 1 em 10 pessoas) do tratamento com filgrastim Pergunte ao seu médico qual medicamento pode utilizar para melhorar este sintoma
Você pode apresentar ainda as seguintes reações adversas: Pacientes com câncer Muito comum (pode afetar mais de 1 em 10 pessoas): - Elevação de GGT, elevação da fosfatase alcalina e elevação de lactato desidrogenase (níveis elevados de enzimas hepáticas e sanguíneas); hiperuricemia (níveis sanguíneos elevados de ácido úrico); - Náusea; vômito; - Dor torácica (dor no peito), dor musculoesquelética Comum (pode afetar até 1 em 10 pessoas): - Cefaleia; - Tosse; faringite (dor de garganta); - Constipação; anorexia (perda de apetite); diarreia; mucosite (inflamação dolorosa e ulceração das membranas mucosas do trato digestivo); - Alopecia (perda de cabelo); rash cutâneo; - Fadiga; fraqueza generalizada Incomum (pode afetar até 1 em 100 pessoas): - Dor inespecífica; - Síndrome do extravasamento capilar (vazamento do sangue de pequenos vasos sanguíneos para o corpo, e requer tratamento médico urgente) Rara (pode afetar até 1 em 1 000 pessoas): - Distúrbios vasculares, que podem causar dor, rubor e inchaço dos membros Muito rara (pode afetar até 1 em 10 000 pessoas): - Infiltrado pulmonar (infiltração do pulmão por secreções) - Síndrome de Sweet (se caracteriza por feridas dolorosas avermelhadas nos membros e às vezes na face e pescoço, associadas à febre); vasculite cutânea (inflamação dos vasos sanguíneos),reação alérgica; - Exacerbação da artrite reumatoide (piora dos sintomas reumáticos); - Disúria (dor ou dificuldade ao urinar) Desconhecida (a frequência não pode ser estimada com base nos dados disponíveis): - Rejeição de transplante de medula óssea; - Pressão sanguínea diminuída transitória; - Pseudogota (dor e inchaço das juntas, similar à gota) 8 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL Doadores saudáveis de células tronco Muito comum (pode afetar mais de 1 em 10 pessoas): - Leucocitose (aumento dos leucócitos); trombocitopenia (redução das plaquetas, o que pode levar a aumento do risco de sangramento e machucados); - Cefaleia; - Dor musculoesquelética Comum (pode afetar até 1 em 10 pessoas): - Elevação da fosfatase alcalina e elevação de lactato desidrogenase (níveis elevados de algumas enzimas sanguíneas) Incomum (pode afetar até 1 em 100 pessoas): - Elevação de TGO (níveis elevados de enzimas do fígado); hiperuricemia (níveis sanguíneos elevados de ácido úrico) - Síndrome do extravasamento capilar (vazamento do sangue de pequenos vasos sanguíneos para o corpo, e requer tratamento médico urgente); - Exacerbação da artrite reumatoide (piora dos sintomas reumáticos); - Reação alérgica; - Distúrbios esplênicos (problemas no baço) Desconhecida (a frequência não pode ser estimada com base nos dados disponíveis): - Tosse; pirexia (febre) e dificuldade para respirar ou tosse com sangue Pacientes com neutropenia crônica grave Muito comum (pode afetar mais de 1 em 10 pessoas): - Anemia (redução de hemácias, o que pode causar palidez da pele e fraqueza ou falta de ar), esplenomegalia (aumento do tamanho do baço); - Hipoglicemia (diminuição da glicose no sangue); elevação da fosfatase alcalina e elevação de lactato desidrogenase (níveis elevados de algumas enzimas sanguíneas); hiperuricemia (níveis sanguíneos elevados de ácido úrico); - Epistaxe (sangramento pelo nariz); - Dor musculoesquelética Comum (pode afetar até 1 em 10 pessoas): - Trombocitopenia (redução de plaquetas, o que pode levar a aumento do risco de sangramento e machucados); - Cefaleia; - Diarreia; - Hepatomegalia (aumento do fígado); - Alopecia (perda de cabelo); vasculite cutânea (inflamação dos vasos sanguíneos); dor no local da injeção, rash cutâneo; - Osteoporose (perda de cálcio dos ossos); artralgia (dor nas articulações) Incomum (pode afetar até 1 em 100 pessoas): - Hematúria (sangue na urina); proteinúria (proteína na urina); - Distúrbios esplênicos (problemas no baço) Se você apresentar qualquer reação adversa, informe o seu médico, farmacêutico ou enfermeira, incluindo
reações adversas não listadas aqui 9 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento Informe também à empresa através do seu serviço de atendimento 9 O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO Se você utilizar mais TEVAGRASTIM® (filgrastim) do que prescrito, informe o seu médico o mais rápido possível Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível Ligue para 0800 722 6001, se você precisar de mais orientações
REAÇÕES ADVERSAS
Composição
COMPOSIÇÃO Cada seringa preenchida de 0,5 mL de TEVAGRASTIM® (filgrastim) contém: filgrastim 300,0 mcg Excipientes: ácido acético, hidróxido de sódio, sorbitol, polissorbato 80, água para injetáveis INFORMAÇÕES AO PACIENTE Leia atentamente esta bula antes de começar a tomar este medicamento, pois ela contém informações importantes para você • Guarde esta bula Você pode precisar ler novamente • Se você tiver qualquer dúvida, pergunte ao seu médico ou farmacêutico • Este medicamento foi receitado para você Não o forneça a outras pessoas Ele pode ser prejudicial para elas, mesmo que os sintomas delas sejam os mesmos que os seus • Se você tiver quaisquer efeitos indesejáveis, fale com seu médico ou farmacêutico Isso inclui os possíveis efeitos indesejáveis não mencionados nesta bula 1
Superdosagem
SUPERDOSE
Interação Medicamentosa
Não foram ainda estabelecidas a segurança e a eficácia de Filgrastim (substância ativa) quando administrado no mesmo dia que a quimioterapia citotóxica mielossupressora. Tendo em vista a sensibilidade da rapidez da divisão das células mieloides à quimioterapia citotóxica mielossupressora, a utilização de Filgrastim (substância ativa) não é recomendada no período que decorre entre as 24 horas anteriores e às 24 horas posteriores à quimioterapia. Evidências preliminares obtidas a partir de um grupo pequeno de pacientes tratados concomitantemente com Filgrastim (substância ativa) e 5-fluoruracila indicam que a gravidade da neutropenia pode ser exacerbada.
Nos estudos clínicos conduzidos não foram investigadas as possíveis interações do Filgrastim (substância ativa) com outros fatores de crescimento hematopoiéticos e com citocinas.
Considerando que o lítio promove a liberação de neutrófilos, é provável que possa potencializar o efeito de Filgrastim (substância ativa). No entanto, esta interação não foi formalmente investigada e não existe qualquer evidência de que tal interação possa ser prejudicial.
Ação da Substância
Resultados de eficácia
A eficácia e segurança clínica do Filgrastim (substância ativa) foram avaliadas em três estudos clínicos fase III.
Câncer de mama
Estudo clínico fase III, multinacional, multicêntrico, randomizado e controlado de comparação entre Filgrastim (substância ativa) vs. comparador vs. placebo, conduzido em 348 pacientes com câncer de mama tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 4 ciclos de docetaxel 75mg/m2 IV e doxorrubicina 60mg/m2 IV no 1° dia.
Câncer de pulmão
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em 240 pacientes com câncer de pulmão tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 6 ciclos com derivados de platina. O regime de terapia mais comum utilizado foi cisplatina + etoposídeo ou gencitabina em 49% e 15% dos pacientes, respectivamente. Outros regimes incluíram cisplatina + vinorelbina e combinações de carboplatina + vinorelbina, etoposídeo, gencitabina ou paclitaxel.
Linfomas Não-Hodgkin
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em pacientes com linfoma não-Hodgkin. Durante o estudo, os pacientes estavam sob tratamento quimioterápico, de no máximo 6 ciclos, com ciclofosfamida, doxorrubicina, vincristina e prednisona (CHOP). Tratamento adicional com rituximabe (anticorpo monoclonal anti-CD20) foi utilizado a critério de médico.
Os resultados de eficácia basearam-se nas seguintes determinações:
Característias Farmacológicas
Grupo Farmacoterapêutico:
Imunoestimuladores, Fatores Estimuladores de Colônias.
Código ATC: L03AA02.
Propriedades farmacodinâmicas
Filgrastim (substância ativa), é uma glicoproteína que regula a produção e a liberação de neutrófilos funcionais da medula óssea. O Filgrastim (substância ativa) provoca, em um período de 24 horas, um aumento significativo da contagem de neutrófilos no sangue periférico, com pequenos aumentos de monócitos. Em alguns pacientes com neutropenia crônica grave, o Filgrastim (substância ativa) pode também induzir um pequeno aumento do número de eosinófilos e basófilos circulantes em relação aos valores basais; alguns destes pacientes podem apresentar eosinofilia ou basofilia antes do tratamento. Elevações nas contagens de neutrófilos são dosedependentes nas doses recomendadas. Os neutrófilos produzidos em resposta ao Filgrastim (substância ativa) apresentam função normal ou aumentada, conforme demonstrado em testes de funções fagocítica e quimiostática. Após o término do tratamento com Filgrastim (substância ativa), a contagem de neutrófilos circulantes diminui em 50% dentro de 1 a 2 dias, e para níveis normais dentro de 1 a 7 dias.
O uso de Filgrastim (substância ativa) em pacientes submetidos à quimioterapia citotóxica leva a reduções significativas na incidência, gravidade e duração da neutropenia e da neutropenia febril. O tratamento com Filgrastim (substância ativa) reduz significativamente a duração da neutropenia febril, a utilização de antibióticos e o tempo de hospitalização após quimioterapia de indução para leucemia mieloide aguda ou terapia mieloablativa seguida de transplante de medula óssea. A incidência de relatos de febre e infecções não foi reduzida em nenhum destes quadros clínicos. A duração da febre não diminuiu nos pacientes que receberam terapia mieloablativa seguida de transplante de medula óssea.
A utilização de Filgrastim (substância ativa), isoladamente ou após quimioterapia, mobiliza as células progenitoras hematopoiéticas para o sangue periférico. Estas células progenitoras do sangue periférico (CPSP) autólogas podem ser coletadas e infundidas após terapia citotóxica de dose elevada, em substituição ou em adição ao transplante de medula óssea. A infusão de CPSP acelera a recuperação hematopoiética, reduzindo a duração do risco de complicações hemorrágicas e a necessidade de transfusões de plaquetas.
Os receptores de CPSP alogênicas mobilizadas com Filgrastim (substância ativa) tiveram uma recuperação hematológica significativamente mais rápida, levando a uma diminuição significativa do tempo de recuperação de plaquetas quando comparado com o transplante alogênico de medula óssea.
Um estudo Europeu retrospectivo que avaliou o uso de fator estimulador de colônias de granulócitos (G-CSF) após transplante alogênico de medula óssea em pacientes com leucemia aguda sugeriu risco aumentado de doença do enxerto contra hospedeiro (graft-versus-host disease - GVHD), mortalidade relacionada ao tratamento (TRM) e mortalidade quando o G-CSF foi administrado. Outro estudo retrospectivo internacional, conduzido em pacientes com leucemias mieloides aguda e crônica, não foi observado risco de GVHD, TRM e mortalidade. Uma metanálise de estudos de transplantes alogênicos, incluindo resultados de nove estudos randomizados prospectivos, 8 estudos retrospectivos e 1 estudo de caso-controle, não detectou efeito sobre o risco de GVHD aguda, GVHD crônica ou mortalidade relacionada ao tratamento.
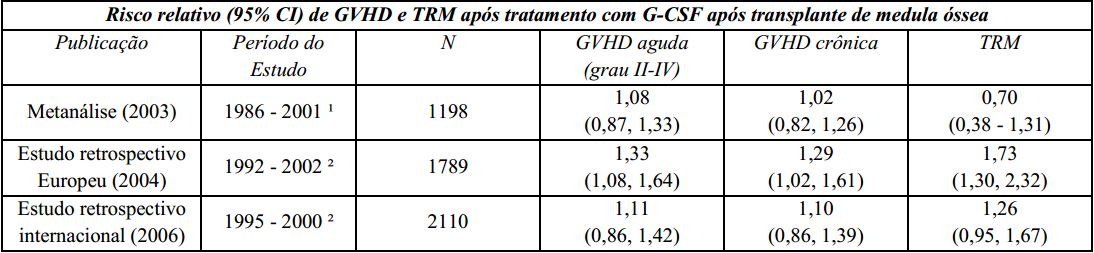 GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
TRM: mortalidade relacionada ao tratamento;
G-CSF: fator estimulador de colônias de granulócitos;
¹ A análise incluiu estudos envolvendo transplante de medula óssea durante este período; alguns estudos utilizaram GM-CSF (fator estimulador de colônias de macrófagos e granulócitos);
² A análise incluiu pacientes recebendo transplante de medula óssea durante este período.
Previamente ao transplante de CPSP alogênicas, a utilização de Filgrastim (substância ativa) para a mobilização de CPSP em doadores saudáveis permite um cultivo de 4 x 106 células CD34+ /kg de peso corporal do receptor na maioria dos doadores, após duas leucaféreses. Para estes doadores saudáveis é dada uma dose de 10 mcg/kg/dia, administrada por via subcutânea durante 4 a 5 dias consecutivos.
O uso de Filgrastim (substância ativa) em pacientes com neutropenia crônica grave (neutropenia congênita grave, neutropenia cíclica e neutropenia idiopática), induz um aumento sustentado das contagens absolutas de neutrófilos no sangue periférico e uma redução das infecções e eventos relacionados.
O Filgrastim (substância ativa), assim como com outros fatores de crescimento hematopoiéticos, demonstrou in vitro propriedades estimuladoras sobre as células endoteliais humanas.
Propriedades Farmacocinéticas
A depuração de Filgrastim (substância ativa), tanto após administração subcutânea como intravenosa, demonstrou seguir uma farmacocinética de primeira ordem. A meia-vida de eliminação sérica do Filgrastim (substância ativa) é de aproximadamente 3,5 horas, com uma taxa de depuração de aproximadamente 0,6mL/min/kg. A infusão contínua com Filgrastim (substância ativa) durante um período de até 28 dias, em pacientes em recuperação de transplante autólogo de medula óssea, não apresentou evidência de acumulação do fármaco e de meias-vidas comparáveis. Há uma correlação linear positiva entre a dose e a concentração sérica de Filgrastim (substância ativa), se administrado por via intravenosa ou por via subcutânea. Após administração subcutânea das doses recomendadas, as concentrações séricas mantiveramse acima dos 10 ng/mL, durante 8 a 16 horas. O volume de distribuição no sangue é aproximadamente de 150mL/kg.
Em pacientes com câncer, o perfil farmacocinético do Filgrastim (substância ativa) e do medicamento comparador foi comparável após administração única e após administrações múltiplas por via subcutânea.
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram risco especial para humanos com base em estudos convencionais de segurança farmacológica, genotoxicidade e tolerância local.
Os dados pré-clínicos de estudos convencionais de toxicidade de doses múltiplas demonstraram os efeitos farmacológicos esperados, incluindo aumento da contagem leucocitária, hiperplasia mieloide da medula óssea, hematopoiese extramedular e dilatação esplênica.
Não foram observados efeitos sobre a fertilidade de ratos do sexo masculino e feminino, assim como sobre a gestação em ratos. Não existe evidência a partir dos estudos conduzidos em ratos e coelhos de que o Filgrastim (substância ativa) seja teratogênico. Foi observada incidência aumentada de perda embrionária em coelhos, porém não foi observada má formação.
Cuidados de Armazenamento
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO TEVAGRASTIM® (filgrastim) apresenta prazo de validade de 24 meses a partir da data de fabricação, devendo ser armazenado sob refrigeração (entre 2°C e 8°C) Quando diluído em solução de glicose a 5%, numa faixa entre 15 mcg/mL e 60 mcg/ mL, o produto se mantém estável por 24 horas sob refrigeração (entre 2°C a 8ºC) e por mais 24 horas à temperatura inferior a 25ºC Quando diluído em solução de glicose a 5% e albumina sérica humana, numa faixa entre 2 mcg/mL e 15 mcg/ mL, o produto se mantém estável por 24 horas sob refrigeração (entre 2°C a 8ºC) e por mais 24 horas à temperatura inferior a 25ºC Número de lote e datas de fabricação e validade: vide embalagem Não use medicamentos com o prazo de validade vencido Guarde-o em sua embalagem original Características físicas e organolépticas: solução límpida e incolor Antes de usar, observe o aspecto do medicamento Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo Todo medicamento deve ser mantido fora do alcance das crianças 6
Dizeres Legais
DIZERES LEGAIS MS n°: 1 5573 0013 Farm Resp : Mônica Riyoko Nekozuka - CRF-SP n°: 16 970 Fabricado por: Lemery S A de C V Toluca - México Embalado por: Teva Pharmaceutical Industries Ltd Kfar Saba - Israel Importado e distribuído por: Teva Farmacêutica Ltda Av Guido Caloi, 1935 – Prédio B – 1º Andar São Paulo - SP CNPJ nº 05 333 542/0001-08 ? Marca registrada de Teva Pharmaceutical Industries Ltd Atendimento ao Consumidor: SAC Teva 0800-777-8382 www tevabrasil com br VENDA SOB PRESCRIÇÃO MÉDICA - USO RESTRITO A HOSPITAIS Lote, fabricação e validade: vide cartucho 10 BU_10 TEVA FARMACÊUTICA LTDA - BRASIL Anexo B Histórico de Alteração para a Bula Dados da submissão eletrônica Dados da petição / notificação que altera bula Dados das alterações de bulas Data do expediente N° expediente Assunto Data do expediente N° expediente Assunto Data da aprovação Itens de bula
DIZERES LEGAIS 19/12/2014 NÃO DISPONÍVEL Notificação de Alteração de Texto de Bula – RDC 60/12 19/12/2014 NÃO DISPONÍVEL Notificação de Alteração de Texto de Bula – RDC 60/12
19/12/2014 DIZERES LEGAIS (ALTERAÇÃO DO ENDEREÇO DA IMPORTADORA NO BRASIL) VP - BU_10 VPS - BU_10 x 1 e x 5 seringas preenchidas com dispositivo de segurança
informações complementares
| Fabricante |
| TEVA |
| Princípio ativo |
| Filgrastim |
| Categoria do medicamento |
| Medicamentos Especiais |
