para o que é indicado e para que serve?
Alenia é um medicamento para o trato respiratório, com 6mcg de fumarato de formoterol di-hidratado e 100mcg de budesonida (princípios ativos) em uma embalagem com inalador contendo 60 cápsulas, de uso adulto e pediátrico acima de 4 anos, sendo administrado por via inalatória oral.Continue lendo...
ofertas de
Alenia 6Mcg + 200Mcg - 60...
ofertas de Alenia 6Mcg + 200Mcg - 60...
R$ 81,90
R$ 89,19
R$ 90,88
R$ 91,50
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
ALENIA 6/100 mcg é indicado para a melhora e controle da falta de ar em pacientes com broncoconstricção (fechamento parcial dos brônquios provocado por uma contração do mesmo) ou broncoespasmo (contração da musculatura do brônquio provocando um fechamento parcial), em pacientes que são portadores de asma brônquica, doença esta que causa diminuição da capacidade de respirar adequadamente.
Como este medicamento funciona?
O formoterol di-hidratado age no sintoma de falta de ar, pois determina uma broncodilatação das vias aéreas inferiores (brônquios) em pacientes com broncoconstricção ou broncoespasmo (constrição dos brônquios, fechamento parcial dos brônquios) em pacientes que são portadores de asma brônquica, doença esta que causa diminuição da capacidade de respirar adequadamente. O efeito broncodilatador (dilatação dos brônquios e facilitador da respiração) manifesta-se muito rapidamente no período de 1 a 3 minutos após a inalação de ALENIA e a sua duração é de 12 horas após administração de dose única.
A budesonida possui ação anti-inflamatória local e mostrou exercer efeitos tanto antialérgicos como anti- inflamatórios, ambos os efeitos foram demonstrados pela melhora da obstrução dos brônquios tanto na fase precoce como na fase tardia da reação alérgica. Apresenta início de ação em 24 horas, com ação tanto no tratamento como na prevenção da asma brônquica. O tratamento com budesonida inalatória demonstrou ser eficaz também na prevenção da asma induzida por exercício. O tempo médio de início da atividade anti-inflamatória da budesonida inalatória é de 24 horas após a primeira inalação.
Contraindicação
ALENIA não deve ser usado por pessoas alérgicas aos componentes do medicamento que são: fumarato de formoterol di-hidratado, budesonida e lactose.
A budesonida também é contraindicada em pacientes com tuberculose pulmonar ativa.
Este medicamento é contraindicado para menores de 4 anos de idade.
Como usar
ALENIA deve ser usado de acordo com a prescrição feita pelo médico e que deve estar de acordo com a gravidade da doença. Quando for obtido o controle da asma, a dose deve ser ajustada para a menor dose que permita manter um controle eficaz dos sintomas, sendo este ajuste denominado de Tratamento de Manutenção Regular.
Atenção:
Em cada inalação de ALENIA 6/100 mcg a dose medida de 6 mcg de fumarato de formoterol di- hidratado equivale à dose liberada de 4,5 mcg e a dose medida de 100 mcg de budesonida equivale à dose liberada de 80 mcg.
Pacientes idosos não necessitam de ajuste de dose. A budesonida e o formoterol di-hidratado são essencialmente metabolizados pelo fígado, é previsível que se verifique um aumento da exposição em pacientes com cirrose hepática grave.
Para assegurar uma administração adequada, o paciente deve ser informado sobre as instruções de uso do inalador pelo médico ou outro profissional de saúde.
É importante para o paciente entender que a cápsula de gelatina pode fragmentar-se e que pequenos pedaços de gelatina podem atingir a boca ou a garganta após a inalação, sem consequências.
As cápsulas só devem ser retiradas do frasco e manuseadas imediatamente antes do uso, para não sofrerem ação da umidade das mãos ou do ambiente. Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não engolir as cápsulas. Usar o pó da cápsula exclusivamente para inalação.
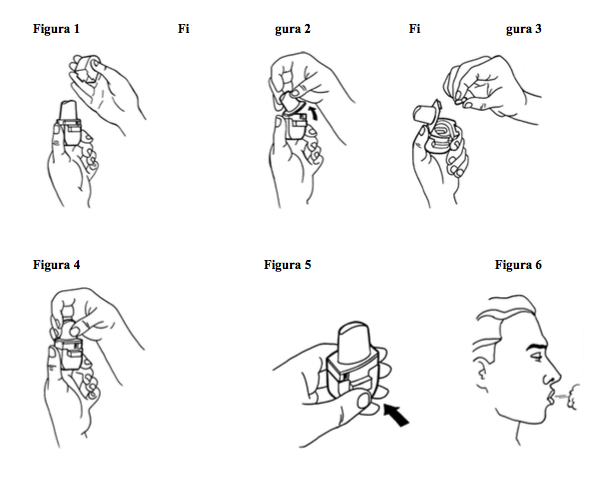
Modo de usar:
- 1. Retire a tampa do inalador.
- 2. Segure a base do inalador e, para abri-lo, levante o bocal na direção indicada pela seta existente na lateral do bocal.
- 3. Remova a cápsula do frasco e coloque-a no compartimento interno, na base do inalador. É importante que a cápsula somente seja retirada do frasco imediatamente antes do uso do inalador.
- 4. Feche o inalador.
- 5. Pressione completamente o botão frontal do inalador para a perfuração da cápsula. Solte o botão.
- 6. Solte o ar dos pulmões o máximo possível.
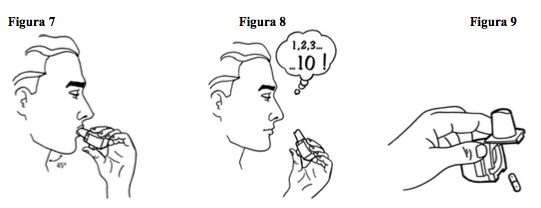
- 7. Coloque o bocal do inalador na boca e feche os lábios ao redor dele. Incline levemente a cabeça para baixo (aproximadamente 45°). Inspire de maneira rápida e o mais profundamente possível. Você deverá ouvir um som de vibração, pois a cápsula gira no compartimento interno dispersando o medicamento. Obs: Se não ouvir o ruído da cápsula girando, essa pode estar grudada; então, abra novamente o compartimento interno, desprenda a cápsula e repita o procedimento.
- 8. Segure a respiração contando mentalmente até 10 (aproximadamente 10 segundos); enquanto isso retire o inalador da boca. Em seguida respire normalmente. Abra o inalador e verifique se ainda há resíduo de pó na cápsula. Caso ainda reste pó, repita os procedimentos de 4 a 8.
- 9. Após o uso, abra o inalador, remova e descarte a cápsula vazia. Feche o bocal e recoloque a tampa.
Importante: Lave bem a boca com água e/ou escove os dentes imediatamente após o uso do medicamento.
Observação: A cápsula é feita de gelatina e pode se partir em pequenos fragmentos que poderão atingir a boca e a garganta. A gelatina é comestível e, portanto, não é prejudicial. Da mesma forma, fragmentos da cápsula podem permanecer no fundo do compartimento interno e estes resíduos deverão ser removidos com auxílio de uma escovinha ou pincel macio.
Dúvidas/ Como evitar dificuldades
1. Como eu evito que a cápsula se quebre em pequenos fragmentos?
As cápsulas podem se quebrar quando você pressiona o botão azul (passo 8), e pequenos fragmentos podem entrar em sua boca ou garganta quando você inala. Você pode ajudar a prevenir isto:
- Pressionando o botão uma única vez.
- Mantendo as cápsulas em sua embalagem original antes do uso.
- Armazenando as cápsulas em temperatura ambiente (entre 15 e 30 °C). Protegido da luz e umidade.
2. Os fragmentos da cápsula são prejudiciais?
Não. A cápsula é feita de gelatina comestível, a qual não é prejudicial. Qualquer fragmento de gelatina que entrar em sua boca ou garganta pode ser engolido.
3. Como faço para soltar a cápsula se ela ficar presa na câmara da cápsula?
Abra o inalador, vire-o de cabeça para baixo e bata suavemente na parte inferior.
4. O que devo fazer se o botão ficar preso?
Com cuidado, puxe o botão de volta para sua posição inicial.
5. Como posso saber que eu realmente utilizei a dose?
- Você vai ouvir um ruído de vibração da cápsula quando você inspira através do inalador.
- Você vai ter um gosto doce na boca, de lactose. Você pode sentir pó na parte de trás de sua garganta. Isto é normal.
- A cápsula estará vazia.
6. Como faço para remover o pó do interior do inalador?
- Use um pano seco ou uma escova macia.
- Lembre-se que você nunca deve lavar o inalador.
Conservação e limpeza do inalador: para melhor conservação de seu inalador, faça uso de escova ou pincel macio, removendo resíduos após cada uso. Após o último uso do dia, limpe o bocal e o compartimento da cápsula com uma haste flexível de algodão, podendo ocasionalmente umedecê-la em solução antisséptica (como, por exemplo, água oxigenada 10 volumes). Não utilize álcool, pois poderá danificar a superfície plástica. Não lave o inalador. Seguindo estes cuidados de conservação, a vida útil estimada de seu inalador é de 3 meses.
Posologia
Quanto utilizar de Alenia
Seu médico irá informar quando e quanto de Alenia você deve utilizar, conforme sua necessidade.
A dose de Alenia deve ser individualizada conforme a gravidade da doença. Quando for obtido o controle da asma, a dose deve ser ajustada para a menor dose que permita manter um controle eficaz dos sintomas.
Terapia de Manutenção Regular
Doses recomendadas:
Asma:
Para uso inalatório em adultos e crianças acima de 4 anos de idade
Crianças (a partir de 4 anos de idade):
Inalar de 1 cápsula, 1 vez ao dia (6 mcg de formoterol e 100 mcg de budesonida), a 1 cápsula, duas vezes ao dia (12 mcg de formoterol e 200 mcg de budesonida), com dose máxima de manutenção diária de 4 cápsulas (24 mcg de formoterol e 400 mcg de budesonida).
Adultos e adolescentes (a partir de 12 anos de idade):
Inalar de 1 cápsula (6 mcg de formoterol e 100 mcg de budesonida), a 2 cápsulas (12 mcg de formoterol e 200 mcg de budesonida, duas vezes ao dia), com dose diária máxima de manutenção de 4 cápsulas inaladas (24 mcg de formoterol e 400mcg de budesonida). Durante uma piora da asma, a dose, em adultos, pode ser temporariamente aumentada para um máximo de 4 cápsulas inaladas duas vezes ao dia (48 mcg de formoterol e 800 mcg de budesonida).
Informações Gerais:
Os pacientes devem ser instruídos a usar mesmo quando estiverem assintomáticos para obter o benefício máximo da terapia.
Não é necessário efetuar qualquer ajuste da dose em pacientes idosos.
Quando usar Alenia
Usar Alenia no mesmo horário todos os dias, irá ajudá-lo a lembrar de quando usar seu medicamento.
Por quanto tempo usar Alenia
É importante que você use Alenia regularmente como orientado pelo seu médico. Você deve continuar a usar este medicamento mesmo que não sinta nenhum sintoma da asma, para que se possa prevenir as crises de asma. Se você tiver dúvidas sobre o tempo de tratamento de Alenia, converse com seu médico ou farmacêutico.
Se você parar de usar Alenia
Interromper o seu tratamento com Alenia pode aumentar as chances de piora da sua asma. Não interrompa o uso deste medicamento de repente a menos que seu médico o oriente a fazê-lo.
Não existem dados disponíveis sobre o uso deste medicamento em pacientes com insuficiência hepática ou renal. Uma vez que a budesonida e o formoterol di-hidratado são essencialmente eliminados por metabolismo hepático, seu médico irá decidir se você poderá utilizar o Alenia e se haverá a necessidade de um ajuste na dose.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento de seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar este medicamento?
Se você esquecer de usar uma dose, utilize-a assim que se lembrar. Se for quase o horário da sua próxima dose, não duplique a dose para compensar a perdida. Siga o horário regular de cada dose.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Siga cuidadosamente todas as instruções do seu médico. Elas podem diferir das informações gerais contidas nesta bula.
Tenha cuidado especial com Alenia:
- Caso você esteja utilizando outro medicamento corticosteroide;
- Se sofrer de algum outro problema respiratório que não seja asma;
- Se você sofre de qualquer doença cardíaca;
- Se você tem pressão alta;
- Se você sofre de tireoide hiperativa (funcionamento excessivo da tireoide);
- Se você tem um aneurisma (área onde uma artéria está inchada como uma bolsa, porque a parede da artéria é fraca);
- Se você tem distúrbios do coração, como sinal eletrocardiográfico anormal chamado “prolongamento do intervalo QT”;
- Se você é diabético;
- Se você tem feocromocitoma (um tumor na glândula adrenal que pode afetar a pressão sanguínea).
Caso qualquer uma das condições se aplique a você, informe seu médico antes de utilizar este medicamento.
- Se você desenvolver uma infecção de pulmão ou de via respiratória durante o tratamento com Alenia. Os sintomas podem incluir aumento da tosse, febre ou secreções das vias respiratórias;
- Se você apresentar dificuldade de respirar com chiado no peito ou tosse após o uso de Alenia;
- Se você apresentar erupção cutânea, coceira, urticária (reação alérgica na pele), dificuldade de respirar ou engolir, vertigem (tontura) ou inchaço da face e da garganta durante o tratamento com Alenia;
- Se você apresentar alteração de peso, fraqueza, obesidade abdominal, náusea ou diarreia persistente durante o tratamento com Alenia;
- Se você apresentar visão borrada ou alterada durante o tratamento com Alenia;
- Se você apresentar problemas para dormir, depressão ou sentir-se preocupado, inquieto, nervoso, agitado ou irritado durante o tratamento com Alenia;
- Se você tiver a impressão que os efeitos de Alenia estão muito fortes ou muito fracos ou se você sentir que sua condição respiratória está piorando enquanto está utilizando Alenia.
- Se você desenvolver qualquer um dos sintomas acima, informe imediatamente seu médico.
Informação importante:
Se você tem asma: não utilize formoterol como seu único medicamento para asma. Utilize formoterol apenas junto com um corticosteroide inalatório (como a budesonida, a outra substância ativa de Alenia).
Quando fizer uso de formoterol, não utilize outra medicação que contenha beta2-agonista de longa duração, como o salmeterol.
Não use Alenia se você:
- Está bem controlado com um corticosteroide inalatório;
- Precisa apenas de medicamentos beta2-agonistas de curta duração de vez em quando.
Em alguns estudos clínicos com formoterol, graves crises de asma foram observadas.
Não inicie o tratamento de Alenia ou aumente a dose recomendada pelo seu médico quando estiver tendo uma crise de asma.
Não altere ou pare com nenhuma de suas medicações para controlar ou tratar seus problemas respiratórios, incluindo corticosteroides inalatórios. Seu médico ajustará seus medicamentos conforme necessário.
Outras advertências especiais:
- Não engula as cápsulas – elas devem apenas ser utilizadas para inalação do conteúdo da cápsula com o inalador Aerocaps.
- Você não deve tentar inalar as cápsulas com um inalador diferente.
- Não interrompa a terapia com anti-inflamatório oral repentinamente. Caso você tenha sido mantido em terapia com anti-inflamatório oral por um longo período de tempo, seu médico deverá reduzir gradualmente a dose deste à medida que Alenia é introduzido.
- Se seu médico decidir trocar a terapia anti-inflamatória oral para Alenia, é recomendado que você carregue um cartão de precaução com você durante os primeiros meses: no caso de acidente, cirurgia ou infecção grave, você pode precisar de um fornecimento adicional de terapia anti-inflamatória.
Após o uso do Alenia enxágue bem sua boca com água, sem engolir. Seguindo este procedimento, a possibilidade de desenvolvimento de infecção fúngica (sapinho) na boca será reduzida.
Informações importantes sobre um produto similar:
O formoterol, uma das substâncias ativas do Alenia, pertence à classe dos medicamentos chamados beta2- agonistas de longa duração (LABAs). Um grande estudo realizado com um LABA diferente (salmeterol) demonstrou um aumento no risco de morte por asma. Não foi realizado um estudo para saber se este efeito também se aplica ao formoterol. Fale com seu médico sobre esse risco e os benefícios do tratamento da asma com o formoterol.
Reações Adversas
Informe seu médico sobre o aparecimento de reações desagradáveis. As reações mais possíveis são:
Reação muito comum (ocorre em 10% dos pacientes que utilizam este medicamento):
Dor de cabeça, irritação ou inflamação de faringe e cavidade nasal e infecções do trato respiratório superior (do nariz a traqueia).
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Palpitações, diarreia, má digestão, náuseas, dor de estômago, dor abdominal superior, infecção intestinal de causa viral, vômitos, infecção urinária, dor nas articulações, dor nas costas, dor muscular, espasmos musculares, tontura, tremor, rinite alérgica, bronquite aguda, infecção do trato respiratório inferior (da traquéia até os pulmões), congestão nasal, inflamação da faringe, sinusite, boca seca, rouquidão, leve irritação de garganta, tosse, rouquidão, infecções fúngicas na boca e garganta (candidíase), agitação, náuseas, insônia, dor abdominal, infecções respiratórias, taquicardia (aumento da frequência de batimentos cardíacos), tremores e queda do potássio sanguíneo.
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
Catarata, glaucoma (aumento da pressão ocular).
População Especial
Idosos (65 anos de idade ou mais):
Se você possui 65 anos de idade ou mais, você pode utilizar Alenia na mesma dosagem que os demais adultos.
Crianças e adolescentes (4 anos de idade ou mais):
Alenia é indicado para crianças de 4 anos de idade ou mais. As crianças devem utilizar este medicamento apenas se forem capazes de manusear o inalador corretamente. Elas apenas devem usar o inalador com a ajuda de um adulto.
Se uma criança estiver usando um esteroide inalatório em doses altas por um longo período, o médico deve monitorar a altura da criança como parte de um check-up regular.
Doenças do fígado:
Se você tiver qualquer doença no fígado ou sofre de icterícia (coloração amarelada da pele), avise seu médico antes de utilizar.
Seu médico irá prescrever a dose correta para você.
Efeitos sobre a habilidade de dirigir e/ou operar máquinas:
Em alguns pacientes, foi relatado que formoterol (uma das substâncias ativas de Alenia) causa tontura. Se você sentir tontura, não dirija, opere máquinas ou realize qualquer outra atividade que necessite de sua atenção.
Gravidez e lactação
Informe ao seu médico se você está grávida ou pretende engravidar.
Você não deve usar Alenia durante a gravidez, a menos que seu médico o indique. Seu médico discutirá com você os potenciais riscos de utilizar este medicamento durante a gravidez
Mães que estejam fazendo uso de Alenia não devem amamentar. Se você estiver amamentando, informe ao seu médico.
Converse com seu médico ou farmacêutico antes de tomar qualquer medicamento.
Composição
| Cada cápsula de Alenia 6/100 mcg contém: | |
| fumarato de formoterol di-hidratado | 6mcg |
| budenosida | 100mcg |
| excipiente: lactose monoidratada | |
| Atenção: em casa inalação de Alenia 6/100mcg a dose medida de 6mcg de fumarato de formoterol di-hidratado equivale a dose liberada de 4,5mcg e a dose medida de 100mcg de budenosina equivale a dose liberada de 80mcg. | |
Superdosagem
Se acidentalmente, você utilizar mais Alenia do que seu médico prescreveu, você pode se sentir enjoado ou apresentar vômito, ou apresentar tremor, dor de cabeça, insônia, palpitações, taquicardia, dor no peito, tontura (possíveis sintomas de pressão alta), batimento cardíaco acelerado ou sonolência, diminuição da pressão. Informe seu médico ou vá ao pronto socorro imediatamente. Você pode precisar de atenção médica. Leve a embalagem do medicamento. Se alguém acidentalmente usar suas cápsulas, contate o médico ou pronto-socorro para aconselhamento imediatamente. Mostre a embalagem do medicamento. Tratamento médico pode ser necessário.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações sobre como proceder.
Interação Medicamentosa
Interações resultando em um uso concomitante não recomendado
Interações que afetam o uso de formoterol
Bloqueadores beta-adrenérgicos podem enfraquecer ou antagonizar os efeitos do formoterol. Portanto, o formoterol não deve ser utilizado juntamente com bloqueadores beta-adrenérgicos (incluindo colírios) a menos que existam razões convincentes para seu uso.
Interações a serem consideradas
Interações que afetam o uso de formoterol
O formoterol, como outros beta2-agonistas, deve ser administrado com cautela em pacientes tratados com fármacos como quinidina, disopiramida, procainamida, fenotiazínicos, anti-histamínicos, macrolídeos, inibidores de monoaminoxidase e antidepressivos tricíclicos ou qualquer outro fármaco que prolongue o intervalo QTc, pois a ação dos agonistas adrenérgicos no sistema cardiovascular pode ser potencializada por estes agentes. Os fármacos que são conhecidos por prolongar o intervalo QTc têm um risco aumentado de arritmia ventricular.
A administração concomitante de outros agentes simpatomiméticos pode potencializar os efeitos não desejados de formoterol.
O tratamento concomitante com derivados xantínicos, esteroides ou diuréticos pode potencializar o possível efeito hipopotassêmico dos beta2-agonistas.
Existe um risco elevado de arritmias em pacientes recebendo concomitantemente anestesia com hidrocarbonos halogenados.
Interações que afetam o uso de budesonida
A principal via metabólica da budesonida é via citocromo P450 (CYP) isoenzima 3A4 (CYP3A4). A coadministração de inibidores conhecidos da CYP3A4 (por exemplo, itraconazol, cetoconazol, ritonavir, nelfinavir, amiodarona, claritromicina), pode inibir o metabolismo e aumentar a exposição sistêmica à budesonida. Se estes produtos forem administrados concomitantemente, a função adreno-cortical deve ser monitorada e a dose de budesonida ajustada de acordo com a resposta.
A coadministração de potentes indutores da CYP3A4 (por exemplo, rifampicina) pode aumentar o metabolismo e diminuir a exposição sistêmica à budesonida.
Ação da Substância
Resultados da eficácia
Formoterol
Em humanos, tem-se demonstrado que formoterol é eficaz na prevenção do broncoespasmo induzido por alérgenos inalados, exercícios, ar frio, histamina ou metacolina.
O formoterol administrado pelo inalador Aerolizer em doses de 12 microgramas e 24 microgramas, duas vezes ao dia, exibiu um rápido início da broncodilatação em pacientes com doença pulmonar obstrutiva crônica (DPOC) estável, a qual foi mantida por no mínimo 12 horas e foi acompanhada por uma melhora subjetiva em termos de qualidade de vida, usando-se o “Saint George’s Respiratory Questionnaire”.
Budesonida
Quando utilizado como cápsulas para inalação por pacientes que se beneficiam da terapia com corticoide, pode ocasionar o controle da asma geralmente dentro de 10 dias após o início do tratamento. O uso regular da budesonida reduz a inflamação crônica dos pulmões dos asmáticos. Deste modo, budesonida melhora a função pulmonar e os sintomas da asma, reduz a hiper-reatividade brônquica e previne as exacerbações da asma.
Características Farmacológicas
Grupo farmacoterapêutico
Formoterol
- - Grupo farmacoterapêutico: agonista seletivo beta2-adrenérgico.
- - Código ATC: R03AC13.
Budesonida
- - Grupo farmacoterapêutico: outros medicamentos inalatórios para doenças obstrutivas de vias aéreas, inalantes, glicocorticoides.
- - Código ATC: R03B A02.
Mecanismo de ação e Farmacodinâmica
Formoterol
O formoterol é um potente estimulante seletivo beta2-adrenérgico. Exerce efeito broncodilatador em pacientes com obstrução reversível das vias aéreas. O efeito inicia-se rapidamente (em 1 a 3 minutos), permanecendo ainda significativo 12 horas após a inalação. Com as doses terapêuticas, os efeitos cardiovasculares são pequenos e ocorrem apenas ocasionalmente.
O formoterol inibe a liberação de histamina e dos leucotrienos do pulmão humano sensibilizado passivamente. Algumas propriedades anti-inflamatórias, tais como inibição de edema e do acúmulo de células inflamatórias, têm sido observadas em experimentos com animais.
Estudos in vitro em traqueia de cobaia indicaram que o formoterol racêmico e seus enantiômeros (R, R)- e (S, S)-são adreno-receptores beta2-agonistas altamente seletivos.
O enantiômero (S, S)- foi 800 a 1.000 vezes menos potente que o enantiômero (R, R)- e não afetou a atividade deste no músculo liso da traqueia. Nenhuma base farmacológica para o uso de um dos dois enantiômeros em preferência à mistura racêmica foi demonstrada.
No homem, tem-se demonstrado que formoterol é eficaz na prevenção do broncoespasmo induzido por alérgenos inalados, exercícios, ar frio, histamina ou metacolina.
O formoterol administrado pelo inalador Aerolizer em doses de 12 microgramas e 24 microgramas, duas vezes ao dia, exibiu um rápido início da broncodilatação em pacientes com doença pulmonar obstrutiva crônica (DPOC) estável, a qual foi mantida por no mínimo 12 horas e foi acompanhada por uma melhora subjetiva na Qualidade de Vida, usando-se o “Saint George’s Respiratory Questionnaire”.
Budesonida
A budesonida é um corticosteroide com ação tópica acentuada, mas praticamente desprovida de ação sistêmica no ser humano. Assim como outros glicocorticoides inalatórios, a budesonida exerce seus efeitos farmacológicos através da interação com os receptores de glicocorticoides intracelulares. A produção dos diferentes tipos de citocinas, quimiocinas, enzimas e moléculas de adesão celular, é inibida. Quando utilizado como pó para inalação por pacientes que se beneficiam da terapia com corticosteroide, pode ocasionar o controle da asma geralmente dentro de 10 dias após o início do tratamento. O uso regular da budesonida reduz a inflamação crônica dos pulmões dos asmáticos. Deste modo, budesonida melhora a função pulmonar e os sintomas da asma, reduz a hiper-reatividade brônquica e previne as exacerbações da asma.
Farmacocinética
O formoterol tem uma dose terapêutica na faixa de 12 a 24 microgramas, duas vezes ao dia. Dados de farmacocinética plasmática do formoterol foram coletados em voluntários sadios após inalação de doses mais altas que as recomendadas e em pacientes com DPOC após inalação de doses terapêuticas. A excreção urinária de formoterol inalterado, utilizada como indicador indireto da exposição sistêmica, correlaciona-se com os dados de disposição do fármaco no plasma. A meia-vida de eliminação calculadas para urina e plasma é similar.
Absorção
Formoterol
Após inalação de uma dose única de 120 microgramas de fumarato de formoterol di-hidratado por voluntários sadios, formoterol foi rapidamente absorvido para o plasma, atingindo a concentração máxima de 266 pmol/L em 5 min após a inalação. Em pacientes com DPOC tratados por 12 semanas com 12 ou 24 microgramas de fumarato de formoterol di-hidratado, duas vezes ao dia, a média da concentração plasmática de formoterol estendeu-se entre 11,5 e 25,7 pmol/L e 23,3 e 50,3 pmol/L, respectivamente, 10 min, 2 horas e 6 horas após a inalação.
Estudos investigativos da excreção urinária cumulativa de formoterol e/ou seus enantiômeros (R, R)- e (S, S)- mostrou que a quantidade de formoterol disponível na circulação aumenta em proporção à dose inalada (12 a 96 microgramas). Após inalação de 12 ou 24 microgramas de fumarato de formoterol di-hidratado, duas vezes ao dia durante 12 semanas, a excreção urinária de formoterol inalterado aumentou entre 63 e 73% (última vs. primeira dose), em pacientes com asma, e entre 19 e 38% em pacientes com DPOC. Isto sugere um acúmulo limitado de formoterol no plasma com doses múltiplas. Não houve acúmulo relativo de um enantiômero em relação ao outro após doses repetidas.
Como relatado para outros fármacos inalados, é provável que a maioria do formoterol administrado pelo inalador seja ingerido e, em seguida, absorvido pelo trato gastrintestinal.
Quando 80 microgramas de fumarato de formoterol di-hidratado 3H-marcado foi administrado oralmente a 2 voluntários sadios, pelo menos 65% do fármaco foi absorvido.
Budesonida
A quantidade de budesonida depositada nos pulmões é rápida e completamente absorvida.
O pico de concentração plasmática é atingido imediatamente após a administração. Após correção da dose depositada na orofaringe, a biodisponibilidade absoluta é de 73%.
Apenas 10 a 13% da fração ingerida da dose inalada é biodisponível devido ao metabolismo pré-sistêmico significante no fígado.
Distribuição
Formoterol
A ligação do formoterol às proteínas plasmáticas foi de 61 a 64%, e a ligação à albumina humana sérica foi 34%. Não há saturação dos sítios de ligação na extensão da concentração alcançada com doses terapêuticas.
Budesonida
A ligação de budesonida às proteínas plasmáticas é de 85 a 90% sobre a taxa de concentração de 1 a 100 nmol. A budesonida é extensivamente distribuída nos tecidos. O volume de distribuição de budesonida no estado de equilíbrio é aproximadamente 183 a 301 L. Em experimentos com animais foram observadas altas concentrações no baço e nas glândulas linfáticas, no timo, no córtex da adrenal, nos órgãos reprodutivos e nos brônquios. A budesonida atravessa a barreira placentária em camundongos. A budesonida passa para o leite materno, com a razão de concentração de leite para o plasma de cerca de 0,46. A dose diária estimada para crianças é de 0,3% da dose diária materna e estima-se que a concentração plasmática média em crianças é de 1/600 da concentração observada no plasma materno, mesmo após assumir a biodisponibilidade oral infantil completa.
Biotransformação/Metabolismo
Formoterol
O formoterol é eliminado principalmente pelo metabolismo, sendo a glicuronidação direta a principal via de biotransformação. A O-demetilação seguida de glicuronidação é outra via.
Outras vias de menor importância, envolvem sulfato conjugação do formoterol e deformilação seguida de sulfato conjugação. Isoenzimas múltiplas catalisam a glicuronidação (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7 e 2B15) e O-demetilação (CYP2D6, 2C19, 2C9 e 2A6) do formoterol, sugerindo um baixo potencial para interações fármaco-fármaco, apesar da inibição de uma isoenzima específica envolvida no metabolismo do formoterol. O formoterol não inibe isoenzimas do citocromo P450 em concentrações terapeuticamente relevantes.
Budesonida
A budesonida não é metabolizada nos pulmões. Após a absorção, é metabolizada no fígado, originando vários metabólitos inativos, inclusive 6-beta-hidroxi-budesonida e 16-alfa-hidroxiprednisolona.
A principal via de metabolização da budesonida é a via CYP3A4 e pode ser afetada por inibidores ou indutores conhecidos desta enzima.
Eliminação
Formoterol
Em pacientes asmáticos e com DPOC tratados por 12 semanas com 12 ou 24 microgramas de fumarato de formoterol, duas vezes por dia, aproximadamente 10% e 7% da dose de formoterol inalterado é recuperado na urina, respectivamente. Os enantiômeros (R, R)- e (S, S)- contabilizaram, respectivamente, 40% e 60% da recuperação urinária de formoterol inalterado, após doses únicas (12 a 120 microgramas) em voluntários sadios e após doses únicas e repetidas em pacientes com asma.
O fármaco e seus metabólitos foram completamente eliminados do organismo, sendo aproximadamente dois terços de uma dose oral excretada na urina e um terço nas fezes. O clearance (depuração) renal do formoterol do sangue foi de 150 mL/min.
Em voluntários sadios, a meia-vida de eliminação terminal do formoterol no plasma, após inalação de uma dose única de 120 microgramas de fumarato de formoterol, foi 10 horas e as meias-vidas de eliminação terminal dos enantiômeros (R, R)- e (S, S)-, como derivados das taxas de excreção urinária, foram 13,9 e 12,3 horas, respectivamente.
Budesonida
Em voluntários humanos que inalaram budesonida marcada radioativamente (através de inaladores dosimetrados - MDI), aproximadamente 32% da dose liberada foi recuperada na urina e 15% da dose foi recuperada nas fezes. Após inalação, a budesonida não foi detectada na urina onde foi detectado 16 alfa-hidroxiprednisolona.
A budesonida tem o clearance (depuração) plasmático alto (84 L/h) após dose intravenosa.
A meia-vida de eliminação de budesonida foi aproximadamente 2,8 a 5h.
Populações especiais
Efeitos relacionados ao gênero:
Após correção do peso corpóreo, a farmacocinética de formoterol não diferiu significativamente entre homens e mulheres.
Pacientes geriátricos (65 anos de idade ou mais):
A farmacocinética de formoterol e budesoninda não foi estudada em idosos.
Pacientes pediátricos:
Formoterol
Em um estudo em crianças entre 5 e 12 anos de idade com asma, nas quais se administrou 12 ou 24 microgramas de fumarato de formoterol, duas vezes ao dia por inalação, durante 12 semanas, a excreção urinária de formoterol inalterado aumentou entre 18 e 84%, quando comparado a quantidades medidas após a primeira dose. Acúmulo em crianças não excedeu ao dos adultos, onde o aumento foi entre 63 e 73% (vide acima). Nas crianças estudadas, aproximadamente 6% da dose foi recuperada como formoterol inalterado na urina.
Budesonida
A farmacocinética da budesonida não foi estudada na população pediátrica. No entanto, dados com outros produtos contendo budesonida para inalação sugerem que o peso corporal que normalizou a depuração em crianças acima de 3 anos de idade é aproximadamente 50% maior quando comparado a adultos.
Pacientes com insuficiência hepática/renal:
A farmacocinética de formoterol e budesonida não foi estudada em pacientes com doença hepática ou renal.
Dados de segurança pré-clínicos
Mutagenicidade
Formoterol
Foram conduzidos testes de mutagenicidade cobrindo uma ampla faixa de parâmetros experimentais com formoterol. Não foi encontrado efeito genotóxico em qualquer dos testes efetuados in vitro ou in vivo.
Budesonida
A budesonida não demonstrou ter potencial mutagênico na bateria de testes de mutagenicidade in vitro ou in vivo.
Carcinogenicidade
Formoterol
Estudos de dois anos de formoterol em ratos e camundongos não indicaram qualquer potencial carcinogênico. Camundongos machos tratados com níveis de dosagem bastante altos demonstraram uma incidência ligeiramente maior de tumor benigno de célula subcapsular adrenal. Entretanto, o mesmo não foi observado em um segundo estudo de alimentação para camundongos, no qual alterações patológicas com altas doses consistiram em um aumento da incidência de ambos os tumores benignos de músculo liso no trato genital das fêmeas e tumores de fígado em ambos os sexos. Tumores de músculo liso são efeitos conhecidos de beta-agonistas quando administrados em altas doses em roedores.
Dois estudos em ratos, com diferentes faixas de dosagem, demonstraram um aumento de leiomiomas mesovarianos. Esses neoplasmas benignos são tipicamente associados, em tratamentos prolongados de ratos, com altas dosagens de fármacos beta2-adrenérgicos.
Um aumento na incidência de cistos ovarianos e células tumorais benignas da teca e da granulosa também foi observado; são conhecidos os efeitos dos beta-agonistas em ovário de ratas, sendo os mesmos específicos de roedores. Alguns outros tipos de tumores observados no primeiro estudo com altas dosagens estavam de acordo com a incidência do controle histórico da população e não foram observados no ensaio de doses menores.
Nenhuma das incidências de tumores aumentou a uma extensão estatisticamente significativa na dose mais baixa do segundo estudo com ratos, dose esta que levou a uma exposição sistêmica 10 vezes maior do que a esperada com a dosagem máxima recomendada de formoterol em humanos.
Baseando-se nas conclusões dos estudos e na ausência de potencial mutagênico, conclui-se que o uso de formoterol em doses terapêuticas não apresenta risco carcinogênico.
Budesonida
A budesonida administrada oralmente demonstrou um aumento na incidência de tumor no fígado em ratos machos em doses iniciais de 25 mcg/kg/dia. Estes efeitos também foram observados em um estudo de acompanhamento incluindo outros esteroides (prednisolona e acetonido de triancinolona) e são considerados como efeitos de classe, relacionados com a administração de corticosteroides.
Toxicidade sobre a reprodução
Formoterol
Testes em animais não demonstraram potencial teratogênico do formoterol. Os efeitos do formoterol sobre a fertilidade e desempenho reprodutivo em geral foram avaliados em ratos machos e fêmeas sexualmente maduros. Os estudos de reprodução em ratos não revelou prejuízo na fertilidade ou efeitos sobre o desenvolvimento embrionário inicial em doses orais de até 3 mg/kg (aproximadamente 1200 vezes a dose máxima recomendada pó para inalação diária humana com base em mg/m2). Após administração oral, o formoterol foi excretado no leite de ratas lactantes.
Budesonida
Vide “Advertências e Precauções – Gravidez”.
Cuidados de Armazenamento
Conservar Alenia em temperatura ambiente (entre 15 e 30 °C). Proteger da luz e umidade.
Não deixe o medicamento em locais úmidos como banheiro e lavanderia; nem em locais quentes como dentro do carro, próximo ao fogão nem em exposição solar como, por exemplo, próximo a janelas.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido.
Para sua segurança, mantenha o medicamento na embalagem original.
As cápsulas de ALENIA 6/100 mcg possuem a tampa de coloração rosa claro e o corpo incolor.
Antes de usar, observe o aspecto do medicamento.
Caso você observe alguma mudança no aspecto do medicamento que ainda esteja no prazo de validade, consulte o médico ou o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Mensagens de Alerta
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe também à empresa através do seu serviço de atendimento.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Este medicamento pode causar doping.
Dizeres Legais
MS - 1.1213.0399
Farmacêutico Responsável: Alberto Jorge Garcia Guimarães
CRF-SP no 12.449
Biosintética Farmacêutica Ltda.
Av. das Nações Unidas, 22.428 São Paulo - SP
CNPJ 53.162.095/0001-06
Indústria Brasileira
informações complementares
| Fabricante |
| ACHÉ |
| Princípio ativo |
| Fumarato de formoterol diidratado + budesonida |
| Categoria do medicamento |
| Medicamentos de A-Z |
