para o que é indicado e para que serve?
Para que serve Bromidrato de Citalopram (substância ativa) é usado para tratar a depressão e, após a melhora, para prevenir a recorrência desses sintomas.Continue lendo...
ofertas de
Bromidrato De Citalopram ...
ofertas de Bromidrato De Citalopram ...
R$ 9,13
R$ 9,71
R$ 22,58
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Bromidrato de Citalopram (substância ativa) é usado para tratar a depressão e, após a melhora, para prevenir a recorrência desses sintomas.
Bromidrato de Citalopram (substância ativa) é usado em tratamentos de longo prazo para prevenir a recorrência de novos episódios depressivos em pacientes que tem depressão recorrente.
Bromidrato de Citalopram (substância ativa) é eficaz também para o tratamento de pacientes com transtorno do pânico com ou sem agorafobia e para o tratamento de pacientes com transtorno obsessivo compulsivo (TOC).
Contraindicação
O Bromidrato de Citalopram (substância ativa) é contraindicado em pacientes que apresentam hipersensibilidade ao Citalopram (substância ativa) ou a qualquer um de seus componentes.
O tratamento concomitante com IMAO (inibidores da monoaminoxidase) e pimozida é contraindicado.
O Bromidrato de Citalopram (substância ativa) não deve ser dado a pacientes recebendo Inibidores da Monoaminoxidase (IMAOs) incluindo selegilina em doses diárias que excedam 10mg/dia. O Bromidrato de Citalopram (substância ativa) não deve ser administrado por até catorze dias após a descontinuação de um IMAO irreversível ou pelo tempo especificado após a descontinuação de um IMAO reversível (RIMA) como descrito no texto de bula do RIMA. IMAOs não devem ser introduzidos antes de sete dias após descontinuação do Citalopram (substância ativa).
O Bromidrato de Citalopram (substância ativa) é contraindicado para uso concomitante com linezolida a menos que seja possível monitorar de perto a pressão sanguínea do paciente.
Citalopram (substância ativa) é contraindicado em pacientes que apresentam prolongamento do intervalo QT ou síndrome congênita do prolongamento QT.
Gravidez
Categoria de risco B: não há dados clínicos disponíveis do Citalopram (substância ativa) sobre a exposição durante a gravidez.
Uma grande quantidade de dados de mulheres grávidas (mais do que 2500 exposições relatadas) indicou não haver malformação do feto ou toxicidade neonatal. Entretanto, o Citalopram (substância ativa) não deve ser usado durante a gravidez a menos que seja claramente necessário e somente após uma avaliação criteriosa do benefício/risco.
Recém-nascidos devem ser observados se o uso materno de Bromidrato de Citalopram (substância ativa) continua nas fases finais da gravidez, especialmente no terceiro trimestre. A descontinuação abrupta deve ser evitada durante a gravidez.
Os seguintes sintomas podem ocorrer nos neonatos após uso maternal de ISRS / uso SNRI nos estágios mais avançados da gravidez: dificuldade respiratória, cianose, apneia, convulsões, instabilidade térmica, dificuldade de alimentação, vômitos, hipoglicemia, hipertonia, hipotonia, hiperreflexia, tremor, agitação, irritabilidade, letargia, choro constante, sonolência e dificuldade para dormir. Estes sintomas podem ser devido a efeitos serotoninérgicos ou sintomas de descontinuação. Na maioria dos casos, as complicações iniciam-se imediatamente ou brevemente (<24 horas) após o parto.
Dados epidemiológicos sugerem que o uso de ISRS durante a gravidez, especialmente no final da gravidez, podem aumentar o risco de hipertensão pulmonar persistente do recém-nascido (HPP). O risco observado foi de cerca de 5 casos por 1.000 gestações. Na população geral 1-2 casos de HPP por 1000 gestações ocorrem.
Baseado em dados de estudos de toxicidade reprodutiva (segmento I, II e III) não há nenhuma razão para ter preocupação especial com o uso de Citalopram (substância ativa) em mulheres em idade fértil.
Lactação
O Citalopram (substância ativa) é excretado no leite materno em baixas concentrações. Estima-se que o lactente receberá cerca de 5% do peso da dose diária materna relacionados (emmg/kg). Nenhuma ou apenas pequenos eventos têm sido observados em lactentes. No entanto, a informação existente é insuficiente para a avaliação do risco para a criança. Recomenda-se precaução.
Fertilidade
Dados de estudos em animais mostraram que o Citalopram (substância ativa) pode afetar a qualidade do esperma.
Relatos de casos em humanos com alguns ISRSs mostram que este efeito na qualidade do esperma é reversível. Até o momento não foi observado impacto na fertilidade humana.
Não usar Bromidrato de Citalopram (substância ativa) durante a gravidez, a menos que a necessidade seja clara e seja avaliado cuidadosamente o risco-benefício do uso deste medicamento.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Como usar
Os comprimidos de Bromidrato de Citalopram (substância ativa) são administrados por via oral, uma única vez ao dia. Os comprimidos de Bromidrato de Citalopram (substância ativa) podem ser tomados em qualquer momento do dia, com ou sem alimentos. Engolir os comprimidos com água, sem mastigá-los.
Tratamento da depressão
Administrar o Bromidrato de Citalopram (substância ativa) na forma de uma dose oral única de 20mg por dia. Dependendo da resposta individual do paciente e da gravidade da depressão, aumentar a dose até um máximo de 40mg por dia.
Tratamento do transtorno de pânico
Uma dose oral única de 10mg é recomendada na primeira semana, antes de se aumentar a dose para 20mg por dia. Dependendo da resposta individual, aumentar a dose até um máximo de 40mg por dia.
Tratamento do transtorno obsessivo compulsivo
É recomendada a dose inicial de 20mg. Dependendo da resposta individual, aumentar a dose até um máximo de 40mg por dia.
Posologia
Pacientes idosos (> 65 anos de idade)
Para pacientes idosos, a dose precisa ser reduzida para a metade da dose recomendada, por ex.: 10-20mg/dia. A dose máxima recomendada para idosos é 20mg/dia.
Crianças e adolescentes
Bromidrato de Citalopram (substância ativa) não deve ser usado para tratamento de crianças e adolescentes com menos de 18 anos de idade.
Pacientes com função renal reduzida
Não é necessário ajuste da posologia em pacientes com comprometimento renal leve ou moderado. Não está disponível nenhuma informação sobre o tratamento de pacientes com função renal gravemente reduzida (clearance de creatinina < 30mL/min).
Pacientes com função hepática reduzida
Uma dose diária inicial de 10mg nas primeiras duas semanas de tratamento é recomendada em pacientes com comprometimento hepático leve a moderado.
Dependendo da resposta individual, a dose pode ser aumentada para um máximo de 20mg diários. Cuidados e uma cuidadosa titulação da dose são aconselháveis em pacientes com comprometimento hepático grave.
Metabolizadores pobres CYP2C19
Para pacientes que são metabolizadores pobres da enzima CYP2C19, recomenda-se uma dose inicial de 10mg durante as duas primeiras semanas de tratamento. A dose poderá ser aumentada até no máximo 20mg/dia, dependendo da resposta individual.
Descontinuação
A descontinuação abrupta precisa ser evitada. Ao interromper o tratamento com Bromidrato de Citalopram (substância ativa), reduzir gradualmente a dose durante um período de uma ou duas semanas, para evitar possíveis sintomas de descontinuação. Se sintomas intoleráveis ocorrerem após redução da dose ou descontinuação do tratamento, retornar à dose anteriormente prescrita e reiniciar abredução da dose de forma mais gradual.
Esquecimento da dose
A meia-vida do Bromidrato de Citalopram (substância ativa) é de aproximadamente 1 ½ dia, o que permite que o esquecimento da ingestão da dose diária possa ser contornado com a simples supressão daquela dose. Retomar a prescrição usual. Não dobrar a dose.
Precauções
As seguintes advertências e precauções aplicam-se à classe terapêutica dos ISRSs (Inibidores Seletivos da Recaptação de Serotonina).
Crianças e adolescentes (< 18 anos de idade)
Não usar o Bromidrato de Citalopram (substância ativa) para tratar crianças ou adolescentes menores de 18 anos, ao menos que a necessidade clínica seja clara e o paciente seja cuidadosamente monitorado pelo médico quanto ao aparecimento de sintomas suicidas. Em estudos clínicos realizados com crianças e adolescentes tratados com antidepressivos, comparados com o placebo, foi observado aumento da hostilidade e do comportamento suicida (tentativas de suicídio e pensamentos suicidas).
Não existem dados de longo-prazo pela utilização por crianças e adolescentes no que se refere a crescimento, maturação e desenvolvimento cognitivo e comportamental.
Ansiedade paradoxal
Alguns pacientes com transtorno de pânico podem apresentar sintomas de ansiedade intensificados no início do tratamento com antidepressivos. Esta reação paradoxal geralmente desaparece dentro de 02 semanas durante o tratamento contínuo. Recomenda-se uma dose inicial baixa para reduzir a probabilidade de um efeito ansiogênico paradoxal.
Hiponatremia
Hiponatremia, provavelmente relacionada à secreção inapropriada de hormônio antidiurético (SIADH), foi relatada como efeito adverso raro com o uso de ISRS e geralmente se resolve com a descontinuação do tratamento. Pacientes idosos (especialmente mulheres) parecem ter o risco aumentado.
Suicídio/pensamentos suicidas ou piora clínica
A depressão está associada com um aumento dos pensamentos suicidas, atos de autoflagelação e suicídio (eventos relacionados ao suicídio). Este risco persiste até que ocorra uma remissão significativa da doença.
Como não há uma melhora expressiva nas primeiras semanas de tratamento, os pacientes devem ser cuidadosamente monitorados até que uma melhora significativa ocorra. É observado na prática clínica um aumento do risco de suicídio no início do tratamento, quando há uma pequena melhora parcial.
Outras doenças psiquiátricas para as quais o Citalopram (substância ativa) é indicado também podem estar associadas a um aumento do risco de suicídio ou eventos a ele relacionados. Estas doenças podem ser comórbidas à depressão. As mesmas precauções indicadas nos casos de tratamento dos pacientes com depressão devem ser aplicadas quando são tratados pacientes com outros transtornos psiquiátricos.
Os pacientes com histórias de tentativas de suicídio e/ou com ideação suicida, ambas prévias ao início do tratamento, apresentam um risco maior para tentativas de suicídio e devem ser monitorados cuidadosamente durante o tratamento antidepressivo.
Uma meta-análise de estudos clínicos placebo-controlados de drogas antidepressivas em pacientes adultos com distúrbios psiquiátricos mostrou um risco aumentado de comportamento suicida com o uso de antidepressivos comparado ao placebo em pacientes com menos de 25 anos de idade.
Uma supervisão dos pacientes, em especial estes de alto risco, deve ter a terapia medicamentosa acompanhada especialmente no início do tratamento e na mudança de doses. Pacientes (e cuidadores) precisam ser alertados sobre a necessidade de monitorar qualquer agravamento da situação clínica, comportamento suicida ou pensamentos ou mudanças não-usuais no comportamento e devem procurar aconselhamento médico imediatamente caso estes sintomas se façam presentes.
Acatisia/agitação psicomotora
O uso de ISRSs e IRSNs tem sido associado ao desenvolvimento de acatisia, caracterizada por uma inquietude desagradável ou desconfortável e necessidade de se movimentar, associada à incapacidade de ficar sentado ou em pé, parado.
Quando ocorre é mais comum nas primeiras semanas de tratamento. Os pacientes que desenvolverem estes sintomas podem piorar dos mesmos com o aumento da dose.
Mania
Em pacientes com doença maníaco-depressiva, uma mudança de fase maníaca pode ocorrer. Deve-se descontinuar os ISRSs em qualquer paciente que entre em fase maníaca.
Convulsões
Convulsões são riscos potenciais com as drogas antidepressivas. O Citalopram (substância ativa) deve ser descontinuado em qualquer paciente que apresente convulsões.
Deve-se evitar o uso dos ISRSs em pacientes com epilepsia instável e pacientes com epilepsia controlada. Estes pacientes precisam ser cuidadosamente monitorados por um médico.
Descontinuar o uso dos ISRSs caso haja um aumento da frequência de convulsões.
Diabetes
Em pacientes diabéticos, o tratamento com ISRSs poderá alterar o controle glicêmico. Pode ser necessário um ajuste na dose de insulina e/ou hipoglicemiantes orais em uso.
Síndrome serotoninérgica
Em raros casos foi relatada síndrome serotoninérgica em pacientes utilizando ISRSs. A combinação de sintomas como agitação, tremor, mioclonia e hipertermia podem indicar o desenvolvimento desta condição. O tratamento com Citalopram (substância ativa) precisa ser descontinuado imediatamente e tratamento sintomático deve ser iniciado.
Medicamentos serotoninérgicos
O Citalopram (substância ativa) não deve ser usado concomitantemente com medicamentos de efeitos serotoninérgicos tais como sumatriptano ou outros triptanos, tramadol, oxitriptano e triptofano.
Hemorragia
Há relatos de sangramentos cutâneos com tempo e/ou características anormais, tais como equimoses, hemorragias ginecológicas, sangramentos gastrointestinais e outros sangramentos cutâneos ou das mucosas com o uso dos ISRSs.
Recomenda-se cautela no caso de pacientes em tratamento com ISRSs, especialmente em uso concomitantemente com medicamentos conhecidos por afetar a função de plaquetas ou outros medicamentos que possam aumentar o risco de hemorragia, bem como em pacientes com conhecida tendência a sangramentos.
Eletroconvulsoterapia (ECT)
A experiência clínica no uso combinado de ISRSs e ECT é limitada e, portanto, recomenda-se cautela.
Erva de são joão
Efeitos indesejáveis podem ser mais comuns durante a utilização concomitante de Citalopram (substância ativa) e produtos fitoterápicos contendo Erva de São João (Hypericum perforatum). Sendo assim, o Citalopram (substância ativa) e produtos fitoterápicos à base de Erva de São João (Hypericum perforatum) não devem ser utilizados concomitantemente.
Sintomas de descontinuação
Sintomas de descontinuação são comuns ao interromper o tratamento, particularmente se a descontinuação for abrupta. Em um estudo clínico de prevenção das recorrências com o Citalopram (substância ativa), os eventos adversos após a descontinuação do tratamento com Citalopram (substância ativa) foram observados em 40% dos pacientes versus 20% dos pacientes que continuavam o uso de Citalopram (substância ativa).
O risco de sintomas de descontinuação podem ser dependentes de diversos fatores incluindo a duração e a dose do tratamento e a taxa de redução da dose.
Tonturas, distúrbios sensoriais (incluindo parestesia), distúrbios do sono (incluindo insônia e sonhos intensos), agitação ou ansiedade, náusea e ou vômitos, tremor, confusão, sudorese, dor de cabeça, diarreia, palpitações, instabilidade emocional, irritabilidade e distúrbios visuais são as reações mais comumente relatadas. Geralmente estes sintomas são leves a moderados, entretanto, em alguns pacientes, podem ser severos na intensidade.
Ocorrem geralmente nos primeiros dias de descontinuação do tratamento, mas há relatos muito raros destes sintomas em pacientes que inadvertidamente esqueceram uma dose.
Geralmente esses sintomas são autolimitados e usualmente desaparecem em 2 semanas, embora em alguns pacientes possam ser prolongados (2-3 meses ou mais). Sendo assim, é recomendado que a concentração do Citalopram (substância ativa) seja gradualmente diminuída quando o tratamento for descontinuado durante algumas semanas ou meses, de acordo com as necessidades do paciente.
Psicose
O tratamento de pacientes psicóticos com depressão pode aumentar os sintomas psicóticos.
Prolongamento do intervalo QT
Citalopram (substância ativa) mostrou causar um aumento do prolongamento do intervalo QT dose-dependente. Casos de prolongamento do intervalo QT e arritmia ventricular, incluindo Torsade de Pointes foram relatados durante o período de pós-comercialização do produto, predominantemente em pacientes do sexo feminino, com hipocalemia, ou com prolongamento QT ou outras doenças cardíacas pré-existentes.
Recomenda-se precaução nos pacientes que apresentam bradicardia significativa ou em pacientes que sofreram infarto agudo do miocárdio recentemente ou insuficiência cardíaca descompensada.
Distúrbios eletrolíticos como hipocalemia e hipomagnesemia aumentam o risco de arritmias malignas e devem ser tratadas antes do início do tratamento com Citalopram (substância ativa).
Uma revisão do ECG deve ser considerada antes do início do tratamento com Citalopram (substância ativa) nos pacientes que apresentam doença cardíaca estável.
Se ocorrerem sinais de arritmia cardíaca durante o tratamento com Citalopram (substância ativa), o tratamento deve ser descontinuado e deve ser realizado um ECG.
Glaucoma
Como ocorre com outros ISRSs, Citalopram (substância ativa) pode causar midríase e deve ser usado com precaução em pacientes com aumento da pressão intraocular ou naqueles com glaucoma de ângulo estreito.
Efeitos na capacidade de dirigir ou operar máquinas
O Citalopram (substância ativa) tem influência menor ou moderada na habilidade de dirigir ou operar máquinas. Medicamentos psicoativos podem reduzir a capacidade de julgamento e de reagir à emergências.
Os pacientes devem ser informados sobre esses efeitos e alertados quanto ao risco de interferência na sua capacidade de dirigir automóveis e de operar máquinas.
Geralmente, Bromidrato de Citalopram (substância ativa) não afeta a habilidade de suas atividades diárias normais. Entretanto, você precisa ter cautela quando dirigir veículos, operar máquinas ou realizar atividades que requeiram sua atenção.
Uso em idosos, crianças e outros grupos de risco
Para o uso em idosos, crianças e outros grupos de risco, ver “Como usar o Bromidrato de Citalopram (substância ativa)”.
Este medicamento contém lactose.
Os comprimidos contém lactose. Pacientes com problemas hereditários raros de intolerância à galactose, deficiência de lactase ou mal absorção de glucosegalactose não devem tomar este medicamento.
Reações Adversas
As reações adversas observadas com Citalopram (substância ativa) são em geral moderadas e transitórias.
As reações adversas são mais frequentes durante a primeira ou segunda semana de tratamento e, geralmente, diminuem de intensidade e frequência com a continuação do tratamento.
Para as reações após uma dose-resposta foi descoberto:
Aumento da sudorese, boca seca, insônia, sonolência, diarreia, náuseas e fadiga.
A tabela mostra o percentual de reações adversas associadas com ISRSs e/ou Citalopram (substância ativa) visto em ?1% dos pacientes em estudos duplo-cego placebo-controlados ou no período pós comercialização. As frequências foram definidas como:
- Muito comum (>1/10);
- Comum (>1/100 a ?1/10);
- Incomum (>1/1000 a <1/100);
- Raro (>1/10000 a <1/1000);
- Muito raro (<1/10000);
- Desconhecido (não pode ser estimado com os dados atuais).
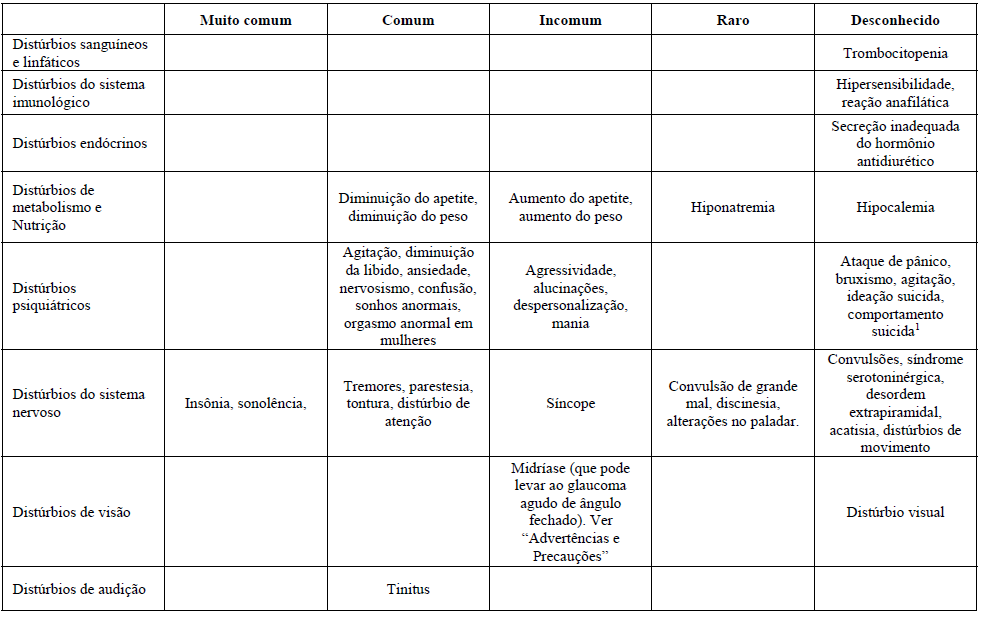
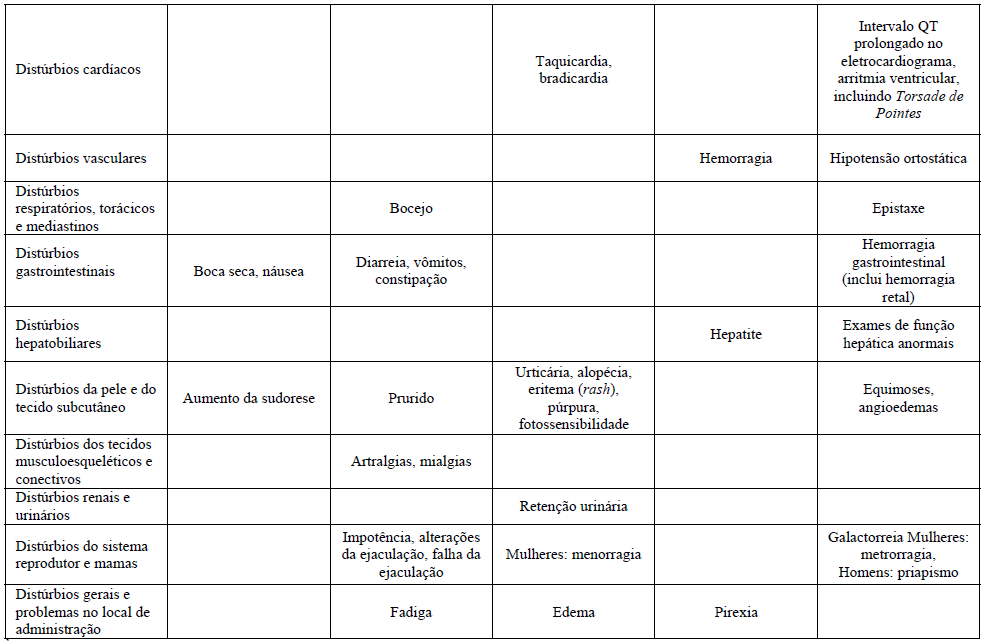
1Casos de ideação suicida e comportamentos suicidas foram relatados durante a terapia do Citalopram (substância ativa) ou logo após a descontinuação do tratamento.
Fraturas Ósseas
Estudos epidemiológicos, conduzidos principalmente em pacientes com 50 anos de idade e mais velhos, mostram um aumento do risco de fraturas ósseas em doentes tratados com ISRS e antidepressivos tricíclicos. O mecanismo que leva a este risco é desconhecido.
Prolongamento do Intervalo QT
Casos de Prolongamento do intervalo QT e arritmia ventricular incluindo Torsade de Pointes foram relatados durante o período de comercialização, predominantemente em pacientes do sexo feminino, com hipocalemia ou com prolongamento do intervalo QT pré-existente causado por outras doenças cardíacas.
As seguintes reações adversas a medicamentos também foram reportadas para a classe terapêutica dos ISRS: inquietude psicomotora/acatisia e anorexia.
Sintomas observados na descontinuação do tratamento com ISRSs
A descontinuação do Citalopram (substância ativa) (particularmente quando abrupta) causa sintomas de descontinuação.
Tonturas, alterações da senso-percepção (inclui parestesias), alterações do sono (inclui insônia e sonhos vividos), agitação ou ansiedade, náusea e/ou vômitos, tremores, confusão, sudorese, cefaleia, diarreia, palpitações, instabilidade emocional, irritabilidade e alterações visuais são as reações mais comumente reportadas.
Geralmente, esses eventos são de intensidade leve a moderada e autolimitados, porém em alguns pacientes podem ser graves e/ou prolongados.
Os eventos geralmente se resolvem dentro de 2 semanas, embora em alguns indivíduos este tempo possa se prolongar (2-3 meses ou mais). Logo, quando o tratamento com o Citalopram (substância ativa) não for mais necessário, recomenda-se fazer uma descontinuação gradual, com diminuição progressiva da dose.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
Interações farmacodinâmicas
Em um nível farmacodinâmico, casos de síndrome serotoninérgica de Citalopram (substância ativa) com moclobemida e buspirona já foram relatados.
Combinações medicamentosas contraindicadas
Pimozida
A coadministração de uma dose única de pimozida 2mg em indivíduos tratados com o Citalopram (substância ativa) racêmico 40mg/dia durante 11 dias causou um aumento da ASC e da Cmáx da pimozida, embora não consistentemente em todo o estudo. A coadministração de pimozida e Citalopram (substância ativa) resultou num aumento médio do intervalo QTc de aproximadamente 10ms. Devido a interação observada com uma baixa dose de pimozida, a administração concomitante de Citalopram (substância ativa) e pimozida é contraindicada.
Combinações medicamentosas que requerem precaução
Selegilina (inibidor seletivo MAO B)
Um estudo de interação farmacocinética/farmacodinâmica com a administração concomitante de Citalopram (substância ativa) (20mg/dia) e selegilina (10mg/dia) não demonstrou interações clinicamente relevantes. O uso concomitante de Citalopram (substância ativa) e selegilina (em doses acima de 10mg/dia) é contraindicado.
Medicamentos serotoninérgicos
Levomepromazina, digoxina, carbamazepina
Nenhuma mudança ou apenas mudanças muito pequenas de pouca importância clínica foram observadas quando o Citalopram (substância ativa) foi dado com substratos CYP1A2 (clozapina e teofilina), CYP2C9 (varfarina), CYP2C19 (imipramina e mefenitoína), CYP2D6 (esparteína, imipramina, amitriptilina e risperidona) e CYP3A4 (varfarina, carbamazepina (e seu metabólito carbamazepina epóxido) e triazolam). Nenhuma interação farmacocinética foi observada entre Citalopram (substância ativa) e levomepromazina, ou digoxina (indicando que o Citalopram (substância ativa) nem induz nem inibe a glicoproteína-P).
Imipramina, desipramina
Em um estudo farmacocinético, nenhum efeito foi demonstrado nos níveis de Citalopram (substância ativa) ou imipramina, embora o nível de desipramina, o metabólito primário da imipramina, foi aumentado.
Quando desipramina é combinada com Citalopram (substância ativa), um aumento da concentração plasmática de desipramina tem sido observado. A redução da dose de desipramina pode ser necessária
Interação Alimentícia
A absorção e outras propriedades farmacocinéticas do Citalopram (substância ativa) não é afetada pelos alimentos.
Álcool
Nenhuma interação farmacodinâmica ou farmacocinética é esperada entre o Citalopram (substância ativa) e o álcool. Entretanto, a combinação com álcool não é recomendada.
Ação da Substância
Resultados de eficácia
Dados de segurança pré-clínica
Estudos em humanos
Características farmacológicas
Farmacodinâmica
Propriedades farmacocinéticas
Relação farmacocinética/farmacodinâmica
Não há relação clara entre níveis plasmáticos de Citalopram (substância ativa) e resposta terapêutica ou eventos adversos. Os metabólitos não contribuem para o efeito antidepressivo geral.
informações complementares
| Fabricante |
| TEUTO |
| Princípio ativo |
| Bromidrato de citalopram |
| Categoria do medicamento |
| Medicamentos de A-Z |
