Comparamos o preço de Daisan 37,5/325Mg 20 Comprimidos, veja o menor preço

R$ 58,85
ISimilar Intercambiável
8
ofertasMelhores preços a partir de R$ 58,85 até R$ 69,05
Oferta patrocinada
vendido por Drogaria Nova Esperança
economize
14.77%
R$ 58,85
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
Oferta patrocinada
vendido por Drogarias Pacheco
economize
2.42%
R$ 67,38
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Oferta patrocinada
vendido por Drogaria São Paulo
R$ 69,05
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Drogaria Vera Cruz
economize
14.69%
R$ 58,91
Entregas para todo o Brasil. Clique e confira!
vendido por Farmácia Preço Popular
economize
12.98%
R$ 60,09
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Pague Menos
economize
6.60%
R$ 64,49
vendido por Drogaria Catarinense
economize
6.39%
R$ 64,64
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Panvel Farmácias
economize
2.36%
R$ 67,42
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Este medicamento é indicado para dores moderadas a severas de caráter agudo, subagudo e crônico.
Como este medicamento funciona?
O tramadol é um analgésico sintético de ação central. Embora o seu modo de ação não seja totalmente conhecido, a partir de testes em animais, pelo menos dois mecanismos complementares parecem aplicáveis: ligação do fármaco e do metabólito M1 aos receptores de
?-opioide e inibição fraca da recaptação da norepinefrina e da serotonina.
O paracetamol é outro analgésico de ação central. Embora o sítio e os mecanismos de ação exatos não estejam claramente definidos, parece que o paracetamol produz analgesia através da elevação do limiar da dor. O mecanismo potencial pode envolver inibição da via do óxido nítrico mediada por uma variedade de receptores de neurotransmissores incluindo N-metil-D- aspartato e Substância P.
O início do alívio da dor é rápido (30 a 60 minutos) e, dependendo da intensidade da dor, o efeito analgésico perdura por até 8 horas.
Contraindicação
- Hipersensibilidade ao tramadol, paracetamol ou a qualquer componente da fórmula ou aos opioides;
- Intoxicações agudas pelo álcool, hipnóticos, narcóticos, analgésicos de ação central, opioides ou psicotrópicos;
- Pacientes em tratamento com inibidores da monoaminoxidase (MAO) ou tratados com estes agentes nos últimos 14 dias.
Como usar
Os comprimidos de Cloridrato de Tramadol + Paracetamol (substância ativa) devem ser administrados por via oral. Cloridrato de Tramadol + Paracetamol (substância ativa) pode ser administrado independentemente das refeições.
Posologia
A dose diária máxima de Cloridrato de Tramadol + Paracetamol (substância ativa) é 1 a 2 comprimidos a cada 4 a 6 horas, de acordo com a necessidade para alívio da dor, até o máximo de 8 comprimidos ao dia.
Nas condições dolorosas crônicas, o tratamento deve ser iniciado com 1 comprimido ao dia e aumentado em 1 comprimido a cada 3 dias, conforme a tolerância do paciente, até atingir a dose de 4 comprimidos ao dia. Depois disso, Cloridrato de Tramadol + Paracetamol (substância ativa) pode ser administrado na dose de 1-2 comprimidos a cada 4-6 horas, até o máximo de 8 comprimidos ao dia.
Nas condições dolorosas agudas, o tratamento pode ser iniciado com a dose terapêutica completa (1-2 comprimidos a cada 4-6 horas), até o máximo de 8 comprimidos ao dia.
Tratamento de Abstinência
Os sintomas de abstinência podem ser aliviados pela redução gradual da medicação.
Disfunção renal
Em pacientes com depuração de creatinina inferior a 30 mL/min, recomenda-se aumentar o intervalo entre as administrações de Cloridrato de Tramadol + Paracetamol (substância ativa) de forma a não exceder 2 comprimidos a cada 12 horas.
Insuficiência hepática
Não é recomendado o uso de Cloridrato de Tramadol + Paracetamol (substância ativa) em pacientes com insuficiência hepática grave.
Idosos (65 anos ou mais)
Não foram observadas diferenças gerais em relação à segurança ou à farmacocinética entre indivíduos ? 65 anos de idade e indivíduos mais jovens.
Este medicamento não deve ser partido, aberto ou mastigado.
Precauções
Precauções gerais
A dose recomendada de Cloridrato de Tramadol + Paracetamol (substância ativa) não deve ser excedida.
Cloridrato de Tramadol + Paracetamol (substância ativa) não deve ser coadministrado com outros produtos à base de tramadol ou paracetamol.
Não use outro produto que contenha paracetamol.
Convulsões
Convulsões foram relatadas em pacientes recebendo tramadol na dose recomendada. Relatos espontâneos pós-comercialização indicam que o risco de convulsões está aumentado com doses de tramadol acima das recomendadas.
O uso concomitante de tramadol aumenta o risco de convulsões em pacientes tomando:
- Inibidores seletivos da recaptação da serotonina (antidepressivos ou anoréticos);
- Antidepressivos tricíclicos e outros compostos tricíclicos (ex.: ciclobenzaprina, prometazina, etc) ou;
- Opioides.
A administração de tramadol pode aumentar o risco de convulsão em pacientes tomando inibidores da MAO, neurolépticos ou outros fármacos que reduzem o limiar convulsivo.
O risco de convulsões também pode estar aumentado em pacientes com epilepsia, aqueles com história de convulsões ou em pacientes com risco reconhecido para convulsões [tais como trauma craniano, distúrbios metabólicos, abstinência de álcool ou drogas, infecções do Sistema Nervoso Central (SNC)]. Na superdose de tramadol, a administração de naloxona pode aumentar o risco de convulsão.
Reações anafilactoides
Pacientes com história de reações anafilactoides à codeína e a outros opioides podem estar sob risco aumentado e, portanto, não devem ser tratados com Cloridrato de Tramadol + Paracetamol (substância ativa).
Dependência de drogas e potencial de abuso
Cloridrato de Tramadol + Paracetamol (substância ativa) contém tramadol como princípio ativo. Parte do efeito analgésico de Cloridrato de Tramadol + Paracetamol (substância ativa) é atribuível à ligação do princípio ativo, tramadol, ao receptor mu-opioide. Após administrações repetidas de opioides, pode ocorrer o desenvolvimento de tolerância, dependência física e dependência psicológica, mesmo nas doses recomendadas. Avaliar o risco de cada paciente para dependência e abuso de opioides antes de prescrever Cloridrato de Tramadol + Paracetamol (substância ativa) e monitorar todos os pacientes que recebem Cloridrato de Tramadol + Paracetamol (substância ativa) em relação ao desenvolvimento destes comportamentos. Os riscos são maiores em pacientes com história pessoal ou familiar de abuso de substâncias (incluindo abuso ou dependência de drogas ou álcool) ou doença mental (por exemplo, depressão maior).
Cloridrato de Tramadol + Paracetamol (substância ativa) não deve ser administrado a pacientes dependentes de opioides.
O tramadol reinicia a dependência física em alguns pacientes previamente dependentes de outros opioides.
Uso com depressores do Sistema Nervoso Central (SNC), incluindo álcool
O uso concomitante de tramadol (princípio ativo de Cloridrato de Tramadol + Paracetamol (substância ativa)) com depressores do SNC, incluindo o álcool, pode causar efeitos aditivos aos depressores do SNC, incluindo sedação profunda e depressão respiratória. Cloridrato de Tramadol + Paracetamol (substância ativa) deve ser usado com cautela e em dose reduzida em pacientes recebendo depressores do SNC, ambos pelo menor tempo possível.
Risco aumentado de hepatotoxicidade com o uso de álcool
Alcoólatras crônicos podem estar sob risco aumentado de toxicidade hepática com o uso excessivo de paracetamol.
Uso com inibidores seletivos da recaptação da serotonina
Cloridrato de Tramadol + Paracetamol (substância ativa) deve ser usado com bastante cautela em pacientes sob tratamento com inibidores seletivos da recaptação da serotonina (ISRSs). O uso concomitante de tramadol com inibidores seletivos da recaptação da serotonina (ISRSs) aumenta o risco de eventos adversos, incluindo convulsões e síndrome serotoninérgica.
Depressão respiratória
Pacientes com depressão respiratória significativa ou asma brônquica grave ou aguda apresentam um risco aumentado de depressão respiratória com risco de vida, quando tratados com opioides. Cloridrato de Tramadol + Paracetamol (substância ativa) só deve ser utilizado nesta população de pacientes em um ambiente monitorado e com disponibilidade de equipamento de ressuscitação.
Cloridrato de Tramadol + Paracetamol (substância ativa) deve ser administrado com cautela em pacientes sob risco de depressão respiratória. Quando grandes doses de tramadol são administradas com medicamentos anestésicos ou álcool, pode ocorrer depressão respiratória e tais casos devem ser tratados como superdose. Se a naloxona for administrada, deve-se ter cautela, pois ela pode precipitar a ocorrência de convulsões.
Metabolismo ultrarrápido do tramadol pela CYP2D6
Os pacientes que são metabolizadores ultrarrápidos através da CYP2D6, podem converter o tramadol para o seu metabolito ativo (M1) de maneira mais rápida e completa do que outros pacientes. Esta rápida conversão pode resultar em níveis maiores que os esperados de M1 no soro, o que poderia levar a um aumento do risco de depressão respiratória.
Medicação alternativa, a redução da dose e / ou aumentando a monitorização frequente dos sinais de superdose por tramadol, tais como depressão respiratória, é recomendado em pacientes sabidamente metabolizadores ultrarrápidos por CYP2D6.
Aumento da pressão intracraniana ou traumatismo craniano
Cloridrato de Tramadol + Paracetamol (substância ativa) deve ser usado com cautela em pacientes com pressão intracraniana aumentada ou traumatismo craniano.
Alterações da pupila (miose) provocadas pelo tramadol podem mascarar a existência, extensão ou curso da patologia intracraniana. Um alto índice de suspeita de reação adversa deve ser observado ao avaliar o estado mental alterado destes pacientes se estiverem recebendo Cloridrato de Tramadol + Paracetamol (substância ativa).
A administração de Cloridrato de Tramadol + Paracetamol (substância ativa) pode complicar a avaliação clínica de pacientes com condições abdominais agudas.
Tratamento de abstinência
Sintomas de abstinência como ansiedade, sudorese, insônia, rigidez, dor, náusea, tremores, diarreia, sintomas do trato respiratório superior e piloereção podem ocorrer se Cloridrato de Tramadol + Paracetamol (substância ativa) for descontinuado de forma abrupta. ataque de pânico, ansiedade grave, alucinação, parestesia, tinido e sintomas do SNC não usuais foram também raramente relatados com a descontinuação abrupta do cloridrato de tramadol. A experiência clínica sugere que os sintomas de abstinência podem ser aliviados pela redução gradual da medicação.
Disfunção renal
O cloridrato de tramadol +paracetamol não foi estudado em pacientes com disfunção renal. A experiência com tramadol sugere que a disfunção renal resulta em decréscimo da taxa e da extensão de excreção do tramadol e seu metabólito ativo, M1. Em pacientes com depuração de creatinina menor que 30 mL/min, recomenda-se que o intervalo de administração de Cloridrato de Tramadol + Paracetamol (substância ativa) seja aumentado, não excedendo 2 comprimidos a cada 12 horas.
Disfunção hepática
O cloridrato de tramadol +paracetamol não foi estudado em pacientes com disfunção hepática e o seu uso não é recomendado em pacientes com disfunção hepática grave.
Reações cutâneas graves
Reações cutâneas graves, tais como pustulose exantematosa aguda generalizada, síndrome de StevensJohnson, e necrólise epidérmica tóxica, foram relatadas muito raramente em pacientes recebendo paracetamol. Os pacientes devem ser informados sobre os sinais de reações cutâneas graves e o uso do medicamento deve ser descontinuado no primeiro aparecimento de erupção cutânea ou de qualquer outro sinal de hipersensibilidade.
Hiponatremia
A hiponatremia foi relatada muito raramente com o uso de Cloridrato de Tramadol + Paracetamol (substância ativa), geralmente em pacientes com fatores de risco predisponentes, como pacientes idosos e / ou em pacientes em uso de medicações concomitantes que podem causar hiponatremia. Em alguns relatórios, a hiponatremia pareceu ser o resultado da síndrome de secreção de hormônio antidiurético inadequada (SIADH) e resolvida com a descontinuação de Cloridrato de Tramadol + Paracetamol (substância ativa) e do tratamento apropriado (por exemplo, restrição de fluidos). durante o tratamento com Cloridrato de Tramadol + Paracetamol (substância ativa), monitorização de sinais e sintomas da hiponatremia é recomendado para pacientes com fatores de risco predisponentes.
Uso em crianças
A segurança e a eficácia de Cloridrato de Tramadol + Paracetamol (substância ativa) não foram estudadas na população pediátrica.
Uso em pacientes fisicamente dependentes de opioides
Cloridrato de Tramadol + Paracetamol (substância ativa) não é recomendado para pacientes dependentes de opioides. pacientes que tomaram recentemente quantidades substanciais de opioides podem experimentar sintomas de abstinência. devido à dificuldade de avaliar a dependência em pacientes que receberam previamente quantidades substanciais de medicamentos opioides, Cloridrato de Tramadol + Paracetamol (substância ativa) deve ser administrado com cautela em tais pacientes.
Uso na gravidez (Categoria C), lactação e fertilidade
Gravidez
Foi demonstrado que tramadol atravessa a placenta.
Não existem estudos adequados e bem controlados em mulheres grávidas.
Não foi estabelecida a utilização segura durante a gravidez.
O uso prolongado de Cloridrato de Tramadol + Paracetamol (substância ativa) ou outros opioides durante a gravidez, pode levar à síndrome de abstinência neonatal. Este risco é particularmente aumentado durante o último trimestre da gravidez.
Lactação
Cloridrato de Tramadol + Paracetamol (substância ativa) não é recomendado para mães que estejam amamentando, pois a segurança em crianças e recém-nascidos não foi estudada.
Fertilidade
Não foi avaliado o efeito de tramadol ou a combinação tramadol/paracetamol na fertilidade humana.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Efeitos sobre a capacidade de dirigir e operar máquinas
Cloridrato de Tramadol + Paracetamol (substância ativa) pode afetar a habilidade mental ou física necessária para a realização de tarefas potencialmente perigosas como dirigir ou operar máquinas.
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Reações Adversas
Reações adversas ao medicamento em estudos clínicos
Como os estudos clínicos são conduzidos sob condições muito específicas, as taxas dos eventos adversos em estudos clínicos podem não refletir as taxas observadas na prática e não devem ser comparados com taxas de estudos clínicos de outros fármacos. As informações provenientes de estudos clínicos são úteis para identificar os eventos adversos relacionados ao medicamento e para aproximação das taxas.
O Cloridrato de Tramadol + Paracetamol (substância ativa) foi administrado em 1597 pacientes durante estudos duplo-cegos ou abertos em períodos longos para dor crônica não oncológica. Destes pacientes, 539 tinham 65 anos de idade ou mais. Os eventos adversos relatados com maior frequência foram no sistema nervoso central e gastrintestinal. Estes são efeitos comuns associados com outros fármacos com atividade agonista opioide.
Tabela 2. Eventos adversos relatados em pelo menos 2% dos indivíduos que receberam Cloridrato de Tramadol + Paracetamol (substância ativa) para dor crônicaa e com incidência maior que o placebo
| Sistema corpóreo | ||
|
Eventos Adversos | Cloridrato de Tramadol + Paracetamol (substância ativa) (N=481) | Placebo (N=479) |
| Corpo como um todo | ||
| Fadiga | 7 | 2 |
| Ondas de calor | 2 | 0 |
| Sintomas gripais | 3 | 1 |
| Distúrbios cardiovasculares | ||
| Hipertensão | 3 | 1 |
| Dor de cabeça | 15 | 10 |
| Tontura | 11 | 4 |
| Hipoestesia | 2 | 0 |
| Distúrbios do sistema gastrintestinal | ||
| Náusea | 18 | 5 |
| Constipação | 16 | 5 |
| Boca seca | 8 | 1 |
| Vômito | 5 | 1 |
| Dor abdominal | 5 | 4 |
| Diarreia | 5 | 3 |
| Distúrbios psiquiátricos | ||
| Sonolência | 14 | 2 |
| Insônia | 5 | 1 |
| Anorexia | 4 | 1 |
| Nervosismo | 2 | 0 |
| Distúrbios da pele e anexos | ||
| Prurido | 6 | 1 |
| Sudorese aumentada | 4 | 0 |
| Erupção cutânea | 3 | 1 |
aEm estudos controlados com placebo com duração de 3 meses.
Incidência de pelo menos 1% - Relação de causalidade pelo menos possível ou maior
A lista a seguir contem reações adversas que ocorreram com incidência de pelo menos 1% em estudos clínicos com uma população exposta ao tramadol/paracetamol de 2836 indivíduos em 18 estudos combinados para tratamento da dor aguda e crônica.
Corpo como um todo
Astenia, fadiga, ondas de calor.
Sistema nervoso central e periférico
Tontura, dor de cabeça, tremor.
Sistema gastrintestinal
Dor abdominal, constipação, diarreia, dispepsia, flatulência, boca seca, náusea, vômito.
Distúrbios psiquiátricos
Anorexia, ansiedade, confusão, euforia, insônia, nervosismo, sonolência.
Pele e anexos
Prurido, erupção cutânea, sudorese aumentada.
Entre estes, os eventos adversos mais comuns (5% dos indivíduos) foram náusea (14%), tontura (10%), sonolência (9%), constipação (8%), vômito (5%) e dor de cabeça (5%). Estes dados estão consistentes com os dados apresentados na Tabela 2.
Eventos adversos clinicamente relevantes que ocorreram com incidência menor que 1%
A lista a seguir contém eventos adversos clinicamente relevantes que ocorreram com incidência menor que 1% com tramadol/paracetamol em estudos clínicos.
Corpo como um todo
Dor no peito, rigidez, síncope, síndrome de abstinência, reação alérgica.
Distúrbios cardiovasculares
Hipertensão, agravamento da hipertensão, hipotensão, edema dependente.
Sistema nervoso central e periférico
Ataxia, convulsões, hipertonia, enxaqueca, agravamento da enxaqueca, contração involuntária dos músculos, parestesia, estupor, vertigem.
Sistema gastrintestinal
Disfagia, melena, edema de língua.
Distúrbios auditivos e vestibulares
Zumbido.
Distúrbios do ritmo e batimentos cardíacos
Arritmia, palpitação, taquicardia.
Distúrbios do sistema hepático e biliar
Função hepática anormal, aumento da TGP (ALT), aumento da TGO (AST).
Distúrbios do metabolismo e nutricionais
Perda de peso, hipoglicemia, aumento da fosfatase alcalina, aumento de peso.
Distúrbios musculoesqueléticos
Artralgia.
Distúrbios plaquetários, hemorrágicos e da coagulação
Aumento do tempo de coagulação, púrpura.
Distúrbios psiquiátricos
Amnésia, despersonalização, depressão, abuso de drogas, labilidade emocional, alucinação, impotência, pesadelos, pensamento anormal.
Distúrbios das células vermelhas sanguíneas
Anemia.
Sistema respiratório
Dispneia, broncoespasmo.
Distúrbios da pele e anexos
Dermatite, erupção cutânea eritematosa.
Sistema urinário
Albuminúria, distúrbios da micção, oliguria, retenção urinária.
Distúrbios da visão
Visão anormal.
Distúrbios das células brancas e sistema retículo-endotelial:
Granulocitopenia e leucocitose.
Outros eventos adversos clinicamente significativos relatados previamente em estudos clínicos ou em relatos pós-comercialização com cloridrato de tramadol
Outros eventos adversos que foram relatados durante o tratamento com medicamentos a base de tramadol e cuja relação de causalidade não foram bem determinadas incluem
Vasodilatação, hipotensão ortostática, isquemia do miocárdio, edema pulmonar, reações alérgicas (incluindo anafilaxia, urticária, síndrome de Stevens-Johnson/síndrome da necrólise epidérmica tóxica), disfunção cognitiva, dificuldade de concentração, depressão, tendência suicida, hepatite, insuficiência hepática e sangramento gastrintestinal. Relatos de anormalidades em exames laboratoriais incluiram elevação nos testes de creatinina e função hepática. Síndrome serotoninérgica (cujos sintomas podem incluir alteração da situação mental, hiperreflexia, febre, calafrios, tremor, agitação, diaforese, convulsões, coma) foi relatada quando o tramadol foi utilizado concomitantemente com outros agentes serotoninérgicos como inibidores seletivos de recaptação da serotonina e inibidores da MAO. A experiência pós-comercialização com o uso de produtos que contenham tramadol incluiu raros relatos de“delirium”, miose, midríase, transtornos da fala e, muito raramente, relatos de transtorno de movimento. A vigilância pós-comercialização revelou raras alterações do efeito da varfarina, incluindo elevação dos tempos de protrombina. Foram relatados muito raramento casos de hipoglicemia em pacientes fazendo uso de tramadol. A maoria dos relatos foi em pacientes com fatores de risco de pré-disposição, incluindo diabetes ou insuficiência renal, ou em pacientes idosos. Casos de hiponatremia e / ou SIADH foram notificados muito raramente em doentes que tomaram tramadol, geralmente em pacientes com fatores de risco predisponentes, tais como os idosos ou aqueles que utilizaram medicações concomitantes e que podem causarhiponatremia.
Outros eventos adversos clinicamente significativos previamente relatados em estudos clínicos ou relatos pós-comercialização com paracetamol
Reações alérgicas (erupção cutânea primária) ou relatos de hipersensibilidade secundária ao paracetamol foram raros e geralmente controlados pela descontinuação do medicamento e, quando necessário, tratamento sintomático. Houve vários relatos que sugerem que o paracetamol pode produzir hipoprotrombinemia quando administrado com compostos com ação semelhante à varfarina. Em outros estudos, o tempo da protrombina não foi alterado.
Foi verificado através do “Netherlands Pharmacovigilance Center Lareb”, consulta ao banco de dados do CNMM – Centro Nacional de Monitorização de Medicamentos e Micromedex (Drugdex Evaluation), que há registro da reação adversa rubor associada ao uso da substância tramadol.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em http://www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.
Composição
Daisan
cloridrato de tramadol e paracetamol
MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO REFERÊNCIA.
Apresentações
Comprimido revestido de 37,5 MG + 325 MG: embalagens com 10 e 20 comprimidos.
USO ORAL / USO ADULTO
Composicão
Cada comprimido revestido de cloridrato de tramadol + paracetamol contém:
- cloridrato de tramadol - 37,5 mg
- paracetamol - 325 mg
- Excipientes: copovidona, amido, estearato de magnésio, álcool polivinílico, macrogol, talco, dióxido de titânio, corante óxido de ferro amarelo, ácido esteárico, crospovidona e povidona.
Superdosagem
Sintomas
Os sintomas iniciais de uma dose excessiva de tramadol incluem depressão respiratória (dificuldade para respirar) e/ou convulsões e do paracetamol, observados dentro das primeiras 24 horas, incluem: anorexia, náusea, vômito, malestar, palidez e diaforese.
O tramadol: Ao tratar uma dose excessiva de Daisan, a atenção principal deve ser para a manutenção de ventilação adequada e tratamento de suporte. Ao mesmo tempo em que a naloxona reverte alguns, mas não todos os sintomas de superdose de Daisan, o risco de convulsões também é aumentado pela administração de naloxona. Com base na experiência com tramadol, a hemodiálise não será útil, pois ela remove menos de 7% da dose administrada em um período de 4 horas de diálise.
O paracetamol: Na superdose de paracetamol, o evento adverso mais grave é a necrose hepática potencialmente fatal e dependente da dose, podendo ocorrer também, necrose tubular renal, coma hipoglicêmico e trombocitopenia.
Os sintomas iniciais de uma superdose potencialmente hepatotóxica podem incluir náusea, vômito, diaforese e mal estar geral. Evidência clínica e laboratorial de toxicidade hepática pode não ser aparente antes de 48 a 72 horas após a ingestão.
Em adultos, raramente foi relatada toxicidade hepática com doses agudas de menos de 7,5 a 10 g ou fatalidades com menos de 15 g.
A experiência clínica sugere que as crianças são menos susceptíveis ao dano hepático que os adultos; no entanto, a dose mínima tóxica deve ser considerada como 150 mg/kg.
Tratamento
O tratamento imediato inclui suporte da função cardiorespiratória e medidas para reduzir a absorção do medicamento. Vômito pode ser induzido mecanicamente ou com xarope de ipeca, se o paciente estiver alerta, seguido pela administração de carvão ativado (1g/kg) após o esvaziamento gástrico. A primeira dose deve ser acompanhada de um catártico adequado. Se doses repetidas forem necessárias, o catártico deve ser incluído em doses alternadas. A hipotensão é, em geral, hipovolêmica e deve responder à administração de fluidos. Vasopressores e outras medidas de suporte devem ser empregados conforme necessário. Em pacientes inconscientes, um tubo endotraqueal deve ser inserido antes da lavagem gástrica e, quando necessário, para fornecer respiração assistida.
Atenção meticulosa deve ser dada à manutenção de ventilação pulmonar. Se ocorrer hipoprotrombinemia devido à dose excessiva de paracetamol, deve-se administrar vitamina K por via intravenosa.
Em adultos e adolescentes, independente da quantidade de paracetamol ingerida, administrar acetilcisteína imediatamente se a ingestão ocorreu há 24 horas ou menos.
Não esperar o resultado do nível plasmático de paracetamol antes de iniciar o tratamento com acetilcisteína. A determinação do nível plasmático de paracetamol deve ser realizada o mais breve possível, mas não antes de 4 horas após a ingestão. Os estudos da função hepática devem ser obtidos inicialmente e repetidos a intervalos de 24 horas.
Em crianças, a quantidade máxima ingerida pode ser mais facilmente estimada. Se mais de 150 mg/kg ou quantidade desconhecida forem ingeridas, o nível plasmático de paracetamol deve ser determinado o quanto antes, mas não antes de 4 horas após a ingestão.
A acetilcisteína deve ser iniciada e continuada por um curso completo de tratamento se não for possível determinar o nível de paracetamol e a ingestão exceder 150 mg/kg e sempre que os níveis plasmáticos indicarem a necessidade.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Uso com inibidores da MAO
O uso concomitante de Cloridrato de Tramadol + Paracetamol (substância ativa) com inibidores da MAO, ou dentro de 14 dias após sua descontinuação, é contraindicado devido ao risco aumentado de convulsões e síndrome serotoninérgica.
Uso com inibidores seletivos da recaptação da serotonina
O uso concomitante de tramadol com ISRSs aumenta o risco de eventos adversos, incluindo convulsões e síndrome serotoninérgica. Deve-se ter cautela quando administrar Cloridrato de Tramadol + Paracetamol (substância ativa) a pacientes utilizando ISRSs e monitorar os sinais de eventos adversos.
Depressores do Sistema Nervoso Central (SNC), incluindo álcool
O uso concomitante de tramadol com depressores do sistema nervoso central, como benzodiazepinas e outros sedativos/hipnóticos, agentes anestésicos, fenotiazinas, tranquilizantes, opioides ou álcool, pode produzir efeitos depressivos aditivos no SNC, tais como sedação profunda e depressão respiratória. Se o uso concomitante de Cloridrato de Tramadol + Paracetamol (substância ativa) com um depressor do SNC for clinicamente necessário, prescrever as menores doses eficazes com duração mínima para ambos os medicamentos, e acompanhar rigorosamente os pacientes quanto a sinais de depressão respiratória.
Uso com carbamazepina
A administração concomitante de Cloridrato de Tramadol + Paracetamol (substância ativa) e carbamazepina causa um aumento significativo no metabolismo de tramadol. Pacientes tomando carbamazepina podem ter redução significativa do efeito analgésico do tramadol.
Uso com quinidina
O tramadol é metabolizado para M1 pela isoenzima CYP2D6. A administração concomitante de quinidina e tramadol resulta em concentrações aumentadas de tramadol e reduzidas de M1. As consequências clínicas destes achados são desconhecidas. Estudos de interação medicamentosa “in vitro” em microssomas hepáticos humanos indicam que o tramadol não tem efeito sobre o metabolismo da quinidina.
De acordo com os relatórios de farmacovigilância, os relatos de toxicidade da digoxina são raros.
Uso com compostos do tipo varfarina
Existem vários relatos que sugerem que o paracetamol pode produzir hipoprotrombinemia discreta quando administrado com varfarina. Os dados de farmacovigilância revelaram alterações raras do efeito da varfarina, incluindo elevação dos tempos de protrombina. Embora tais alterações tenham significância clínica limitada, a avaliação periódica do tempo de protrombina deve ser realizada quando Cloridrato de Tramadol + Paracetamol (substância ativa) e estes agentes são administrados concomitantemente, devido aos relatos de aumento de RNI (Relação Normalizada Internacional) em alguns pacientes.
Uso com anticonvulsivantes
Alguns relatos sugerem que os pacientes tomando anticonvulsivantes a longo prazo que excedem a dose de paracetamol podem estar sob risco aumentado de hepatotoxicidade devido ao metabolismo acelerado do paracetamol.
Uso com diflunisal e paracetamol
A administração concomitante de diflunisal e paracetamol produz aumento de 50% nos níveis plasmáticos de paracetamol em voluntários normais. Cloridrato de Tramadol + Paracetamol (substância ativa) deve ser usado com cautela e os pacientes monitorados cuidadosamente.
Uso com inibidores da CYP2D6
Os estudos de interação medicamentosa “in vitro” em microssomas hepáticos humanos indicam que a administração concomitante de Cloridrato de Tramadol + Paracetamol (substância ativa) com inibidores da CYP2D6, como fluoxetina, paroxetina e amitriptilina pode resultar em alguma inibição do metabolismo do tramadol.
Uso com cimetidina
A administração concomitante de Cloridrato de Tramadol + Paracetamol (substância ativa) e cimetidina não foi estudada.
A administração de tramadol e cimetidina não resulta em alterações clinicamente significativas na farmacocinética do tramadol.
Interação Alimentícia
A administração de Cloridrato de Tramadol + Paracetamol (substância ativa) com alimentos não afeta de forma significativa a sua taxa ou extensão de absorção.
Ação da Substância
Resultados de Eficácia
Estudos de dose única
Em estudos duplo-cegos controlados por placebo e ativo, de grupos paralelos, de dose única e com desenho fatorial, dois comprimidos de Cloridrato de Tramadol + Paracetamol (substância ativa) administrados em pacientes com dor após procedimentos cirúrgicos orais proporcionaram melhor alívio do que o placebo ou até mesmo que uma mesma dose dos componentes ativos isolados. O início do alívio da dor após a administração de Cloridrato de Tramadol + Paracetamol (substância ativa) foi mais rápido que o tramadol isolado. O início da analgesia ocorreu em menos de uma hora. A duração do alívio da dor após administração de Cloridrato de Tramadol + Paracetamol (substância ativa) foi maior que a do paracetamol isolado. A analgesia foi, em geral, comparável ao ibuprofeno, o comparador. Em outro estudo de dose única em indivíduos com dor houve uma dose-resposta estatisticamente significativa para o alívio da dor proveniente de procedimentos cirúrgicos orais em relação ao placebo; 37,5 mg de cloridrato de tramadol/325 mg de paracetamol; e 75 mg de cloridrato de tramadol/650 mg de paracetamol.
Estudos para o tratamento de dor aguda
O estudo CAPSS-105 avaliou a segurança e eficácia de Cloridrato de Tramadol + Paracetamol (substância ativa) no tratamento de crises dolorosas de osteoartrite no joelho e quadril. Todos os 308 indivíduos randomizados foram incluídos na população a ser tratada (intenção de tratamento) e na população a ser avaliada quanto à segurança. Desses indivíduos, 197 foram randomizados com Cloridrato de Tramadol + Paracetamol (substância ativa) (102 com 37,5 mg de cloridrato de tramadol/325 mg de paracetamol; 95 com 75 mg de cloridrato de tramadol/ 650 mg de paracetamol para a dose inicial) e 111 foram randomizados com placebo. Os grupos de tratamento foram semelhantes em relação às características demográficas, como sexo e idade. A maioria dos indivíduos teve o joelho designado como articulação alvo do estudo (77,9%). Após uma dose inicial, os indivíduos receberam 1 a 2 comprimidos de 37,5 mg de cloridrato de tramadol/325 mg de paracetamol ou placebo correspondente a cada 4 a 6 horas, conforme necessário. Em geral, o Cloridrato de Tramadol + Paracetamol (substância ativa) foi mais efetivo que o placebo em ajudar os indivíduos em gerenciar as crises dolorosas de osteoartrite. Durante os Dias 1 ao 5, o Cloridrato de Tramadol + Paracetamol (substância ativa) foi significativamente mais efetivo que o placebo em diminuir a média diária do Escore de Intensidade da Dor (p<0,001) e em aumentar a média diária do Escore para Alívio da Dor (p<0,001).
O estudo CAPSS-115 comparou o Cloridrato de Tramadol + Paracetamol (substância ativa) e paracetamol/codeína em indivíduos com dor pós-cirúrgica (ortopédica ou abdominal). De 306 indivíduos randomizados, 98 foram randomizados com Cloridrato de Tramadol + Paracetamol (substância ativa), 99 com placebo e 109 com paracetamol com fosfato de codeína (30 mg). Não houve diferenças clinicamente significativas entre os três grupos de tratamento para qualquer característica demográfica ou de linha de base. O Cloridrato de Tramadol + Paracetamol (substância ativa) foi estatisticamente superior ao placebo para todas as três variáveis primárias, ou seja, TOTPAR (alívio total da dor) (p=0,004), SPID (soma da diferença da intensidade da dor) (p=0,015) e SPRID (soma do total de alívio da dor e soma das diferenças da intensidade da dor) (p=0,005).
Estudos de tratamento de dor crônica
Os comprimidos de Cloridrato de tramadol 37,5mg + Paracetamol 325 mg foram avaliados em três estudos controlados por placebo, em 960 pacientes com osteoartrite do quadril e joelho, e dor lombar.
Cada estudo controlado por placebo iniciou com um período de titulação de dose de aproximadamente 10 dias, seguidos por uma fase de manutenção com doses de 1 a 2 comprimidos (37,5 mg de tramadol/325 mg de paracetamol para 75 mg de tramadol/650 mg de paracetamol) a cada 4 a 6 horas, não excedendo o máximo de 8 comprimidos ao dia. Todos os três estudos tiveram uma duração de tratamento de 90 dias. A dose diária média de Cloridrato de Tramadol + Paracetamol (substância ativa) para os estudos controlados variou de 4,1 para 4,2 comprimidos.
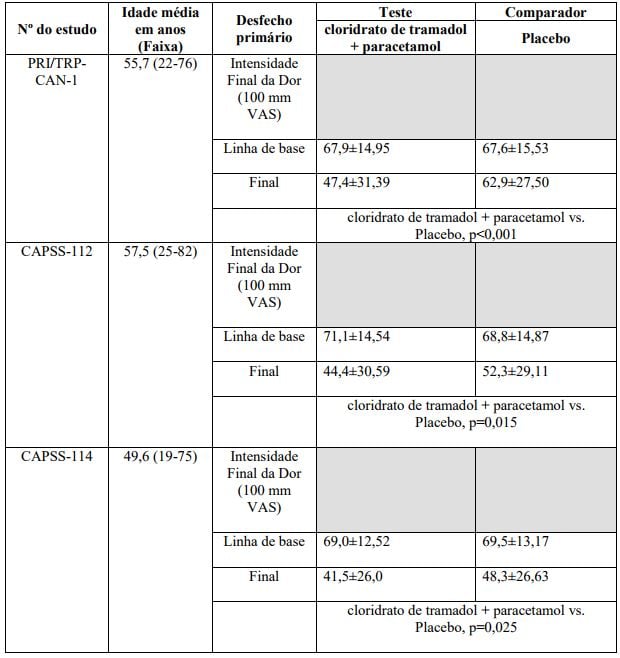
Dores de osteoartrite (CAPSS-114) e dor lombar (TRP-CAN-1 e CAPSS-112)
Todos os três estudos tiveram a intensidade final da dor medida pela Escala Visual Analógica da Dor (100 mm) (VAS) como desfecho primário (veja Tabela 1 a seguir).
CAPSS-114
O estudo CAPSS-114 incluiu 306 indivíduos que tiveram osteoartrite sintomática durante pelo menos 1 ano e continuaram a ter ao menos dor moderada devido à osteoartrite (? 50/100 mm na VAS) apesar do tratamento com doses estabelecidas de celecoxibe (? 200 mg/dia) ou rofecoxibe (25 mg/dia) por pelo menos 2 semanas. Nenhuma outra medicação para dor ou outro tratamento que não fosse o medicamento estudado e os inibidores seletivos da COX-2 foram permitidos durante o andamento do estudo. Os indivíduos tratados com Cloridrato de Tramadol + Paracetamol (substância ativa) receberam uma média de 155 mg de tramadol/1346 mg de paracetamol durante o período de estudo.
CAPSS-112 e TRP-CAN-1
Nos estudos CAPSS-112 e TRP-CAN-1 foram incluídos 654 pacientes com dor lombar crônica que foi suficientemente grave para requerer medicação diariamente nos três meses anteriores e ao menos dor moderada (40/100 mm) na VAS. A média diária de doses de Cloridrato de Tramadol + Paracetamol (substância ativa) para CAPSS-112 e TRP-CAN-1 foi 159 mg de tramadol/1391 mg de paracetamol e 158 mg de tramadol/1369 mg de paracetamol, respectivamente.
Tabela 1: Intensidade final da dor medida pela Escala Visual Analógica (100 mm), estudos de longa duração de dor de osteoartrite (CAPSS-114), dor lombar (TRP-CAN-1 e CAPSS-112)
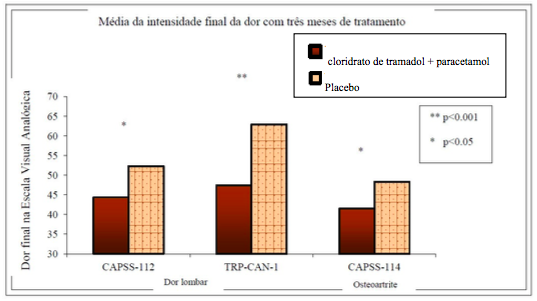
A média dos Escores de Intensidade Final da Dor com três meses de tratamento estão apresentadas na Figura 1 a seguir.
Figura 1: Média da intensidade final da dor com três meses de tratamento vs. Dor final na Escala Visual Analógica
Características Farmacológicas
Grupo farmacoterapêutico: analgésicos, opioides em combinação com analgésicos não-opioides.
Código ATC: N02AJ13.
Propriedades Farmacodinâmicas
O tramadol é um analgésico sintético de ação central. Embora o seu modo de ação não seja totalmente conhecido, a partir de testes em animais pelo menos dois mecanismos complementares parecem aplicáveis: ligação do fármaco e do metabólito M1 aos receptores de ?-opioide e inibição fraca da recaptação da norepinefrina e da serotonina.
O paracetamol é outro analgésico de ação central. Embora o sítio e os mecanismos de ação exatos não estejam claramente definidos, parece que o paracetamol produz analgesia através da elevação do limiar da dor. O mecanismo potencial pode envolver inibição da via do óxido nítrico mediada por uma variedade de receptores de neurotransmissores incluindo N-metil-D-aspartato e Substância P.
Quando avaliada em modelo animal padrão, a combinação de tramadol e paracetamol exibiu um efeito sinérgico. Isto é, quando tramadol e paracetamol são administrados em conjunto, uma quantidade significativamente menor de cada fármaco foi necessária para produzir um determinado efeito analgésico que seria esperado se seus efeitos fossem meramente aditivos. O tramadol atinge atividade de pico em 2 a 3 horas com um efeito analgésico prolongado, de forma que a sua combinação com paracetamol, um agente analgésico de início de ação rápido e de curta duração, fornece benefício substancial aos pacientes em relação aos componentes isolados.
Propriedades Farmacocinéticas
O tramadol é administrado sob a forma de racemato e tanto a forma (-) como a (+) do tramadol e do metabólito M1 são detectadas na circulação. Embora o tramadol seja absorvido rapidamente após a administração, a sua absorção é mais lenta (e a meia-vida mais longa) quando comparado ao paracetamol.
Após dose oral única da combinação de tramadol e paracetamol (37,5 mg/325,0 mg), concentrações plasmáticas de pico de 64,3 ng/mL / 55,5 ng/mL de (+) tramadol/(-) tramadol e 4,2 mcg/mL de paracetamol são alcançadas após 1,8 horas e 0,9 hora respectivamente. As meias-vidas de eliminação (t½) são 5,1 h / 4,7 h para (+) tramadol / (-) tramadol e 2,5 horas para o paracetamol.
Estudos farmacocinéticos de dose única e múltipla realizados com Cloridrato de Tramadol + Paracetamol (substância ativa) em voluntários não mostraram interações medicamentosas significativas entre tramadol e paracetamol.
Absorção
O cloridrato de tramadol apresenta biodisponibilidade absoluta média de aproximadamente 75% após a administração de uma única dose oral de tramadol comprimido de 100 mg. A concentração plasmática máxima média de tramadol racêmico e M1 após administração de dois comprimidos de Cloridrato de Tramadol + Paracetamol (substância ativa) ocorre aproximadamente duas e três horas, respectivamente, após a dose em adultos saudáveis.
A absorção oral de paracetamol após a administração de Cloridrato de Tramadol + Paracetamol (substância ativa) é rápida e quase completa e ocorre, principalmente, no intestino delgado. O pico de concentração plasmática do paracetamol ocorre dentro de 1 hora e não é afetado pela coadministração com tramadol.
Efeito da alimentação
A administração oral de Cloridrato de Tramadol + Paracetamol (substância ativa) com alimentos não afeta de forma significativa a concentração plasmática máxima ou a extensão de absorção de tramadol ou paracetamol, de modo que Cloridrato de Tramadol + Paracetamol (substância ativa) pode ser tomado independentemente das refeições.
Distribuição
Após dose intravenosa de 100 mg, o volume de distribuição de tramadol foi 2,6 e 2,9 L/kg em homens e mulheres, respectivamente. A ligação de tramadol às proteínas plasmáticas é aproximadamente 20% e a ligação parece ser independente da concentração até 10 mcg/mL. A saturação da ligação à proteína plasmática ocorre apenas em concentração fora da faixa clinicamente relevante. O paracetamol parece ser amplamente distribuído para a maioria dos tecidos, exceto para a gordura. O seu volume de distribuição aparente é 0,9 L/kg. Uma porção relativamente pequena (~20%) do paracetamol liga-se às proteínas plasmáticas e não ocorre ligação aos glóbulos vermelhos.
Metabolismo
Os perfis de concentração plasmática de tramadol e seu metabólito M1 medidos após a administração de Cloridrato de Tramadol + Paracetamol (substância ativa) em voluntários, não mostraram alteração significativa comparado à administração de tramadol isolado. Aproximadamente 30% da dose é excretada na urina como fármaco inalterado, enquanto que 60% da dose é excretada como metabólitos. As principais vias metabólicas parecem ser a N- e a O-desmetilação e a glicuronidação ou sulfatação no fígado. O tramadol é extensivamente metabolizado por diversas vias, incluindo a CYP2D6 e CYP3A4, assim como por conjugação do fármaco “mãe” e dos metabólitos. Os pacientes que são metabolizadores ultrarrápidos através da CYP2D6 podem converter tramadol no seu metabolito ativo (M1) de maneira mais rápida e completa do que outros pacientes. A prevalência deste genótipo CYP2D6 varia de acordo com a população e tem sido relatados na literatura de 1% a 10% em afro-americanos, americanos caucasianos, asiáticos e europeus (incluindo estudos específicos em gregos, húngaros e europeus do norte) para cifras tão altas quanto 29% em Africanos / etíopes.
Aproximadamente 7% da população tem atividade reduzida da isoenzima CYP2D6 do citocromo P450 e são considerados “metabolizadores pobres” de debrisoquina, dextrometorfano, antidepressivos tricíclicos, entre outros medicamentos. Após uma dose oral única de tramadol, as concentrações de tramadol foram apenas ligeiramente maiores em “metabolizadores pobres” em relação aos “metabolizadores extensivos”, enquanto que as concentrações de M1 foram menores.
O paracetamol é metabolizado principalmente no fígado pela cinética de primeira ordem e envolve 3 vias principais separadas:
- Conjugação com glicuronídeo;
- Conjugação com sulfato e;
- Oxidação via citocromo.
P450-dependente, via enzima oxidase de função mista para formar um metabólito intermediário reativo, o qual se conjuga com glutationa e é metabolizado para formar cisteína e conjugados do ácido mercaptúrico. A principal isoenzima do citocromo P450 envolvida parece ser a CYP2E1, com vias adicionais da CYP1A2 e CYP3A4.
Em adultos, a maior parte do paracetamol é conjugada com ácido glicurônico e, em menor extensão, com sulfato. Estes metabólitos derivados de glicuronídeo, sulfato e glutationa não têm atividade biológica. Em bebês prematuros, recém-nascidos e crianças pequenas, o conjugado de sulfato predomina.
Excreção
O tramadol e seus metabólitos são eliminados principalmente pelo rim. As meias-vidas de eliminação do tramadol e de M1 são aproximadamente 6 e 7 horas, respectivamente. A meia-vida de eliminação plasmática do tramadol aumentou de aproximadamente 6 para 7 horas com doses múltiplas.
A meia-vida do paracetamol é cerca de 2 a 3 horas em adultos, sendo um pouco mais curta em crianças e um pouco mais longa em recém-nascidos e pacientes cirróticos. O paracetamol é eliminado principalmente pela formação de conjugados de glicuronídeo e sulfato de maneira dose-dependente. Menos de 9% do paracetamol é excretado inalterado na urina.
Cuidados de Armazenamento
Conservar em temperatura ambiente (entre 15 e 30°C). Proteger da luz e umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
Comprimido revestido oblongo de cor amarela.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Reg. MS.: Farm. Resp.:
Fabricado por:
Registrado por:
Servico de Atendimento ao Consumidor (SAC)
www.daiichisankyo.com.br
1.0454.0183
Eduardo Mascari Tozzi CRF – SP N° 38.995
Aché Laboratórios Farmacêuticos S.A. Via Dutra, km 222,2 Guarulhos - SP CNPJ 60.659.463/0001-91
Indústria Brasileira
DAIICHI SANKYO BRASIL FARMACÊUTICA LTDA. Alameda Xingu, 766 Alphaville – Barueri – SP
CNPJ no 60.874.187/0001-84
Indústria Brasileira
08000 556596
Número de lote, data de fabricação e prazo de validade: vide cartucho.
VENDA SOB PRESCRIÇÃO MÉDICA.
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA.