Comparamos o preço de Dexilant - 30 Mg 60 Cápsulas De Liberação Retardada, veja o menor preço

R$ 201,68
RReferência
16
ofertasMelhores preços a partir de R$ 201,68 até R$ 252,10
Menor preço
vendido por Farmácia Indiana
economize
20.00%
R$ 201,68
vendido por Drogarias Pacheco
economize
19.48%
R$ 203,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Drogaria Araújo
economize
17.50%
R$ 207,99
vendido por Farmácia Preço Popular
economize
15.14%
R$ 213,92
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogaria Nova Esperança
economize
11.96%
R$ 221,96
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
vendido por Drogaria São Paulo
economize
11.31%
R$ 223,59
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Drogaria Vera Cruz
economize
11.00%
R$ 224,37
Entregas para todo o Brasil. Clique e confira!
vendido por Drogaria Soares
economize
10.00%
R$ 226,89
Enviamos para todo o Brasil. Clique e confira!
vendido por Pague Menos
economize
9.96%
R$ 226,99
vendido por Drogaria Primus
economize
7.62%
R$ 232,88
vendido por Drogão Net
economize
6.93%
R$ 234,62
vendido por Farmácia Online Farmagora
economize
6.83%
R$ 234,89
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Drogaria Catarinense
economize
6.83%
R$ 234,89
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Super Droga 10
economize
5.00%
R$ 239,50
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Promofarma
economize
3.23%
R$ 243,95
vendido por Farmanita Drogaria
R$ 252,10
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Este medicamento é indicado, em adultos, para:
- Cicatrização de lesão no esôfago causada por esofagite erosiva (EE) (8 semanas de tratamento);
- Manter a cicatrização da EE e alívio da azia;
- Tratamento da azia relacionada à doença de refluxo gastroesofágico (DRGE) por até 4 semanas.
A DRGE ocorre quando o ácido do estômago entra no esôfago, tubo que conecta a boca ao estômago. Isto pode causar uma sensação de queimação no peito ou na garganta, gosto azedo ou arrotos.
Em alguns casos, o ácido pode danificar o revestimento do esôfago. Este dano é chamado esofagite erosiva ou EE. Dexilant pode ajudar nos sintomas relacionados à acidez, mas você ainda pode ter problemas graves de estômago. Converse com seu médico.
Não se sabe se Dexilant é seguro e eficaz em crianças menores de 18 anos de idade.
Como Dexilant funciona?
Dexilant é um medicamento sob prescrição médica chamado de inibidor de bomba de próton (IBP). Dexilant reduz a quantidade de ácido no estômago.
Contraindicação
Não tome Dexilant se você for alérgico ao dexlansoprazol ou a qualquer de seus componentes.
Como usar
Dexilant está disponível para uso adulto nas concentrações de 30 mg e 60 mg.
Posologia e ajuste de dose recomendados
Tabela 1: Posologia recomendada para Dexilant
|
Indicação | Dose recomendada |
Frequência |
|
Cicatrização da esofagite erosiva | 60 mg |
Uma vez ao dia por 8 semanas |
|
Manutenção da cicatrização da esofagite | 30 mg ou 60 mg* |
Uma vez ao dia |
|
Doença do refluxo gastroesofágico | 30 mg |
Uma vez ao dia por até 4 semanas |
* Uma dose de manutenção de 60 mg pode ser administrada a pacientes com esofagite erosiva moderada ou grave.
Insuficiência hepática
Se você apresentar algum problema de fígado, o médico poderá prescrever uma dose diária de 30 mg Dexilant.
- Tome Dexilant exatamente como prescrito pelo seu médico.
- Não altere a dose nem pare de tomar Dexilant sem primeiro falar com seu médico.
- Você pode tomar Dexilant com ou sem alimentos.
- Pode engolir as cápsulas inteiras de Dexilant.
- Se tiver dificuldade para engolir as cápsulas de Dexilant, você pode abrir as cápsulas e adicionar o seu conteúdo a uma colher de sopa de alimento pastoso. Certifique-se de engolir a mistura imediatamente. Não mastigue a mistura e não a armazene para uso posterior.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser mastigado.
O que devo fazer quando eu me esquecer de usar Dexilant?
A dose esquecida deve ser tomada tão logo seja lembrada. No entanto, se estiver muito perto da administração da próxima dose, não a tome; tome somente a dose seguinte e continue com o esquema posológico regular. Não tome uma dose dupla para compensar a dose esquecida e não exceda a dose recomendada para cada dia.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico ou cirurgião-dentista.
Precauções
Antes de tomar Dexilant, informe o seu médico se você:
- Tem osteoporose.
- Tem ou teve baixos níveis de magnésio no sangue.
- Tem problemas de fígado.
- Tem quaisquer outras condições médicas.
- Estiver grávida ou planejar engravidar. Não se sabe se Dexilant vai fazer mal ao feto.
- Estiver amamentando ou planejar amamentar. Você e seu médico devem decidir se você vai tomar Dexilant ou amamentar.
Diarreia
Dexilant pode aumentar o risco de acometimento por diarreia severa. A diarreia pode ser causada por uma infecção, pela bactéria Clostridium difficile em seu trato gastrointestinal.
Fraturas ósseas
Pessoas que estejam tomando múltiplas doses diárias de medicamentos inibidores de bomba de prótons por período prolongado podem apresentar um risco aumentado de fraturas de quadril, pulso ou coluna vertebral.
Câncer gástrico
A resposta sintomática ao Dexilant não exclui a presença de malignidade gástrica.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interações Medicamentosas
Informe seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos e não prescritos, vitaminas e medicamentos à base de plantas.
Dexilant pode afetar a forma como outros medicamentos funcionam, e outros medicamentos podem afetar a forma como Dexilant funciona.
Informe ao seu médico especialmente se você toma:
- Ampicilina sódica ou ampicilina tri-hidratada;
- Atazanavir;
- Nelfinavir;
- Digoxina;
- Produto que contenha ferro;
- Cetoconazol;
- Varfarina;
- Tacrolimo;
- Metotrexato;
- Inibidores de HIV protease.
Interações com alimentos
Não existem restrições quanto à ingestão de Dexilant com alimentos.
Influência na absorção de Vitamina B12
O tratamento diário com qualquer medicação ácido-supressora, como Dexilant, por períodos prolongados (vários anos) pode levar a uma má absorção da vitamina B12.
A deficiência dessa vitamina dever ser considerada em pacientes que requeiram tratamentos de longo prazo, pacientes com reservas corporais reduzidas ou fatores de risco para a absorção reduzida de vitamina B12 (tais como idosos) em terapias de longo prazo ou se outros sintomas clínicos relevantes forem observados.
Interferência com exames laboratoriais:
Níveis de cromogranina A aumentados podem interferir com as investigações de tumores neuroendócrinos. Para evitar essa interferência, o tratamento com Dexilant deve ser interrompido 14 dias antes do doseamento de CgA.
Informe ao seu médico ou cirurgião dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
As reações adversas mais comuns incluem: diarreia, dor abdominal, náusea, resfriado, vômito e flatulência.
Outras reações adversas
Reações alérgicas graves: informe o seu médico se você apresentar algum dos seguintes sintomas com Dexilant:
- Erupção cutânea (brotoeja);
- Inchaço da face;
- Aperto na garganta;
- Dificuldade em respirar.
Outras reações adversas que foram relatadas em estudos controlados numa incidência menor que 2% estão listadas abaixo por sistema corporal:
|
Distúrbios do sangue e do sistema |
Anemia, aumento de linfonodos (linfoadenopatia). |
|
Distúrbios cardíacos |
Dor no peito (angina), arritmia, baixa frequência cardíaca |
|
Distúrbios do ouvido e labirinto |
Dor no ouvido (otalgia), zumbido, tontura (vertigem). |
|
Distúrbios endócrinos |
Papo (bócio). |
|
Distúrbios oculares |
Irritação dos olhos , inchaço dos olhos. |
|
Distúrbios gastrintestinais |
Desconforto abdominal, hipersensibilidade ao toque |
|
Distúrbios gerais e condições do |
Reação adversa à droga, diminuição da força física (astenia), |
|
Distúrbios hepatobiliares |
Cólica biliar, pedra na vesícula (colelitíase), aumento do |
|
Distúrbios do sistema imunológico |
Alergia (hipersensibilidade). |
|
Infecções e infestações |
Candidíase, gripe (influenza), nasofaringite, herpes oral, |
|
Lesão, envenenamento e |
Quedas, fraturas, perda de alinhamento momentâneo das |
|
Exames laboratoriais |
Aumento da fosfatase alcalina, aumento da alanina aminotransferase (ALT), aumento da aspartato aminotransferase (AST) aumento/redução dos níveis de bilirrubina, aumento dos níveis séricos de creatinina, aumento da gastrinemia, aumento de potássio, aumento da glicemia, |
|
Distúrbios metabólicos e |
Alterações do apetite, nível de cálcio elevado no sangue |
|
Distúrbios musculoesqueléticos e |
Dor nas articulações (artralgia), inflamação das articulações |
|
Distúrbios do sistema nervoso |
Alteração do paladar, convulsão, tontura, dor de cabeça |
|
Transtornos psiquiátricos |
Sonhos anormais, ansiedade, depressão, dificuldade de dormir |
|
Distúrbios renais e urinários |
Dificuldade para urinar (disúria), urgência urinária. |
|
Distúrbios do sistema reprodutor e |
Cólica menstrual (dismenorreia), dor durante ato sexual |
|
Distúrbios respiratórios, torácicos |
Aspiração, asma, bronquite, tosse, falta de ar (dispneia), |
|
Distúrbios de pele e tecido |
Espinha (acne), inflamação da pele (dermatite), vermelhidão |
|
Distúrbios vasculares |
Trombose venosa profunda, ondas de calor (fogachos), pressão |
As reações adversas adicionais relatadas em um estudo a longo prazo e não-controlado e que foram consideradas pelo médico como relacionadas ao tratamento com Dexilant incluem:
Reação anafilática, alucinação auditiva, linfoma de células B, bursite, obesidade central, colecistite aguda, desidratação, diabetes mellitus, rouquidão (disfonia), sangramento pelo nariz (epistaxe), inflamação da raíz dos pelos (foliculite), gota, herpes zoster, elevação dos níveis de gordura no sangue (hiperlipidemia), hipotireoidismo, aumento da contagem de neutrófilos, redução dos níveis de hemoglobina, redução dos níveis de neutrófilos (neutropenia), sensação constante de necessidade de defecar (tenesmo retal), síndrome das pernas inquietas, sonolência, inflamação das amígdalas (tonsilite).
Reações adversas ao medicamento pós-comercialização
Distúrbios do sangue e do sistema linfático:
Anemia hemolítica autoimune, púrpura trombocitopênica idiopática.
Distúrbios do ouvido e labirinto:
Surdez.
Distúrbios oculares:
Visão turva.
Distúrbios gastrintestinais:
Inchaço (edema) oral, pancreatite.
Distúrbios gerais e condições do local de administração:
Inchaço (edema) facial.
Distúrbios hepatobiliares:
Hepatite induzida por medicamento.
Distúrbios do sistema imunológico:
Choque anafilático (exigindo intervenção de emergência), dermatite esfoliativa, síndrome de Stevens-Johnson, necrólise epidérmica tóxica (algumas fatais).
Distúrbios metabólicos e nutricionais:
Baixo nível de magnésio ( hipomagnesemia), baixo nível de sódio (hiponatremia).
Distúrbios musculoesqueléticos:
Fratura óssea.
Distúrbios do sistema nervoso:
Acidente vascular cerebral, ataque isquêmico transitório.
Distúrbios renais e urinários:
Insuficiência aguda dos rins.
Distúrbios respiratórios, torácicos e mediastinais:
Inchaço da faringe (edema faríngeo), aperto na garganta.
Distúrbios de pele e do tecido subcutâneo:
Erupção cutânea generalizada, vasculite leucocitoclástica.
Seu médico pode descontinuar Dexilant se estes sintomas acontecerem.
Baixos níveis corporais de magnésio
Este problema pode ser sério. Baixo nível de magnésio pode ocorrer em algumas pessoas que tomam medicamento inibidor de bomba de prótons há pelo menos 3 meses. Se ocorrerem baixos níveis de magnésio, isto normalmente acontece após um ano de tratamento. Você pode ou não apresentar sintomas de baixos níveis de magnésio.
Procure imediatamente o seu médico se apresentar qualquer destes sintomas:
- Convulsões;
- Vertigem;
- Batimento cardíaco rápido ou anormal;
- Agitação;
- Movimentos convulsivos ou agitação (tremores);
- Fraqueza muscular;
- Espasmos das mãos e pés;
- Cãibras ou dores musculares;
- Espasmo da laringe.
Seu médico deve verificar o seu nível corporal de magnésio antes que você comece a tomar Dexilant, ou durante o tratamento caso tenha de tomar Dexilant por um longo período.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente podem ocorrer reações adversas imprevisíveis ou desconhecidas. Nesse caso, informe seu médico ou cirurgião-dentista. Informe também a empresa através do seu serviço de atendimento.
Composição
Cada cápsula de liberação retardada contém:
|
Dexlansoprazol |
30 ou 60 mg |
|
Excipientes q.s.p |
1 cápsula |
Excipientes: Dióxido de silício coloidal, hidroxipropilcelulose, hipromelose 2910, hidroxipropilcelulose de baixa substituição, carbonato de magnésio, copolímero de ácido metacrílico, polietilenoglicol 8000, polissorbato 80, sacarose, esferas de açúcar, talco, dióxido de titânio e citrato de trietila.
O revestimento da cápsula contém os seguintes ingredientes não medicinais:
Carragenina, hipromelose, cloreto de potássio. De acordo com a cor da cápsula, a azul contém corante FD&C azul número 2 laca de alumínio; a cinza contém óxido férrico preto; e ambas contêm dióxido de titânio.
Superdosagem
Se você tomar mais Dexilant que o necessário, contate o seu médico imediatamente ou vá para o hospital mais próximo.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Ligue para 0800 722 6001 se você precisar de mais orientações.
Interação Medicamentosa
Medicamentos com farmacocinética de absorção dependente do pH
Este medicamento pode interferir na absorção de outros medicamentos cujo o pH gástrico é um determinante importante da sua biodisponibilidade, tais como ésteres de ampicilina, sais de ferro, digoxina, cetoconazol.
Inibidores de HIV Protease
Coadministração de dexlansoprazol não é recomendada com inibidores de HIV protease para os quais a absorção é dependente do pH intragástrico ácido tal como o atazanavir e nelfinavir, devido à redução significante da biodisponibilidades destes fármacos.
Metotrexato
O uso concomitante com altas doses de metotrexato podem elevar e prolongar os níveis séricos de metotrexato e / ou de seu metabólito, possivelmente, levando a toxicidade do metotrexato.
Interações com o citocromo P450
Este medicamento é parcialmente metabolizado pelo CYP2C19 e o CYP3A4. Estudos in vitro demonstraram que este medicamento provavelmente não inibe as isoformas CYP1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 ou 3A4. Assim, não se esperam interações clinicamente relevantes com medicamentos metabolizados por estas enzimas do citocromo P450. Além disso, estudos clínicos de interação mostraram que não há influência na farmacocinética quando este medicamento é coadministrado com fenitoína (substrato da CYP 2C9) ou teofilina (substrato da CYP1A).
Em estudos de interação droga-droga com teofilina não se determinaram genótipos de CYP1A2. Embora estudos in vitro tenham demonstrado que este medicamento é potencialmente inibidor da CYP2C19, um estudo in vivo de interação droga-droga, principalmente em metabolizadores extensivos e intermediários de CYP2C19, demonstrou que este medicamento não afeta a farmacocinética de diazepam (substrato da CYP2C19).
Interações com varfarina
A administração concomitante deste medicamento na dose de 90 mg e 25 mg de varfarina não afetou a farmacocinética de varfarina ou o INR. Entretanto, houve relatos de aumento do tempo de protrombina e INR em pacientes tratados concomitantemente com IBPs e varfarina. O aumento no tempo de protrombina e INR podem levar ao sangramento anormal e até mesmo óbito. Consequentemente, em pacientes que estejam sendo tratados com este medicamento e varfarina pode ser necessária a monitorização do aumento do tempo de protrombina e INR.
Interações com tacrolimus
A administração concomitante de dexlansoprazol e tacrolimus pode aumentar os níveis de tacrolimus no sangue total, principalmente em pacientes transplantados que sejam metabolizadores intermediários ou fracos de CYP2C19.
Interação com clopidogrel
A administração concomitante de clopidogrel e dexlansoprazol em indivíduos saudáveis não teve efeito clinicamente importante sobre a exposição ao metabólito ativo de clopidogrel ou a inibição plaquetária induzida por clopidogrel.
Não há necessidade de ajuste de dose de clopidogrel quando este for administrado com uma dose aprovada deste medicamento.
Interação Alimentícia
Não existem restrições quanto à ingestão deste medicamento com alimentos.
Ação da Substância
Resultados de Eficácia
Cicatrização da esofagite erosiva
A eficácia e a segurança do uso de dexlansoprazol na cicatrização da esofagite erosiva (EE) (graus A-D da classificação de Los Angeles) confirmada endoscopicamente foram avaliadas em dois estudos multicêntricos, duplo-cegos, randomizados, comparativos com lansoprazol, de 8 semanas de duração. Os pacientes foram randomizados para receberem Dexlansoprazol (substância ativa) com 60 mg/dia ou 90 mg/dia ou lansoprazol 30 mg/dia. Foram excluídos destes estudos pacientes que fossem H. pylor- positivos ou que tivessem esôfago de Barret e/ou alterações displásicas definitivas no período basal. A idade média dos 4.092 pacientes admitidos aos estudos foi de 48 anos (variando de 18 a 90 anos), sendo 54% do gênero masculino e 87% caucasianos; 5% negros e 8% de outras etnias. Com base na classificação de Los Angeles, 71% dos pacientes apresentavam antes do tratamento EE graus A e B (leve) e 29% EE graus C e D (moderada a grave).
Pela análise de tabela de vida, 92,3% a 93,1% dos pacientes apresentaram cicatrização com Dexlansoprazol (substância ativa) com 60 mg/dia, versus 86,1% a 91,5% com lansoprazol 30 mg/dia após oito semanas de tratamento. Em ambos os estudos demonstrou-se não-inferioridade. O teste log-rank não estabeleceu superioridade estatística. Os cálculos de taxas brutas (não processadas) consideraram como não curados os pacientes que não apresentavam esofagite erosiva cicatrizada documentada endoscopicamente e que descontinuaram prematuramente o tratamento.
Com base nos cálculos das taxas brutas (não-processadas), as taxas de cicatrização na semana 4 (desfecho secundário) ou na semana 8 (desfecho primário) foram mais elevadas com Dexlansoprazol (substância ativa) do que com lansoprazol (Tabela 1). O tratamento com Dexlansoprazol (substância ativa) com 60 mg foi não-inferior àquele com lansoprazol 30 mg na semana 8 em ambos os estudos. A superioridade estatística de Dexlansoprazol (substância ativa) com 60 mg em relação ao lansoprazol 30 mg foi estabelecida no primeiro estudo, porém não replicada no segundo estudo.
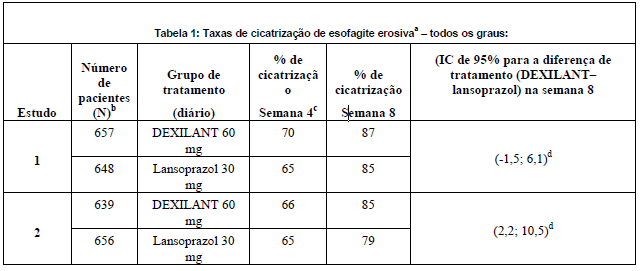
IC = Intervalo de confiança.
a Com base nas estimativas de taxa bruta, os pacientes que não apresentaram EE cicatrizada comprovada por endoscopia e descontinuaram prematuramente foram considerados não curados.
b Pacientes com ao menos uma endoscopia após o nível basal.
c Desfecho primário de eficácia.
d Demonstrada não-inferioridade em relação ao lanzoprazol.
Dexlansoprazol 90 mg, foi estudado e não apresentou nenhum benefício clínico adicional em relação à Dexlansoprazol (substância ativa) com 60 mg.
Manutenção da cicatrização da esofagite erosiva
Realizou-se um estudo multicêntrico, duplo-cego, randomizado e controlado com placebo em pacientes que concluíram com sucesso um estudo clínico em esofagite erosiva e que apresentaram cicatrização da esofagite confirmada endoscopicamente. A manutenção da cicatrização e o alívio da pirose por um período de 6 meses foi avaliada com Dexlansoprazol (substância ativa) 30 mg ou 60 mg uma vez ao dia em comparação com placebo.
Incluiu-se um total de 445 pacientes com idades variando de 18 a 85 anos (média de 49 anos), com predominância do sexo feminino (52%) e 90% de caucasianos, 5% de negros e 5% de outras etnias. Sessenta e seis por cento dos pacientes tratados com Dexlansoprazol (substância ativa) 30 mg tiveram a cicatrização mantida ao longo de seis meses, conforme confirmado por endoscopia (vide Tabela 2).
|
Tabela 2: Taxa de manutençãoa da cicatrização da EE por até 6 meses | ||
|
Número de pacientes (N)b |
Grupo de tratamento (dose diária) |
Taxa de manutenção (%) |
|
125 |
Dexlansoprazol (substância ativa) 30 mg |
66,4c |
|
119 |
Placebo |
14,3 |
a Com base em estimativas dos dados brutos, os pacientes que não tiveram recaída endoscopicamente documentada e os pacientes com tratamento prematuramente interrompido foram considerados como tendo uma recaída.
b Pacientes com pelo menos uma endoscopia após o período basal
c Estatisticamente significativo versus placebo.
Dexlansoprazol 60 mg não apresentou benefício clínico adicional a Dexlansoprazol (substância ativa) com 30 mg.
O efeito Dexlansoprazol 30 mg na manutenção do alívio da pirose também foi avaliado. Após a entrada no estudo de manutenção, a pirose com gravidade baixa da maioria dos pacientes foi classificada como inexistente. Dexlansoprazol (substância ativa) 30 mg demonstrou uma porcentagem significativamente maior de períodos de 24 horas sem pirose em comparação com placebo durante o período de 6 meses de tratamento (vide Tabela 3). A maioria dos pacientes tratados com placebo descontinuou o tratamento devido a recaída de EE entre dois e seis meses.
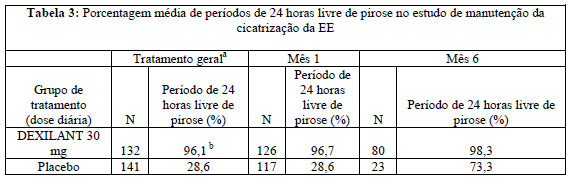 a Desfecho secundário.
a Desfecho secundário.
b Estatisticamente significante versus placebo.
DRGE sintomática Não-Erosiva
Realizou-se um estudo multicêntrico, duplo-cego, controlado com placebo, randomizado, de 4 semanas de duração em pacientes com diagnóstico de DRGE não-erosiva sintomática feito primariamente pela presença de sintomas. Esses pacientes identificaram a pirose como sintoma primário, apresentaram histórico de pirose por 6 meses ou mais em no mínimo quatro de setedias imediatamente antes da randomização, sem erosões esofágicas à endoscopia. Entretanto, pacientes com sintomas não- relacionados ao ácido podem não ter sido excluídos mediante estes critérios de inclusão.
Os pacientes foram randomizados para um dos três grupos de tratamento: Dexlansoprazol (substância ativa) 30 mg/dia, Dexlansoprazol (substância ativa) com 60 mg/dia ou placebo. Foi admitido ao estudo um total de 947 pacientes com idade entre 18 e 86 anos (média de 48 anos), sendo 71% do sexo feminino; 82% caucasianos, 14% negros e 4% de outras etnias.
Dexlansoprazol (substância ativa) 30 mg apresentou porcentagem significantemente mais elevada de dias com ausência de pirose por períodos de 24 horas em relação ao placebo nas quatro semanas de estudo segundo a avaliação do diário do paciente (vide Tabela 4). Dexlansoprazol (substância ativa) com 60 mg também foi avaliado e não proporcionou benefício clínico adicional em relação ao Dexlansoprazol (substância ativa) 30 mg.
|
Tabela 4: Porcentagens médias de períodos livres de pirose por 24 horas durante 4 semanas de tratamento do estudo de DRGE sintomática não erosiva. | ||
|
Grupo de tratamento | N |
Períodos de 24 horas sem pirose (%) |
|
Dexlansoprazol (substância ativa) 30 mg | 312 |
54,9* |
|
Placebo | 310 | 18,5 |
|
* Estatisticamente significativo vs. placebo, P<0,00001 | ||
Uma porcentagem maior de pacientes tratados com Dexlansoprazol (substância ativa) 30 mg que aquela de tratados com placebo apresentou períodos de 24 horas sem pirose durante as 4 semanas de tratamento. Este resultado foi observado desde os três primeiros dias de tratamento e sustentado por todo o período do estudo (porcentagem de pacientes no dia 3: Dexlansoprazol (substância ativa) 38% versus placebo15%; no dia 28: Dexlansoprazol (substância ativa) 63% versus placebo 40%).
Características Farmacológicas
Mecanismo de ação
Dexlansoprazol (substância ativa) é um inibidor de bomba de prótons que suprime a secreção de ácido gástrico pela inibição específica da (H+,K+)-ATPase na célula parietal gástrica. Ao atuar especificamente na bomba de prótons, Dexlansoprazol (substância ativa) bloqueia a etapa final da produção de ácido.
Propriedades farmacodinâmicas
Atividade Antissecretora
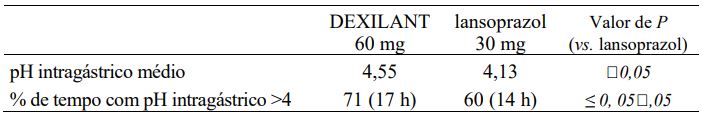
Os efeitos de 24 horas de Dexlansoprazol (substância ativa) com 60 mg sobre o pH intragástrico foram avaliados em indivíduos sadios (n = 20) em um estudo cruzado de doses múltiplas em comparação com lansoprazol 30 mg (n = 23) uma vez ao dia por 5 dias. Os resultados estão resumidos na Tabela 5.
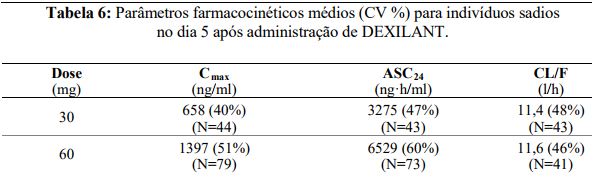
Tabela 5: Efeito de 24 horas sobre o pH intragástrico no dia 5 após administração de DEXILANT ou lansoprazol.
Efeito sobre a gastrina sérica
O efeito Dexlansoprazol sobre as concentrações de gastrina sérica foi avaliado em estudos clínicos que envolveram cerca de 3.460 pacientes tratados por até oito semanas e 1.025 pacientes tratados por 6 a 12 meses. As médias das concentrações de gastrina em jejum aumentaram em relação aos valores basais durante o tratamento com Dexlansoprazol (substância ativa) 30 mg e 60 mg.
Nos pacientes tratados por mais de seis meses, a média dos níveis de gastrina sérica aumentou durante os três primeiros meses de tratamento, aproximadamente, e se estabilizaram durante o período restante da terapia. A média dos níveis de gastrina sérica retornou aos níveis pré-tratamento dentro de um mês após a descontinuação terapêutica.
Efeitos sobre as células tipo-enterocromafins (ECL)
Não se relatou hiperplasia das células tipo-enterocromafins (ECL) nas biópsias gástricas de 857 pacientes tratados por até 12 meses com Dexlansoprazol (substância ativa) 30 mg, 60 mg ou 90 mg.
Durante o período de vida de ratos expostos a até 150 mg/kg/dia de lansoprazol, observou-se marcada hipergastrinemia seguida por proliferação de células ECL e formação de tumores carcinóides, especialmente nas fêmeas.
Efeitos sobre a repolarização cardíaca
Doses de 90 mg ou 300 mgDexlansoprazol não causaram retardo na repolarização cardíaca em comparação com placebo em um estudo conduzido para avaliar o potencial de dexlansoprazol para prolongar o intervalo QT/QTc em indivíduos adultos sadios. O controle positivo (moxifloxacina) produziu uma média máxima maior e tempos médios dos intervalos QT/QTc estatisticamente significativos quando comparados com placebo.
Propriedades farmacocinéticas
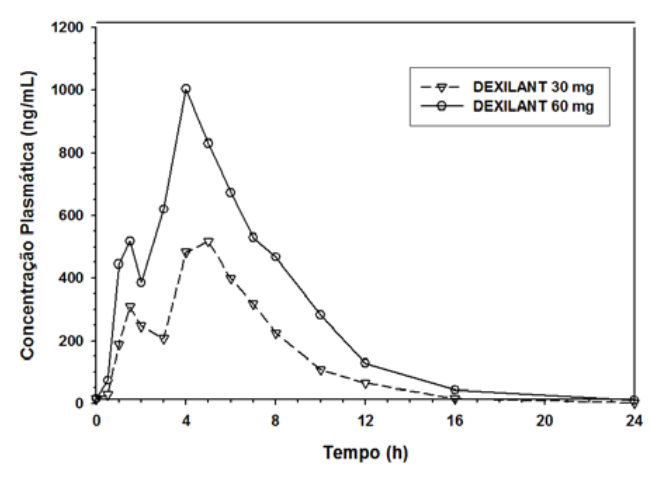
A formulação Dexlansoprazol utiliza tecnologia de liberação retardada dupla e cria um perfil de concentração plasmática/tempo de dexlansoprazol com dois picos distintos: o primeiro pico ocorre uma a duas horas após a administração e é seguido por um segundo pico no período de quatro a cinco horas (Figura 1). Dexlansoprazol é eliminado com meia-vida de aproximadamente 1 a 2 horas tanto em indivíduos sadios como em pacientes com DRGE sintomática. Não há acúmulo de dexlansoprazol após doses orais múltiplasDexlansoprazol 30 mg ou 60 mg uma vez ao dia, embora os valores médios de ASCt e Cmax sejam discretamente (menos que 10%) mais altos no dia 5 do que no dia 1.
Figura 1: Perfil de concentração plasmática média de dexlansoprazol-tempo após administração oral de 30 mg ou 60 mg de uma vez ao diaDexlansoprazol por 5 dias em indivíduos sadios
Os parâmetros farmacocinéticos do dexlansoprazol são altamente variáveis, com valores percentuais de coeficiente de variação (CV%) para Cmax, ASC e CL/F superiores a 30%, e estão resumidos na Tabela 6
Absorção
Após a administração oralDexlansoprazol 30 mg ou 60 mg a indivíduos sadios e pacientes com DRGE sintomática, os valores médios de Cmax e ASC de dexlansoprazol foram elevados de modo aproximadamente proporcional à dose (vide Figura 1).
Distribuição
A ligação de dexlansoprazol às proteínas plasmáticas variou de 96,1% a 98,8% em indivíduos sadios e foi independente da concentração de 0,01 a 20 mcg/mL. O volume aparente de distribuição (Vz/F) após doses múltiplas em pacientes que apresentavam DRGE sintomática foi de 40,3 L.
Metabolismo
Dexlansoprazol é extensamente metabolizado no fígado, por oxidação, redução e subsequente formação de conjugados de sulfato, glicuronida e glutationa em metabólitos inativos. Os metabólitos oxidantes são formados pelo sistema enzimático do citocromo P450 (CYP), incluindo hidroxilação principalmente pelo CYP2C19 e oxidação em sulfona pelo CYP3A4. A CYP2C19 é uma enzima hepática polimórfica que apresenta três fenótipos no metabolismo dos substratos de CYP2C19; metabolizadores extensos (*1/*1), metabolizadores intermediários (*1/mutante) e metabolizadores fracos (mutante/mutante).
Dexlansoprazol é o principal componente circulante no plasma, independentemente do status de metabolização do CYP2C19. Os principais metabólitos plasmáticos dos metabolizadores intermediários e extensos de CYP2C19 são 5-hidroxidexlansoprazol e seu conjugado glicuronídeo, ao passo que a sulfona de dexlansoprazol é o principal metabólito plasmático dos metabolizadores fracos do CYP2C19.
Excreção
Após a administraçãoDexlansoprazol não há excreção urinária de dexlansoprazol não-metabolizado. Após a administração de [14C]dexlansoprazol a seis indivíduos sadios do sexo masculino, aproximadamente 50,7%±9,0% da radioatividade administrada foi excretada na urina e 47,6%±7,3% nas fezes. A depuração aparente (CL/F) nos indivíduos sadios foi respectivamente de 11,4 a 11,6 L/h após cinco dias de administração de 30 ou 60 mg uma vez ao dia.
Efeito do polimorfismo da CYP2C19 sobre a exposição sistêmica ao dexlansoprazol
A exposição sistêmica ao dexlansoprazol é geralmente mais elevada em metabolizadores intermediários e fracos. Em indivíduos japoneses do sexo masculino que receberam uma dose únicaDexlansoprazol de 30 mg ou 60 mg (N = 2 a 6 indivíduos /grupo), a média dos valores de Cmax e ASC foi até duas vezes maior com metabolizadores intermediários do que com metabolizadores extensos; com metabolizadores fracos, o valor médio de Cmax foi até 4 vezes maior e o valor médio da ASC foi até 12 vezes maior do que com metabolizadores extensos. Embora tal estudo não tenha sido realizado em caucasianos e afro-americanos, espera-se que a exposição dessas raças ao dexlansoprazol também seja afetada por fenótipos CYP2C19.
Efeito do alimento sobre a farmacocinética e a farmacodinâmica
Dexlansoprazol (substância ativa) pode ser administrado independentemente da presença de alimento ou dos horários das refeições. Em estudos sobre o efeito de alimento em indivíduos sadios tratados com Dexlansoprazol (substância ativa) em diversas condições alimentares em comparação ao jejum, os aumentos de Cmax variaram de 12% a 55% e os aumentos da AUC variaram de 9% a 37%.
Entretanto, não se observaram diferenças significativas em relação ao pH intragástrico. Um estudo adicional demonstrou que a administração de 60 mgDexlansoprazol antes do café da manhã, do almoço, de um lanche ou do jantar não causa efeito sobre a exposição ao dexlansoprazol ou um efeito clinicamente relevante sobre o controle do pH intragástrico em 24 horas.
Características em pacientes especiais
Pacientes pediátricos
A farmacocinética de dexlansoprazol não foi estudada em pacientes com menos de 18 anos de idade.
Pacientes idosos
Em um estudo com 12 indivíduos sadios do sexo masculino e 12 do sexo feminino tratados com uma dose oral única de Dexlansoprazol (substância ativa) com 60 mg, a meia-vida de eliminação terminal de dexlansoprazol foi significativamente mais longa em indivíduos idosos do que em indivíduos mais jovens (2,23 e 1,5 horas, respectivamente). Além disso, dexlansoprazol apresentou exposição sistêmica mais elevada (ASC) nos indivíduos idosos (34,5% mais elevada) do que em indivíduos mais jovens. Estas diferenças não foram clinicamente relevantes, não sendo necessário ajuste de dose em pacientes idosos.
Gênero
Em um estudo com 12 indivíduos sadios do sexo masculino e 12 do sexo feminino tratados com uma dose oral única de Dexlansoprazol (substância ativa) com 60 mg, as mulheres apresentaram exposição sistêmica mais elevada (ASC) (42,8% mais elevada) que os homens. Entretanto, não é necessário ajustar a dose em pacientes com base no gênero.
Insuficiência hepática
Em um estudo com 12 pacientes que apresentavam comprometimento moderado da função hepática tratados com uma dose oral única de Dexlansoprazol (substância ativa) com 60 mg, a exposição plasmática (ASC) de dexlansoprazol ligado e não-ligado foi aproximadamente duas vezes maior no grupo de comprometimento hepático do que em indivíduos com função hepática normal. Esta diferença na exposição não foi causada por uma diferença na ligação às proteínas entre os dois grupos de função hepática.
Não é necessário ajustar a doseDexlansoprazol em pacientes que apresentam comprometimento hepático leve (Child-Pugh classe A). Para pacientes que apresentam comprometimento hepático moderado (Child-Pugh classe B) deverá ser considerado Dexlansoprazol (substância ativa) 30 mg. Não foram realizados estudos em pacientes que apresentam comprometimento hepático grave (Child-Pugh classe C).
Insuficiência renal
Dexlansoprazol é extensamente metabolizado no fígado em metabólitos inativos e nenhum precursor é recuperado na urina após uma dose oral de dexlansoprazol. Portanto, a farmacocinética de dexlansoprazol não deverá ser alterada em pacientes que apresentarem comprometimento renal. Não foram realizados estudos em indivíduos com comprometimento renal.
Cuidados de Armazenamento
Dexilant deve ser conservado na embalagem original e à temperatura ambiente (15ºC a 30ºC).
Características fisícas
As cápsulas de Dexilant 30 mg são azuis e cinzas; as cápsulas de Dexilant 60 mg são azuis. Dentro das cápsulas há grânulos brancos a quase brancos.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS – 1.0639.0261
Farm. Resp.:
Carla A. Inpossinato - CRF-SP nº 38.535
Fabricado por:
Takeda Pharmaceutical Company Limited
Osaka - Japão
Importado e embalado por:
Takeda Pharma Ltda.
Rodovia SP 340 S/N, km 133,5
Jaguariúna - SP
CNPJ 60.397.775/0008-40
Indústria Brasileira
Venda sob prescrição médica.