para o que é indicado e para que serve?
Para que serve Dicoxibe é indicado para o tratamento sintomático da osteoartrite (lesão crônica das articulações ou “juntas”) e artrite reumatoide (inflamação crônica das "juntas" causada por reações autoimunes (quando o sistema de defesa do corpo agride por engano a si próprio); alívio dos sintomas da espondilite anquilosante (doença inflamatória crônica que atinge as articulações da coluna, quadris e ombros); alívio da dor aguda, no pós-operatório de cirurgia ortopédica, ou odontológica e em doenças musculoesqueléticas (como entorse do tornozelo e dor no joelho e na coxa); alívio da dismenorreia primária (cólica menstrual) e alívio da lombalgia (dor nas costas).Continue lendo...
ofertas de
Dicoxibe 200Mg 10 Comprim...
ofertas de Dicoxibe 200Mg 10 Comprim...
R$ 61,29
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Dicoxibe é indicado para o tratamento sintomático da osteoartrite (lesão crônica das articulações ou “juntas”) e artrite reumatoide (inflamação crônica das "juntas" causada por reações autoimunes (quando o sistema de defesa do corpo agride por engano a si próprio); alívio dos sintomas da espondilite anquilosante (doença inflamatória crônica que atinge as articulações da coluna, quadris e ombros); alívio da dor aguda, no pós-operatório de cirurgia ortopédica, ou odontológica e em doenças musculoesqueléticas (como entorse do tornozelo e dor no joelho e na coxa); alívio da dismenorreia primária (cólica menstrual) e alívio da lombalgia (dor nas costas).
Como o Dicoxibe funciona?
Dicoxibe é um agente analgésico (promove redução da dor) e anti-inflamatório (combate a inflamação que é a reação do sistema de defesa do nosso corpo a uma agressão, que se manifesta como dor, calor, vermelhidão no local) não esteroidal (não derivado de hormônios) da classe dos inibidores específicos da enzima ciclooxigenase 2 (COX-2, enzima responsável por desencadear a inflamação).
Além da inibição da COX-2 os anti-inflamatórios não esteroidais tradicionais inibem também a COX-1, o que pode aumentar os riscos de eventos adversos gastrintestinais (lesões, úlceras e sangramentos).
A dor aguda é reduzida cerca de 28 minutos após a tomada da dose de Dicoxibe , já a redução dos sintomas da osteoartrite e da artrite reumatoide é percebida em 1-2 semanas de uso da medicação.
Contraindicação
Dicoxibe não deve ser usado por pacientes que:
- Tenham tido crise de asma (doença pulmonar com crises de chiado), urticária (alergia de pele) ou reações alérgicas após uso de ácido acetilsalicílico ou outros antiinflamatórios; pois há risco de alergia com o uso de Dicoxibe;
- Com doença hepática (do fígado) grave e/ou com insuficiência renal grave (redução importante do funcionamento dos rins);
- Tenham dor relacionada à cirurgia de revascularização do miocárdio (cirurgia da ponte de veia safena ou de artéria mamária para desobstrução da coronária).
Como usar
Dicoxibe deve ser engolido com ou sem alimentos.
Para o tratamento de dor aguda (pós operatório e doenças musculoesqueléticas) e dismenorreia primária:
400mg na primeira dose, seguidos de uma dose de 200mg por via oral (engolido) após 12 horas, seguido de 200mg a cada 12 horas nos dias seguintes durante o tempo indicado pelo seu médico.
Uso para o tratamento de dor crônica:
Todo anti-inflamatório deve ser usado na sua menor dose diária eficaz durante o menor período possível. O tempo adequado deverá ser decisão do seu médico.
As doses sugeridas para essas doenças são as seguintes:
O que devo fazer quando eu me esquecer de usar o Dicoxibe?
Caso você se esqueça de tomar Dicoxibe no horário estabelecido pelo seu médico, tome-o assim que lembrar.
Entretanto, se já estiver perto do horário de tomar a próxima dose, pule a dose esquecida e tome a próxima, continuando normalmente o esquema de doses recomendado pelo seu médico.
Neste caso, não tome o medicamento duas vezes para compensar doses esquecidas. O esquecimento da dose pode comprometer o resultado do tratamento.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
O uso de AINEs (anti-inflamatórios não esteroidais), incluindo Dicoxibe, pode retardar ou inibir a ovulação, o que pode estar associado com a infertilidade reversível em algumas mulheres.
Se usado durante o segundo ou terceiro trimestre da gravidez, os AINEs podem causar disfunção renal fetal que pode resultar na redução do volume de líquido amniótico ou oligoidrâmnio em casos graves.
Tais efeitos podem ocorrer logo após o início do tratamento e são geralmente reversíveis. As mulheres grávidas utilizando Dicoxibe devem ser cuidadosamente monitoradas quanto ao volume de líquido amniótico.
Dicoxibe não deve ser usado por grávidas sem orientação e seguimento médico; especialmente durante o primeiro e segundo trimestres (até por volta do 6º mês).
O uso de Dicoxibe durante a gravidez requer que se pesem os potenciais benefícios para a mãe e riscos para a criança, o que só pode ser feito pelo médico ou dentista. Informe imediatamente o seu médico em caso de suspeita de gravidez ou se estiver amamentando.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Embora reduza o risco de desenvolvimento de complicações gastrintestinais associadas ao uso de antiinflamatórios, esse risco não está eliminado pelo uso de Dicoxibe; sendo maior em maiores de 65 anos, consumo de bebidas alcoólicas ou com história anterior de perfuração, úlcera ou sangramento gastrintestinal.
Dicoxibe deve ser usado com cautela em pacientes com:
- Hipertensão (pressão alta), pois pode piorá-la;
- Com maior risco de lesões nos rins devido ao uso de anti-inflamatórios: portadores de insuficiência renal (redução grave da função dos rins), alterações da função do fígado em idosos;
- Portadores das alterações das enzimas metabolizadoras CYP2C9. Comunique ao seu médico se você tiver qualquer uma dessas condições.
Dicoxibe deve ser descontinuado ao aparecimento de rash cutâneo (vermelhidão), lesões nas mucosas (olhos, nariz, boca) ou outros sinais de alergias.
Sempre avise ao seu médico todas as medicações que você toma quando ele for prescrever uma medicação nova.
Interação medicamentosa
O médico precisa avaliar se as medicações reagem entre si alterando a sua ação, ou da outra; isso se chama interação medicamentosa.
Dicoxibe pode interagir com:
- Anticoagulantes (medicamentos que reduzem a coagulação sanguínea como a varfarina) aumentando o risco de sangramento;
- Anti-hipertensivos (medicações para a pressão alta) das classes dos inibidores da enzima conversora de angiotensina (ECA) e/ou antagonistas da angiotensina II, diuréticos e beta-bloqueadores podem ter seu efeito reduzido; em pacientes idosos, com desidratação (incluindo aqueles em tratamento com diuréticos) ou com função renal comprometida, a coadministração de anti-inflamatórios, incluindo os inibidores específicos da COX-2, com inibidores da ECA, pode resultar no comprometimento da função renal, incluindo possível insuficiência renal aguda (redução aguda grave da função dos rins);
- Fluconazol (medicamento contra infecção por fungos) pode aumentar os níveis sanguíneos de Dicoxibe;
- Lítio (medicamento usado para doenças mentais) pode ter seu nível sanguíneo aumentado;
- Ciclosporinas medicamentos anti-inflamatórios podem aumentar o risco de toxicidade no rim associada à ciclosporina;
- A administração concomitante de dextrometorfano (medicamento para tosse) ou metoprolol (medicamento para pressão alta) com Dicoxibe 200 mg duas vezes ao dia resultou em aumento de 2,6 vezes e 1,5 vezes das concentrações no sangue de dextrometorfano e metoprolol, respectivamente;
- Lisinopril (medicamento para pressão alta) administrado concomitante com Dicoxibe pode não controlar a pressão alta.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para a sua saúde.
Atenção: Este medicamento contém Açúcar, portanto, deve ser usado com cautela em portadores de Diabetes.
Reações Adversas
Reações Adversas relatadas em Estudos Clínicos para Dor e Inflamação
Reações Adversas relatadas em Estudos Clínicos para Prevenção de Pólipos
Os eventos citados a seguir foram relatados no período pós-comercialização
Composição
Cada cápsula de Dicoxibe 100mg contém:
Celecoxibe: 100mg.
Cada cápsula de Dicoxibe 200mg contém:
Celecoxibe: 200mg.
Excipientes: lactose monoidratada, povidona, estearato de magnésio, croscarmelose sódica, laurilsulfato de sódio.
Superdosagem
Dose única de até 1.200mg e múltiplas doses de até 1.200mg duas vezes ao dia foram administradas em indivíduos saudáveis sem efeito adverso clinicamente significante.
Nos casos suspeitos de overdose (altas doses), suporte médico apropriado deve ser providenciado.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
O metabolismo do celecoxibe é mediado, predominantemente, pelo citocromo P450 (CYP)2C9 no fígado. Pacientes com deficiência ou suspeita de deficiência de metabolizadores CYP2C9, baseados no histórico prévio/experiência com outros substratos CYP2C9, devem utilizar celecoxibe com cautela, uma vez que podem apresentar níveis plasmáticos altos anormais devido à redução do clearance metabólico.
Considerar o início do tratamento com metade da menor dose recomendada.
A administração concomitante de celecoxibe com inibidores de CYP2C9 pode levar a aumentos nas concentrações plasmáticas de celecoxibe. Portanto, uma redução da dose de celecoxibe pode ser necessária quando o celecoxibe for coadministrado com inibidores de CYP2C9.
A administração concomitante de celecoxibe com indutores de CYP2C9, como rifampicina, carbamazepina e barbitúricos, pode levar a uma diminuição nas concentrações plasmáticas de celecoxibe. Portanto, um aumento da dose de celecoxibe pode ser necessário quando o celecoxibe for coadministrado com indutores de CYP2C9.
Estudo de farmacocinética clínica e estudos in vitro indicam que o celecoxibe, embora não seja um substrato, também é um inibidor do CYP2D6. Portanto, existe um potencial para interação medicamentosa in vivo com fármacos metabolizados pelo CYP2D6.
Interações Específicas
Interação de celecoxibe com varfarina ou agentes similares:
Uso com anticoagulantes orais.
Fluconazol e cetoconazol:
A administração concomitante de fluconazol, 200mg/dia, resultou em um aumento de duas vezes a concentração plasmática de celecoxibe. Este aumento é devido à inibição do metabolismo do celecoxibe via CYPP450 2C9 proporcionada pelo fluconazol. O celecoxibe deve ser introduzido com a menor dose recomendada em pacientes recebendo o inibidor da CYP2C9, fluconazol. O cetoconazol, um inibidor da CYP3A4, não mostrou inibição clinicamente relevante no metabolismo de celecoxibe.
Dextrometorfano e metoprolol:
A administração concomitante de celecoxibe 200mg duas vezes ao dia resultou em aumento de 2,6 vezes e 1,5 vezes nas concentrações plasmáticas de dextrometorfano e metoprolol (substratos CYP2D6), respectivamente. Esses aumentos são devido à inibição do celecoxibe ao metabolismo do substrato CYP2D6 via CYP2D6. Portanto, a dose de medicamentos, como o substrato CYP2D6, pode precisar ser reduzida quando o tratamento com celecoxibe for iniciado ou aumentado quando o tratamento com celecoxibe terminar.
Anti-hipertensivos, incluindo inibidores da enzima conversora de angiotensina (IECAs), antagonistas da angiotensina II (também conhecidos como bloqueadores do receptor da angiotensina, BRAs), diuréticos e betabloqueadores:
A inibição das prostaglandinas pode reduzir o efeito dos anti-hipertensivos, incluindo inibidores da enzima conversora de angiotensina (IECAs) e/ou antagonistas da angiotensina II (BRAs), diuréticos e betabloqueadores. Essa interação deve ser considerada em pacientes que recebem celecoxibe juntamente com IECAs e/ou antagonistas da angiotensina II (BRAs), diuréticos e betabloqueadores. Em pacientes idosos, com depleção de volume (incluindo aqueles em tratamento com diuréticos) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos da COX-2, com inibidores da ECA, antagonistas da angiotensina II ou diuréticos, pode resultar na deterioração da função renal, incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. Portanto, a administração concomitante desses medicamentos deve ser feita com cautela. Os pacientes devem ser adequadamente hidratados e a necessidade clínica de monitorar a função renal deve ser avaliada no início do tratamento concomitante e depois periodicamente.
Resultados do estudo com lisinopril:
Em um estudo clínico de 28 dias em pacientes com hipertensão Estágio I e II controlada com lisinopril, a administração de celecoxibe 200mg duas vezes ao dia, quando comparado ao tratamento com placebo, não resultou em aumentos clinicamente significativos na pressão arterial sistólica ou diastólica média diária determinado por meio de monitoramento ambulatorial da pressão arterial por 24 horas. Entre os pacientes que receberam concomitantemente celecoxibe 200mg duas vezes ao dia, 48% foram considerados não responsivos ao lisinopril na visita clínica final (definido como pressão arterial diastólica medida com manguito >90mmHg ou pressão arterial diastólica medida com manguito aumentada em >10% em relação à linha de base), em comparação com 27% dos pacientes que receberam placebo concomitante; essa diferença foi estatisticamente significativa.
Ciclosporina:
Devido ao seu efeito sobre as prostaglandinas renais, os AINEs podem aumentar o risco de nefrotoxicidade associada à ciclosporina.
Diuréticos:
Estudos clínicos mostraram que os AINEs podem reduzir o efeito natriurético da furosemida e tiazídicos em alguns pacientes através da inibição da síntese de prostaglandinas renais.
Metotrexato:
Não foram observadas interações farmacocinéticas e clinicamente importantes em um estudo clínico entre celecoxibe e metotrexato.
Contraceptivos orais:
Em um estudo de interação, celecoxibe não demonstrou efeitos clinicamente relevantes na farmacocinética de um protótipo de um contraceptivo oral combinado (1mg noretindrona/0,035mg etinilestradiol).
Lítio:
Em indivíduos sadios, os níveis plasmáticos de lítio aumentaram aproximadamente 17% em indivíduos recebendo lítio associado ao celecoxibe. Pacientes sob tratamento com lítio devem ser monitorados cuidadosamente quando celecoxibe for introduzido ou retirado.
Ácido acetilsalicílico:
Celecoxibe não interfere no efeito antiplaquetário com baixas doses de ácido acetilsalicílico. Por causa da ausência de efeitos sobre as plaquetas, celecoxibe não é um substituto para o ácido acetilsalicílico na profilaxia da doença cardiovascular.
Outros:
Não foram observadas interações clinicamente importantes no uso de celecoxibe e antiácidos (alumínio e magnésio), omeprazol, glibenclamida (gliburida), fenitoína ou tolbutamida.
Ação da Substância
Resultados de eficácia
Estudos Clínicos
Osteoartrite (OA)
O celecoxibe demonstrou uma redução significativa na dor articular em comparação com o placebo. O celecoxibe foi avaliado para o tratamento dos sinais e sintomas da osteoartrite do joelho e quadril em aproximadamente 4.200 pacientes de estudos clínicos controlados por placebo e por agente ativo com até 12 semanas de duração. Em pacientes com osteoartrite, o tratamento com celecoxibe 100mg duas vezes ao dia ou 200mg em dose única diária resultou em melhora do índice de osteoartrite de WOMAC (Western Ontario and McMaster Universities), um índice composto de dor, rigidez, e medidas funcionais em osteoartrite. Em três estudos de 12 semanas de duração em osteoartrite acompanhada de dor e vermelhidão, as doses de celecoxibe de 100mg duas vezes ao dia ou 200mg duas vezes ao dia proporcionaram redução significativa da dor dentro de 24-48 horas após o início da administração.
Em doses de 100mg duas vezes ao dia ou 200mg duas vezes ao dia, a eficácia do celecoxibe mostrou ser semelhante à do naproxeno 500mg duas vezes ao dia. Doses de 200mg duas vezes ao dia não proporcionaram benefício adicional acima do observado com 100mg duas vezes ao dia.
Uma dose diária total de 200mg mostrou ser igualmente eficaz quer seja administrada como 100mg duas vezes ao dia ou como 200mg em dose única diária.
Foi alcançado alívio similar e significativo da dor com celecoxibe 100mg ou 200mg duas vezes por dia e naproxeno 500mg duas vezes por dia em um ensaio de 12 semanas, controlado com placebo, de fase III. Foi alcançado alívio similar e significativo da dor com celecoxibe 100mg ou 200mg duas vezes por dia e naproxeno 500mg duas vezes por dia em 1.003 pacientes com osteoartrite do joelho. Além de alívio da dor, houve melhora significativa no funcionamento físico e rigidez articular.
Artrite Reumatoide (AR)
O celecoxibe demonstrou uma redução significativa na sensibilidade/dor articular e no inchaço articular em comparação com o placebo. O celecoxibe foi avaliado para o tratamento dos sinais e sintomas de artrite reumatoide em aproximadamente 2.100 pacientes em estudos clínicos controlados por placebo e por agente ativo com até 24 semanas de duração. O celecoxibe mostrou ser superior ao placebo nestes estudos, quando se utilizou o Índice de Resposta do American College of Rheumatology 20 (ACR20), um índice composto de medidas clínicas, laboratoriais e funcionais da artrite reumatoide. As doses de celecoxibe 100mg duas vezes ao dia e 200mg duas vezes ao dia apresentaram eficácia semelhante e ambas foram comparáveis à eficácia do naproxeno 500mg duas vezes ao dia.
Embora o celecoxibe nas doses de 100mg duas vezes ao dia e 200mg duas vezes ao dia tenha proporcionado eficácia global semelhante, alguns pacientes obtiveram benefício adicional com a dose de 200mg duas vezes ao dia. Doses de 400mg duas vezes ao dia não proporcionaram benefício adicional acima do observado com 100mg-200mg duas vezes ao dia.
O celecoxibe foi igualmente eficaz quanto o naproxeno e superior ao placebo na superação de sinais e sintomas da artrite reumatoide em um estudo multicêntrico, duplo-cego (n=1.149). O celecoxibe 100mg duas vezes por dia, 200mg duas vezes por dia, 400mg duas vezes por dia e naproxeno 500mg duas vezes por dia foram igualmente eficazes e superiores ao placebo na superação de sinais e sintomas da artrite reumatóide. O celecoxibe, em todas as doses, foi mais seguro do que o naproxeno no que diz respeito à ocorrência de úlceras gastrointestinais.
Analgesia em dor aguda, incluindo Dismenorreia Primária
Nos modelos de analgesia aguda de dor pós-cirúrgica oral, ortopédica e dismenorreia primária, o celecoxibe aliviou a dor classificada pelos pacientes como moderada a grave. Doses únicas de celecoxibe proporcionaram alívio da dor dentro de um período de 60 minutos.
Espondilite Anquilosante (EA)
O celecoxibe foi avaliado em pacientes com espondilite anquilosante em dois estudos clínicos controlados por placebo e por agente ativo (naproxeno ou cetoprofeno) com 6 e 12 semanas de duração.
O celecoxibe nas doses de 100mg duas vezes ao dia, 200mg em dose única diária e 400mg em dose única diária mostrou ser estatisticamente superior ao placebo nestes estudos para todas as três medidas de eficácia primárias que avaliam a intensidade de dor global (Escala Visual Analógica), atividade da doença global (Escala Visual Analógica) e comprometimento funcional (Índice Funcional de Espondilite Anquilosante de Bath).
No estudo de 12 semanas, não houve diferença no nível de melhora entre as doses de 200mg e 400mg de celecoxibe em uma comparação de alteração média em relação ao basal, porém houve uma maior porcentagem de pacientes que responderam ao celecoxibe 400mg (53%) do que ao celecoxibe 200mg (44%), utilizando-se a Avaliação dos Critérios de Resposta de Espondilite Anquilosante (ASAS 20).
A ASAS 20 define resposta de um paciente ao tratamento como melhora em relação ao basal de pelo menos 20% e melhora absoluta de pelo menos 10mm, em uma escala de 0 a 100mm, em pelo menos, três de quatro dos seguintes domínios: avaliação global do paciente, dor, Índice Funcional de Espondilite Anquilosante de Bath e inflamação. A análise de resposta também demonstrou ausência de alteração nas taxas de resposta em períodos superiores a 6 semanas.
O celecoxibe reduziu significativamente a dor e incapacidade funcional associadas com espondilite anquilosante em comparação com o placebo, sem diferença na eficácia em comparação ao cetoprofeno, em um ensaio clínico randomizado, duplo-cego de 6 semanas.
Estudos em Dismenorreia
Dois estudos foram realizados para avaliar a eficácia do celecoxibe em dismenorreia, ambos randômicos, duplocegos, com 3 braços cruzados, que compararam celecoxibe (n=253) a naproxeno (n=251) e placebo (n=256).
Nos dois estudos as pacientes receberam a dose inicial da medicação definida randomicamente (celecoxibe 400mg, naproxeno 550mg ou placebo) no primeiro dia do ciclo menstrual e, se necessário, doses das mesmas medicações (celecoxibe 200mg, naproxeno 550mg e placebo) eram repetidas a cada 12 horas por 3 dias.
Em todas as medidas de eficácia utilizadas (tempo até o alívio da dor, redução da intensidade da dor nas 8 e 12 horas após a dose inicial; manutenção da intensidade da analgesia durante os 3 dias de tratamento – quando necessário – e o uso de medicação analgésica de resgate) celecoxibe e naproxeno foram estatisticamente superiores ao placebo (p<0,001). A avaliação do paciente em relação à eficácia do tratamento também foi superior (p<0,01) nos braços em que as medicações ativas foram usadas.
Nestes dois estudos desenhados de forma idêntica em mulheres com idades entre 18 a 44 anos, o celecoxibe 400mg (seguido de 200mg cada 12h) foi mais eficaz, tal como medido utilizando os escores de dor, no tratamento da dismenorreia primária em comparação com placebo. Em cada estudo, os escores de medida de eficácia primária foram significativamente melhores com celecoxibe e naproxeno em comparação com placebo. Ambos celecoxibe e naproxeno foram bem tolerados e forneceram alívio da dor menstrual dentro de 1 hora de administração.
Lombalgia
O celecoxibe foi utilizado para tratar pacientes que apresentavam lombalgia não neuropática preexistente de duração ?12 semanas. Na tabela a seguir, os resultados de eficácia de 5 estudos clínicos são apresentados utilizando a Escala de Avaliação da Intensidade da Dor do Paciente (escala visual analógica de 100mm), a partir da linha de base ao fim do tratamento:
Escala de Avaliação da Intensidade da Dor do Paciente em Estudo Clínico de Lombalgia
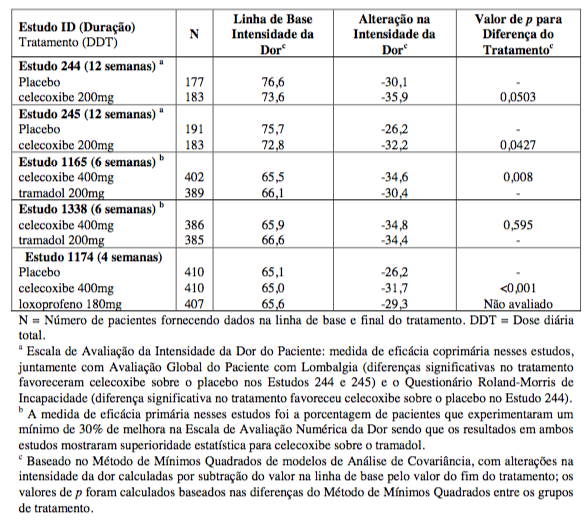
Informações Adicionais de Estudos Clínicos
Estudos Endoscópicos
As avaliações endoscópicas do trato gastrintestinal foram realizadas em mais de 4.500 pacientes com artrite que foram admitidos em 5 estudos randomizados e controlados de 12-24 semanas de duração que utilizaram agentes comparativos ativos, 2 dos quais também incluíram controles com placebo. Não houve relação consistente entre a incidência de úlceras gastroduodenais e a dose de celecoxibe dentro do intervalo estudado.
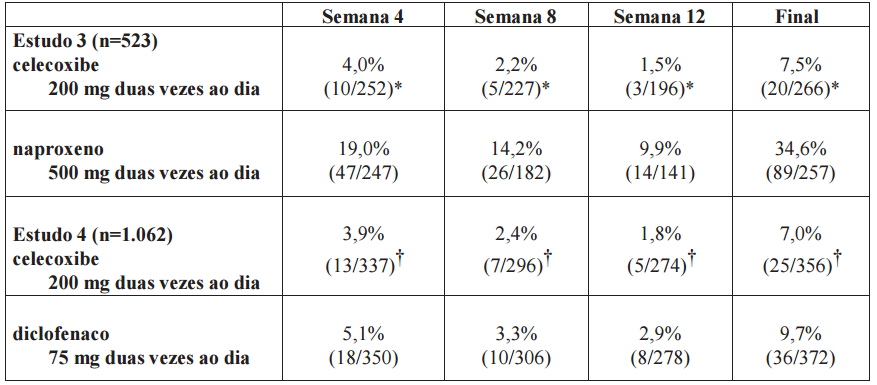
A Tabela 1 resume a incidência de úlceras endoscópicas em dois estudos de 12 semanas de duração que admitiram pacientes cujas endoscopias basais revelaram inexistência de úlceras.
Tabela 1 - Incidência de Úlceras Gastroduodenais nos Estudos Endoscópicos em Pacientes com Osteoartrite e Artrite Reumatoide?
| Estudos de 3 meses | ||
| Estudo 1 (n=1108) | Estudo 2 (n=1049) | |
| Placebo | 2,3% (5/217) | 2,0% (4/200) |
| Celecoxibe 50mg duas vezes ao dia | 3,4% (8/233) | - |
| Celecoxibe 100mg duas vezes ao dia | 3,1% (7/227) | 4,0% (9/223) |
| Celecoxibe 200mg duas vezes ao dia | 5,9% (13/221) | 2,7% (6/219) |
| Celecoxibe 400mg duas vezes ao dia | - | 4,1% (8/197) |
| Naproxeno 500mg duas vezes ao dia | 16,2% (34/210)* | 17,6% (37/210)* |
*P ? 0,05 versus todos os outros tratamentos.
A Tabela 2 resume os dados de dois estudos de 12 semanas que incluiu pacientes cujas endoscopias basais revelaram ausência de úlceras. Os pacientes foram submetidos a intervalos entre as endoscopias a cada 4 semanas para fornecer informações sobre o risco de úlcera em função do tempo.
Tabela 2 - Incidência de Úlceras Gastroduodenais em Estudos de Endoscopias seriadas em 3 meses em Pacientes com Osteoartrite e Artrite Reumatoide?
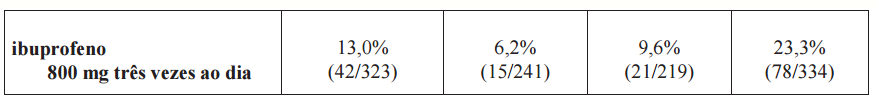
*P ? 0,05 celecoxibe vs naproxeno com base nos intervalos e análises cumulativas.
†P ? 0,05 celecoxibe vs ibuprofeno com base nos intervalos e análises cumulativas.
Foi conduzido um estudo randomizado e duplo-cego de 6 meses de duração em 430 pacientes com artrite reumatoide, no qual um exame endoscópico foi realizado no 6° mês.
A incidência de úlceras endoscópicas em pacientes recebendo celecoxibe 200mg duas vezes ao dia foi de 4% versus 15% para pacientes recebendo diclofenaco SR (liberação prolongada) 75mg duas vezes ao dia (p<0,001).
Em 4 dos 5 estudos endoscópicos, aproximadamente 11% dos pacientes (440/4.000) estavam tomando ácido acetilsalicilico (? 325mg/dia). Nos grupos celecoxibe, a taxa de úlcera endoscópica pareceu ser maior nos usuários de ácido acetilsalicílico do que nos não usuários. No entanto, a taxa aumentada de úlceras nestes usuários de ácido acetilsalicílico foi menor que a taxa de úlceras endoscópicas observada nos grupos com agentes comparativos ativos, com ou sem ácido acetilsalicílico.
A correlação entre os achados dos estudos endoscópicos e a incidência relativa de eventos sérios clinicamente significativos no trato gastrintestinal superior não foi estabelecida. Sangramento sério clinicamente significativo no trato gastrintestinal superior foi observado, embora infrequentemente, em pacientes recebendo celecoxibe em estudos controlados e abertos.
Meta-Análises em Segurança Gastrintestinal de Estudos em Osteoartrite e Artrite Reumatoide
Uma análise de 31 estudos clínicos controlados randomizados em osteoartrite (OA) e artrite reumatoide (AR), envolvendo 39.605 pacientes com osteoartrite (OA) (n=25.903), artrite reumatoide (AR) (n=3.232) ou pacientes com outras condições (n=10.470), comparou a incidência de eventos adversos gastrintestinais em pacientes tratados com celecoxibe à incidência em pacientes recebendo placebo ou AINEs (incluindo naproxeno, diclofenaco e ibuprofeno). A incidência clínica de úlcera e sangramento da úlcera com celecoxibe na dose diária total de 200mg-400mg foi de 0,2%, comparada à incidência de 0,6% com AINEs (RR=0,35; 95% IC 0,22-0,56).
Estudo de Segurança Prolongada do celecoxibe em Artrite (CLASS) incluindo o uso concomitante de ácido acetilsalicílico
Em um estudo prospectivo prolongado de resultados da segurança conduzido na fase pós-comercialização em aproximadamente 5.800 pacientes com osteoartrite e 2.200 pacientes com artrite reumatoide, os pacientes receberam celecoxibe 400mg duas vezes ao dia (4 vezes e 2 vezes as doses recomendadas para osteoartrite e artrite reumatoide, respectivamente, ibuprofeno 800mg 3 vezes/dia ou diclofenaco 75mg duas vezes ao dia (doses terapêuticas usuais). As exposições medianas para o celecoxibe (n=3.987) e o diclofenaco (n=1.996) foram de 9 meses enquanto com o ibuprofeno (n=1.985) foi de 6 meses.
As taxas cumulativas de Kaplan-Meier em 9 meses são fornecidas para todas as análises. O desfecho primário deste estudo foi a incidência de úlceras complicadas (sangramento gastrintestinal, perfuração ou obstrução). Os pacientes podiam tomar ácido acetilsalicilico (AAS) em baixa dose concomitante (?325mg/dia) como profilático cardiovascular (subgrupos de AAS: celecoxibe, n=882; diclofenaco, n=445; ibuprofeno, n=412). As diferenças de incidência de úlceras complicadas entre o celecoxibe e o grupo combinado de ibuprofeno e diclofenaco não foram estatisticamente significativas. Os pacientes recebendo celecoxibe e AAS em baixa dose concomitante apresentaram taxas 4 vezes maiores de úlceras complicadas em comparação com os que não receberam AAS. Os resultados para celecoxibe encontram-se na Tabela 3.
Tabela 3 - Efeitos da Coadministração de ácido acetilsalicílico em Baixa Dose sobre as Taxas de Úlcera Complicada com celecoxibe 400mg Duas Vezes ao Dia (Taxas de Kaplan-Meier em 9 Meses [%])
| Não usuários de ácido acetilsalicílico n=3.105 | Usuários de ácido acetilsalicílico n=882 | |
| Úlceras complicadas | 0,32 | 1,12 |
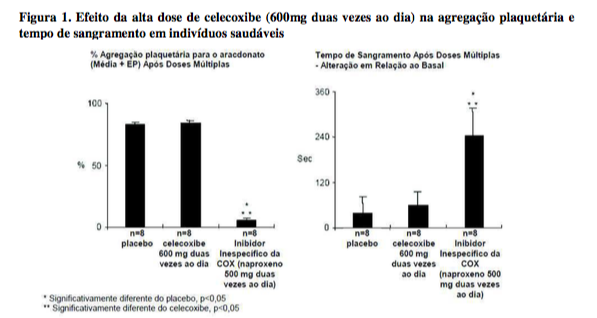
Função Plaquetária
Em voluntários sadios, o celecoxibe em doses terapêuticas e em doses múltiplas de 600mg duas vezes ao dia (três vezes a dose mais alta recomendada) não apresentou efeito sobre a agregação plaquetária e tempo de sangramento em comparação com o placebo. Todos os controles ativos (Inibidores inespecíficos da COX) reduziram significativamente a agregação plaquetária e prolongaram o tempo de sangramento (vide Figura 1).
Estudo de celecoxibe versus omeprazol e diclofenaco em Pacientes sob Risco de Osteoartrite e Artrite Reumatoide (CONDOR)
Neste estudo prospectivo de 24 semanas em pacientes com idade ?60 anos ou com histórico de úlcera gastroduodenal (excluindo usuários de ácido acetilsalicílico em baixa dose), a porcentagem de pacientes com eventos gastrintestinais clinicamente significativos (desfecho primário composto) foi menor em pacientes tratados com celecoxibe 200mg duas vezes ao dia comparado aos pacientes tratados com diclofenaco SR (liberação prolongada) 75mg duas vezes ao dia + omeprazol 20mg uma vez ao dia. Este resultado é baseado na diminuição clinicamente significativa na hemoglobina (?2g/dL) e/ou hematócrito (?10%) de origem gastrintestinal definida ou suposta. Os resultados dos desfechos individuais desse desfecho composto foram os seguintes:
| Desfecho composto gastrointestinal pré-definido | Celecoxibe 200mg duas vezes ao dia (n=2238) | Diclofenaco SR 75mg duas vezes ao dia + omeprazol 20mg uma vez ao dia (n=2246) |
| Desfechos | n (%) de pacientes | |
| Hemorragia gastroduodenal | 3 (0,1) | 3 (0,1) |
| Hemorragia do intestino grosso | 1 (<0,1) | 1 (<0,1) |
| Hemorragia gastrointestinal aguda de origem desconhecida | 1 (<0,1) | 0,(0,0) |
| Diminuição clinicamente significativa na hemoglobina (>2g/dL) e/ou hematocrito (>10%) de origem gastrointestinal definida | 5 (0,2) | 24 (1,1) |
| Diminuição clinicamente significativa na hemoglobina (>2g/dL) e/ou hematócrito (>10%) de origem gastrointestinal supostamente oculta | 10 (0,4) | 53 (2,3) |
| Total* | 20 (0,9) | 81 (3,6) |
Para os seguintes componentes do desfecho composto gastrintestinal pré-definido, não houve eventos em ambos os grupos de tratamento: obstrução da saída gástrica; perfuração gastroduodenal, do intestino delgado ou do intestino grosso; hemorragia do intestino delgado. Todos os eventos compreendendo o desfecho composto gastrintestinal foram avaliados por um grupo de especialistas independente que não tinha conhecimento de qual grupo randomizado de tratamento o paciente fazia parte.
*Em uma análise de tempo para ocorrência de um desfecho, p<0,0001 para a comparação entre o grupo de tratamento com celecoxibe e o grupo de tratamento com omeprazol + diclofenaco para este desfecho.
Segurança Cardiovascular – Estudos em Longo Prazo Envolvendo Pacientes com Pólipos Adenomatosos
Esporádicos
Foram conduzidos dois estudos com celecoxibe envolvendo pacientes com pólipos adenomatosos esporádicos por ex., estudo APC (Adenoma Prevention with Celecoxib) e o estudo PreSAP (Prevention of Spontaneous Adenomatous Polyps). No estudo APC, houve um aumento relacionada à dose no desfecho composto de morte cardiovascular, infarto do miocárdio e acidente vascular encefálico (julgado) com celecoxibe comparado ao placebo por mais de 3 anos de tratamento. O estudo PreSAP não demonstrou um aumento de risco estatisticamente significativo para o mesmo desfecho.
No estudo APC, os riscos relativos comparados ao placebo para o desfecho composto de morte cardiovascular, infarto do miocárdio ou acidente vascular encefálico (julgado) foram 3,4 (95% IC 1,4-8,5) com celecoxibe 400mg duas vezes ao dia e 2,8 (95% IC 1,1-7,2) com celecoxibe 200mg duas vezes ao dia. As taxas cumulativas para o desfecho composto por mais de 3 anos de estudo foram de 3,0% (20/671) e 2,5% (17/685) para grupos de tratamento com celecoxibe 200mg e 400mg duas vezes ao dia, respectivamente, comparadas a 0,9% (6/679) para o grupo placebo. Os aumentos para ambos os grupos de doses de celecoxibe versus placebo foram devidos principalmente ao infarto do miocárdio.
No estudo PreSAP, o risco relativo comparado ao placebo para o mesmo desfecho composto foi de 1,2 (95% IC 0,6-2,4) com celecoxibe 400mg uma vez ao dia. As taxas cumulativas para o desfecho composto por mais de 3 anos foram de 2,3% (21/933) comparadas a 1,9% (12/628 indivíduos), para o grupo placebo.
Segurança Cardiovascular – Estudo de Longa Duração e Prevenção da Doença de Alzheimer com o uso de Anti-inflamatórios (ADAPT
Dados do estudo ADAPT não apresentou um aumento significativo do risco cardiovascular com o celecoxibe 200mg duas vezes por dia em comparação com placebo. O risco relativo em comparação ao placebo para um desfecho semelhante (morte por alteração cardiovascular, infarto do miocárdio ou acidente vascular cerebral – AVC) foi de 1,14 (95% CI 0,61-2,12) com celecoxibe 200mg duas vezes por dia.
Segurança Cardiovascular – Meta-Análise de Estudos com Uso Crônico
Não foi conduzido qualquer estudo clínico de longo prazo controlado e delineado especificamente para avaliar a segurança cardiovascular na administração crônica de celecoxibe com qualquer duração. Entretanto, foi conduzida uma meta-análise dos dados de segurança (eventos adversos considerados sérios pelo investigador) de 39 estudos clínicos completos com celecoxibe, de até 65 semanas de duração, representando 41.077 pacientes (23.030 (56,1%) pacientes expostos ao celecoxibe dose diária total de 200mg-800mg, 13.990 (34,1%) pacientes expostos aos AINEs não seletivos e 4.057 (9,9%) pacientes expostos ao placebo).
Nesta análise, a taxa de eventos considerados para o desfecho composto de morte cardiovascular, infarto do miocárdio não fatal e acidente vascular encefálico não fatal foi similar entre celecoxibe (n=19.773; 0,96 eventos/100 pacientes-ano) e o tratamento com AINEs não seletivos (n=13.990; 1,12 eventos/100 pacientes-ano) (RR=0,90; 95% IC 0,60-1,33). Este padrão de efeito foi mantido com ou sem o uso do ácido acetilsalicílico (?325mg). Houve uma incidência maior de infarto do miocárdio não fatal (RR=1,76; 95% IC 0,93–3,35); entretanto, houve uma tendência de acidente vascular encefálico não fatal menor (RR=0,51; 95% IC 0,23-1,10) e a incidência de morte cardiovascular foi similar (RR=0,57; 95% IC 0,28- 1,14) para celecoxibe comparado aos AINEs não seletivos combinados.
Nesta análise, a taxa de eventos considerados do desfecho composto de morte cardiovascular, infarto do miocárdio não fatal e acidente vascular encefálico não fatal foram de 1,42/100 paciente-ano para o tratamento com celecoxibe (n=7.462) e 1,20/100 pacientes-ano para placebo (n=4.057) (RR=1,11; 95% IC 0,47-2,67). Este padrão de efeito foi mantido com ou sem o uso de ácido acetilsalicilico (?325mg). Houve uma tendência maior de incidência de infarto do miocárdio não fatal (RR=1,56; 95% IC 0,21- 11,90) e de morte cardiovascular (RR=1,26; 95% IC 0,33-4,77), e a de acidente vascular encefálico não fatal foi similar (RR=0,80; 95% IC 0,19-3,31) para celecoxibe comparada ao placebo.
Segurança Cardiovascular
Os resultados de segurança cardiovascular foram avaliados no estudo CLASS (veja acima a descrição do estudo). As taxas cumulativas Kaplan-Meier para os eventos adversos tromboembólicos cardiovasculares sérios relatados pelo investigador (incluindo infarto do miocárdio, embolia pulmonar, trombose venosa profunda, angina instável, ataque isquêmico transitório e acidente cerebrovascular isquêmico) não demonstraram diferenças entre os grupos de tratamento com celecoxibe, diclofenaco ou ibuprofeno. As taxas cumulativas em todos os pacientes no nono mês para celecoxibe, diclofenaco e ibuprofeno foram 1,2%, 1,4% e 1,1% respectivamente. As taxas cumulativas em pacientes que não estavam utilizando o ácido acetilsalicílico no nono mês em cada um dos 3 grupos de tratamento foram menores que 1%. As taxas cumulativas para infarto do miocárdio em pacientes não usuários de ácido acetilsalicílico no nono mês em cada um dos 3 grupos de tratamento foram menores que 0,2%. Não havia grupo placebo no estudo CLASS, o que limita a possibilidade de determinar se os 3 fármacos testados não tinham aumento de risco de eventos cardiovasculares ou se eles todos tiveram o risco aumentado em um grau similar.
Características Farmacológicas
Propriedades Farmacodinâmicas
O mecanismo de ação do celecoxibe é via inibição da síntese das prostaglandinas, principalmente pela inibição da enzima ciclooxigenase 2 (COX-2). Em concentrações terapêuticas em humanos, celecoxibe não inibe a ciclooxigenase 1 (COX-1). A COX-2 é induzida em resposta a estímulos inflamatórios. Isto leva à síntese e ao acúmulo de prostanoides inflamatórios, em particular a prostaglandina E2, causando inflamação, edema e dor. O celecoxibe age como um agente anti-inflamatório, analgésico e antipirético em modelos animais pelo bloqueio da produção de prostanoides inflamatórios via inibição da COX-2. Em modelos animais de tumores de colo, celecoxibe reduziu a incidência e a multiplicidade dos tumores. Estudos in vivo e ex vivo mostram que celecoxibe tem afinidade muito baixa pela enzima COX-1 de expressão constitutiva. Consequentemente, em doses terapêuticas, celecoxibe não tem efeito sobre prostanoides sintetizados pela ativação da COX-1, não interferindo, portanto, nos processos fisiológicos relacionados à COX-1 nos tecidos, particularmente no estômago, intestino e plaquetas.
Propriedades Farmacocinéticas
Absorção
A farmacocinética do celecoxibe foi avaliada em aproximadamente 1.500 indivíduos. Quando administrado em condições de jejum, o celecoxibe é bem absorvido atingindo concentrações plasmáticas máximas após aproximadamente 2-3 horas. A biodisponibilidade oral das cápsulas é de cerca de 99% em relação à administração em suspensão (forma farmacêutica oral de disponibilidade ideal). Em condições de jejum, tanto os níveis plasmáticos máximos (Cmáx) como as áreas sob a curva (AUC) são quase proporcionais à dose de até 200mg duas vezes ao dia; em doses mais altas, ocorrem aumentos menos proporcionais na Cmáx e AUC.
Distribuição
A taxa de ligação às proteínas plasmáticas, que é independente da concentração, é de cerca de 97% em concentrações plasmáticas terapêuticas e o celecoxibe não se liga preferencialmente aos eritrócitos no sangue.
Metabolismo
O metabolismo de celecoxibe é mediado principalmente pela via citocromo P450 2C9. Foram identificados 3 metabólitos, inativos como os inibidores da COX-1 e COX-2, no plasma humano: álcool primário, o ácido carboxílico correspondente e seu glicuronídeo conjugado.
A atividade do citocromo P450 2C9 é reduzida em indivíduos com polimorfismos genéticos que levam à atividade reduzida da enzima, tais como aquelas homozigóticas para o polimorfismo CYP2C9*3.
Em um estudo farmacocinético de celecoxibe 200mg administrado uma vez ao dia em voluntários sadios, genotipados como CYP2C9*1/*1, CYP2C9*1/*3 ou CYP2C9*3/*3, a média de Cmáx e AUC0-24 de celecoxibe no 7o dia foi de aproximadamente 4 vezes e 7 vezes, respectivamente, em indivíduos genotipados como CYP2C9*3/*3 comparados aos outros genótipos. Em três estudos diferentes de dose única, envolvendo um total de 5 indivíduos genotipados como CYP2C9*3/*3, AUC0-24 aumentada com dose única em aproximadamente 3 vezes comparado aos metabolizadores normais. É estimado que a frequência do genótipo homozigoto *3/*3 é 0,3-1,0% entre os diferentes grupos étnicos.
O celecoxibe deve ser administrado com cautela a pacientes com deficiência ou suspeita de deficiência de metabolizadores CYP2C9 baseados no histórico prévio/experiência com outros substratos CYP2C9. Considerar o início de tratamento com a metade da menor dose recomendada.
Excreção
O celecoxibe é eliminado predominantemente por metabolismo hepático, com menos de 1% da dose excretada inalterada na urina. Após múltiplas doses, a meia-vida de eliminação é de 8 a 12 horas e o clearance é de aproximadamente 500mL/min. Com administrações múltiplas, as condições do estado de equilíbrio são atingidas até o 5o dia.
A variação dos parâmetros farmacocinéticos (AUC, Cmáx e meia-vida) entre indivíduos é da ordem de 30%. O volume médio de distribuição é de aproximadamente 500 litros por 70kg em indivíduos jovens adultos saudáveis, indicando extensa distribuição em todos os tecidos. Estudos pré-clínicos indicam que o celecoxibe atravessa a barreira hematoencefálica.
Efeitos dos alimentos
A administração com alimentos (refeição rica em gorduras) retarda a absorção do celecoxibe resultando em um Tmáx de cerca de 4 horas e aumenta a biodisponibilidade em cerca de 20%.
Em voluntários adultos saudáveis, a exposição sistêmica global (AUC) de celecoxibe foi equivalente quando o celecoxibe foi administrado como cápsulas intactas ou cápsulas abertas cujo conteúdo foi misturado ao molho de maçã. Não houve alterações significantes no Cmáx, Tmáx ou T1/2 após a administração do conteúdo das cápsulas abertas misturadas ao molho de maçã.
Populações Especiais
Idosos
Na população com idade >65 anos, ocorre um aumento de 1,5 a 2 vezes a média de Cmáx e de AUC para o celecoxibe. Esta é uma alteração predominantemente relacionada ao peso em vez de ser relacionada à idade, os níveis de celecoxibe ficando mais altos em indivíduos de menor peso e, consequentemente, mais altos na população idosa, que geralmente apresenta peso médio inferior ao peso médio da população mais jovem.
Portanto, as mulheres idosas tendem a apresentar concentrações plasmáticas do fármaco mais altas do que os homens idosos. Geralmente não é necessário ajuste de dose. No entanto, para pacientes idosos com menos de 50kg, deve-se introduzir o tratamento com a menor dose recomendada.
Raça
Uma meta-análise de estudos farmacocinéticos sugeriu que a AUC de celecoxibe é aproximadamente 40% maior em pacientes da raça negra quando comparada a pacientes da raça branca. A causa e o significado clínico desse achado não são conhecidos.
Insuficiência hepática
As concentrações plasmáticas de celecoxibe em pacientes com insuficiência hepática leve (classe A de Child-Pugh) não são significativamente diferentes dos controles pareados por sexo e idade. Em pacientes com insuficiência hepática moderada (classe B de Child-Pugh) a concentração plasmática de celecoxibe é cerca de 2 vezes a do grupo controle.
Insuficiência renal
A farmacocinética do celecoxibe em indivíduos idosos com redução do ritmo de filtração glomerular (RFG) relacionada à idade (RFG médio > 65mL/min/1,73m2) e em pacientes com insuficiência renal crônica estável (RFG entre 35 e 60mL/min/1,73m2) foi comparável a de indivíduos com função renal normal. Não foi descoberta relação significante entre creatinina sérica (ou clearance de creatinina) e clearance de celecoxibe. Em insuficiência renal grave, não é esperada uma alteração do clearance de celecoxibe uma vez que a principal via de eliminação é hepática para metabólitos inativos.
Efeitos renais
Os papéis das enzimas COX-1 e COX-2 na fisiologia renal ainda não são plenamente conhecidos. O celecoxibe reduz a excreção urinária de PGE2 e da 6-ceto-PGF1? (um metabólito da prostaciclina), mas não altera o nível sérico de tromboxano B2 (TXB2), e a excreção urinária de 11-deidro-TXB2, um metabólito do tromboxano inalterado (ambos resultantes da atividade da COX-1). Estudos específicos demonstraram que celecoxibe não produz diminuição da taxa de filtração glomerular em idosos ou em pacientes com insuficiência renal crônica. Estes estudos também demonstraram reduções transitórias na excreção fracionada de sódio.
Nos estudos conduzidos em pacientes com artrite, uma incidência comparável de edema periférico foi observada em relação à verificada com inibidores inespecíficos da COX (que também apresentam atividade inibitória da COX-2). Isto foi mais evidente em pacientes recebendo terapia diurética concomitante. No entanto, não foram observados aumentos das incidências de hipertensão e insuficiência cardíaca e o edema periférico foi leve e autolimitante.
Dados de Segurança Pré-clínico
Dados de segurança não clínicos revelaram a ausência de risco especial para humanos com base nos estudos convencionais de toxicidade de dose repetida, mutagenicidade ou carcinogenicidade.
O celecoxibe em doses orais ?150mg/kg/dia (aproximadamente 2 vezes a dose de exposição humana em 200mg duas vezes ao dia, conforme medido por AUC0-24), causou um aumento da incidência de defeitos do septo ventricular, um evento raro, e alterações fetais, tais como costelas fundidas, esterno fundido e esterno disforme quando coelhos foram tratados durante toda a organogênese.
Foi observado um aumento dose-dependente na hernia diafragmática quando os ratos receberam celecoxibe em doses orais ? 30mg/kg/dia (aproximadamente 6 vezes a dose de exposição humana com base na AUC0-24 em 200mg duas vezes ao dia) durante toda a organogênese. Estes efeitos são esperados com a inibição da síntese de prostaglandinas. Em ratos, a exposição ao celecoxibe durante o desenvolvimento embrionário inicial resultou em perdas pré-implantação e pós-implantação, e reduziu a sobrevivência embrionária/fetal.
Toxicologia animal
Um aumento na incidência de achados experimentais de espermatocele com ou sem alterações secundárias, assim como hipoespermia epididimal mínima, assim como insignificante dilatação dos túbulos seminíferos tem sido encontrado em ratos jovens. Estes achados reprodutivos aparentemente relacionados ao tratamento, não aumentaram a incidência ou severidade com dose, e podem indicar uma exacerbação de uma condição espontânea. Achados reprodutivos similares não foram observados em estudos com cachorros jovens e adultos ou em ratos adultos tratados com celecoxibe. A significância clínica desta observação é desconhecida.
Cuidados de Armazenamento
Dicoxibe deve ser conservado em temperatura ambiente (entre 15 e 30°C), protegido da luz e umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características Físicas:
Cápsula de gelatina dura, opaca, branca a esbranquiçada com as marcas de identificação: Corpo com anel amarelo gravado “200” em branco. Tampa com anel gravado “7767” em branco. Cada anel não circunda completamente a cápsula.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS - 1.2110.0336
Farm. Resp.:
Edina S. M. Nakamura - CRF-SP nº 9258
Registrado por:
Wyeth Indústria Farmacêutica Ltda.
Rua Alexandre Dumas, 1.860
CEP 04717-904 – São Paulo – SP
CNPJ nº 61.072.393/0001-33
Fabricado por:
Neolpharm Inc.
Caguas – Porto Rico
Ou
Fabricado por:
Pfizer Pharmaceuticals, LLC
Vega Baja – Porto Rico
Embalado e Importado por:
Wyeth Indústria Farmacêutica Ltda.
Rodovia Presidente Castelo Branco, nº 32501, Km 32,5
CEP 06696-000 - Itapevi - SP
Indústria Brasileira.
Sac: 0800-7710575
Venda sob prescrição médica.
Só pode ser vendido com retenção da receita.
informações complementares
| Fabricante |
| LABORATORIOS WYETH-WHITEHALL |
| Princípio ativo |
| Celecoxibe |
| Categoria do medicamento |
| Medicamentos de A-Z |
