para o que é indicado e para que serve?
Para que serve Effient é indicado para a redução da taxa de eventos aterotrombóticos (morte cardiovascular, infarto do coração e derrame cerebral, incluindo trombose de stent) nas doenças coronarianas agudas tratadas por intervenção coronariana percutânea (angioplastia).Continue lendo...
ofertas de
Effient - 10Mg C 30 Compr...
ofertas de Effient - 10Mg C 30 Compr...
R$ 326,82
R$ 347,64
R$ 349,33
R$ 349,83
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Effient é indicado para a redução da taxa de eventos aterotrombóticos (morte cardiovascular, infarto do coração e derrame cerebral, incluindo trombose de stent) nas doenças coronarianas agudas tratadas por intervenção coronariana percutânea (angioplastia).
Contraindicação
É contraindicado em pacientes com: sangramento patológico ativo, história conhecida de ataque isquêmico transitório (circulação cerebral inadequada temporária) ou derrame cerebral, insuficiência hepática grave (mau funcionamento grave do fígado) e conhecida hipersensibilidade ao cloridrato de prasugrel ou a qualquer componente do comprimido acetilsalicílico diariamente (75 mg a 325 mg), salvo contraindicações. Recomenda-se prosseguir o tratamento por 12 meses, a menos que a interrupção de Effient seja clinicamente indicada.
Administração em pacientes idosos (? 75 anos). Geralmente, Effient não é recomendado em pacientes com ? 75 anos de idade devido ao maior risco de sangramento fatal e intracraniano e seu benefício incerto, exceto em situações específicas de alto risco em que seu efeito pareça ser maior e seu uso possa ser considerado, como em pacientes com histórico de infarto agudo do miocárdio ou portadores de diabetes. Effient quando indicado nesta população, deve ser iniciado com dose de ataque de 60 mg e, em seguida, considerar a administração de uma dose diária de 5 mg como alternativa à dose de 10 mg. O aumento da exposição ao metabólito ativo do cloridrato de prasugrel na dose de 10 mg diária e, possivelmente uma maior sensibilidade ao sangramento em pacientes ? 75 anos de idade, indica a consideração por uma dose de 5 mg ao dia.
Administração em pacientes com peso < 60 kg Effient deve ser iniciado com uma dose de ataque de 60 mg e, em seguida, prosseguir com uma dose diária de 5 mg, uma vez que indivíduos com peso corporal < 60 kg recebendo 10 mg uma vez ao dia apresentam risco aumentado de sangramento, por aumento da concentração plasmática do metabólito ativo de cloridrato de prasugrel Administração em pacientes com insuficiência renal.
Não é necessário ajuste de dose em pacientes com insuficiência renal, incluindo pacientes com doença renal em fase terminal Administração em pacientes com insuficiência hepática. Não é necessário ajuste de dose em indivíduos com insuficiência hepática leve a moderada (Child Pugh Classes A e B).
Effient não deve ser utilizado em pacientes com doença hepática grave (Child Pugh Classe C)
Crianças e adolescentes Devido à falta de dados sobre segurança e eficácia, o uso de Effient não é recomendado em pacientes com idade inferior a 18 anos.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico. Este medicamento não deve ser partido, aberto ou mastigado.
Como usar
Effient deve ser administrado por via oral, independente das refeições.
Administração em Adultos: Effient deve ser iniciado com uma dose de ataque de 60 mg e, em seguida, prosseguir com uma dose de 10 mg, administrada uma vez por dia.
Em pacientes com Infarto Agudo do Miocárdio sem elevação do segmento ST a dose de ataque deve ser administrada no momento da intervenção coronariana percutânea (ICP).
Effient pode ser administrado com ou sem alimentos. Pacientes que estejam sob tratamento com Effient também devem tomar ácido.
Precauções
Advertências e Precauções: Geralmente, Effient não é recomendado em pacientes com ? 75 anos de idade devido ao maior risco de sangramento fatal e intracraniano e seu benefício incerto, exceto em situações específicas de alto risco em que seu efeito pareça ser maior e seu uso possa ser considerado, como em pacientes com histórico de infarto agudo do miocárdio ou portadores de diabetes.
Effient deve ser utilizado com cautela em: pacientes com propensão para sangramento (por exemplo, devido a trauma recente, cirurgia recente, úlcera péptica ativa) ou com insuficiência hepática grave; insuficiência renal de moderada a grave; pacientes com peso corporal < 60 kg e pacientes que tomam medicamentos que possam aumentar o risco de hemorragia, incluindo anticoagulantes orais, anti-inflamatórios não esteroidais (pergunte ao seu médico mais informações sobre essa classe de medicamentos) e fibrinolíticos (medicamentos que dissolvem coágulos). Não foram realizados estudos sobre os efeitos de Effient na capacidade de dirigir e utilizar máquinas. Espera-se que Effient não tenha qualquer influência ou tenha influência desprezível sobre a capacidade de dirigir e utilizar máquinas.
Pacientes com hipersensibilidade ao Effient (cloridrato de prasugrel) ou a qualquer outro medicamento da mesma classe – tienopiridinas (como por exemplo, o cloridrato de ticlopidina e o bissulfato de clopidogrel), podem apresentar reação alérgica incluindo erupção na pele Effient não deve ser iniciado em pacientes que serão submetidos à cirurgia para revascularização do miocárdio, devendo ser descontinuado 7 dias antes do procedimento, quando possível. O medicamento deve ser usado com cautela neste grupo de pacientes. Este medicamento não deve ser utilizado por mulheres grávidas ou amamentando, sem orientação médica. Este medicamento contém Lactose. Portanto, deve ser usado com cautela em pacientes que apresentem intolerância à lactose Pacientes com problemas hereditários raros de intolerância à galactose, deficiência de lactase LAPP ou de má absorção de glicose e/ou galactose não devem tomar Effient.
Reações Adversas
As seguintes reações adversas foram relatadas pelos pacientes em estudos clínicos com Effient:
Reação comum: contusão, hematoma, epistaxe (sangramento nasal), hematoma no local da punção, hemorragia no local da punção, hemorragia gastrintestinal, equimose (extravasamento sanguíneo), hematúria (presença de sangue na urina), exantema (um tipo de erupção da pele) e anemia.
Reação incomum: hematoma subcutâneo, hemorragias após procedimentos, hemoptise (expectoração sanguínea), hemorragia retal, hemorragia gengival, hematoquesia (evacuação de sangue), hemorragia retroperitoneal e hemorragia ocular.
Reação rara: trombocitopenia (diminuição do número de plaquetas).
Relatos espontâneos: A seguinte lista de eventos indesejáveis (reações adversas) é baseada em relatos espontâneos pós-lançamento e correspondem à frequência de relatos fornecidos:
Reação rara: hipersensibilidade incluindo angioedema (erupção cutânea)
Reação muito rara: púrpura trombocitopênica trombótica (doença hematológica grave, caracterizada por doença dos pequenos vasos, capilares e aumento da agregação plaquetária). Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento Informe também à empresa através do seu serviço de atendimento.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos Nesse caso, informe seu médico ou cirurgião-dentista.
Composição
Cada comprimido revestido contém:
Effient 5 mg: cloridrato de prasugrel 5,49 mg, equivalente a 5 mg de prasugrel. Excipientes: celulose microcristalina, manitol, croscarmelose sódica, hipromelose, estearato de magnésio, lactose monoidratada, dióxido de titânio, triacetina e óxido de ferro amarelo.
Effient 10 mg: cloridrato de prasugrel 10,98 mg, equivalente a 10 mg de prasugrel Excipientes: celulose microcristalina, manitol, croscarmelose sódica, hipromelose, estearato de magnésio, lactose monoidratada, dióxido de titânio, triacetina, óxido de ferro vermelho e óxido de ferro amarelo.
Superdosagem
O uso de uma grande quantidade de Effient pode levar a um retardo na coagulação do sangue (alteração do tempo de sangramento) e possíveis complicações hemorrágicas. Não há um antídoto (medicamento ou substância que reverta o efeito orgânico de outro medicamento ou substância) para Effient; no entanto, se for necessária a correção imediata da coagulação, pode-se considerar a transfusão de plaquetas (produto derivado do sangue).
Interação Medicamentosa
Uso concomitante de Cloridrato de Prasugrel (substância ativa) com outros medicamentos – Cloridrato de Prasugrel (substância ativa) pode ser administrado concomitantemente com medicamentos metabolizados pelas enzimas do citocromo P450 (incluindo as estatinas) ou medicamentos que sejam indutores ou inibidores das enzimas do citocromo P450. Cloridrato de Prasugrel (substância ativa) pode também ser administrado concomitantemente com ácido acetilsalicílico (AAS), heparina, digoxina e medicamentos que elevam o pH gástrico, incluindo inibidores da bomba de prótons e bloqueadores H2.
Embora não tenha sido avaliado em estudos específicos de interação, Cloridrato de Prasugrel (substância ativa) foi coadministrado, em estudos clínicos Fase 3, com heparina de baixo peso molecular, bivalirudina e inibidores da GPIIb/IIIa sem evidência de interações adversas clinicamente significativas.
Essas informações encontram-se detalhadas a seguir
Efeitos de Cloridrato de Prasugrel (substância ativa) sobre outros medicamentos
Varfarina
A administração concomitante de Cloridrato de Prasugrel (substância ativa) com outros derivados cumarínicos diferentes da varfarina não foi estudada. Devido ao potencial de aumento do risco de sangramento, varfarina (ou outros derivados cumarínicos) e Cloridrato de Prasugrel (substância ativa) devem ser coadministrados com cautela.
Anti-inflamatórios não esteroidais (AINEs)
A administração concomitante de Cloridrato de Prasugrel (substância ativa) com uso crônico de AINEs não foi estudada. Devido ao potencial de aumento do risco de sangramento, a coadministração de Cloridrato de Prasugrel (substância ativa)e o uso crônico de AINEs devem ser feitos com cautela.
Interação Alimentícia
Suco de toranja (grapefruit) não devem ter um efeito significativo sobre a farmacocinética do seu metabólito ativo.
Ação da Substância
Resultados de eficácia
Síndrome Coronariana Aguda (SCA)
O estudo Fase 3 TRITON comparou Cloridrato de Prasugrel (substância ativa) com clopidogrel, ambos coadministrados com ácido acetilsalicílico (AAS) e outras terapias-padrão. TRITON foi um estudo de grupos paralelos, multicêntrico internacional, randomizado, duplo-cego, com 13.608 pacientes. Os pacientes tinham SCA com risco moderado ou elevado, angina instável (AI), infarto do miocárdio sem elevação do segmento ST (IAM sem supra de ST) ou infarto do miocárdio com elevação do segmento ST (IAM com supra de ST) e submetidos à intervenção coronariana percutânea (ICP). Pacientes com AI/IAM sem supra de ST dentro de 72 horas dos sintomas ou com IAM com supra de ST de 12 horas a 14 dias dos sintomas foram randomizados após conhecimento da anatomia coronariana. Os pacientes com IAM com supra de ST dentro de 12 horas dos sintomas e com previsão de ICP primária puderam ser randomizados sem conhecimento da anatomia coronariana.
Para todos os pacientes, a dose de ataque pôde ser administrada a qualquer tempo entre a randomização e 1 hora após o paciente ter deixado o laboratório de cateterismo. Os pacientes randomizados para receber Cloridrato de Prasugrel (substância ativa) (dose de ataque de 60 mg, seguida de uma dose de 10 mg, uma vez por dia) ou clopidogrel (dose de ataque de 300 mg, seguida de uma dose de 75 mg, uma vez por dia) foram tratados durante uma mediana de 14,5 meses (máximo de 15 meses, com um mínimo de 6 meses de acompanhamento). Os pacientes também receberam AAS (dose de 75 mg a 325 mg, uma vez por dia). Uso de qualquer tienopiridino dentro de 5 dias antes da randomização foi um critério de exclusão.
Outras terapias, como a heparina e inibidores GPIIb/IIIa, foram administradas a critério do médico. Aproximadamente 50% dos pacientes (em cada grupo de tratamento) receberam inibidores da GPIIb/IIIa em suporte à ICP (nenhuma informação avaliou relativamente o tipo de inibidor GPIIb/IIIa usado). Aproximadamente 98% dos pacientes (em cada grupo de tratamento) receberam antitrombina (heparina, heparina de baixo peso molecular, bivalirudina, ou outro agente) diretamente em suporte à ICP.
O desfecho primário do estudo clínico foi o tempo até a primeira ocorrência de morte cardiovascular, infarto do miocárdio não fatal ou de acidente vascular cerebral não fatal. A análise do desfecho combinado em toda população com SCA (grupos com AI/IAM sem supra de ST e com IAM com supra de ST combinados) apresentou superioridade estatística de Cloridrato de Prasugrel (substância ativa) versus clopidogrel (p < 0,001).
O PRINCIPLE-TIMI 44 foi um estudo randomizado, duplo-cego, cruzado de duas fases de prasugrel comparado com altas doses de clopidogrel em pacientes sendo submetidos à ICP planejada. Na fase de dose de ataque do estudo, 201 pacientes foram randomizados para clopidogrel 600 mg ou prasugrel 60 mg cerca de uma hora antes do início esperado do cateterismo cardíaco para realização da ICP. O objetivo primário para esta etapa do estudo foi a inibição da agregação plaquetária com 20 µmol/L de ADP, mensurada após seis horas.
Na fase de manutenção, 28 dias, uma comparação cruzada de prasugrel 10 mg/dia vs clopidogrel 150 mg/dia, cujo desfecho primário foi a inibição de agregação plaquetária de ambos os fármacos mensurada após 14 dias. Entre os pacientes submetidos à ICP planejada, dose de ataque com 60 mg de prasugrel resultou em maior inibição plaquetária que 600 mg de dose de ataque com clopidogrel. A terapia de manutenção com prasugrel 10 mg/dia resultou em um maior efeito antiplaquetário do que 150 mg/ dia de clopidogrel.
Toda população com SCA Cloridrato de Prasugrel (substância ativa) demonstrou eficácia superior, comparado ao clopidogrel, na redução do desfecho primário combinado, bem como nos desfechos secundários pré-definidos, incluindo trombose de stent (vide Tabela 1). O benefício de prasugrel foi aparente dentro dos 3 primeiros dias e persistiu até o final do estudo. A eficácia superior foi acompanhada por um aumento dos sangramentos maiores.
A população de pacientes era formada por 92% de caucasianos, 26% do sexo feminino e 39% tinham 65 anos ou mais. Os benefícios associados ao Cloridrato de Prasugrel (substância ativa) foram independentes da utilização de outras terapias cardiovasculares agudas e de longo prazo, incluindo heparina/heparina de baixo peso molecular, bivalirudina, inibidores GPIIb/IIIa intravenosos, drogas redutoras de lipídios, beta-bloqueadores e inibidores da enzima de conversão da angiotensina. A eficácia do Cloridrato de Prasugrel (substância ativa) foi independente da dose de AAS (75 mg a 325 mg, uma vez por dia).
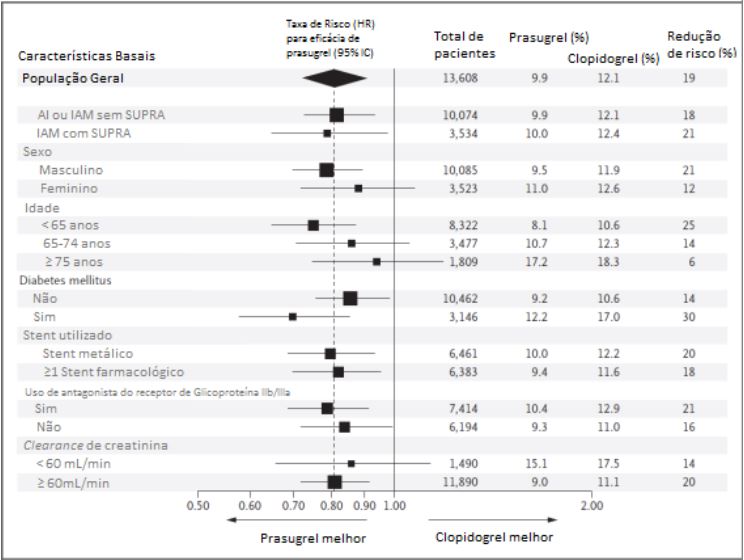
O uso de anticoagulantes orais, drogas antiplaquetárias fora do estudo e uso crônico de anti-inflamatórios não esteroidais (AINEs) não foi permitido no estudo TRITON. Em toda a população com SCA, Cloridrato de Prasugrel (substância ativa) foi associado a uma menor incidência de morte cardiovascular, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal, comparado ao clopidogrel, independentemente de características de base como idade, sexo, peso corporal, região geográfica, uso de inibidores GPIIb/IIIa e tipo de stent. O benefício foi principalmente devido a uma diminuição significante no infarto do miocárdio não fatal.
Indivíduos com diabetes apresentaram reduções significativas nos desfechos combinados primário e em todos os secundários.
O benefício observado de prasugrel em pacientes ? 75 anos foi menor do que o observado em pacientes < 75 anos. Pacientes ? 75 anos estavam em maior risco de sangramento, inclusive fatal. Pacientes ? 75 anos nos quais o benefício de prasugrel foi mais evidente incluem aqueles com diabetes, IAM com supra, maior risco de trombose de stent, ou eventos recorrentes.
Pacientes com histórico de ataque isquêmico transitório (AIT) ou um histórico de acidente vascular cerebral isquêmico por mais que 3 meses antes da terapia com
Cloridrato de Prasugrel (substância ativa) não tiveram redução nos desfechos combinados primários.
Tabela 1: Pacientes com Desfechos Clínicos na Análise Primária do Estudo TRITON:
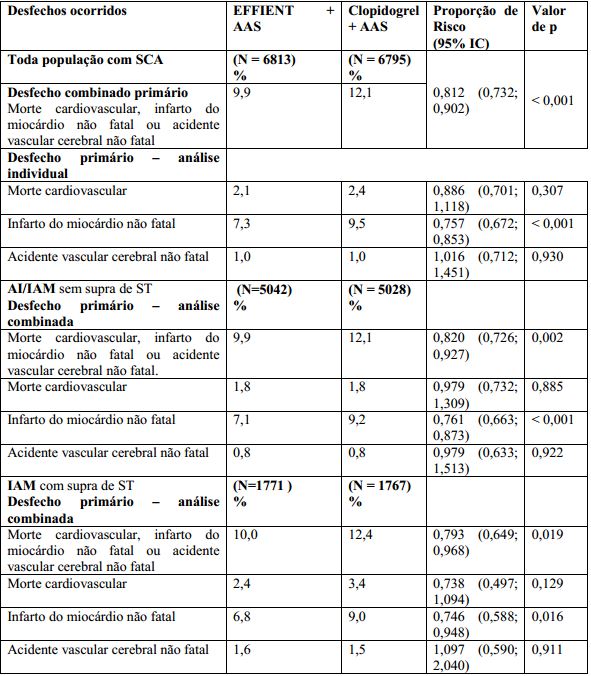
Cloridrato de Prasugrel (substância ativa) foi associado a uma redução de 52 % de trombose de stent nos 15 meses do período de acompanhamento. A redução de trombose de stent com o uso de Cloridrato de Prasugrel (substância ativa) foi observada tanto antes como após 30 dias para os stents farmacológicos e stents metálicos.
Em toda a população com SCA, a análise de cada desfecho combinado secundário demonstrou um significante benefício (p < 0,001) de prasugrel versus clopidogrel. Estes incluíram definitiva ou provável trombose devido ao uso de stent até o final do estudo (1,1 % vs 2,4 %; PR 0,498; IC 0,364; 0,683), morte cardiovascular, infarto do miocárdio não fatal, ou necessidade de cirurgia de revascularização miocárdica (CRM) de urgência em até 30 dias (5,9% vs 7,4%; PR 0,784; IC 0,688; 0,894); todas as causas de morte, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal até o final do estudo (10,2% vs 12,3 %; PR 0,831; IC 0,751; 0,919); morte cardiovascular, infarto do miocárdio não fatal, acidente vascular cerebral não fatal, ou evento de re-hospitalização por evento isquêmico cardíaco até o final do estudo (12,3 % vs 14,6 %; PR 0,838; IC 0,762; 0,921).
A análise de todos os casos de morte não demonstrou nenhuma diferença significativa entre prasugrel e clopidogrel em toda população com SCA (3,0 % vs 3,2 %), na população com AI/IAM sem supra de ST (2,58% vs 2,41%) e em população com IAM com supra de ST (3,28% vs 4,31%).
Nos pacientes que sobreviveram a um acidente vascular cerebral ou infarto do miocárdio durante o estudo, Cloridrato de Prasugrel (substância ativa) foi associado a uma redução na incidência de desfechos primários subsequentes (7,8% para Cloridrato de Prasugrel (substância ativa) e 11,9% para clopidogrel). Pacientes em tratamento com Cloridrato de Prasugrel (substância ativa) e que forem vítimas de AIT ou AVC devem ter o seu uso descontinuado.
Embora o sangramento tenha sido aumentado com prasugrel, uma análise do desfecho combinado de morte por qualquer causa, infarto do miocárdio não fatal, acidente vascular cerebral não fatal e grandes sangramentos classificados pelos critérios do grupo TIMI (TIMI, do inglês Trombolysis In Myocardial Infaction) não relacionadas à cirurgia de revascularização do miocárdio (CABG, do inglês Coronary Artery Bypass Graft), benefício clínico líquido, favoreceu Cloridrato de Prasugrel (substância ativa) em comparação ao clopidogrel [Coeficiente de Risco (HR) de 0,87; Intervalo de Confiança (IC) de 95%, 0,79 a 0,95, p = 0,004]. No estudo TRITON, para cada 1.000 pacientes tratados com Cloridrato de Prasugrel (substância ativa), houve 23 pacientes a menos com infarto do miocárdio e 6 pacientes a mais com grandes sangramentos classificados pelos critérios do grupo TIMI e não relacionadas a CABG, em comparação aos pacientes tratados com clopidogrel.
Uma análise de um subgrupo post hoc identificou três subgrupos de interesse nos quais houve menor eficácia clínica e maiores níveis absolutos de sangramento do que a coorte geral, resultando em dano clínico ou menor benefício clínico líquido.
Estes incluíam pacientes com histórico de AVC ou ataque isquêmico transitório antes da seleção; por estas razões, Cloridrato de Prasugrel (substância ativa) é contraindicado para esta população. Outros subgrupos estão entre os idosos e pacientes com peso corporal < 60 kg, nos quais não foram observados benefícios líquidos e nem danos líquidos; supôs-se que maiores níveis do metabólito ativo de prasugrel podem ter levado a um maior risco de sangramento devido à uma disponibilidade alterada do fármaco ou menor peso corporal.
Em contraste, a grande maioria dos pacientes sem nenhum destes fatores de risco tiveram significantes benefícios líquidos com o regime de prasugrel estudado, em comparação com o regime do clopidogrel (razão de risco, 0,80; IC 95%, 0,71 a 0,89; p<0,001).
Estudos de fase 2 avaliaram a atividade plaquetária em dois desenhos cruzados de 28 dias após o tratamento com prasugrel e clopidogrel, onde os indivíduos foram randomicamente designados a um dos grupos de tratamento e após 14 dias um crossover era realizado. As particularidades do estudo são descritas a seguir.
O estudo PRINCIPLE – TIMI 44 (Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44) consistiu de um estudo randomizado, duplo-cego, cruzado de duas fases de prasugrel comparado com altas doses de clopidogrel em pacientes sendo submetidos à ICP planejada. O objetivo primário da fase da dose de ataque (prasugrel 60 mg vs clopidogrel 600 mg) foi a inibição da agregação plaquetária com 20 µmol/L de ADP após 6 horas.
Neste estudo, 201 indivíduos foram randomizados. A inibição da agregação plaquetária em 6 horas foi significativamente maior em indivíduos recebendo prasugrel 60 mg (média do desvio padrão, 74,8 13,0%) comparado com clopidogrel 600 mg (31,8 21,1%; p<0,0001). Durante a fase da dose de manutenção, a inibição de agregação plaquetária com 20 µmol/L de ADP foi maior que em indivíduos recebendo prasugrel 10 mg (61,3 17,8%) comparado com clopidogrel 150 mg (46,1 21,3%; p<0,0001). Os resultados foram consistentes por todos os desfechos secundários chave; diferenças significativas surgiram aos 30 minutos e persistiram por todos os pontos no período subsequente.
O SWAP (SWitching Anti Platelet) foi um estudo de fase 2, multicêntrico, randomizado, duplocego e controlado. Após run-in com terapia diária de clopidogrel 75 mg e aspirina por 10 a 14 dias, os pacientes foram randomizados para 1 dos 3 tratamentos a seguir: dose de ataque (DA) de placebo/dose de manutenção (DM) de clopidogrel 75 mg, DA de placebo/DM de prasugrel 10 mg, ou DA de prasugrel 60mg/ DM de 10 mg.
Do total de 139 pacientes randomizados, 100 foram elegíveis para análise. A agregação plaquetária em uma semana (desfecho primário) foi menor após DM de prasugrel comparada com DM de clopidogrel (41,1% vs 55,0%, p<0,0001), e também foi menor no grupo prasugrel DA+DM comparada com DM de clopidogrel (41,0% vs 55,0%, p<0,0001). Após 2 horas, a DA de prasugrel resultou em maior inibição plaquetária quando comparada com outros regimes posológicos.
Na troca da terapia de clopidogrel para a de prasugrel após um evento de SCA, após a dose de ataque ou durante a fase de manutenção, os efeitos farmacodinâmicos não aumentaram o risco de sangramento.
Características Faramcológicas
Descrição
Cloridrato de Prasugrel (substância ativa) (cloridrato de prasugrel) é um antagonista do receptor ADP das plaquetas e, portanto, inibe a ativação e a agregação plaquetária. O cloridrato de prasugrel tem fórmula empírica C20H20FNO3S•HCl, representando um peso molecular de 409,90. O nome químico é cloridrato de (±)-2-[2-Acetiloxi-6,7-dihidrotieno[3,2-c]piridino-5(4H)-il]-1-ciclopropil-2-(2-fluorofenil) etanona. É um sólido de coloração que varia do branco ao marrom claro.
Propriedades Farmacodinâmicas
Cloridrato de Prasugrel (substância ativa) (cloridrato de prasugrel) é um inibidor da ativação e agregação plaquetária através da ligação irreversível de seu metabólito ativo aos receptores plaquetários ADP da classe P2Y12. Uma vez que as plaquetas participam do início e/ou da evolução de complicações trombóticas de doença aterosclerótica, a inibição da função plaquetária pode resultar na redução da taxa de eventos cardiovasculares como mortes, infarto do miocárdio ou acidente vascular cerebral (AVC).
Após a dose de ataque de 60 mg de cloridrato de prasugrel, a inibição da agregação plaquetária induzida por ADP ocorre em 15 minutos para 5 mcM de ADP e, em 30 minutos, para 20 mcM de ADP. A inibição máxima da agregação plaquetária para 5mcM de ADP é de 83% e, para 20 mcM de ADP, é de 79%, com 89% de indivíduos sadios e pacientes com doença coronariana estável atingindo, pelo menos, 50% de inibição da agregação plaquetária até 1 hora para ambas concentrações de ADP. A inibição da agregação plaquetária mediada por prasugrel apresenta uma baixa variabilidade em cada indivíduo (9%) e entre diferentes indivíduos (12%) em ambas as concentrações de 5 mcM e 20 mcM de ADP.
O estado de equilíbrio médio da inibição da agregação plaquetária foi de 69% e 74%, respectivamente, para 20 mcM e 5 mcM de ADP e foi alcançado após 3 a 5 dias da dose de manutenção de 10 mg, precedida da dose de ataque de cloridrato de prasugrel. Mais de 98% de indivíduos apresentaram ? 20% de inibição da agregação plaquetária durante a dose de manutenção.
A agregação plaquetária retorna gradualmente aos valores basais após 7 a 9 dias da administração da dose de ataque de 60 mg de cloridrato de prasugrel e após 5 dias da interrupção da dose de manutenção no estado de equilíbrio.
Propriedades farmacocinéticas
Dizeres Legais
DIZERES LEGAIS Registro MS – 1 0454 0178 Farm Resp : Eduardo Mascari Tozzi – CRF-SP nº 38 995 Fabricado por: ELI LILLY AND COMPANY, Indianápolis, EUA Embalado por: LILLY S A , Alcobendas, Espanha Importado e comercializado por: DAIICHI SANKYO BRASIL FARMACÊUTICA LTDA Alameda Xingu, 766 Alphaville – Barueri – SP CNPJ 60 874 187/0001-84 Indústria Brasileira Serviço de Apoio ao Consumidor: 08000-556596 www daiichisankyo com br
VENDA SOB PRESCRIÇÃO MÉDICA B07 Anexo B – VP Número de Expediente Nome do Assunto Data da notificação/ petição Data de aprovação da petição Itens alterados - MEDICAMENTO NOVO – Notificação de alteração de bula RDC 60/12 19 05 2015 19 05 2015 Bula do paciente 1 PARA QUE ESTE MEDICAMENTO É INDICADO 0930979/14-9 MEDICAMENTO NOVO – Notificação de alteração de bula RDC 60/12 14 10 2014 14 10
2014 - DIZERES LEGAIS 0828432/13-6 MEDICAMENTO NOVO – Notificação de alteração de bula RDC 60/12 02 10 2013 02 10 2013 - COMO DEVO USAR ESTE MEDICAMENTO 0459475/13-4 MEDICAMENTO NOVO – Notificação de alteração de bula RDC 60/12 10 06 2013 10 06 2013 - O QUE SABER ANTES DE USAR ESSE MEDICAMENTO 0261427/13-8 MEDICAMENTO NOVO – Inclusão Inicial de Texto de Bula – RDC 60/12 08 04 2013 08 04 2013 Adequação ao Guia de submissão eletrônica de texto de bula, de 18 de março de 2013, e teve o objetivo de encaminhar os arquivos para publicação no novo Sistema Eletrônico da ANVISA
informações complementares
| Fabricante |
| DAIICHI-SANKYO |
| Princípio ativo |
| Cloridrato De Prasugrel |
| Categoria do medicamento |
| Medicamentos de A-Z |
