Comparamos o preço de Exjade 125Mg 28 Comprimidos Dispersiveis, veja o menor preço

R$ 1.132,70
RReferência
10
ofertasMelhores preços a partir de R$ 1.132,70 até R$ 1.399,00
Menor preço
vendido por Farma Visa
economize
19.04%
R$ 1.132,70
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
Menor preço
vendido por Life Medicamentos
economize
19.04%
R$ 1.132,70
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Imune Farma Medicamentos Especiais
economize
19.03%
R$ 1.132,80
vendido por Farma Ame
economize
19.02%
R$ 1.132,85
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farma Silva
economize
18.94%
R$ 1.134,00
Frete Grátis para SP e MG em Compras Acima de R$ 149,90.
vendido por Pague Menos
economize
15.30%
R$ 1.184,99
vendido por Facilita Medicamentos
economize
14.57%
R$ 1.195,20
vendido por Drogaria Dinâmica
economize
14.05%
R$ 1.202,51
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Onco Express Medicamentos Especiais e Oncológicos
R$ 1.399,00
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
vendido por OncoExpresso Medicamentos
R$ 1.399,00
Para que serve
Exjade é usado para tratar a sobrecarga de ferro causada por transfusões de sangue repetidas. Pode ser usado para tratar adultos, adolescentes e crianças com 02 anos de idade ou mais. Transfusões de sangue repetidas podem ser necessárias para pacientes que sofrem certos tipos de anemia, como talassemia, anemia falciforme ou síndromes mielodisplásicas.
Entretanto, transfusões repetidas podem causar acúmulo de ferro. Isso acontece porque o sangue contém ferro e o seu corpo não possui uma maneira natural de remover esse ferro em excesso adquirido pelas transfusões de sangue.
?Com o tempo, o excesso de ferro pode causar prejuízos em órgãos importantes, como o fígado e o coração.?Portanto, medicamentos chamados quelantes de ferro são usados para remover o excesso de ferro, reduzindo, desta forma, o risco da ocorrência de danos nos órgãos.
Como Exjade funciona??
Exjade contém uma substância ativa chamada deferasirox. É um agente quelante de ferro usado para remover o excesso de ferro do corpo (também chamado de sobrecarga de ferro).
Exjade se liga ao ferro em excesso, o qual é então eliminado principalmente através das fezes.
Contraindicação
Você não deve tomar Exjade:
- ?- Se for alérgico (hipersensível) ao deferasirox ou a qualquer um dos outros ingredientes da fórmula.
Se você acha que pode ser alérgico, consulte o seu médico para aconselhamento; - Se tiver problemas graves nos rins;?
- Se tiver síndrome mielodisplásica (SMD) em estágio avançado ou câncer avançado.?
Se isto se aplica a você, não tome Exjade e avise seu médico.
Como usar
Sempre tome Exjade seguindo a orientação de seu médico. Se tiver qualquer dúvida consulte seu médico ou farmacêutico.
Quando tomar Exjade
- Tome Exjade uma vez ao dia, todos os dias, aproximadamente no mesmo horário;
- ?- Tome os comprimidos com o estômago vazio;
- ?- Então espere pelo menos 30 minutos antes de ingerir qualquer alimento.?
Tomar Exjade no mesmo horário todos os dias irá ajudá-lo a lembrar quando tomar seus comprimidos.
Como tomar os comprimidos de Exjade:
- Jogue o(s) comprimido(s) em um copo de água, ou suco de laranja ou maça (100 – 200 mL) (figura 1)?;
- Agite até que o comprimido(s) esteja completamente dissolvido. O líquido dentro do copo ficará turvo;
- ?- Beba todo o conteúdo do copo. Então, adicione um pouco de água ou suco no resíduo que restou no copo e beba também.
Não dissolva os comprimidos em bebidas gaseificadas ou leite.
Não mastigue, parta ou esmague os comprimidos.?
Não engula os comprimidos inteiros.
Quanto tomar de Exjade
A dose de Exjade está relacionada ao peso corpóreo para todos os pacientes. Seu médico irá calcular e informar quantos comprimidos você deve tomar por dia.?
A dose diária normal de Exjade no início do tratamento é de 20 mg por quilo de peso corpóreo.
Uma dose inicial maior ou menor pode ser recomendada por seu médico baseada nas necessidades individuais do tratamento.?
Dependendo da sua resposta ao tratamento, seu médico poderá aumentar ou diminuir a dose.?
A dose diária máxima recomendada é de 40 mg por quilo de peso corpóreo.
Idosos (com 65 anos de idade ou mais)
Exjade pode ser usado por pessoas com 65 anos de idade ou mais com a mesma dose para outros adultos. Pacientes idosos podem ter mais eventos adversos do que pacientes mais jovens. Eles devem ser monitorados cautelosamente para reações adversas que podem requerer o ajuste de dose.
Crianças e adolescentes (com 2 a 17 anos de idade)
Exjade pode ser usado em adolescentes e crianças com 2 anos de idade ou mais. O médico deverá ajustar a dose de acordo com o crescimento do paciente.
Por quanto tempo devo tomar Exjade
Continue tomando Exjade todos os dias durante todo o período que o seu médico indicar. Este é um tratamento a longo prazo, durando, possivelmente, meses ou anos. Seu médico irá monitorar regularmente suas condições para verificar se o tratamento está fazendo o efeito desejado.
Se você parar de tomar Exjade
Não pare de tomar Exjade a menos que seu médico solicite. Se você parar de tomar Exjade, o excesso de ferro não será mais removido de seu organismo.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido ou mastigado.
O que devo fazer quando eu me esquecer de usar este medicamento?
Se você esquecer de tomar uma dose, tome-a no dia e assim que você se lembrar. Tome a próxima dose como de costume. Não tome uma dose dobrada no dia seguinte para completar os comprimidos que faltaram.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Siga cuidadosamente as instruções de seu médico. Elas podem diferir das informações gerais desta bula.
Você deve ter cuidado especial com Exjade
Se alguns destes casos se aplicar a você, avise seu médico, farmacêutico ou profissional de saúde antes de tomar Exjade:
- ?- Se você tem problema no fígado ou nos rins;?- se você estiver tomando ou tenha recentemente tomado analgésicos, anti-inflamatórios ou bisfosfonatos orais;
- Se você estiver tomando ou tenha recentemente tomado anticoagulantes;
- Se você teve um resultado de nível baixo de plaquetas no seu exame de sangue;
Avise seu médico, farmacêutico ou um profissional de saúde imediatamente se você apresentar algum destes sintomas durante o tratamento com Exjade:
- ?- Se você vomitar sangue e/ou tiver fezes escuras;?
- Se você tiver azia frequente ou dor abdominal (úlceras) particularmente após comer ou tomar Exjade;
- Se você observar uma diminuição importante na quantidade de urina (sinal de problema nos rins);?
- Se você tiver uma erupção cutânea grave ou dificuldade de respirar e tontura ou inchaço, principalmente da face e da garganta (sinais de reação alérgica grave);
- Se você tiver uma erupção cutânea, vermelhidão da pele, surgimento de bolhas nos lábios, olhos ou boca, descamação da pele, dor de garganta (sinais de reações graves de pele);
- ?- Se você sentir uma combinação de sonolência, dor abdominal no lado direito superior, notar amarelamento da pele ou olhos ou piora deste sinal (amarelamento da pele ou olhos) e urina escura (sinais de problemas hepáticos).
Monitorando seu tratamento com Exjade
Seu médico deverá solicitar exames regulares (de sangue, urina ou Ressonância Magnética) antes e durante o tratamento para monitorar a quantidade de ferro em seu organismo. Este monitoramento poderá ser feito pela determinação do nível de ferritina, teor de ferro hepático e/ou cardíaco, avaliando assim, se o Exjade está funcionando adequadamente. Os exames irão monitorar também sua função renal (nível sanguíneo de creatinina, presença de proteína na urina) e a função do fígado (nível sanguíneo de transaminases, bilirrubina e fosfatase alcalina). Seu médico levará estes exames em consideração na decisão da dose mais apropriada de Exjade para você.
Sua visão e audição serão testadas anualmente durante o tratamento, como medida de precaução.?Se você tem dúvidas sobre como Exjade funciona ou porque este medicamento foi prescrito para você, pergunte ao seu médico, farmacêutico ou um profissional de saúde.
Reações Adversas
Como todos os medicamentos, pacientes tratados com Exjade podem apresentar reações adversas, porém nem todos as apresentam.
?Pare de tomar Exjade e procure ajuda médica imediatamente se você ou sua criança apresentar algum dos seguintes sintomas:
Sintomas que podem ser sinais de uma reação alérgica:
- Dificuldade de respirar ou engolir; ?
- Inchaço na face, lábios, língua ou garganta; ?
- Coceira de pele severa, com erupção cutânea vermelha ou protuberâncias.
Algumas reações adversas que podem ser sérias
?Se você apresentar alguma destas reações adversas, pare de tomar o medicamento e avise seu médico imediatamente.
?Algumas reações adversas são incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)?:
- Vomitar sangue e/ou apresentar fezes escuras;?
- Azia frequente, dor abdominal ou estomacal particularmente após comer ou tomar Exjade (sinais de úlcera);?
- Se você observar uma diminuição importante na quantidade de urina (sinal de problema nos rins);?
- Combinação de sonolência, dor abdominal no lado direito superior, notar amarelamento da pele ou dos olhos ou piora deste sinal (amarelamento da pele ou dos olhos) e urina escura (sinais de problemas hepáticos);?
- Perda parcial da visão;?
- Dor súbita nas costas ou dor no lado direito do abdome (sinais de cálculos biliares);
- Dor de estômago superior grave (pancreatite).
Algumas reações adversas são raras (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
- Erupção cutânea, vermelhidão da pele, inchaço nos lábios, olhos ou boca, escamação da pele, dor de garganta (sinais de reações graves de pele).
Reações Adversas de Frequência Desconhecida
Formação de perfurações na parede do estômago ou do intestino.
Outras possíveis Reações Adversas
Outras reações adversas incluem as listadas a seguir. Se alguma destas reações se agravarem, contate seu médico, farmacêutico ou profissional de saúde.
Algumas reações adversas são muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento)
- Teste sanguíneo renal anormal (aumento de creatinina).
Algumas reações adversas são comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Distúrbios gastrintestinais, tais como náusea, vômito, diarreia, dor abdominal, distensão abdominal, constipação, indigestão;?
- Erupção cutânea (rash);?
- Dor de cabeça;
- Teste sanguíneo hepático anormal (aumento de transaminase);
- Coceira;?
- Proteína na urina.
Algumas reações adversas são incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Tontura;
- ?- Febre;
- ?- Visão “borrada” ou turva;
- ?- Distúrbios na audição;?
- Dor de garganta;
- ?- Inchaço de braços e pernas;
- Mudança na cor da pele;
- ?- Ansiedade;
- ?- Distúrbios do sono;
- ?- Cansaço.
A frequência de algumas reações adversas são desconhecidas:
- Queda de cabelo.
Se você observar qualquer reação adversa não listada nesta bula, informe seu médico, farmacêutico ou profissional de saúde.
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer efeitos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
População Especial
Gravidez
O efeito de Exjade na fertilidade humana não é conhecido.?
O uso de Exjade não é recomendado durante a gravidez, a menos que claramente necessário. Se você estiver grávida ou acha que pode estar, avise seu médico antes de tomar Exjade. Seu médico irá discutir com você se você poderá tomar Exjade durante a gravidez.?
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Lactação
A amamentação não é recomendada durante o tratamento com Exjade. Avise seu médico se você estiver amamentando.
Efeitos sobre a habilidade de dirigir veículos e/ou operar máquinas
Se você se sentir tonto após tomar Exjade, não dirija ou opere máquinas até se sentir normal novamente.
Composição
Cada comprimido dispersível de Exjade contém:
125 mg, 250 mg ou 500 mg de deferasirox.
?Excipientes:
Lactose monoidratada, crospovidona, povidona, laurilsulfato de sódio, celulose microcristalina, dióxido de silício e estearato de magnésio.
Superdosagem
Se você tomou mais Exjade do que recomendado, ou se alguém tomou seus comprimidos acidentalmente, procure imediatamente seu médico ou hospital. Você deve mostrar a embalagem dos comprimidos ingeridos. Um tratamento médico pode ser necessário.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Agentes que podem diminuir a exposição sistêmica ao Deferasirox (substância ativa)
Em estudo com voluntários sadios, a administração concomitante de Deferasirox (substância ativa) (dose única de 30 mg/kg, comprimidos dispersíveis) e rifampicina, potente indutor de UDP-glucorosiltransferase (UGT) (dose repetida de 600 mg/dia) resultou em diminuição da exposição de Deferasirox (substância ativa) de 44% (IC de 90%: 37% - 51%). Desta forma, o uso concomitante de Deferasirox (substância ativa) com indutores potentes de UGT (ex.: rifampicina, fenitoína, fenobarbital, ritonavir) pode resultar na diminuição da eficácia de Deferasirox (substância ativa). Se Deferasirox (substância ativa) e um indutor potente de UGT forem usados concomitantemente, aumentos na dose de Deferasirox (substância ativa) devem ser considerados baseando-se na resposta clínica à terapia.
Interação com midazolam e outros agentes metabolizados pelo CYP3A4
Em um estudo com voluntários sadios, a administração concomitante de Deferasirox (substância ativa) comprimidos dispersíveis e midazolam (um substrato do CYP3A4) resultou na diminuição da exposição de midazolam em 17% (IC de 90%: 8% - 26%). Na prática clínica, este efeito pode ser mais pronunciado. Portanto, devido à possível diminuição na eficácia, deve-se ter cautela quando Deferasirox (substância ativa) for combinado com substâncias metabolizadas pelo CYP3A4 (como ciclosporina, sinvastatina, contraceptivos hormonais).
Interação com repaglinida e outros agentes metabolizados pelo CYP2C8
Em estudo com voluntários sadios, a administração concomitante de Deferasirox (substância ativa) (dose repetida de 30 mg/kg/dia, comprimidos dispersíveis) com repaglinida, um substrato da CYP2C8 (dose única de 0,5 mg), resultou em aumento na AUC e Cmáx de repaglinida de 131% (IC de 90%: 103% - 164%) e 62% (IC de 90%: 42% - 84%), respectivamente.
Quando Deferasirox (substância ativa) e repaglinida são usados concomitantemente, deve ser feito monitoramento cuidadoso dos níveis de glicose. A interação entre Deferasirox (substância ativa) e outros substratos da CYP2C8, como paclitaxel, não pode ser excluída.
Interação com teofilina e outros agentes metabolizados pelo CYP1A2
Em um estudo com voluntários sadios, a administração concomitante de Deferasirox (substância ativa) (dose repetida de 30 mg/kg/dia, comprimidos dispersíveis) com teofilina, um substrato do CYP1A2 (dose única de 120 mg), resultou em aumento da AUC da teofilina em 84% (IC de 90%: 73% a 95%). A Cmáx da dose única não foi afetada, mas um aumento da Cmáx de teofilina deverá ocorrer com administração crônica. Quando Deferasirox (substância ativa) e teofilina são utilizados concomitantemente, o monitoramento da concentração de teofilina e uma possível redução da dose de teofilina devem ser considerados. Uma interação entre Deferasirox (substância ativa) e outros substratos de CYP1A2 pode ser possível.
Outras informações
Não foram observadas interações entre Deferasirox (substância ativa) e digoxina em voluntários sadios.
A administração concomitante de Deferasirox (substância ativa) e vitamina C não foi estudada formalmente.
As doses de vitamina C até 200 mg por dia não foram associadas com reações adversas.
O perfil de segurança de Deferasirox (substância ativa) em combinação com outros quelantes de ferro (deferoxamina, deferiprona) observado nos estudos clínicos, experiência pós-comercialização ou literatura publicada (conforme o caso) foi consistente com o caracterizado para monoterapia.
A administração concomitante de Deferasirox (substância ativa) e preparações antiácidas contendo alumínio não foi estudada formalmente. Embora Deferasirox (substância ativa) tenha uma afinidade mais baixa por alumínio que por ferro, comprimidos de Deferasirox (substância ativa) não devem ser tomados com preparações antiácidas contendo alumínio.
A administração concomitante de Deferasirox (substância ativa) com drogas que são conhecidas como ulcerogênicas potenciais, tais como AINEs, corticosteroides, ou bisfosfonatos orais, e o uso de Deferasirox (substância ativa) em pacientes recebendo anticoagulantes podem aumentar o risco de irritação gastrintestinal.
Interação Alimentícia
A biodisponibilidade do Deferasirox (substância ativa) comprimidos dispersíveis foi aumentada para uma extensão variável quando tomada ao longo da refeição. Embora a biodisponibilidade tenha sido quase dobrada quando Deferasirox (substância ativa) foi ingerido com refeições contendo alto teor de gordura, este aumento também variou de forma importante com outros teores de gordura e horários de ingestão de Deferasirox (substância ativa) com relação às refeições.
Como nos estudos pivotais, Deferasirox (substância ativa) foi administrado em pacientes com estômago vazio, recomenda-se que Deferasirox (substância ativa) deva ser tomado com o estômago vazio, pelo menos 30 minutos antes da refeição, e de preferência no mesmo horário todos os dias.
Ação da Substância
Resultados da eficácia
Um estudo de fase III controlado, aberto e randomizado com comparador ativo para comparar Deferasirox (substância ativa) e Desferal (desferroxamina) foi conduzido em pacientes com beta-talassemia e hemossiderose transfusional. Pacientes com idade maior ou igual a 2 anos foram randomizados à razão de 1:1 para receber Deferasirox (substância ativa) oral nas doses iniciais de 5, 10, 20 ou 30 mg/kg uma vez ao dia ou Desferal (desferroxamina) subcutâneo nas doses iniciais de 20 a 60 mg/kg por pelo menos 5 dias por semana, baseados na concentração de ferro hepático (CHF) inicial (2 a 3, > 3 a 7, > 7 a 14 e > 14 mg de Fe/g de peso seco). Foi permitido que pacientes randomizados para desferroxamina que tiveram valores de CHF < 7 mg de Fe/g de peso seco continuassem em sua dose prévia de desferroxamina, mesmo que a dose fosse maior do que aquela estabelecida no protocolo.
A CHF foi avaliada no início da terapia e após 12 meses por biopsia hepática ou não invasivamente por susceptometria biomagnética. A taxa de sucesso, o desfecho primário de eficácia, foi definido com uma redução na CHF de > 3 mg de Fe/g de peso seco para valores iniciais > 10 mg de Fe/g de peso seco, redução de valores iniciais entre 7 e < 10 para < 7 mg de Fe/g de peso seco, ou manutenção ou redução para valores iniciais de < 7 mg de Fe/g de peso seco. Deferasirox (substância ativa) seria declarado como não inferior à desferroxamina se o limite inferior do intervalo de confiança de 95% (two-sided) da diferença nas taxas de sucesso fosse acima de -15%.
No total, 586 pacientes foram randomizados. As características demográficas foram bem balanceadas. Entre os pacientes, 51% tinham < 16 anos de idade. As taxas globais de sucesso foram de 52,9% para Deferasirox (substância ativa) e 66,4% para desferroxamina com uma diferença de -13,5 nas taxas de sucesso e um IC de 95% de [-21,6 a -5,4]. A não inferioridade à desferroxamina não foi atingida porque o limite inferior do IC foi abaixo de -15%.
Isto foi atribuído ao desequilíbrio da dose estabelecida no protocolo em relação à dose real nas duas coortes de doses mais baixas do braço da desferroxamina (Tabela 1). No entanto, a não inferioridade foi demonstrada no grupo de pacientes com níveis iniciais de CHF > 7 mg de Fe/g de peso seco que foram alocados para grupos de doses maiores (doses de Deferasirox (substância ativa) de 20 ou 30 mg/kg e doses de desferroxamina > 35 mg/kg).
As taxas de sucesso com Deferasirox (substância ativa) e desferroxamina foram de 58,6% e 58,9%, respectivamente, e o limite inferior do IC de 95% (-10,2%) foi acima do limite de não inferioridade de -15%. Em pacientes com CHF > 7 mg de Fe/g de peso seco que foram tratados com Deferasirox (substância ativa) 20 a 30 mg/kg por dia foi observada uma redução estatisticamente significativa na CHF inicial (-5,3 ± 8,0 mg de Fe/g de peso seco, p < 0,001, teste t) que não foi estatisticamente diferente da desferroxamina (-4,3 ± 5,8 mg de Fe/g de peso seco, p = 0,367). Os efeitos doses-dependentes na ferritina sérica e na razão de ferro excretado/recebido nas doses de Deferasirox (substância ativa) de 5 a 30 mg/kg também foram observados (Tabela 1).
Tabela 1 - Razão de ferro excretado/recebido e mudança nos níveis de ferritina sérica no início e com 1 ano de tratamento no estudo de eficácia primária:
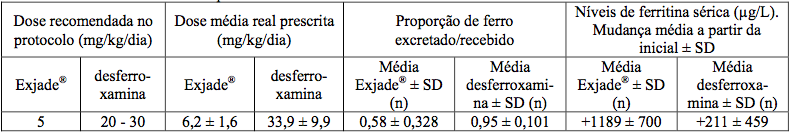
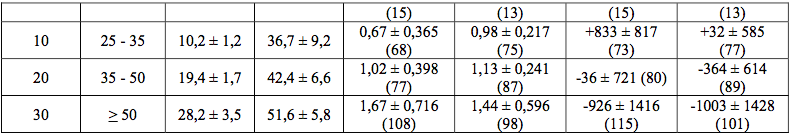
Um segundo estudo de fase II, aberto e não comparativo, de eficácia e segurança de Deferasirox (substância ativa) administrado por um ano para pacientes com anemias crônicas e hemossiderose transfusional não tratáveis com desferroxamina também foi conduzido. Os pacientes receberam 5, 10, 20 ou 30 mg/kg por dia de Deferasirox (substância ativa) baseados na CHF inicial. O objetivo principal foi demonstrar uma taxa de sucesso significativamente maior do que 50% com Deferasirox (substância ativa).
Um total de 184 pacientes foram tratados neste estudo: 85 pacientes com beta-talassemia e 99 pacientes com outras anemias congênitas ou adquiridas (síndromes mielodisplásicas, n = 47; síndrome de Blackfan-Diamond, n = 30; outras, n = 22). Entre os pacientes, 19% tinham < 16 anos e 16% tinham > 65. Trinta e sete pacientes não receberam terapia prévia de quelação. Na população total, a taxa de sucesso (50,5%) não foi estatisticamente maior do que 50%. Isto foi atribuído ao fato que as doses de 5 e 10 mg/kg foram insuficientes para a taxa de ferro que estava sendo recebido por transfusões sanguíneas. No entanto, em pacientes com CHF > 7 mg de Fe/g de peso seco para os quais a CHF inicial e ao final do estudo estavam disponíveis e que receberam Deferasirox (substância ativa) 20 a 30 mg/kg por dia, a taxa de sucesso foi 58,5% [p = 0,022 (50,3; 66,6)] e houve uma redução estatisticamente significativa na CHF absoluta do início ao final do estudo (- 5,5 ± 7,4 mg de Fe/g de peso seco, p < 0,001, teste t).
Houve também um efeito dose-dependente na ferritina sérica e na razão de ferro excretado/recebido nas doses de 5 a 30 mg/kg por dia.
Um terceiro estudo foi conduzido em pacientes com doença falciforme e hemossiderose transfusional. Este estudo foi um estudo de fase II, aberto, randomizado, de segurança e eficácia de Deferasirox (substância ativa) comparado à desferroxamina, administrados por um ano. Os pacientes foram randomizados para Deferasirox (substância ativa) nas doses de 5, 10, 20 ou 30 mg/kg por dia ou desferroxamina subcutânea nas doses de 20 a 60 mg/kg por dia por 5 dias por semana de acordo com a CHF inicial.
Um total de 195 pacientes foram tratados no estudo: 132 com Deferasirox (substância ativa) e 63 com desferroxamina. 44% dos pacientes tinham < 16 anos e 91% eram negros. No final do estudo, a mudança média na CHF na população per protocolo-1 (PP- 1), que consistiu de pacientes que tiveram pelo menos uma avaliação de CHF após o início do estudo, foi -1,3 mg de Fe/g de peso seco para pacientes recebendo Deferasirox (substância ativa) (n = 113) e -0,7 mg de Fe/g de peso seco para pacientes recebendo desferroxamina (n = 54).
Um subestudo cardíaco foi conduzido como parte de um estudo de fase IV. O subestudo cardíaco foi de um ano, de braço único, aberto e prospectivo, e incluíram duas coortes de pacientes beta-talassêmicos com sobrecarga de ferro grave com valores de fração de ejeção de ventrículo esquerdo (LVEF) > 56%. Foram estudados 114 pacientes com valores iniciais de T2* > 5 a < 20 ms, indicando siderose miocárdica (coorte de tratamento) e 78 pacientes com T2*cardíaco > 20 ms, indicando depósito de ferro cardíaco sem significância clínica (coorte de prevenção). Na coorte de tratamento, a dose inicial de Deferasirox (substância ativa) foi 30 mg/kg/dia, com escalonamento até o máximo de 40 mg/kg/dia.
Na coorte de prevenção, a dose inicial foi 20-30 mg/kg/dia, com escalonamento até o máximo de 40 mg/kg/dia. O objetivo principal do subestudo cardíaco foi a mudança no T2* em um ano. Na coorte de tratamento, o T2* (média geométrica ± coeficiente de variação) aumentou significativamente do valor inicial de 11,2 ms ± 40,5% para 12,9 ms ± 49,5%, representando uma melhora significativa de 16% (p < 0,0001). Na coorte de tratamento, foi observada melhora no T2* em 69,5% dos pacientes e estabilização de T2* em 14,3% dos pacientes. A LVEF permaneceu estável e dentro da variação normal: 67,4 ± 5,7% a 67,1 ± 6,0%. Na coorte de prevenção, o T2* cardíaco permaneceu dentro da faixa normal e não mudou do valor inicial de 32,0 ms ± 25,6% a 32,5 ms ± 25,1% (+2%; p = 0,565), indicando que o tratamento diário com Deferasirox (substância ativa) pode prevenir sobrecarga de ferro cardíaca em pacientes com beta-talassemia com história de exposição transfusional alta e regular, e com transfusões em andamento.
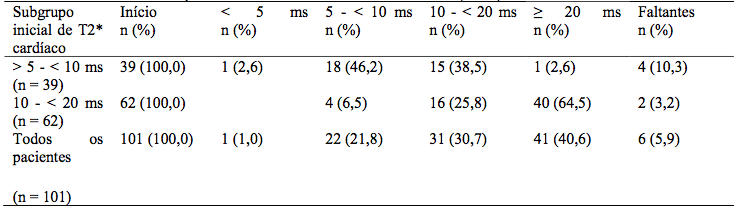
Pacientes na coorte de tratamento do estudo de 1 ano tiveram a opção de participar em duas extensões de 1 ano. Durante o período de 3 anos de tratamento, houve melhora estatisticamente significativa (p < 0,0001), progressiva e clinicamente relevante na média geométrica do T2* cardíaco a partir do inicial no geral, no subgrupo com sobrecarga de ferro grave, o qual está associado a alto risco de insuficiência cardíaca (T2* > 5 a < 10 ms), e no subgrupo com sobrecarga de ferro leve a moderada (T2* 10 a < 20 ms) (Tabela 2). Usando a taxa da média geométrica, o aumento de T2* foi de 43% acima do inicial em todos os pacientes, 37% acima do inicial no subgrupo de T2* > 5 a < 10 ms, e 46% acima do inicial no subgrupo de T2* 10 a < 20 ms). O tratamento contínuo com Deferasirox (substância ativa) por até 3 anos em doses > 30 mg/kg/dia reduziu efetivamente o ferro cardíaco em pacientes com talassemia maior com siderose miocárdica, como mostrado pelo número de pacientes que tiveram seus T2* normalizados ou melhorados a uma categoria associada a menor risco de insuficiência cardíaca (Tabela 3).
Tabela 2 – Média Geométrica de T2* (ms) no início e no final dos anos 1, 2 e 3:
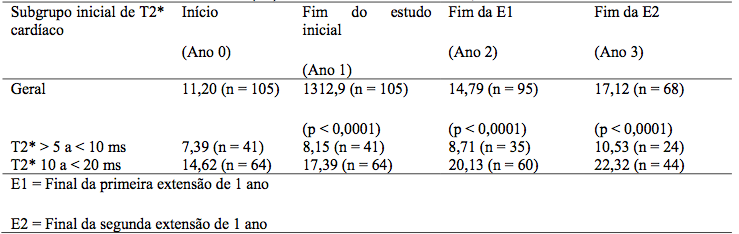
Tabela 3 – Tabela de transição do T2* cardíaco inicial até o fim da E2 (ano 3):
Características Farmacológicas
Características farmacológicas
Grupo farmacoterapêutico: agente quelante de ferro, código ATC V03AC03.
Mecanismo de ação
O Deferasirox (substância ativa) é um quelante ativo oral que é altamente seletivo para ferro (III). É um agente tridentado que se liga ao ferro com alta afinidade na proporção 2:1. O Deferasirox (substância ativa) promove excreção de ferro, principalmente nas fezes. O Deferasirox (substância ativa) tem uma baixa afinidade por zinco e cobre, não alterando os níveis séricos destes metais.
Farmacodinâmica
Em um estudo de balanço metabólico de ferro em pacientes adultos talassêmicos com sobrecarga de ferro, Deferasirox (substância ativa) em doses diárias de 10, 20 e 40 mg/kg induziu média de excreção líquida de 0,119; 0,329 e 0,445 mg de Fe/kg de peso corpóreo por dia, respectivamente.
Deferasirox (substância ativa) foi investigado em pacientes adultos e pediátricos (com 2 anos de idade ou mais) com sobrecarga crônica de ferro devido à transfusões sanguíneas. As condições clínicas que requeriam transfusão foram beta-talassemia, anemia falciforme e outras anemias congênitas e adquiridas (síndromes mielodisplásticas, síndrome de Blackfan-Diamond, anemia aplástica e outras anemias raras).
O tratamento diário com Deferasirox (substância ativa) nas doses de 20 e 30 mg/kg por um ano em pacientes adultos e pediátricos politransfundidos com beta-talassemia levou a reduções em indicadores de ferro corpóreo total; a concentração de ferro hepático foi reduzida em aproximadamente -0,4 e -8,9 mg de Fe/g de tecido hepático (peso seco da biópsia) em média, respectivamente, e a ferritina sérica foi reduzida em aproximadamente -36 e -926 micrograma/L em média, respectivamente.
Nestas mesmas doses, as razões de excreção de ferro: consumo de ferro foram de 1,02 (indicando balanço líquido de ferro) e 1,67 (indicando remoção líquida de ferro), respectivamente. Deferasirox (substância ativa) induziu respostas similares em pacientes com sobrecarga de ferro devido a outras anemias. Doses diárias de 10 mg/kg por um ano mantiveram os níveis de ferro hepático e de ferritina sérica e induziram o balanço líquido de ferro em pacientes recebendo transfusões eventuais ou transfusão de troca de hemácias. A ferritina sérica avaliada mensalmente refletiu as mudanças na concentração de ferro hepático, indicando que tendências na ferritina sérica podem ser usadas para monitorar a resposta à terapia.
Em pacientes com acúmulo cardíaco de ferro (MRI T2* < 20 ms), o tratamento com Deferasirox (substância ativa) mostrou remover o ferro cardíaco, demonstrado por melhora progressiva nos valores de T2* durante 3 anos de observação. Em pacientes sem acúmulo cardíaco, Deferasirox (substância ativa) mostrou prevenir o acúmulo cardíaco de ferro de modo clinicamente relevante (manutenção de T2* > 20 ms) durante 1 ano de observação, embora houvesse significante exposição a transfusões sanguíneas.
Farmacocinética
Absorção
O Deferasirox (substância ativa) é absorvido após administração oral com um tempo mediano para a concentração plasmática máxima (tmáx) de aproximadamente 1,5 a 4 horas. A biodisponibilidade absoluta (AUC) do Deferasirox (substância ativa) de Deferasirox (substância ativa) comprimidos é de aproximadamente 70% comparada a uma dose intravenosa. A exposição total (AUC) foi aproximadamente dobrada quando administrado junto com um desjejum gorduroso (conteúdo de gordura > 50% das calorias), e por aproximadamente 50% quando administrado junto com um desjejum convencional.
A biodisponibilidade (AUC) do Deferasirox (substância ativa) foi moderadamente elevada (aproximadamente 13 a 25%) quando administrado 30 minutos antes das refeições com conteúdo normal ou alto de gordura. A exposição total (AUC) do Deferasirox (substância ativa) após administração dos comprimidos dispersos em suco de laranja ou maçã foi equivalente à exposição total (AUC) obtida após administração dos comprimidos de Deferasirox (substância ativa) dispersos na água (razões relativas de AUC foram de 103% e 90%, respectivamente).
Distribuição
O Deferasirox (substância ativa) tem alta afinidade por proteínas plasmáticas (99%), quase exclusivamente pela albumina sérica, e tem um pequeno volume de distribuição, de aproximadamente 14 L em adultos.
Biotransformação
A glucuronidação é a principal via de metabolização do Deferasirox (substância ativa), com subsequente excreção biliar. Parece ocorrer desconjugação de glucuronidatos no intestino e subsequente reabsorção (ciclo entero-hepático). O Deferasirox (substância ativa) é glucuronizado principalmente por UGT1A1 e, em um menor grau, por UGT1A3. O metabolismo oxidativo via CYP450 parece ter importância menor no metabolismo do Deferasirox (substância ativa) em humanos (8%). Não foi observada inibição do metabolismo in vitro do Deferasirox (substância ativa) por hidroxiureia. O Deferasirox (substância ativa) sofre reciclagem entero-hepática. Em estudo com voluntários sadios, a administração de colestiramina após uma dose única de Deferasirox (substância ativa) resultou em diminuição de 45% na exposição (AUC) de Deferasirox (substância ativa).
Eliminação
O Deferasirox (substância ativa) e seus metabólitos são excretados principalmente nas fezes (84% da dose).
A excreção renal do Deferasirox (substância ativa) e de seus metabólitos é mínima (8% da dose). A média da meia-vida de eliminação (t1/2) variou de 8 a 16 horas.
Linearidade/não linearidade
A Cmáx e a AUC0-24h do Deferasirox (substância ativa) aumentam de forma linear com doses abaixo das condições em estado de equilíbrio. A exposição em múltiplas dosagens aumentou linearmente a Cmáx com um fator de acúmulo de 1,3 a 2,3.
Pacientes pediátricos
A exposição total em adolescentes (12 a < 17 anos) e crianças (2 a < 12 anos) ao Deferasirox (substância ativa) após doses únicas ou múltiplas, foi menor do que em pacientes adultos. Em crianças menores de 6 anos, a exposição à droga é aproximadamente 50% menor do que em adultos. Como a dosagem é individualmente ajustada de acordo com a resposta à terapia, não são esperadas consequências clínicas.
Sexo
Mulheres têm um clearance (depuração) discretamente menor (aproximadamente 17,5%) para Deferasirox (substância ativa) comparadas aos homens. Como a dosagem é individualmente ajustada de acordo com a resposta à terapia, não são esperadas consequências clínicas.
Pacientes idosos
A farmacocinética do Deferasirox (substância ativa) não foi estudada em pacientes idosos (com 65 anos ou mais).
Insuficiência renal e hepática
A farmacocinética do Deferasirox (substância ativa) não foi estudada em pacientes com insuficiência renal. A AUC média de Deferasirox (substância ativa) em 6 indivíduos com insuficiência hepática leve (Child-Pugh A) aumentou 16% em relação àquela encontrada em 6 indivíduos com função hepática normal, enquanto que a AUC média de Deferasirox (substância ativa) em 6 indivíduos com insuficiência hepática moderada (Child-Pugh B) aumentou 76% em relação ao encontrado em 6 indivíduos com função hepática normal.
A Cmáx média de Deferasirox (substância ativa) em indivíduos com disfunção hepática leve ou moderada aumentou 22% em relação ao encontrado em indivíduos com função hepática normal. O impacto da insuficiência hepática grave (Child-Pugh C) foi avaliado em apenas um indivíduo.
A farmacocinética do Deferasirox (substância ativa) não foi influenciada por níveis de transaminases hepáticas até 5 vezes o limite superior para a idade.
Dados de segurança pré-clínicos
Os dados pré-clínicos não revelam riscos especiais para pacientes com sobrecarga de ferro, baseados em estudos convencionais de segurança farmacológica, toxicidade de dose repetida, genotoxicidade ou potencial carcinogênico. Os principais achados foram toxicidade renal e opacidade do cristalino (catarata). Achados similares foram observados em animais neonatos e jovens. A toxicidade renal é considerada principalmente devido à privação de ferro em animais que não tinham, previamente, sobrecarga de ferro.
O potencial de toxicidade para reprodução foi avaliado em ratos e coelhos. Em ratos sem sobrecarga de ferro e submetidos a altas doses de Deferasirox (substância ativa), a medicação não mostrou efeito teratogênico, mas causou frequência aumentada de prematuridade e variações esqueléticas em ratos recém-natos. O Deferasirox (substância ativa) não causou outros efeitos na fertilidade ou reprodução.
Cuidados de Armazenamento
Você deve guardar este medicamento em temperatura ambiente (entre 15 e 30°C).
Número de lote e datas de fabricação e validade: vide embalagem.
?Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspecto físico
- Comprimido de 125 mg: comprimido dispersível, branco, redondo, plano, sem revestimento, com bordas chanfradas e impressão (NVR em uma face e J125 em outra);?
- Comprimido de 250 mg: comprimido dispersível, branco, redondo, plano, sem revestimento, com bordas chanfradas e impressão (NVR em uma face e J250 em outra);
- Comprimido de 500 mg: comprimido dispersível, branco, redondo, plano, sem revestimento, com bordas chanfradas e impressão (NVR em uma face e J500 em outra).
Características organolépticas
Sabor e odor característicos.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Mensagens de Alerta
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Dizeres Legais
MS – 1.0068.1040?
Farm. Resp.: Flavia Regina Pegorer – CRF-SP 18.150
Importado por:
Novartis Biociências S.A.
Av. Prof. Vicente Rao, 90 São Paulo - SP?
CNPJ: 56.994.502/0001-30
Indústria Brasileira
Fabricado por:
Novartis Pharma Stein AG, Stein, Suíça