para o que é indicado e para que serve?
Para que serve Onbrize é indicado para facilitar a respiração em pessoas que apresentam dificuldade de respirar devido à doenças pulmonares chamadas doença pulmonar obstrutiva crônica (DPOC) moderada a grave.Continue lendo...
ofertas de
Onbrize - 300Mcg C 30 Com...
ofertas de Onbrize - 300Mcg C 30 Com...
R$ 153,90
R$ 159,79
R$ 160,09
R$ 169,99
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Onbrize é indicado para facilitar a respiração em pessoas que apresentam dificuldade de respirar devido à doenças pulmonares chamadas doença pulmonar obstrutiva crônica (DPOC) moderada a grave.?
O uso regular de Onbrize, uma vez ao dia, irá ajudar a minimizar os efeitos da doença em todos os dias da sua vida.
Como Onbrize funciona?
Onbrize contém uma substância ativa chamada indacaterol. Este medicamento pertence ao grupo de medicamentos chamados broncodilatadores. Quando você inala Onbrize, ele ajuda você a respirar mais facilmente.?
Você deve utilizá-lo com um aparelho chamado de inalador (utilize Onbrize apenas com o inalador contido nesta embalagem).
Nesta embalagem, você encontrará um inalador e as cápsulas (em blíster) que contém o medicamento em pó inalatório. O inalador de Onbrize permite que você inale o medicamento contido em uma cápsula.
Onbrize relaxa os músculos das paredes das pequenas passagens de ar do pulmão. Isto ajuda abrir as vias aéreas, facilitando a entrada e saída do ar.?
Se você tiver qualquer dúvida sobre como Onbrize funciona ou porque foi indicado para você, converse com seu médico.
O indacaterol administrado uma vez ao dia no mesmo horário todos os dias, tanto pela manhã ou à noite, tem um rápido início de ação dentro de 5 minutos.
Contraindicação
Hipersensibilidade ao princípio ativo ou a qualquer um dos excipientes.
Não use Onbrize:
- Se você já teve uma reação incomum ou uma reação alérgica ao indacaterol ou a qualquer um dos componentes deste produto, listados no início desta bula. ?
- Onbrize é contraindicado para pacientes asmáticos.
Se algum destes se aplicar a você, avise seu médico antes de utilizar Onbrize.
Se você acha que pode ser alérgico, converse com seu médico.
Este medicamento é contraindicado para menores de 18 anos.
Como usar
Siga as orientações do seu médico cuidadosamente. Não exceda a dose recomendada.
Como inalar Onbrize?
Utilize apenas o inalador fornecido nesta embalagem (inalador do Onbrize). Não engula as cápsulas.
Instruções para utilizar o inalador do Onbrize
Este item explica como usar e cuidar do seu inalador do Onbrize. Leia atentamente e siga estas instruções. Vide também “Como inalar Onbrize”. Se você tiver alguma dúvida, converse com seu médico.
Sua embalagem de Onbrize:
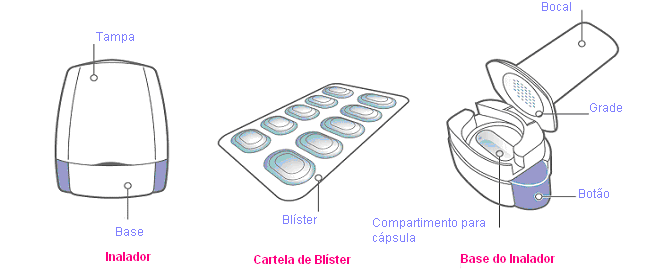
Cada embalagem de Onbrize contém:
- Um inalador
- Blíster contendo as cápsulas de Onbrize para serem usadas com o inalador
Não engolir as cápsulas de Onbrize:
O inalador do Onbrize permite que você inale o medicamento contido nas cápsulas.
Use apenas o inalador de Onbrize fornecido nesta embalagem.
Não use as cápsulas de Onbrize com nenhum outro inalador, e não use o inalador de Onbrize para outros medicamentos em cápsulas.
Como utilizar o seu inalador
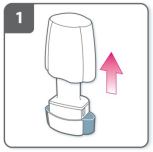
1) Retire a tampa
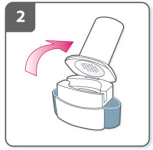
2) Abra o inalador
- Segure a base do inalador firmemente e incline o bocal para abrir o inalador.
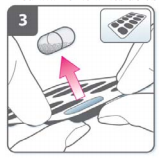
3) Prepare a cápsula
- ?Imediatamente antes do uso, com as mãos secas, remova uma cápsula do blíster.
4) Insira a cápsula
- Coloque a cápsula dentro do compartimento para cápsulas.
- Nunca coloque uma cápsula diretamente dentro do bocal.
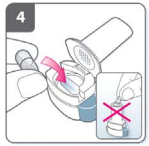
5) Feche o inalador?
- Feche completamente o inalador. Você deve ouvir um “click” quando estiver completamente fechado.
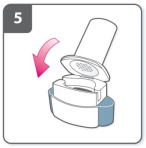
6) Perfure a cápsula
- Segure o inalador para cima, com o bocal apontado para cima.
- Aperte ambos os botões completamente uma única vez. Você deve ouvir um “click” quando a cápsula estiver sendo perfurada.
- Não aperte os botões de perfuração mais de uma vez.
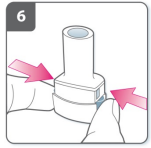
7) Libere os botões completamente
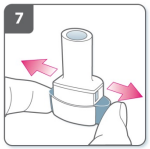
8) Expire
- Antes de colocar o bocal em sua boca, expire completamente.
- Nunca assopre dentro do bocal.
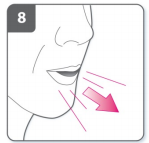
9) Inale o medicamento
- Antes de inspirar, coloque o bocal em sua boca e feche seus lábios firmemente em volta do bocal.
- Segure o inalador com os botões virados para esquerda e direita (não para cima e para baixo).
- Inspire rapidamente, mas constantemente, o mais profundo que puder.
- Não aperte os botões de perfuração.
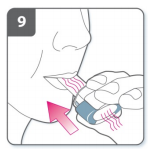
10) Observação
- Enquanto você inspira pelo inalador, a cápsula gira no compartimento e você deve ouvir um som de vibração. Você sentirá um sabor doce enquanto o medicamento segue para o seu pulmão.
- Se você não ouvir o som de vibração, a cápsula pode estar presa dentro do compartimento. Se isso ocorrer, abra o inalador e cuidadosamente desprenda a cápsula batendo levemente na base do aparelho. Não aperte os botões de perfuração para desprender a cápsula. Repita as etapas 8 e 9 se necessário.
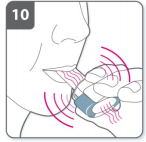
11) Segure a respiração
- ?- Continue segurando a sua respiração por pelo menos 5-10 segundos ou pelo maior tempo que você confortavelmente conseguir enquanto remove o inalador da sua boca. Então, expire.
- Abra o inalador para ver se ficou algum pó na cápsula. Se houver resíduo de pó na cápsula, feche o inalador e repita as etapas de 8 a 11. A maioria das pessoas é capaz de esvaziar a cápsula com uma ou duas inalações.
- Algumas pessoas ocasionalmente tossem logo após a inalação do medicamento. Se você tossir não se preocupe, pois se a cápsula estiver vazia, você recebeu a dose completa.
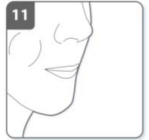
12) Remova a cápsula
- Após você ter terminado de tomar sua dose diária de Onbrize, abra o bocal novamente, remova a cápsula vazia batendo levemente e descarte-a. Feche o inalador e recoloque a tampa.
- Não armazene as cápsulas de Onbrize no inalador.
13) Marque na tabela de acompanhamento de dose diária
- Dentro da embalagem há uma tabela de acompanhamento da dose diária. Assinalar no quadradinho da tabela a data correspondente, ajudará a lembrar-se quando será a próxima dose.
 ?
?
Lembre-se:
- Não engula as cápsulas de Onbrize;?
- Use apenas o inalador do Onbrize que acompanha esta embalagem;
- As cápsulas de Onbrize devem sempre ser mantidas no blíster, e apenas removidas imediatamente antes do uso; ?
- Nunca coloque uma cápsula de Onbrize diretamente no bocal do inalador de Onbrize; ?
- Não aperte os botões de perfuração mais de uma vez; ?
- Nunca assopre dentro do bocal do inalador de Onbrize; ?
- Sempre desarme os botões apertados antes da inalação; ?
- Nunca lave o inalador de Onbrize com água. Mantenha-o seco;
- Nunca adquira o inalador de Onbrize separadamente;
- Sempre use o inalador de Onbrize novo que acompanha a sua embalagem nova do medicamento Onbrize;
- Não armazene as cápsulas no inalador de Onbrize; ?
- Sempre mantenha o inalador de Onbrize e as cápsulas de Onbrize em lugar seco.
Informações adicionais
?Ocasionalmente, pedaços muito pequenos da cápsula podem passar pela grade e entrar na sua boca. Se acontecer, você pode sentir estes pedaços em sua língua. Não é prejudicial se estes pedaços são engolidos ou inalados. As chances de a cápsula despedaçar serão aumentadas se a cápsula for perfurada mais de uma vez (etapa 6).
?Como limpar seu inalador?
?Limpe seu inalador uma vez por semana. Limpe o bocal dentro e fora com um pano sem fibras, limpo e seco para remover qualquer resíduo de pó. Nunca lave seu inalador com água. Mantenha-o sempre seco.
Quanto inalar de Onbrize??
A dose usual é a inalação do conteúdo de uma cápsula uma vez ao dia, todos os dias. A dose máxima diária é de 300 mcg em adultos. ?
Quando inalar Onbrize?
Você precisa inalar apenas uma vez ao dia porque os efeitos de Onbrize perduram por 24 horas.?Inalar Onbrize no mesmo horário todo dia irá ajudar a minimizar seus sintomas durante todo o dia e noite. Irá também ajudar a se lembrar de usar seu medicamento. ?
Por quanto tempo Onbrize deve ser administrado?
Continue seu tratamento com Onbrize pelo tempo que seu médico determinar.?A DPOC é uma doença crônica e por isso você deve usar Onbrize todos os dias e não apenas quando você apresentar problemas de respiração ou outros sintomas da DPOC.?Se você tiver dúvidas sobre por quanto tempo continuar o seu tratamento com Onbrize, converse com seu médico ou farmacêutico
População especial
Nenhum ajuste de dose é necessário para pacientes idosos, com disfunção hepática leve e moderada ou disfunção renal. Não há dado disponível para pacientes com disfunção hepática grave. Onbrize™ não deve ser utilizado por pacientes abaixo de 18 anos de idade.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar este medicamento?
Se você esquecer uma dose, inale a próxima dose no dia seguinte no horário usual. Não administre duas doses para compensar a dose esquecida. Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Antes de usar Onbrize
Siga todas as instruções médicas cuidadosamente. Elas podem divergir da informação geral descrita nesta bula. ?
Tenha atenção especial com Onbrize:
Antes de utilizar Onbrize, informe seu médico se alguma destas situações se aplica a você:
- Se você é asmático (neste caso você não deve ser tratado com Onbrize); ?
- Se você tiver problemas do coração; ?
- Se você sofre de epilepsia; ?
- Se você tem problemas da glândula da tireoide; ?
- Se você sofre de diabetes; ?
- Se você está tomando medicamentos similares para a sua doença pulmonar.
Durante o tratamento com Onbrize, informe seu médico imediatamente se você sentir qualquer um dos sintomas abaixo:
- Se você sentir um aperto no peito, tosse, chiado ou falta de ar imediatamente após a inalação da medicação (sinais de broncoespasmo); ?
- Se você apresentar dificuldade para respirar ou engolir, inchaço da língua, lábios e face, urticária (erupção cutânea, coceira, ardência), (sinais de reação alérgica); ?
- Se seus sintomas da DPOC (falta de ar, chiado, tosse) não melhorarem ou se piorarem durante o seu tratamento. ?
Reações Adversas
Assim como com todos os medicamentos, pacientes utilizando Onbrize podem apresentar reações adversas embora nem todos os apresentem.
Algumas reações adversas podem ser graves (frequência incomum: ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Você pode apresentar sintomas de reações de hipersensibilidade, tais como dificuldade para respirar ou engolir, inchaço da língua, lábios e face, urticária, erupção cutânea; ?
- Você pode apresentar sintomas de broncoespasmo paradoxal, como dificuldade para respirar com chiado ou tosse.
Se você apresentar alguma destas, avise seu médico imediatamente.
Algumas reações adversas são muito comuns (ocorrem em 10% dos pacientes que utilizam este medicamento): ?
- Combinação de garganta inflamada, nariz escorrendo, nariz entupido, espirros, tosse e dor de cabeça com ou sem febre.
Se alguma destas reações te afetarem gravemente, avise seu médico.
Algumas reações adversas são comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento):
- Dor de cabeça; ?
- Tontura; ?
- Tosse; ?
- Espasmo muscular; ?
- Dor de garganta; ?
- Sensação de pressão ou dor nas bochechas ou testa (sinusite); ?
- Dor muscular;
- Inchaço das mãos, tornozelos e pés; ?
- Aperto no peito (problemas cardíacos); ?
- Palpitações; ?
- Sede excessiva, aumento da quantidade de urina, aumento do apetite com perda de peso, cansaço, alto nível ?de açúcar no sangue (que são sinais de uma doença chamada diabetes); ?
- Nariz escorrendo; ?
- Dor nos ossos e juntas; ?
- Dor no peito; ?
- Coceira / Erupção cutânea.
?Se qualquer um destes efeitos afetarem você gravemente, informe seu médico.
Algumas reações adversas são incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Batimento cardíaco irregular; ?
- Batimento cardíaco acelerado; ?
- Dor nos músculos;?
- Formigamento ou dormência.
Se qualquer uma destas reações afetarem você gravemente, informe ao seu médico.
?Algumas pessoas ocasionalmente tossem logo após a inalação do medicamento. A tosse é um sintoma comum em pacientes com DPOC. Se você apresentar uma breve tosse após inalar o medicamento, não se preocupe, uma vez que a cápsula esteja vazia, você recebeu a dose completa. ?
Caso alguma dessas reações adversas se torne grave ou se você notar alguma reação adversa não listada nesta bula, informe ao seu médico. ?
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista. ?
População Especial
Pacientes idosos (65 anos de idade ou mais) ?
Se você tiver 65 anos de idade ou mais, pode usar Onbrize na mesma dose indicada para adultos.
?Crianças e adolescentes (menores de 18 anos de idade)
?Onbrize não deve ser administrado para crianças ou adolescentes. ?
Gravidez e lactação ?
Se você estiver grávida ou acha que está grávida, ou se você está amamentando, converse com seu médico que avaliará se você pode usar Onbrize.?Peça orientações ao seu médico ou farmacêutico antes de utilizar qualquer medicamento. ?Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
?Efeitos sobre a habilidade de dirigir veículos e/ou operar máquinas
?Onbrize não tem influência, ou tem influência desprezível, sobre a capacidade de dirigir e operar máquinas. ?
Composição
Onbrize 150 mcg - cada cápsula de Onbrize contém:
194 mcg de maleato de indacaterol que equivale a 150 mcg de indacaterol.?
A dose disponibilizada (dose medida a partir do bocal do inalador de Onbrize) é de 120 mcg de indacaterol.
Onbrize 300 mcg - cada cápsula de Onbrize contém:
389 mcg de maleato de indacaterol que equivale a 300 mcg de indacaterol.
A dose disponibilizada (dose medida a partir do bocal do inalador de Onbrize) é de 240 mcg de indacaterol.
Excipientes:
Lactose monoidratada e gelatina (componente da cápsula).
Superdosagem
Se você inalar Onbrize em excesso ou se alguém acidentalmente inalou seu medicamento, você pode apresentar alguns dos seguintes eventos adversos:
- Batimento cardíaco rápido ou irregular; ?
- Respiração rápida, confusão, cansaço (sinais de acidose metabólica); ?
- Fraqueza muscular, espasmos musculares, batimento cardíaco anormal (sinais de baixo nível de potássio no ?sangue); ?
- Tremor; ?
- Dor de cabeça; ?
- Náuseas, vômitos; ?
- Sonolência;
- Alto nível de açúcar no sangue.
?Se você acha que está enfrentando algum destes eventos adversos, interrompa o uso do Onbrize e procure um médico ou hospital para obter orientação imediatamente. Mostre a embalagem do medicamento. Cuidados médicos podem ser necessários.
Interação Medicamentosa
Medicamentos que conhecidamente prolongam o intervalo QTc
Maleato de Indacaterol (substância ativa), como outros agonistas beta2-adrenérgicos, deve ser administrado com precaução para pacientes que estão sendo tratados com inibidores de monoamino oxidase, antidepressivos tricíclicos ou medicamentos que sabidamente prolongam o intervalo QT, pois qualquer efeito desses medicamentos no intervalo QT pode ser potencializado. Os medicamentos conhecidos por prolongar o intervalo QT podem aumentar o risco de arritmia ventricular.
Agentes simpatomiméticos
A administração concomitante de agentes simpatomiméticos (isolados ou como parte de uma terapia combinada) pode potencializar os efeitos adversos de Maleato de Indacaterol (substância ativa).
Hipocalemia
Tratamento concomitante com derivados de metilxantinas, esteroides ou diuréticos não poupadores de potássio podem potencializar o possível efeito de hipocalemia dos agonistas beta2-adrenérgicos.
Bloqueadores beta-adrenérgicos
Os bloqueadores beta-adrenérgicos podem enfraquecer ou antagonizar o efeito dos agonistas beta2-adrenérgicos. Portanto, Maleato de Indacaterol (substância ativa) não deve ser administrado junto com bloqueadores beta-adrenérgicos (incluindo colírios) a menos que haja razões fortes para seu uso. Quando necessário, os bloqueadores beta-adrenérgicos cardiosseletivos devem ser os de preferência, embora devam ser administrados com precaução.
Interação medicamentosa metabólica e baseada em transportadores
A inibição dos principais mecanismos de clearance (depuração) do indacaterol, CYP3A4 e P-gp, não tem impacto na segurança das doses terapêuticas de Maleato de Indacaterol (substância ativa).
Estudos de interação medicamentosa foram realizados utilizando inibidores potentes e específicos de CYP3A4 e P-gp (por ex., cetoconazol, eritromicina, verapamil e ritonavir). O verapamil foi usado como o inibidor prototípico de P-gp e resultou no aumento de ASC de 1,4 a 2 vezes e aumento de 1,5 vezes em Cmáx. A coadministração de eritromicina com Maleato de Indacaterol (substância ativa) resultou em um aumento de ASC de 1,4 a 1,6 vezes e 1,2 vezes para Cmáx. A inibição combinada de P-gp e CYP3A4 pelo inibidor duplo muito forte cetoconazol, causou um aumento de 2 e 1,4 vezes em ASC e Cmáx, respectivamente. O tratamento concomitante com ritonavir, outro inibidor duplo da CYP3A4 e P-gp, resultou em um aumento de 1,6 a 1,8 na ASC e a Cmáx não foi afetada. Tomados juntos, os dados sugerem que o clearance (depuração) sistêmico é influenciado pela modulação das atividades de P-gp e CYP3A4 e que o aumento de 2 vezes em ASC causado pelo inibidor duplo muito forte cetoconazol, reflete o impacto da inibição máxima combinada. A magnitude do aumento da exposição devido às interações medicamentosas não levanta nenhuma preocupação de segurança dada a experiência de segurança do tratamento com Maleato de Indacaterol (substância ativa) em estudos clínicos de até um ano em doses de 2 a 4 vezes maiores que as doses terapêuticas recomendadas.
Maleato de Indacaterol (substância ativa) não causou interações medicamentosas com comedicação. As investigações in vitro indicaram que o indacaterol tem potencial negligenciável de causar interações metabólicas com medicamentos nos níveis de exposição sistêmica alcançados em prática clínica.
Ação da Substância
Resultados da eficácia
O programa de desenvolvimento do estudo clínico de fase III de Maleato de Indacaterol (substância ativa) consistiu de 16 estudos-chaves e envolveu mais de 9.000 pacientes com diagnóstico clínico de DPOC moderada a grave, com 40 anos de idade ou mais, que tinham histórico de tabagismo de pelo menos 20 maços-ano, VEF1 pós-broncodilatador < 80% e ? 30% do valor normal esperado e uma razão VEF1/CVF pós-broncodilatador menor que 70%.
Nestes estudos, o indacaterol administrado uma vez ao dia, nas doses de 150 mcg e 300 mcg, mostrou melhora clinicamente significativa na função pulmonar (medidas pelo volume expiratório forçado em um segundo, VEF1) por 24 horas. No primeiro ponto de avaliação na semana 12 (VEF1 no nadir em 24 horas), a dose de 150 mcg resultou em um aumento de 0,13-0,18 L comparado ao placebo (p < 0,001) e um aumento de 0,06 L comparado ao salmeterol 50 mcg duas vezes ao dia (p < 0,001). A dose de 300 mcg resultou em um aumento de 0,17-0,18 L comparado ao placebo (p < 0,001) e um aumento de 0,1 L comparado ao formoterol 12 mcg duas vezes ao dia (p < 0,001). Ambas as doses resultaram em um aumento de 0,04-0,05 L sobre tiotrópio open-label 18 mcg uma vez ao dia (150 mcg, p = 0,004; 300 mcg, p = 0,01).
O indacaterol administrado uma vez ao dia no mesmo horário todos os dias, tanto pela manhã ou à noite, teve um rápido início de ação dentro de 5 minutos similar ao do salbutamol 200 mcg e, foi significativa e estatisticamente mais rápido quando comparado com salmeterol/fluticasona 50/500 mcg [6], e as melhoras média do pico em VEF1 em relação ao nível basal de 0,25-0,33 L no estado de equilíbrio ocorrendo entre 2-4 horas após a dose. O efeito broncodilatador de 24 horas de Maleato de Indacaterol (substância ativa) foi mantido a partir da primeira dose por todo um período de um ano com nenhuma evidência de perda de eficácia (taquifilaxia).
Em um estudo de 26 semanas, controlado com placebo e ativo (tiotrópio open-label) em 2.059 pacientes, a melhora média em relação ao nível basal de VEF1 em 5 minutos foi 0,12 L e 0,13 L para Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg, uma vez ao dia, respectivamente; a melhora média do pico, em relação ao nível basal, após a primeira dose (Dia 1) foi 0,19 L e 0,24 L, respectivamente e melhorou para 0,23 L e 0,26 L, respectivamente, quando o estado de equilíbrio farmacodinâmico foi alcançado (Dia 14). No primeiro ponto de avaliação (Semana 12), ambos os grupos de tratamento com Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg uma vez ao dia mostraram um valor de VEF1, no nadir, significativamente maior quando comparado ao placebo (ambas as concentrações 0,18 L, p < 0,001) e ao tiotrópio (0,05 L, p = 0,004, e 0,04 L, p = 0,01, respectivamente).
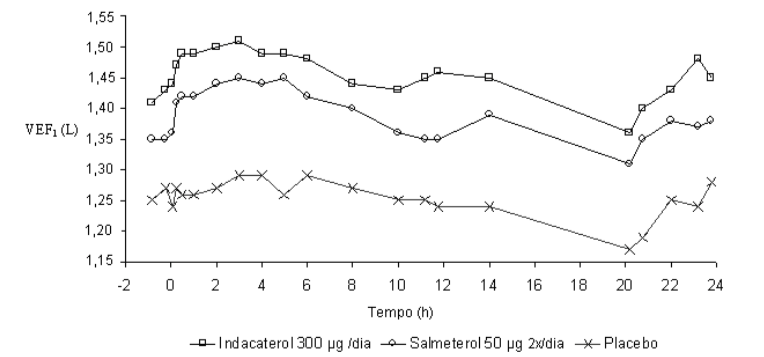
Neste estudo, medidas espirométricas sequenciais de 12-horas foram realizadas em um subgrupo de pacientes durante as horas diurnas (12 horas). Os valores de VEF1 sequenciais de 12 horas do Dia 1 e os valores de VEF1 no nadir, do Dia 2 são mostrados na Figura 1, e do Dia 182/183 na Figura 2, respectivamente. A melhora na função pulmonar perdurou 24 horas após a primeira dose e foi mantida, consistentemente, pelo período de tratamento de 26 semanas sem qualquer evidência de tolerância.
Figura 1 A menor média quadrática de VEF1 sequenciada durante 12 horas no Dia 1 e VEF1 no nadir, no Dia 2 (subconjunto por intenção de tratamento com 12 horas de espirometria sequencial)
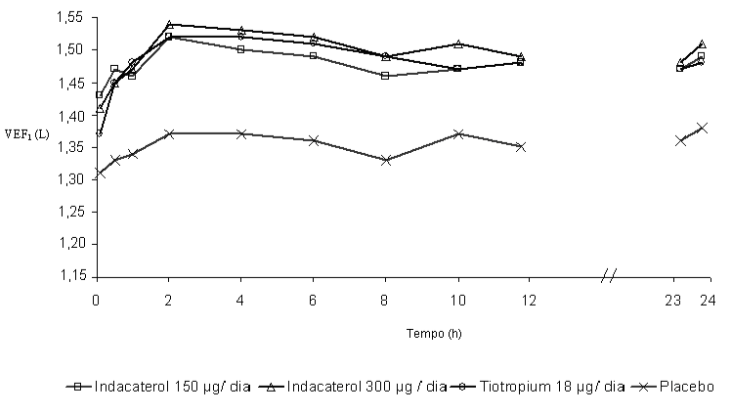
Figura 2 A menor média quadrática de VEF1 sequenciada durante 12 horas no Dia 182 e de VEF1 no nadir, no Dia 183 (subconjunto por intenção de tratamento com 12 horas de espirometria sequencial)
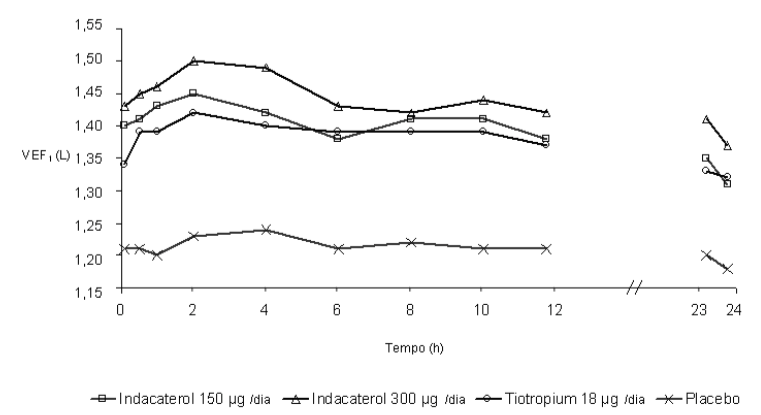
Em uma extensão de segurança deste estudo de 26 semanas, placebo-controlado em 414 pacientes, a eficácia não foi o primeiro ponto de avaliação, entretanto no segundo ponto de avaliação (Semana 52) de VEF1 no nadir, o tratamento tanto com Maleato de Indacaterol (substância ativa) 150 mcg como com 300 mcg uma vez ao dia resultou num valor de VEF1 no nadir significativamente maior comparado ao placebo (0,17 L, p < 0,001 e 0,18 L, p < 0,001, respectivamente).
Os resultados de um estudo de 12 semanas, placebo-controlado com 416 pacientes que avaliou a dose de 150 mcg uma vez ao dia, foram similares aos resultados do estudo de 26 semanas para esta dose. A melhora média do pico de VEF1, em relação ao nível basal, foi de 0,23 L após um dia de tratamento uma vez ao dia. No primeiro parâmetro de avaliação (Semana 12), o tratamento com Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia resultou em um valor de VEF1 no nadir, significativamente maior quando comparado com placebo (0,13 L, p < 0,001).
Em um estudo de 26 semanas, placebo e ativo-(salmeterol cego) controlado em 1.002 pacientes, os quais avaliaram Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia, a melhora média de VEF1, em relação ao basal, nos 5 minutos foi 0,11 L com uma melhora no pico de 0,25 L em relação ao basal após a primeira dose (Dia 1). No primeiro ponto de avaliação (Semana 12), o tratamento com Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia mostrou um valor de VEF1 no nadir significativamente maior comparado tanto ao placebo (0,17 L, p < 0,001) quanto ao salmeterol (0,06 L, p < 0,001).
Em um estudo de 52 semanas, controlado com placebo e ativo (formoterol), com 1.732 pacientes, que avaliou a dose de Maleato de Indacaterol (substância ativa) 300 mcg uma vez ao dia e uma dose maior, a melhora média de VEF1, em relação ao nível basal, em 5 minutos, foram 0,14 L com uma melhora no pico de 0,20 L em relação ao nível basal após a primeira dose (Dia 1). No primeiro parâmetro de avaliação (Semana 12), o tratamento com Maleato de Indacaterol (substância ativa) 300 mcg uma vez ao dia resultou em um valor de VEF1 no nadir, significativamente maior quando comparado ao placebo (0,17 L, p < 0,001) e ao formoterol (0,1 L, p < 0,001). Esta melhora na função pulmonar foi mantida durante o tratamento de 52 semanas, sem nenhuma evidência de perda de eficácia durante este período. Maleato de Indacaterol (substância ativa) foi superior ao formoterol em relação ao VEF1 no nadir, em todas as avaliações.
Em um estudo cruzado de 2 semanas, controlado com placebo e ativo (salmeterol open-label), a espirometria por 24 horas foi avaliada em 68 pacientes. Os valores espirométricos sequenciais durante 24 horas são demonstradas na Figura 3. Após 14 dias de tratamento uma vez ao dia, a melhora na função pulmonar quando comparada ao placebo foi mantida por 24 horas, além disso, o valor de VEF1 no nadir foi significativa e estatisticamente maior quando comparado ao salmeterol (0,09 L, p = 0,011). Resultados similares da espirometria sequencial de 24 horas foram observados após 26 semanas em um subgrupo de pacientes (n = 236) do estudo de 26 semanas. Ambos os estudos embasam ainda a melhora de VEF1 em relação ao placebo com a administração de Maleato de Indacaterol (substância ativa) uma vez ao dia, e que a broncodilatação foi mantida durante o intervalo da dose de 24 horas, em comparação ao placebo.
Figura 3 Perfil de 24h da menor média quadrática de VEF1 (L) após 14 dias de tratamento (população por intenção de tratamento modificada)
Características Farmacológicas
Mecanismo de ação
O indacaterol é um agonista beta2-adrenérgico de “ultra” longa duração para administração uma vez ao dia. Os efeitos farmacológicos dos agonistas beta2-adrenérgicos, incluindo indacaterol, são pelo menos em parte atribuídos ao estímulo da adenilciclase intracelular, a enzima que catalisa a conversão do trifosfato de adenosina (ATP) para 3, 5-monofosfato cíclico de adenosina (monofosfato cíclico). O aumento dos níveis de AMP cíclico causou o relaxamento do músculo liso brônquico. Os estudos in vitro mostraram que o indacaterol tem atividade agonista nos receptores beta2 24 vezes maior que nos receptores beta1 e 20 vezes maior que nos receptores beta3. Este perfil seletivo é similar ao do formoterol.
Quando inalado, o indacaterol age localmente nos pulmões como um broncodilatador. O indacaterol é um agonista quase completo dos receptores humanos beta2-adrenérgicos com potência nanomolar. Em brônquios humanos isolados, o indacaterol tem um rápido início de ação e de longa duração.
Embora os receptores beta2-adrenérgicos sejam os predominantes no músculo liso brônquico e os receptores beta1-adrenérgicos sejam os predominantes no coração humano, há também receptores beta2-adrenérgicos no coração humano que correspondem de 10% a 50% do total dos receptores adrenérgicos. A função exata dos receptores beta2- adrenérgicos no coração é desconhecida, mas sua presença aumenta a possibilidade de, até mesmo os agonistas beta2- adrenérgicos altamente seletivos, apresentarem efeitos cardíacos.
Propriedades Farmacodinâmicas
Farmacocinética
População especial
Uma análise populacional do efeito da idade, sexo e peso na exposição sistêmica em pacientes com DPOC após inalação indicou que Maleato de Indacaterol (substância ativa) pode ser usado seguramente em todos os grupos de idade e de peso e independente do sexo. Não foi sugerida qualquer diferença entre subgrupos étnicos nesta população. Experiências de tratamento limitadas estão disponíveis na população negra.
A farmacocinética de indacaterol foi investigada em dois genótipos UGT1A1 diferentes – o genótipo [(TA)6, (TA)6] completamente funcional e o genótipo [(TA)7, (TA)7] de baixa atividade (síndrome de Gilbert genotípica). O estudo demonstrou que os estados de equilíbrio de ASC e Cmáx do indacaterol foram 1,2 vezes maior no genótipo [(TA)7, (TA)7], indicando que a exposição sistêmica do indacaterol é afetado de forma insignificante apenas por esta variação do genótipo UGT1A1.
Os pacientes com disfunção hepática leve a moderada não apresentaram mudança relevante no Cmáx ou ASC do indacaterol, bem como nenhuma diferença na ligação proteica entre os pacientes com disfunção hepática leve e moderada e seus controles saudáveis. Estudos em pacientes com disfunção hepática grave não foram realizados.
Devido à baixa contribuição da via urinária na eliminação corpórea total, não foi realizado um estudo em pacientes com deficiência renal.
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram risco especial para humanos baseado nos estudos convencionais de segurança farmacológica, toxicidade de dose repetida, genotoxicidade, potencial carcinogênico e toxicidade na reprodução. Os efeitos do indacaterol observados nos estudos de toxicidade em cães ocorreram principalmente no sistema cardiovascular e foram constituídos por taquicardia, arritmias e lesões miocárdicas.
Estes são efeitos farmacológicos conhecidos e poderiam ser explicados pelas propriedades beta2-agonistas do indacaterol. Outros efeitos relevantes notados em estudos de toxicidade de dose repetida foram leve irritação do trato respiratório superior em ratos, compatível com rinite e alterações epiteliais da cavidade nasal e laringe. Todos estes achados foram observados apenas com exposições consideradas suficientemente superiores em relação à exposição máxima humana indicando pequena relevância para o uso clínico.
Os efeitos adversos em relação à fertilidade, gravidez, desenvolvimento embrionário/fetal, desenvolvimento pré e pós- natal só puderam ser demonstrados em doses 195 vezes maiores que a dose inalatória máxima recomendada diariamente de 300 mcg em humanos (em uma base de mg/m2). Esses efeitos, especificamente o aumento da incidência de uma variação esquelética, foram observados em coelhos. O indacaterol não foi teratogênico em ratos e coelhos após administração subcutânea. Os estudos de genotoxicidade não revelaram nenhum potencial mutagênico ou clastogênico. O potencial carcinogênico de indacaterol foi avaliado em um estudo de inalação de 2 anos em ratos e um estudo oral de 26 semanas em camundongos transgênicos. O tratamento vitalício de ratos resultou num aumento da incidência de leiomioma ovariano benigno e hiperplasia focal dos músculos lisos ovarianos em fêmeas, nas doses aproximadamente 68 vezes maiores que a dose máxima recomendada de 300 mcg uma vez ao dia para humanos (em uma base de mg/m2).
Os aumentos em leiomiomas do trato genital de ratas foram similarmente demonstrados com outros medicamentos agonistas beta2-adrenérgicos. Um estudo oral de 26 semanas (por sonda) em camundongos CB6F1/TgrasH2 hemizigóticos com indacaterol não mostrou nenhuma evidência de tumorigenicidade nas doses de aproximadamente 9.800 vezes maiores que a dose máxima recomendada de 300 mcg uma vez ao dia para humanos (em uma base de mg/m2).
Embora o indacaterol não tenha afetado a capacidade reprodutiva geral em um estudo de fertilidade com ratos, verificou-se uma diminuição do número de gravidezes na geração F1 em estudo de pré e pós-desenvolvimento em ratos, com uma exposição 14 vezes superior à de humanos tratados com Maleato de Indacaterol (substância ativa).
Cuidados de Armazenamento
Não use após a data de validade impressa na caixa.Conservar o produto em temperatura ambiente (entre 15 e 30°C) e proteger da umidade.
Mantenha o produto na embalagem original.
Armazene em um lugar seco, protegido do calor e da umidade.
Mantenha o produto fora do alcance e da visão das crianças. ?Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
?Aspectos físicos
- ?- Onbrize 150 mcg – código do produto (IDL 150) e logo da empresa impressos em preto sobre a cápsula transparente e incolor.?
- Onbrize 300 mcg – código do produto (IDL 300) e logo da empresa impressos em azul sob a cápsula transparente e incolor.
?Antes de usar, observe o aspecto do medicamento.
Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo. ?
Mensagens de Alerta
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use este medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde. ?
Dizeres Legais
MS – 1.0068.1073
?Farm. Resp.: Flavia Regina Pegorer - CRF-SP 18.150 ?
Importado por:
Novartis Biociências S.A.?
Av. Professor Vicente Rao, 90 ?São Paulo – SP?
CNPJ: 56.994.502/0001-30
Indústria Brasileira ?
Fabricado por:
Novartis Pharma Stein AG, Stein, Suíça ?
Embalado por:
Novartis Farmacéutica S.A., Barberà Del Vallès
informações complementares
| Fabricante |
| NOVARTIS |
| Princípio ativo |
| Maleato De Indacaterol |
| Categoria do medicamento |
| Medicamentos de A-Z |
