Comparamos o preço de Procoralan - 7,5Mg 56 Comprimidos, veja o menor preço

R$ 173,34
RReferência
14
ofertasMelhores preços a partir de R$ 173,34 até R$ 225,15
Menor preço
vendido por Farmácia Preço Popular
economize
23.01%
R$ 173,34
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogarias Pacheco
economize
22.59%
R$ 174,29
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Indiana
economize
22.54%
R$ 174,41
vendido por Drogaria São Paulo
economize
20.95%
R$ 177,99
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Online Farmagora
economize
19.13%
R$ 182,09
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Pague Menos
economize
18.73%
R$ 182,99
vendido por Sansil Farma
economize
18.23%
R$ 184,10
Frete Reduzido para o estado de São Paulo acesse e confira
vendido por Drogaria Catarinense
economize
14.11%
R$ 193,38
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Drogaria Primus
economize
12.02%
R$ 198,09
vendido por Drogaria Nova Esperança
economize
11.77%
R$ 198,66
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
vendido por Promofarma
economize
11.50%
R$ 199,25
vendido por Farmácia Super Droga 10
economize
9.11%
R$ 204,65
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Panvel Farmácias
economize
7.65%
R$ 207,92
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Oncolog Medicamentos Especiais
R$ 225,15
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Procoralan é destinado ao tratamento dos
Sintomas da angina pectoris estável (que causa dor no peito) em adultos cuja frequência cardíaca é maior ou igual a 70 batimentos por minuto. Procoralan é utilizado quando o tratamento com betabloqueadores não é tolerado ou recomendado. Procoralan também é utilizado em associação com betabloqueadores em pacientes adultos cuja condição não é totalmente controlada com betabloqueadores.
Insuficiência cardíaca crônica em pacientes adultos cuja frequência cardíaca acima ou igual a 70 batimentos por minuto. Procoralan é utilizado em associação com terapia padrão, incluindo betabloqueadores na dose recomendada ou máxima tolerada, ou quando os betabloqueadores não são tolerados.
Sobre a angina pectoris (usualmente conhecida como “angina”)
A angina estável é uma doença do coração que se manifesta sempre que o coração não recebe oxigênio em quantidade suficiente. Ela surge geralmente entre os 40 e os 50 anos de idade. O sintoma mais comum da angina é dor no peito ou desconforto. A angina estável aparece mais frequentemente quando o coração bate mais rápido, em situações de exercício, emoção, exposição ao frio ou após uma refeição. Esse aumento na frequência cardíaca pode causar dor no peito nas pessoas que sofrem de angina.
Sobre a insuficiência cardíaca crônica
A insuficiência cardíaca crônica é uma doença do coração que acontece quando o coração não consegue bombear sangue suficiente para o resto do corpo.
Os sintomas mais comuns da insuficiência cardíaca são
Falta de ar, fadiga, cansaço e inchaço no tornozelo.
Como o Procoralan funciona?
Procoralan age através da redução da frequência cardíaca (ritmo do coração) em alguns batimentos por minuto. Isto diminui a necessidade de oxigênio do coração, especialmente nas situações que uma crise de angina está mais propensa a ocorrer. Desta maneira, Procoralan ajuda a controlar e a reduzir o número de crises de angina. Além disso, como a frequência cardíaca (ritmo do coração) elevada afeta negativamente o funcionamento do coração e o prognóstico vital dos pacientes com insuficiência cardíaca crônica, a ação específica da ivabradina na redução da frequência cardíaca (ritmo do coração) contribui para a melhora do funcionamento do coração e o prognóstico vital nesses pacientes.
Contraindicação
Você não deve utilizar Procoralan
- Se você é alérgico à ivabradina ou a qualquer um dos componentes deste medicamento;
- Se a sua frequência cardíaca (ritmo do coração) em repouso antes do tratamento for muito baixa (inferior a 70 batimentos por minuto);
- Se você sofre de choque cardiogênico (condição cardíaca tratada em hospital);
- Se você sofre de uma alteração do ritmo cardíaco;
- Se você estiver sofrendo um ataque cardíaco;
- Se a sua pressão arterial é muito baixa;
- Se você sofre de uma angina instável (uma forma grave na qual a dor no peito ocorre muito frequentemente, com ou sem esforço);
- Se você tem insuficiência cardíaca que recentemente apresentou piora;
- Se seu batimento cardíaco é exclusivamente imposto pelo seu marca-passo;
- Se você sofre de problemas de fígado graves;
- Se você já estiver utilizando medicamentos para o tratamento de infecções fúngicas (como cetoconazol e itraconazol), antibióticos da família dos macrolídeos (como josamicina, claritromicina, telitromicina ou eritromicina administrada por via oral), medicamentos para tratar infecções por HIV (como nelfinavir e ritonavir) ou nefazodona (um medicamento para tratar a depressão) ou diltiazem, verapamil (para tratamento da hipertensão arterial ou da angina pectoris);
- Se tiver possibilidade de engravidar e não estiver usando métodos contraceptivos adequados;
- Se você está grávida ou planejando engravidar;
- Se você está amamentando.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Como usar
Tome Procoralan exatamente conforme indicado pelo seu médico ou farmacêutico. Fale com seu médico ou farmacêutico se tiver dúvidas.
Procoralan deve ser tomado durante as refeições
Se você está em tratamento da angina pectoris estável
A dose inicial não deve exceder um comprimido de Procoralan 5mg duas vezes ao dia. Se você ainda tem sintomas de angina e se você tolerou bem a dose de 5mg duas vezes ao dia, a dose pode ser aumentada. A dose de manutenção não deve exceder 7.5mg duas vezes ao dia. Seu médico irá prescrever a dose correta para você. A dose habitual é de um comprimido pela manhã e outro à noite. Em alguns casos (ex: se você é idoso), seu médico pode prescrever metade de uma dose, isto é, meio comprimido de Procoralan 5mg (correspondente a 2.5mg de ivabradina) na parte da manhã e meio comprimido de 5mg à noite,
Se você está em tratamento da insuficiência cardíaca crônica
A dose inicial habitualmente recomendada é de um comprimido de Procoralan 5mg duas vezes ao dia aumentando, se necessário, para um comprimido de Procoralan 7,5mg duas vezes ao dia. O seu médico irá decidir a correta dose para você. A dose habitual é de um comprimido pela manhã e outro à noite. Em alguns casos (ex: pacientes idosos), seu médico pode prescrever metade da dose, isto é, meio comprimido de Procoralan 5mg (correspondente a 2,5mg de ivabradina) pela manhã e meio comprimido de Procoralan 5mg à noite.
Se você parar de tomar Procoralan
Como o tratamento da angina ou da insuficiência cardíaca crônica normalmente são tratamentos prolongados, você deve falar com seu médico antes de interromper o tratamento com esse medicamento.
Se você notar que o efeito de Procoralan está muito forte ou muito fraco, consulte o seu médico ou farmacêutico.
Se você tiver qualquer outra dúvida sobre este medicamento, consulte seu médico ou farmacêutico.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Procoralan?
Caso você se esqueça de tomar Procoralan no horário receitado pelo seu médico, tome a dose seguinte no horário usual. Não tome o medicamento duas vezes para compensar a dose esquecida.
O calendário impresso sobre o blister permite que você verifique qual foi o último dia da semana que você tomou um comprimido de Procoralan.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Você deve entrar em contato com seu médico ou farmacêutico antes de tomar Procoralan
- Se você sofre de alterações do ritmo cardíaco (como batimento cardíaco irregular, palpitação e aumento da dor no peito) ou fibrilação atrial sustentada (um tipo de batimento cardíaco irregular) ou uma anormalidade no eletrocardiograma (ECG) denominada “síndrome do QT longo;
- Se você apresenta sintomas como cansaço, tonturas ou falta de ar (isto pode significar que seu coração está batendo lento demais);
- Se você sofre de sintomas de fibrilação atrial (frequência cardíaca em repouso incomumente alta (mais de 110 batimentos por minuto) ou irregular, sem razão aparente, que dificulta a mensuração); Se você teve recentemente um acidente vascular cerebral (derrame cerebral);
- Se você sofre de hipotensão (pressão arterial baixa) leve a moderada;
- Se você sofre de pressão arterial não controlada, especialmente após uma mudança no seu tratamento anti-hipertensivo;
- Se você sofre de insuficiência cardíaca grave ou insuficiência cardíaca com uma anormalidade no ECG denominada como “bloqueio de ramo”;
- Se você sofre de uma doença crônica da retina;
- Se você sofre de problemas moderados do fígado;
- Se você sofre de problemas renais graves. Se qualquer uma dessas situações se aplicar a você, fale imediatamente com seu médico antes ou durante o tratamento com Procoralan
Interações medicamentosas
Informe o seu médico ou farmacêutico se você está fazendo uso, se utilizou recentemente ou se vier a fazer uso de outros medicamentos.
Informe o seu médico se você utiliza qualquer um dos medicamentos abaixo, uma vez que pode ser necessário um ajuste da dose de Procoralan ou sua monitorização:
- Fluconazol (um antifúngico);
- Rifampicina (um antibiótico);
- Barbitúricos (para tratamento de dificuldades em dormir ou epilepsia);
- Fenitoína (para tratamento da epilepsia);
- Hypericum perforatum ou erva de São João (tratamentos fitoterápicos para depressão);
- Medicamentos que prolongam o intervalo QT utilizados para tratamento das alterações do ritmo cardíaco ou outras patologias, tais como: Quinidina, disopiramida, ibutilida, sotalol, amiodarona (para tratamento das alterações do ritmo cardíaco);
- Bepridil (para tratamento da angina pectoris);
- Alguns tipos de medicamentos para tratamento da ansiedade, esquizofrenia ou outras psicoses (tais como pimozida, ziprasidona, sertindol);
- Medicamentos antimaláricos (tais como a mefloquina ou a halofantrina);
- Eritromicina intravenosa (um antibiótico);
- Pentamidina (um medicamento antiparasitário);
- Cisaprida (para tratamento do refluxo gastroesofágico);
- Alguns tipos de diuréticos que podem diminuir o nível de potássio no sangue, tais como a furosemida, hidroclorotiazida, indapamida (utilizados no tratamento de edema e pressão arterial elevada).
Alimentos e bebidas
Evitar o consumo de suco de toranja (grapefruit) durante o tratamento com Procoralan.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Assim como todos os medicamentos, Procoralan pode causar eventos adversos, embora nem todos os pacientes irão apresentá-los.
Os eventos adversos mais comuns com este medicamento são dependentes da dose e relacionados com seu modo de ação
Reações muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento)
Fenômenos visuais luminosos transitórios (breves momentos de luminosidade aumentada, geralmente provocados por alterações súbitas na intensidade da luz). Também podem ser descritos como uma auréola (círculo dourado), luzes coloridas intermitentes, decomposição de imagens ou imagens múltiplas.
Geralmente, estes ocorrem durante os primeiros dois meses de tratamento, após os quais podem ocorrer repetidamente e desaparecer durante ou após o tratamento.
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento
Modificação do funcionamento do coração (os sintomas são redução da frequência cardíaca). Esta situação, em particular, pode ocorrer durante os primeiros 2 a 3 meses de tratamento.
Outros eventos adversos também notificados
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento)
Contração rápida irregular do coração, percepção anormal do batimento cardíaco, pressão arterial não controlada, dor de cabeça, tonturas e visão turva(visão nebulosa).
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
Palpitações e batimentos cardíacos extras, sensação de mal estar (náuseas), constipação (prisão de ventre), diarréia, dor abdominal, sensação giratória (vertigem), dificuldade de respirar (dispnéia), cãimbras musculares, alterações em parâmetros laboratoriais: elevado nível de ácido úrico no sangue, excesso de eosinófilos (um tipo de glóbulos brancos) e elevado nível de creatinina no sangue (um produto de degradação muscular), erupção cutânea, angioedema (tais como inchaço da face, língua ou garganta, dificuldade em respirar ou deglutir), pressão arterial baixa, desmaios, sensação de cansaço, sensação de fraqueza, traçado anormal do eletrocardiograma (ECG), visão dupla e alteração visual.
Reações raras (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
Urticária, coceira, vermelhidão da pele e mal estar.
Reações muito raras (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento)
Batimentos cardíacos irregulares.
Se você tiver qualquer evento adverso, incluindo possíveis eventos adversos não indicados na bula, fale com o seu médico ou farmacêutico.
Atenção: Este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer reações adversas imprevisíveis ou desconhecidas. Neste caso, informe seu médico.
População Especial
Crianças
Procoralan não é destinado para o tratamento de crianças e adolescentes menores que 18 anos.
Efeitos na capacidade de dirigir veículos e operar máquinas
Procoralan pode provocar temporariamente fenômenos visuais luminosos (luminosidade transitória no campo de visão, ver item 8. Quais os males que este medicamento pode me causar?). Se isto lhe acontecer, tenha cuidado quando conduzir veículos ou utilizar máquinas nas ocasiões em que possam ocorrer alterações súbitas na intensidade da luz, especialmente quando dirigir à noite.
Gravidez e lactação
Não utilize Procoralan se você estiver grávida ou planejando engravidar.
Se você estiver grávida e tiver utilizado Procoralan, entre em contato com o seu médico.
Não utilize Procoralan se tiver a possibilidade de engravidar, a não ser que esteja utilizando métodos contraceptivos adequados.
Não utilize Procoralan se você estiver amamentando.
Fale com seu médico se estiver amamentando ou planejando amamentar, uma vez que a amamentação deve ser descontinuada se estiver usando Procoralan.
Se você está grávida ou amamentando, se pensa que pode estar grávida ou planeja engravidar, consulte seu médico ou farmacêutico antes de tomar este medicamento.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
Cada comprimido revestido de 5,0 mg contém:
| Cloridrato de ivabradina* | 5,39 mg |
| Excipientes q.s.p. | 1 comprimido revestido |
*Correspondente a 5,0 mg de ivabradina.
Cada comprimido revestido de 7,5mg contém:
| Cloridrato de ivabradina* | 8,085mg |
| Excipientes q.s.p. | 1 comprimido revestido |
*Correspondente a 7,5 mg de ivabradina.
Excipientes: lactose monoidratada, estearato de magnésio, amido, maltodextrina, dióxido de silício, hipromelose, dióxido de titânio, macrogol, glicerol, óxido de ferro amarelo e óxido férrico vermelho.
Superdosagem
Uma dose elevada de Procoralan pode provocar falta de ar ou cansaço porque seu coração bate menos. Nestes casos, entre imediatamente em contato com seu médico.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações farmacodinâmicas
Associações não recomendadas
Medicamentos que prolongam o intervalo QT
- Medicamentos cardiovasculares que prolongam o intervalo QT (ex: quinidina, disopiramida, bepridil, sotalol, ibutilida, amiodarona).
- Medicamentos não cardiovasculares que prolongam o intervalo QT (ex: pimozida, ziprasidona, sertindol, mefloquina, halofantrina, pentamidina, cisaprida, eritromicina intravenosa).
A associação da Cloridrato de Ivabradina (substância ativa) com medicamentos cardiovasculares e não cardiovasculares que prolongam o intervalo QT deve ser evitada, pois o prolongamento do intervalo QT pode ser potencializado pela redução da frequência cardíaca. Se a associação for necessária, um estreito monitoramento cardíaco deverá ser realizado.
Associações que necessitam de precauções de uso
Diuréticos depletivos de potássio (diuréticos tiazídicos e diuréticos da alça)
Hipocalemia pode aumentar o risco de arritmias. Como a Cloridrato de Ivabradina (substância ativa) pode causar bradicardia, a combinação de hipocalemia e bradicardia é um fator de predisposição para o aparecimento de arritmias graves, especialmente em pacientes com intervalo QT longo, de origem congênita ou induzido por uma substância.
Interações farmacocinéticas
Citocromo P450 3A4 (CYP3A4)
A Cloridrato de Ivabradina (substância ativa) é metabolizada exclusivamente pelo CYP3A4 e é um inibidor muito fraco deste citocromo.
A Cloridrato de Ivabradina (substância ativa) demonstrou não influenciar o metabolismo e as concentrações plasmáticas dos outros substratos do CYP3A4 (sejam eles inibidores fracos, moderados ou fortes). Os inibidores e os indutores do CYP3A4 são susceptíveis de interagir com a Cloridrato de Ivabradina (substância ativa) e influenciam o seu metabolismo e farmacocinética numa extensão clinicamente significativa.
Os estudos de interações medicamentosas estabeleceram que os inibidores do CYP3A4 aumentam as concentrações plasmáticas da Cloridrato de Ivabradina (substância ativa), enquanto que os indutores as diminuem. As concentrações plasmáticas aumentadas da Cloridrato de Ivabradina (substância ativa) podem estar associadas a um risco de bradicardia excessiva.
Associações contraindicadas
O uso concomitante de potentes inibidores do CYP3A4 tais como os antifúngicos azol (cetoconazol, itraconazol), antibióticos macrolídeos (claritromicina, eritromicina via oral, josamicina, telitromicina), inibidores da protease do HIV (nelfinavir, ritonavir) e nefazodona está contraindicado.
Os potentes inibidores do CYP3A4, cetoconazol (200 mg uma vez ao dia) e josamicina (1 g duas vezes ao dia) aumentaram a exposição plasmática média da Cloridrato de Ivabradina (substância ativa) em 7 a 8 vezes.
Inibidores moderados do CYP3A4
Os estudos específicos de interação em voluntários saudáveis e pacientes demonstraram que a associação da Cloridrato de Ivabradina (substância ativa) com os agentes redutores da frequência cardíaca, diltiazem ou verapamil, resultaram em um aumento da exposição à Cloridrato de Ivabradina (substância ativa) (aumento de 2 a 3 vezes a ASC) e uma redução adicional da frequência cardíaca de 5 bpm. A associação da Cloridrato de Ivabradina (substância ativa) com estes medicamentos é contraindicada.
Associações que necessitam de precauções de uso
Inibidores moderados do CYP3A4
A associação da Cloridrato de Ivabradina (substância ativa) com outros inibidores moderados do CYP3A4 (ex: fluconazol) pode ser considerada com a dose inicial de 2,5 mg duas vezes ao dia, se a frequência cardíaca em repouso for superior a 70 bpm, com monitoramento da frequência cardíaca.
Indutores do CYP3A4
Os indutores do CYP3A4 (tais como rifampicina, barbitúricos, fenitoína, Hypericum perforatum [Erva de São João]) podem reduzir a exposição da Cloridrato de Ivabradina (substância ativa) e sua atividade. A associação de medicamentos indutores do CYP3A4 pode requerer um ajuste de dose da Cloridrato de Ivabradina (substância ativa). A associação de 10 mg de Cloridrato de Ivabradina (substância ativa) duas vezes ao dia com o Hypericum perforatum reduziu à metade a ASC da Cloridrato de Ivabradina (substância ativa). O uso do Hypericum perforatum deve ser restrito durante o tratamento com a Cloridrato de Ivabradina (substância ativa).
Outras associações
Estudos específicos de interação demonstraram que não existe efeito clinicamente significativo dos seguintes medicamentos na farmacocinética e farmacodinâmica da Cloridrato de Ivabradina (substância ativa)
Inibidores da bomba de prótons (omeprazol, lansoprazol), sildenafil, inibidores da HMG CoA redutase (sinvastatina), bloqueadores dos canais de cálcio diidropiridínicos (anlodipino, lacidipina), digoxina e varfarina. Além disso, não houve qualquer efeito clinicamente significativo da Cloridrato de Ivabradina (substância ativa) sobre a farmacocinética da sinvastatina, anlodipino, lacidipina, sobre a farmacocinética e a farmacodinâmica da digoxina, varfarina e sobre a farmacodinâmica da aspirina.
Em ensaios clínicos essenciais de fase III, os seguintes medicamentos foram rotineiramente associados à Cloridrato de Ivabradina (substância ativa) sem evidência de problemas de segurança
Inibidores da enzima conversora de angiotensina, antagonistas da angiotensina II, betabloqueadores, diuréticos, antagonistas da aldosterona, nitratos de ação curta e longa, inibidores da HMG CoA redutase, fibratos, inibidores da bomba de prótons, antidiabéticos orais, aspirina e outros agentes antiplaquetários.
População Pediátrica
Estudos de interação só foram conduzidos em adultos.
Interação Alimentícia
Suco de toranja (grapefruit)
A exposição à Cloridrato de Ivabradina (substância ativa) aumentou 2 vezes após a coadministração com suco de pomelo ou toranja (grapefruit). Portanto, a ingestão desse suco deve ser evitada durante o tratamento com a Cloridrato de Ivabradina (substância ativa).
Ação da Substância
Resultados de eficácia
Eficácia e segurança clínica
A eficácia antianginosa e anti-isquêmica da Cloridrato de Ivabradina (substância ativa) foi avaliada em cinco estudos randomizados duplo-cego (três versus placebo, um versus atenolol e um versus anlodipino). Estes estudos incluíram um total de 4.111 pacientes portadores de angina pectoris crônica estável, sendo que 2617 pacientes receberam a Cloridrato de Ivabradina (substância ativa).
Cloridrato de Ivabradina (substância ativa) 5mg duas vezes ao dia demonstrou ser efetiva nos parâmetros de teste de exercício dentro de 3 a 4 semanas de tratamento. A eficácia foi confirmada na dose de 7,5 mg duas vezes ao dia. Em particular, o benefício adicional em comparação a 5 mg duas vezes ao dia foi estabelecido em um estudo controladoreferência, versus atenolol: duração total do exercício no vale aumentou em cerca de 1 minuto após um mês de tratamento com 5 mg duas vezes ao dia e ainda melhorou em quase 25 segundos após um período adicional de 3 meses com titulação forçada para 7,5 mg duas vezes ao dia. Neste estudo, os benefícios anti-anginosos e antiisquêmicos da Cloridrato de Ivabradina (substância ativa) foram confirmados em pacientes com 65 anos ou mais. A eficácia das doses de 5mg e 7,5 mg duas vezes ao dia foi consistente em todos os estudos de parâmetros de teste de exercício (duração total do exercício, tempo para angina limitante, tempo para aparecimento de angina e tempo para depressão de 1mm do segmento ST) e foi associado a uma diminuição de cerca de 70% na taxa de crises de angina. O regime de administração de Cloridrato de Ivabradina (substância ativa) duas vezes ao dia assegurou uma eficácia uniforme durante 24 horas. Em um estudo randomizado placebo controlado envolvendo 889 pacientes, a Cloridrato de Ivabradina (substância ativa) administrada em pacientes já fazendo uso de atenolol 50mg uma vez ao dia, mostrou eficácia adicional em todos os parâmetros dos testes de tolerância ao exercício (EET) no vale da atividade do medicamento (12h após administração oral).
Em um estudo randomizado placebo controlado envolvendo 725 pacientes, a Cloridrato de Ivabradina (substância ativa) não demonstrou eficácia adicional quando administrada em pacientes já fazendo uso de anlodipino no vale da atividade do medicamento (12h após administração oral) enquanto que uma eficácia adicional foi demonstrada no pico (3-4 horas após administração oral).
A eficácia da Cloridrato de Ivabradina (substância ativa) manteve-se plenamente ao longo dos 3 ou 4 meses do período de tratamento nos estudos de eficácia. Não houve nenhuma evidência de tolerância farmacológica (perda da eficácia) durante o tratamento e nem de fenômenos rebotes após a interrupção abrupta do tratamento. Os efeitos antianginosos e anti-isquêmicos da Cloridrato de Ivabradina (substância ativa) foram associados a reduções dose-dependentes da frequência cardíaca e com uma diminuição significativa do produto frequência pressão (frequência cardíaca x pressão arterial sistólica) em repouso e durante o exercício. Os efeitos na pressão arterial e na resistência vascular periférica foram menores e clinicamente não significativos.
A redução sustentada da frequência cardíaca foi demonstrada em pacientes tratados com Cloridrato de Ivabradina (substância ativa) por pelo menos um ano (n = 713). Nenhuma influência sobre o metabolismo glicídico ou lipídico foi observada.
A eficácia antianginosa e anti-isquêmica da Cloridrato de Ivabradina (substância ativa) foi preservada em pacientes diabéticos (n=457), com um perfil de segurança semelhante à população geral.
Um grande estudo, BEAUTIFUL, foi conduzido em 10.917 pacientes com doença arterial coronariana e disfunção ventricular esquerda (FEVE <40%), já tratados com terapêutica considerada ótima em que 86,9% dos pacientes que recebiam betabloqueadores. O principal critério de eficácia foi a composição de morte cardiovascular, hospitalização por infarto agudo do miocárdio ou hospitalização por aparecimento ou agravamento da insuficiência cardíaca. O estudo demonstrou não haver diferença na frequência de desfecho primário composto no grupo Cloridrato de Ivabradina (substância ativa) em comparação ao grupo placebo (risco relativo Cloridrato de Ivabradina (substância ativa): placebo 1,00, p = 0,945).
Em um subgrupo post-hoc de pacientes com angina sintomática na randomização (n=1507), nenhum sinal de segurança foi identificado em relação à morte cardiovascular, hospitalização por infarto agudo do miocárdio ou insuficiência cardíaca (Cloridrato de Ivabradina (substância ativa) 12% versus placebo 15.5%, p=0,05).
Um grande estudo, SIGNIFY, foi realizado com 19102 pacientes com doença arterial coronariana e sem insuficiência cardíaca clínica (FEVE > 40%), associada a terapia otimizada. Um esquema terapêutico maior do que a posologia aprovada foi utilizada (dose inicial 7.5mg duas vezes ao dia (5mg duas vezes ao dia, se ? 75 anos) e titulação até 10mg duas vezes ao dia). O principal critério de eficácia foi o composto de morte cardiovascular ou infarto do miocárdio não fatal. O estudo não demostrou diferença na taxa do principal critério de eficácia(PCE) no grupo da Cloridrato de Ivabradina (substância ativa) em comparação ao grupo placebo (risco relativo Cloridrato de Ivabradina (substância ativa)/placebo 1.08, p=0.197). Bradicardia foi reportada por 17,9% dos pacientes no grupo da Cloridrato de Ivabradina (substância ativa) (2.1% no grupo placebo). Verapamil, diltiazem ou inibidores fortes da CYP3A4 foram recebidos por 7.1% dos pacientes durante o estudo.
Um pequeno aumento estatisticamente significante do PCE foi observado em um subgrupo pré-específico de pacientes com angina em CCS classe II ou superior na linha de base (n=12049) (taxas anuais 3.4% versus 2.9 %, risco relativo Cloridrato de Ivabradina (substância ativa)/placebo 1.18, p=0.018), mas não no subgrupo da população geral dos pacientes com angina em CCS classe ?I (n=14286) (risco relativo Cloridrato de Ivabradina (substância ativa)/placebo 1.11, p=0.110). A dose maior que aprovada utilizada no estudo não explica completamente estes resultados.
O estudo SHIFT foi um grande estudo multicêntrico, internacional, randomizado, duplo-cego placebo controlado, conduzido em 6505 pacientes adultos com insuficiência cardíaca crônica estável (com duração ? 4 semanas:), classe NYHA II a IV, com fração de ejeção ventricular esquerda reduzida (FEVE ? 35%) e uma frequência cardíaca de repouso ? 70 bpm.
Os pacientes receberam o tratamento padrão, incluindo betabloqueadores (89%), inibidores da ECA e / ou antagonistas da angiotensina II (91%), diuréticos (83%), e antagonistas da aldosterona (60%). No grupo de Cloridrato de Ivabradina (substância ativa), 67% dos pacientes foram tratados com 7,5 mg duas vezes ao dia. O tempo de seguimento médio foi de 22,9 meses. O tratamento com Cloridrato de Ivabradina (substância ativa) foi associado com uma redução média da frequência cardíaca de 15 bpm a partir do valor base de 80 bpm. A diferença de frequência cardíaca entre Cloridrato de Ivabradina (substância ativa) e placebo foi de 10,8 bpm aos 28 dias, 9,1 bpm aos 12 meses e de 8,3 bpm aos 24 meses.
O estudo demonstrou uma redução clinicamente e estatisticamente significativa do risco relativo de 18% na taxa de desfecho primário composto de mortalidade cardiovascular e hospitalização por agravamento da insuficiência cardíaca (risco relativo: 0,82, IC 95% [0,75; 0,90] - p <0,0001) evidente dentro de 3 meses do início do tratamento. A redução do risco absoluto foi de 4,2%. Os resultados no desfecho primário são motivados principalmente pelos desfechos da insuficiência cardíaca, hospitalização por agravamento da insuficiência cardíaca (redução do risco absoluto de 4,7%) e mortes por insuficiência cardíaca (redução do risco absoluto de 1,1%).
Efeito do tratamento no desfecho primário composto, seus componentes e desfechos secundários.
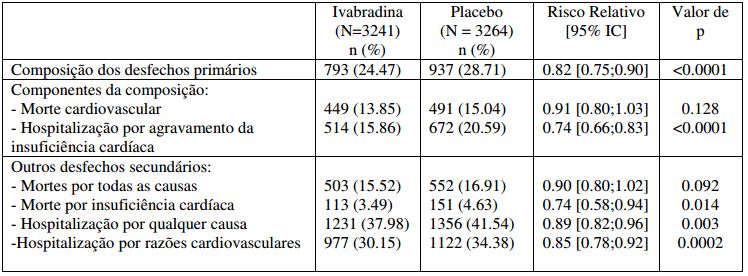
A redução no desfecho primário foi observada de forma consistente, independentemente de gênero, classe NYHA, etiologia da insuficiência cardíaca isquêmica ou não isquêmica e do histórico de diabetes ou hipertensão.
No subgrupo de pacientes com frequência cardíaca ? 75 bpm (n = 4150), uma maior redução foi observada no desfecho primário composto de 24% (risco relativo: 0,76, IC 95% [0,68; 0,85] - p <0,0001) e para outros desfechos secundários, incluindo morte por todas as causas (risco relativo: 0,83, IC 95% [0,72; 0,96] - p = 0,0109) e morte cardiovascular (risco relativo: 0,83, IC 95% [0,71; 0,97] - p = 0,0166). Neste subgrupo de pacientes, o perfil de segurança da Cloridrato de Ivabradina (substância ativa) está em linha com a da população em geral.
Um efeito significativo foi observado no desfecho primário composto para a generalidade de pacientes recebendo terapia de betabloqueadores (risco relativo: 0,85, IC 95% [0,76; 0,94]). No subgrupo de pacientes com frequência cardíaca ? 75 bpm e na dose alvo recomendada de betabloqueador, nenhum benefício estatisticamente significativo foi observado no desfecho primário composto (risco relativo: 0,97, IC 95% [0,74; 1,28]) e outros desfechos secundários, incluindo hospitalização por agravamento da insuficiência cardíaca (risco relativo: 0,79, IC 95% [0,56; 1,10]) ou morte por insuficiência cardíaca (risco relativo: 0,69, IC 95% [0,31; 1,53]).
Houve uma melhora significativa na classe NYHA nos últimos valores registrados, 887 (28%) dos pacientes tratados com Cloridrato de Ivabradina (substância ativa) apresentaram melhora contra 776 (24%) dos pacientes tratados com placebo (p = 0,001).
Dados de segurança pré-clínica
Os dados não clínicos não revelam nenhum risco especial para humanos, segundo estudos convencionais de segurança farmacológica, toxicidade de dose repetida, genotoxicidade e potencial carcinogênico. Os estudos de toxicidade reprodutiva demonstraram nenhum efeito da Cloridrato de Ivabradina (substância ativa) sobre a fertilidade de ratos de ambos os sexos. Quando as fêmeas grávidas foram tratadas durante a organogênese com exposições próximas às doses terapêuticas, observou-se uma maior incidência de fetos com defeitos cardíacos no rato e um pequeno número de fetos com ectrodactilia no coelho.
Nos cães tratados pela Cloridrato de Ivabradina (substância ativa) (doses de 2, 7 ou 24 mg/kg/dia) por um ano, alterações reversíveis da função retiniana foram observadas, mas não foram associadas a qualquer dano nas estruturas oculares. Estes dados são consistentes com o efeito farmacológico da Cloridrato de Ivabradina (substância ativa) relacionado com sua interação com a corrente Ih ativada por hiperpolarização na retina, que partilha extensa homologia com a corrente marca-passo cardíaca If. Outros estudos de longo prazo com doses repetidas e de carcinogecidade revelaram nenhuma alteração clinicamente relevante.
Características farmacológicas
Mecanismo de ação
A Cloridrato de Ivabradina (substância ativa) é um puro agente redutor da frequência cardíaca, agindo através da inibição seletiva e específica da corrente marca-passo If que controla a despolarização diastólica espontânea no nódulo sinusal e regula a frequência cardíaca. Os efeitos cardíacos são específicos do nódulo sinusal sem efeito nos tempos de condução intra-atrial, atrioventricular ou intraventricular, nem sobre a contratilidade miocárdica ou sobre a repolarização ventricular.
A Cloridrato de Ivabradina (substância ativa) pode também interagir com a corrente retiniana Ih que se assemelha à corrente cardíaca If. Ela participa na resolução temporal do sistema visual, reduzindo a resposta da retina a estímulos de luz brilhante. Em circunstâncias desencadeantes (por exemplo, alterações repentinas da luminosidade), a inibição parcial da corrente Ih pela Cloridrato de Ivabradina (substância ativa) justifica os fenômenos luminosos que podem ser ocasionalmente apresentados pelos pacientes. Os fenômenos luminosos (fosfenos) são descritos como um aumento transitório da luminosidade numa área limitada do campo visual.
Efeitos farmacodinâmicos
A principal propriedade farmacodinâmica da Cloridrato de Ivabradina (substância ativa) no homem é uma redução dose-dependente específica na frequência cardíaca. A análise da redução da frequência cardíaca com doses até 20 mg duas vezes ao dia, indica uma tendência para um efeito platô que é consistente com um risco reduzido de bradicardia grave abaixo de 40 bpm.
Nas doses usualmente recomendadas, a redução da frequência cardíaca é de aproximadamente 10 bpm em repouso e durante o exercício. Isso leva a uma redução do trabalho cardíaco e do consumo de oxigênio pelo miocárdio. A Cloridrato de Ivabradina (substância ativa) não influencia a condução intracardíaca, a contratilidade (sem efeito inotrópico negativo) ou a repolarização ventricular nos estudos clínicos de eletrofisiologia, a Cloridrato de Ivabradina (substância ativa) não teve efeito nos tempos de condução atrioventricular ou intraventricular ou sobre os intervalos QT corrigidos. - em pacientes com disfunção ventricular esquerda (fração de ejeção ventricular esquerda - FEVE entre 30 e 45 %), a Cloridrato de Ivabradina (substância ativa) não apresentou qualquer influência deletéria sobre a FEVE.
Propriedades farmacocinéticas
Em condições fisiológicas, a Cloridrato de Ivabradina (substância ativa) é rapidamente liberada dos comprimidos e é altamente solúvel em água (>10 mg/ml). A Cloridrato de Ivabradina (substância ativa) é apresentada sob a forma do enantiômero S sem bioconversão demonstrada in vivo. O derivado N-demetilado da Cloridrato de Ivabradina (substância ativa) foi identificado como o principal metabólito ativo no homem.
Absorção e biodisponibilidade
A absorção da Cloridrato de Ivabradina (substância ativa) é rápida e quase completamente absorvida após administração oral, com um pico de concentração plasmática alcançado em cerca de 1 hora em jejum. A biodisponibilidade absoluta dos comprimidos revestidos é de cerca de 40%, devido ao efeito de primeira passagem no intestino e no fígado.
Os alimentos retardam a absorção em cerca de 1 hora e aumentam a exposição plasmática de 20 a 30 %. A ingestão dos comprimidos durante as refeições é recomendada a fim de diminuir a variabilidade intraindividual à exposição plasmática.
Distribuição
A ligação da Cloridrato de Ivabradina (substância ativa) às proteínas plasmáticas é de cerca de 70 % e o volume de distribuição no estado de equilíbrio é próximo de 100 L nos pacientes. A concentração plasmática máxima após administração crônicada dose recomendada de 5 mg duas vezes ao dia é de 22 ng/ml (CV = 29 %). No estado de equilíbrio, a concentração plasmática média é de 10 ng/ml (CV = 38 %).
Biotransformação
A Cloridrato de Ivabradina (substância ativa) é extensamente metabolizada pelo intestino e pelo fígado, através de um processo oxidativo que envolve exclusivamente o citocromo P 450 3A4 (CYP3A4). O principal metabólito ativo é o derivado Ndemetilado (S18982), com uma exposição de cerca de 40 % do composto original. O metabolismo desse metabólito ativo também envolve o CYP3A4. A Cloridrato de Ivabradina (substância ativa) tem baixa afinidade pelo CYP3A4, não mostra indução ou inibição clinicamente relevante do CYP3A4 e, portanto não é provável que modifique o metabolismo ou as concentrações plasmáticas dos substratos do CYP3A4. Inversamente, potentes inibidores e indutores podem afetar substancialmente as concentrações plasmáticas de Cloridrato de Ivabradina (substância ativa).
Eliminação
A Cloridrato de Ivabradina (substância ativa) é eliminada com uma meia-vida plasmática principal de 2 horas (70-75 % da ASC) e uma meiavida efetiva de 11 horas. O clearance total é de cerca de 400 ml/min e o clearance renal é de cerca de 70 ml/min. A excreção dos metabólitos ocorre a uma extensão semelhante, através das fezes e urina. Cerca de 4 % da dose oral é excretada sob a forma inalterada na urina.
Linearidade / Não Linearidade
A cinética da Cloridrato de Ivabradina (substância ativa) é linear para as doses orais compreendidas entre 0,5 e 24 mg.
Farmacocinética em populações especiais
Idosos
Nenhuma diferença farmacocinética (ASC e Cmáx) foi observada entre os pacientes idosos (? 65 anos) ou muito idosos (? 75 anos) e a população em geral.
Pacientes com disfunção renal
O impacto da insuficiência renal (clearance da creatinina de 15 a 60 ml/min) sobre a farmacocinética da Cloridrato de Ivabradina (substância ativa) é mínimo, em relação com a reduzida contribuição do clearance renal (cerca de 20 %) na eliminação total da Cloridrato de Ivabradina (substância ativa) e de seu principal metabólito S18982.
Pacientes com disfunção hepática
Nos pacientes com disfunção hepática leve (escore de Child-Pugh até 7), a ASC não ligada da Cloridrato de Ivabradina (substância ativa) e do principal metabólito ativo foram cerca de 20% superiores aos de indivíduos com função hepática normal. Os dados são insuficientes para tirar conclusões em pacientes com disfunção hepática moderada. Não existem dados disponíveis em pacientes com disfunção hepática grave.
Relação farmacocinética/farmacodinâmica (FC/FD)
A análise da relação FC/FD mostrou que a frequência cardíaca diminui quase linearmente com o aumento das concentrações plasmáticas da Cloridrato de Ivabradina (substância ativa) e do S18982 para doses até 15 a 20 mg duas vezes ao dia. Em doses mais elevadas, a diminuição da frequência cardíaca deixa de ser proporcional às concentrações plasmáticas da Cloridrato de Ivabradina (substância ativa) e tende a atingir um platô. Exposições elevadas à Cloridrato de Ivabradina (substância ativa) que podem ocorrer quando a Cloridrato de Ivabradina (substância ativa) é administrada em associação com inibidores potentes da CYP3A4 podem resultar em uma diminuição excessiva da frequência cardíaca, embora este risco seja reduzido com inibidores moderados do CYP3A4.
Cuidados de Armazenamento
Procoralan deve ser guardado na sua embalagem original, em temperatura ambiente (entre 15 e 30ºC), protegido da luz e umidade. Nestas condições, este medicamento possui prazo de validade de 36 (trinta e seis) meses, a partir da data de fabricação.
Número do lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
5mg
Procoralan 5mg apresenta-se sob a forma de comprimidos revestidos de coloração salmão, com formato oblongo, apresentando uma barra de divisão e gravados com « 5 » sobre uma face e sobre a outra.
7,5mg
Procoralan 7,5mg é apresenta-se sob a forma de comprimidos revestidos de coloração salmão, com formato triangular e gravados com « 7,5 » sobre uma face e sobre a outra.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS N° 1.1278.0071
Farm. Responsável:
Patrícia Kasesky de Avellar - CRF-RJ nº. 6350
Fabricado por:
Les Laboratoires Servier Industrie.
Route de Saran nº 905, 45520 Gidy - França.
Importado por:
Laboratórios Servier do Brasil Ltda.
Estrada dos Bandeirantes, no. 4211 - Jacarepaguá - 22775-113
Rio de Janeiro - RJ - Indústria Brasileira.
C.N.P.J. 42.374.207 / 0001 - 76
Serviço de Atendimento ao Consumidor:
0800 – 7033431
Venda sob prescrição médica.