para o que é indicado e para que serve?
Ritalina LA é utilizada para o tratamento do Transtorno de deficit de atenção/hiperatividade.Continue lendo...
ofertas de
Ritalina La 10Mg C 30 Com...
ofertas de Ritalina La 10Mg C 30 Com...
R$ 119,99
R$ 129,41
R$ 130,79
R$ 135,12
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Ritalina LA é utilizada para o tratamento do Transtorno de deficit de atenção/hiperatividade.
O Transtorno de deficit de atenção/hiperatividade (TDAH) ou Transtorno hipercinético é um distúrbio de comportamento em crianças, adolescentes e adultos. Cerca de 3% das crianças sofrem deste transtorno, o que as torna incapazes de ficarem paradas e/ou se concentrar em tarefas por um determinado período de tempo. As crianças com esse transtorno podem ter dificuldades para aprender e fazer tarefas escolares.
Elas podem frequentemente se tornar difícil de lidar, tanto na escola quanto em casa.
Adultos com TDAH frequentemente têm dificuldade de se concentrar.
Costumam se sentir inquietos, impacientes, desatentos e ficam entediados com facilidade. Podem ter dificuldades em organizar sua vida pessoal e trabalho.
Se o paciente é uma criança ou se você for um adolescente, o médico prescreveu Ritalina LA como parte de um programa de tratamento de TDAH, o qual incluirá também usualmente terapia psicológica, educacional e social.
Se você tem alguma dúvida sobre como funciona a Ritalina LA ou porque este medicamento foi receitado para você, pergunte ao seu médico.
Como Ritalina LA funciona?
Ritalina LA tem como substância ativa o cloridrato de metilfenidato. Este medicamento é um estimulante do sistema nervoso central.
A Ritalina LA age melhorando as atividades de certas partes do cérebro que são pouco ativas. A Ritalina LA melhora a atenção e a concentração, além de reduzir comportamento impulsivo.
Uma cápsula de Ritalina LA fornece uma liberação inicial da substância ativa e uma segunda liberação aproximadamente 4 horas depois.
Contraindicação
Não tome Ritalina LA se você:
- É alérgico (hipersensível) ao metilfenidato ou a qualquer outro componente de Ritalina LA listado no início desta bula. Se você achar que pode ser alérgico, peça orientação ao seu médico;
- Sofre de ansiedade, tensão ou agitação;
- - Tem algum problema da tireoide;
- - Tem problemas cardíacos, como ataque cardíaco, batimento cardíaco irregular, dor no peito (angina), insuficiência cardíaca, doença cardíaca ou se nasceu com problema do coração;
- Tem pressão sanguínea muito alta (hipertensão) ou estreitamento dos vasos sanguíneos (doença arterial oclusiva que pode causar dor nos braços e pernas);
- Estiver tomando um medicamento chamado “inibidor da monoamino oxidase” (IMAO), utilizado no tratamento da depressão ou tiver tomado IMAO nas últimas duas semanas;
- Tem pressão ocular aumentada (glaucoma);
- Tem um tumor da glândula adrenal chamado feocromocitoma;
- - Tem fala e movimentos corpóreos incontroláveis (síndrome de Tourette) ou se qualquer outro membro da família for portador desta síndrome.
Se você acha que algum dos casos acima aplica-se a você, informe ao seu médico sem tomar Ritalina LA.
Como usar
O médico irá decidir a dose mais adequada de acordo com a necessidade individual do paciente e da resposta.
Siga cuidadosamente as instruções do seu médico. Não exceda a dose recomendada.
Quando e como tomar Ritalina LA
Tome Ritalina LA uma vez ao dia pela manhã, com ou sem alimento. Engula as cápsulas inteiras com água. Não triture, mastigue ou divida.
Se você é incapaz de engolir a cápsula Ritalina LA, você pode espalhar o conteúdo em uma pequena quantidade de alimento, da seguinte forma:
- Abra cuidadosamente a cápsula e espalhe as partes sobre uma pequena quantidade de alimentos leves (por exemplo, suco de maçã).
- A comida não deve ser quente, porque isso poderia afetar as propriedades especiais do conteúdo.
- Coma imediatamente toda a mistura de medicamento/alimento.
- Não guarde a mistura de medicamento/alimento para uso futuro.
Uma cápsula de Ritalina LA fornece uma liberação inicial da substância ativa e uma segunda liberação em aproximadamente 4 horas após. É por isso que a Ritalina LA pode ser tomado pela manhã, em casa, sem a necessidade de outra dose ao meio-dia.
As cápsulas de Ritalina LA tomadas uma vez por dia são comparáveis aos comprimidos de Ritalina tomados duas vezes ao dia. O médico irá aconselhá-lo a tomar a cápsula de Ritalina LA especialmente se você tomava anteriormente o comprimido de Ritalina.
Em alguns pacientes a Ritalina LA pode causar insônia. Para evitar dificuldade em adormecer, a última dose de Ritalina LA deve ser tomada antes das 18 horas, a menos que o seu médico tenha recomendado diferente.
Quanto tomar
Não altere a dose sem falar com o seu médico.
Se você tem a impressão de que o efeito da Ritalina LA é muito forte ou muito fraco, fale com o seu médico.
Crianças
O médico irá dizer-lhe quantas cápsulas de Ritalina LA dar para a criança. O médico irá iniciar o tratamento com uma dose baixa e aumentá-la gradualmente, conforme necessário.
A dose diária máxima recomendada é de 60 mg.
Adultos
A dose usual é de 20 a 30 mg, mas alguns pacientes precisam de uma dose maior.
A dose diária máxima recomendada é de 80 mg para o tratamento de TDAH.
Por quanto tempo tomar
Utilize este medicamento exatamente como indicado pelo seu médico.
Não o use mais, com mais frequência e por mais tempo do que o recomendado pelo seu médico. Se usado de forma inadequada, este medicamento pode causar dependência.
O tratamento para TDAH varia na duração de paciente para paciente. Ele pode ser interrompido durante ou depois da puberdade.
O médico pode descontinuar a Ritalina LA periodicamente para ver se ela ainda é necessária.
Para abrir o frasco, siga as seguintes instruções:
- Pressione a tampa para baixo, apoiando o frasco em uma base (ex.: mesa, pia, etc);
- Mantendo a tampa pressionada, gire-a no sentido indicado. Se ouvir um estalo é sinal que a tampa não está devidamente pressionada;
- Após o uso, feche bem o frasco.
Se você parar de tomar a Ritalina LA
Não pare de tomar Ritalina sem falar com o seu médico. Pode ser necessário reduzir a dose diária gradativamente antes de parar completamente. Você vai precisar de supervisão médica após interromper o tratamento.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar este medicamento?
Se uma dose de Ritalina LA for esquecida, você deve tomá-la assim que possível.
As doses remanescentes deste dia devem ser tomadas nos intervalos espaçados regularmente. Não tome doses dobradas de Ritalina LA para compensar a dose esquecida. Caso você tenha dúvidas em relação a isso, converse com o médico.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
A Ritalina LA só poderá ser prescrita por um médico.
Siga todas as instruções do seu médico cuidadosamente, mesmo que sejam diferentes da informação geral contida nesta bula.
Ritalina LA deve ser utilizada com cuidado se você:
- Tem histórico de abuso de álcool ou droga;
- Tem desmaios (epilepsia, convulsões, crises epilépticas);
- Tem pressão sanguínea alta (hipertensão);
- Tem qualquer anormalidade cardíaca (por exemplo, anormalidade cardíaca estrutural);
- Tem qualquer outro problema cardíaco corrente ou passado;
- Tenha ou teve qualquer distúrbio nos vasos sanguíneos cerebrais, por exemplo enfraquecimento da parede dos vasos sanguíneos (aneurisma), acidente vascular cerebral, inflamação dos vasos sanguíneos (vasculites);
- Tem distúrbios mentais agudos que causam pensamentos e percepções anormais (psicose), ou excitação anormal, atividade aumentada e desinibida (mania aguda) – seu médico dirá se você apresenta estas doenças;
- Tem sintomas psicóticos como ver ou sentir coisas que não estão presentes (alucinações);
- Tem comportamento agressivo;
- Tem pensamentos ou comportamentos suicidas;
- Tem tiques motores ou se qualquer outro membro da família tenha tiques. Os sinais de tiques são difíceis de controlar, ocorre repetida contração em todas as partes do corpo ou repetição de sons e palavras.
Caso qualquer uma destas condições se aplicar a você, informe ao seu médico. O médico decidirá se você pode começar ou continuar a tomar Ritalina LA.
Algumas crianças tomando Ritalina LA por um período longo podem ter um crescimento mais lento que o normal, mas elas geralmente o recuperam quando o tratamento é interrompido.
Não há evidências que pacientes com TDAH fiquem viciados em Ritalina LA, ou que eles tendam a abusar de drogas durante a vida. A Ritalina LA, como todos os medicamentos que contêm estimulantes do sistema nervoso central, será prescrita a você apenas sob supervisão médica próxima e após diagnóstico adequado.
Monitoramento durante o tratamento com Ritalina LA
Para verificar se o uso de Ritalina LA está associado a qualquer efeito indesejado, o médico irá verificar periodicamente as condições de saúde do paciente (por exemplo, pressão sanguínea, frequência cardíaca) e também vai acompanhar o crescimento de crianças que tomam a Ritalina LA. Os testes de sangue serão realizados para monitorar a quantidade de células sanguíneas (glóbulos brancos, glóbulos vermelhos e plaquetas) caso o paciente tome a Ritalina LA por um longo período.
Se você for ser submetido a uma cirurgia
Se você for submetido a uma operação, informe ao médico que você está em tratamento com Ritalina LA. Você não deve tomar Ritalina LA no dia de sua operação, se um determinado tipo de anestésico for usado. Isso ocorre porque há possibilidade de aumento súbito da pressão arterial durante a operação.
Teste para drogas
A Ritalina LA pode dar resultado falso positivo em testes para o uso de drogas. Isto inclui testes utilizados no esporte.
Reações Adversas
Assim como outros medicamentos, a Ritalina LA pode causar alguns efeitos indesejáveis, embora nem todas as pessoas os apresentem. Estes efeitos são, normalmente, leves a moderados e, geralmente, transitórios.
Algumas reações adversas podem ser sérias:
Informe seu medico imediatamente se você apresentar:
- Inchaço dos lábios ou língua, ou dificuldade de respirar (sinais de reação alérgica grave);
- Febre alta repentina, pressão arterial muito elevada e convulsões graves (Síndrome Neuroléptica Maligna);
- Dor de cabeça grave ou confusão, fraqueza ou paralisia dos membros ou face, dificuldade de falar (sinais de distúrbio dos vasos sanguíneos cerebrais);
- Batimento cardíaco acelerado, dor no peito, movimentos bruscos e incontroláveis (sinal de discinesia);
- Equimose (sinal de púrpura trombocitopênica);
- Espasmos musculares ou tiques;
- Garganta inflamada e febre ou resfriado (sinais de baixa contagem de células brancas do sangue);
- Movimentos contorcidos incontroláveis do membro, face e/ou tronco (movimentos coreatetoides);
- Ver ou sentir coisas que não existem na realidade (alucinações);
- Desmaios (convulsões, epilepsia ou crises epilépticas);
- Bolhas na pele ou coceiras (sinal de dermatite esfoliativa);
- Manchas vermelhas sobre a pele (sinal de eritema multiforme).
Algumas reações adversas são muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
- Dor de garganta e coriza;
- Diminuição do apetite;
- Nervosismo;
- Dificuldade em adormecer;
- Náusea, boca seca.
Algumas reações adversas são comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Angústia emocional excessiva , inquietação, distúrbios do sono, excitação emocional, agitação;
- Dor de cabeça, tonturas, sonolência;
- Movimentos involuntários do corpo (sinais de tremor);
- Alterações na pressão arterial (geralmente aumento), ritmo cardíaco anormal, palpitações;
- Tosse;
- Vômitos, dor de estômago, indisposição estomacal; indigestão; dor de dente;
- Alteração cutânea, alteração cutânea associada a coceira (urticária), febre, perda de cabelo;
- Transpiração excessiva;
- Dor nas articulações;
- Diminuição do peso;
- Sentir-se nervoso.
Algumas reações adversas são raras (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Desaceleração do crescimento (peso e altura) durante o uso prolongado em crianças;
- Visão turva.
Algumas reações adversas são muito raras (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento):
- Baixa contagem de glóbulos vermelhos (anemia), baixa contagem de plaquetas (trombocitopenia);
- Atividade anormal, humor deprimido;
- Fala e movimentos corporais descontrolados (síndrome de Tourette);
- Função hepática anormal, incluindo coma hepático;
- Câimbras musculares.
Outras reações adversas que ocorreram com outros medicamentos contendo a mesma substância ativa de Ritalina LA:
- Distúrbios do sangue: diminuição do número de células do sangue (glóbulos vermelhos, glóbulos brancos e plaquetas);
- Distúrbios do sistema imunológico: inchaço das orelhas (um sintoma de reação alérgica);
- Distúrbios psiquiátricos: irritação, agressividade, alterações de humor, comportamento e pensamentos anormais, raiva, pensamentos ou tentativas de suicídio (incluindo suicídio), atenção excessiva ao ambiente, sentimento excepcionalmente animado, atividade aumentada e desinibida (mania), sentimento desorientado, alterações no desejo sexual, falta de sentimento ou emoção, fazer as coisas repetidamente, obsessão por alguma coisa, confusão, vício;
- Distúrbios do sistema nervoso: fraqueza muscular temporária, perda da sensibilidade da pele ou outras funções do corpo devido a uma falta temporária de suprimento sanguíneo no cérebro (deficit neurológico isquêmico reversível), enxaqueca;
- Distúrbios oculares: visão dupla, pupilas dilatadas, dificuldade para enxergar;
- Distúrbios cardíacos: parada de batimento cardíaco, ataque cardíaco;
- Distúrbios vasculares: dormência dos dedos, formigamento e mudança de cor (do branco ao azul, depois vermelho) no frio (“fenômeno de Raynaud”);
- Distúrbios respiratórios: garganta inflamada, falta de ar;
- Distúrbios gastrintestinais: diarreia, constipação;
- Distúrbios da pele: inchaço da face e da garganta, vermelhidão da pele, grandes manchas vermelhas na pele que aparecem algumas horas após tomar o medicamento;
- Distúrbios musculoesqueléticos: dores musculares, espasmos musculares;
- Distúrbios renais e urinários: sangue na urina;
- Distúrbios do sistema reprodutor e da mama: inchaço das mamas em homens;
- Distúrbios gerais: dor no peito, cansaço, morte súbita;
- Laboratorial: sons anormais do coração.
Se um desses efeitos ocorrerem, o médico deve ser avisado.
Se você perceber alguma outra reação adversa não mencionada nesta bula, por favor informe ao seu médico ou farmacêutico.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também a empresa através do seu serviço de atendimento.
População Especial
Crianças e adolescentes
Ritalina LA não é recomendada para crianças com menos de 6 anos de idade.
Dirigir e operar máquinas
Ritalina LA pode causar tonturas, sonolência, visão embaçada, alucinações ou outras reações adversas do sistema nervoso central, que podem afetar a concentração. Se você sentir estes sintomas, não deve dirigir veículos ou operar máquinas, ou envolver-se em qualquer outra atividade em que precisa estar atento.
Gravidez
Informe ao seu médico se você está grávida ou achar que pode estar grávida.
A Ritalina LA não deve ser usada durante a gravidez, a não ser que seja especificamente prescrita pelo seu médico.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Amamentação
Informe ao seu médico se você esta amamentando. Não amamente durante o tratamento com Ritalina LA. A substância ativa da Ritalina LA pode passar para o leite humano.
Composição
Cada cápsula de Ritalina LA contém 10, 20, 30 ou 40 mg de cloridrato de metilfenidato.
Excipientes:
- Cápsula de 10 mg: esferas de sacarose, copolímero de metacrilato de amônio, copolímero de ácido metacrílico, talco, citrato de trietila, macrogol, gelatina, dióxido de titânio, óxido férrico preto, óxido férrico vermelho, óxido férrico amarelo.
- Cápsula de 20 mg: esferas de sacarose, copolímero de metacrilato de amônio, copolímero de ácido metacrílico, talco, citrato de trietila, macrogol, gelatina e dióxido de titânio.
- Cápsula de 30 mg: esferas de sacarose, copolímero de metacrilato de amônio, copolímero de ácido metacrílico, talco, citrato de trietila, macrogol, gelatina, dióxido de titânio e óxido férrico amarelo.
- Cápsula de 40 mg: esferas de sacarose, copolímero de metacrilato de amônio, copolímero de ácido metacrílico, talco, citrato de trietila, macrogol, gelatina, dióxido de titânio, óxido férrico amarelo, óxido férrico preto e óxido férrico vermelho.
Superdosagem
Se muitas cápsulas de Ritalina LA forem acidentalmente tomados, vá imediatamente ao médico ou à emergência do hospital mais próximo. Informe ao médico em que momento foram tomadas as cápsulas. Você pode necessitar de assistência médica.
Os sintomas de superdose são vômitos, agitação, dor de cabeça, tremores, espasmos musculares, batimento cardíaco irregular, rubor, febre, sudorese, dilatação das pupilas, dificuldade em respirar, confusão e convulsões.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações farmacodinâmicas
Medicamentos anti-hipertensivos
A Cloridrato De Metilfenidato pode diminuir a efetividade do medicamento utilizado para o tratamento da hipertensão.
Uso com medicamentos que elevam a pressão sanguínea
A Cloridrato De Metilfenidato deve ser utilizada com cautela em pacientes tratados com medicamentos que aumentam a pressão sanguínea.
Devido à possibilidade de crises hipertensivas, a Cloridrato De Metilfenidato é contraindicada em pacientes tratados (atualmente ou que já fazem uso há 2 semanas) com inibidores da MAO.
Uso com anestésicos
Há o risco de aumento repentino na pressão sanguínea e frequência cardíaca durante cirurgias. Se uma cirurgia está planejada, Cloridrato De Metilfenidato não deve ser tomada no dia da cirurgia.
Uso com agonistas alfa-2 de ação central (ex.: clonidina)
Eventos adversos sérios incluindo morte súbita foram relatados no uso concomitante com clonidina, apesar de não haver relações causais estabelecidas com a combinação.
Uso com medicamentos dopaminérgicos
Como um inibidor da recaptação da dopamina, a Cloridrato De Metilfenidato pode estar associada com interações farmacodinâmicas quando coadministrada com agonistas dopaminérgicos diretos e indiretos (incluindo DOPA e antidepressivos tricíclicos) assim como os antagonistas dopaminérgicos (antipsicóticos, por ex.: haloperidol). A coadministração de Cloridrato De Metilfenidato com antipsicóticos não é recomendada devido ao mecanismo de ação contrário.
Uso de fármacos serotoninérgicos
O uso concomitante de metilfenidato e fármacos serotoninérgicos não é recomendado, uma vez que pode levar ao desenvolvimento da síndrome serotoninérgica (vide “Advertências e Precauções”). Foi demonstrado que metilfenidato aumenta a serotonina e norepinefrina extracelular e aparenta ter um fraco potencial de ligação em transportadores de serotonina.
Interações farmacocinéticas
O Cloridrato De Metilfenidato não é metabolizada pelo citocromo P450 em extensão clinicamente relevante. Não se espera que indutores ou inibidores do citocromo P450 tenham qualquer impacto importante na farmacocinética da Cloridrato De Metilfenidato. Inversamente, o d- e l-enantiômeros do metilfenidato não inibem de forma relevante o citocromo P450 1A2, 2C8, 2C9, 2C19, 2D6, 2E1 ou 3A.
A coadministração de Cloridrato De Metilfenidato não aumenta a concentração plasmática do substrato da desipramina CYP2D6.
Estudos de caso sugerem um potencial de interação de Cloridrato De Metilfenidato com anticoagulantes cumarínicos, alguns anticonvulsivantes (ex.: fenobarbital, fenitoína, primidona), fenilbutazona e antidepressivos tricíclicos, mas as interações farmacocinéticas não foram confirmadas quando maiores quantidades de amostras foram analisadas. Pode ser necessária a redução da dose desses medicamentos.
Uma interação com o anticoagulante etilbiscoumacetato em 4 pacientes não foi confirmada em um estudo subsequente com uma amostra maior (n=12).
Não foram realizados outros estudos de interações específicas medicamento-medicamento com Cloridrato De Metilfenidato in vivo.
Testes laboratoriais/fármacos
O metilfenidato pode induzir a resultados falso-positivos de testes laboratoriais para anfetaminas, particularmente com testes de imunoensaio por triagem.
Interação Alimentícia
Uso com álcool
O álcool pode exacerbar os efeitos adversos de fármacos psicoativos no SNC, inclusive de Cloridrato De Metilfenidato. É, portanto, recomendável que os pacientes abstenham-se de álcool durante o tratamento.
Ação da Substância
Resultados da eficácia
Cloridrato De Metilfenidato tem sido usada há mais de 50 anos no tratamento de TDAH. A sua eficácia no tratamento do TDAH está bem estabelecida. Além de melhorar os sintomas principais do TDAH, o metilfenidato também melhora os comportamentos associados com TDAH, tais como desempenho escolar prejudicado e função social.
Estudos publicados mostram que a Cloridrato De Metilfenidato melhora significativamente a sonolência diurna e cataplexia.
Crianças com TDAH
Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) foi avaliada em um estudo clínico randomizado, duplo-cego, controlado por placebo, grupo paralelo no qual 134 crianças, com idades entre 6 a 12 anos, com diagnóstico DSM-IV de Transtorno de Deficit de Atenção/Hiperatividade (TDAH) receberam uma dose única de manhã de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) no intervalo de 10 a 40 mg/dia, ou placebo, por até 2 semanas. As doses ideais estabelecidas para cada paciente foram determinadas em fase de titulação anterior à randomização.
A variável primária de eficácia foi a mudança da linha de base para a classificação final na escala para professores TDAH/DSM-IV (CADS-T).
O CADS-T avalia sintomas de hiperatividade e desatenção. A análise da variável de eficácia primária mostrou uma diferença de tratamento significativa em favor do tratamento da Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) (p<0,0001). Um efeito estatisticamente significativo no tratamento para a Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) em relação ao placebo também foi encontrado em todas as análises dos CADS das variáveis de eficácia secundária, bem como em duas análises post-hoc para os subtipos de diagnóstico de TDAH (tipo combinado, tipo desatento). Os resultados das análises de eficácia primária e secundária encontram-se resumidos na Tabela a seguir.
Tabela 1: Escala para professores e pais TDAH/DSM-IV, alteração da linha de base (população ITT, análises LOCF)
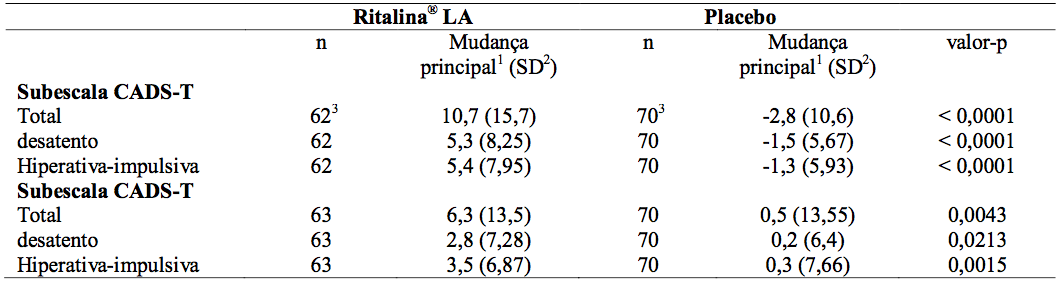 1 Pontuação no final do período placebo-washout menos pontuação final.
1 Pontuação no final do período placebo-washout menos pontuação final.
2 Desvio padrão.
3 Ddois pacientes (um em cada grupo de tratamento) não tiveram valores basais CADS-T, mas tiveram valores após a randomização. Eles não foram, portanto, incluídos nas descrições estatísticas.
Adultos com TDAH
Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) foi avaliada em um estudo (RIT124D2302) randomizado, duplo-cego, placebo-controlado, multicêntrico, no tratamento de 725 pacientes adultos (395 homens e 330 mulheres) com diagnóstico de TDAH de acordo com critérios de TDAH do DSM-IV. O estudo foi projetado para [13-14]:
- Confirmar o intervalo clinicamente eficaz e seguro de dose de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) para adultos (18 a 60 anos de idade) em um período de grupos paralelos de 9 semanas, duplo-cego, randomizado, controlado por placebo, (Período 1), constituído por uma fase de titulação de 3 semanas seguida por uma fase de dose fixa de 6 semanas (40, 60, 80 mg/dia ou placebo). Subsequentemente, os pacientes foram reajustados para sua dose ótima de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) (40, 60 ou 80 mg / dia) durante um período de 5 semanas (Período 2).
- Avaliar a manutenção do efeito de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) em adultos com TDAH em um estudo de retirada de 6 meses, duplo-cego, randomizado (Período 3).
A eficácia foi avaliada usando a escala de avaliação DSM-IV de TDAH (DSM-IV TDAH RS) para o controle sintomático e Escala de Deficiência de Sheehan (SDS) para melhoria funcional como a mudança nas pontuações totais do início até o final do primeiro período, respectivamente. Todas as doses de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) mostraram significativamente maior controle dos sintomas (p<0,0001 para todas as doses) em relação ao placebo, medido por uma redução na pontuação total no DSM-IV TDAH RS. Todas as doses de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) mostraram significativa melhoria funcional (p = 0,0003 a 40 mg, p = 0,0176 a 60 mg, p<0,0001 a 80 mg), em comparação com placebo, conforme medido pela redução na pontuação total SDS (vide tabelas abaixo).
Foi demonstrada eficácia clínica significativa em todas as doses Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) utilizando escalas médicas de classificação [Clinical Impression-Improvement (CGI-I) e Clinical Global Improvement-Severity (CGI-S) (CGI-S)], escalas de autoavaliação [Adult Self-Rating Scale (ASRS)] e escalas de classificação de observação [Conners 'Adult ADHD Rating Scale Observer Short version (CAARS O: S)]. Os resultados foram consistentemente a favor da Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) em relação ao placebo em todas as avaliações no Período 1.
Tabela 2: Análise de melhoria a partir do basal 1 até o fim do Período 1 na pontuação total DSM IV ADHD RS e pontuação total por tratamento / (LOCF *) SDS para o Período 1
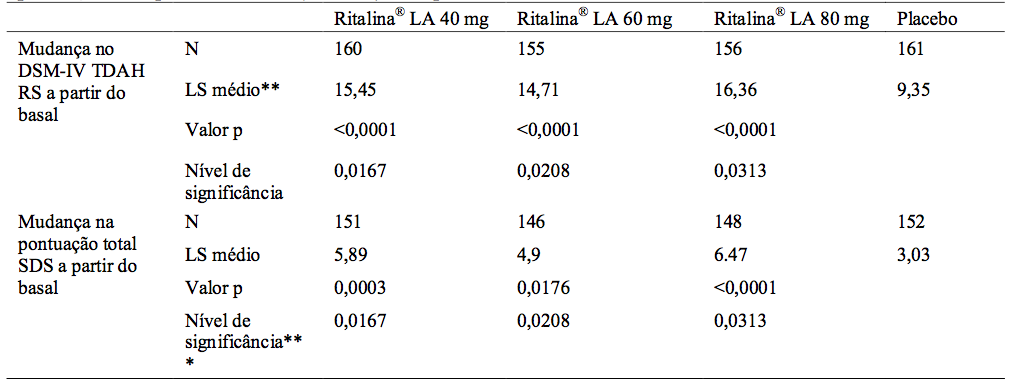 * LOCF - última observação realizada na visita final para cada paciente com dados do estudo de 6 semanas de dose fixa do Período 1,
* LOCF - última observação realizada na visita final para cada paciente com dados do estudo de 6 semanas de dose fixa do Período 1,
** LS médio - Mínimos Quadrados de alterações médias no modelo de Análise de Covariância (ANCOVA) com o grupo de tratamento e centro como fatores e início pontuação total DSM-IV ADHD RS e pontuação total SDS como covariável,
*** nível de significância = o nível final de dois lados de significância (alfa) para o teste seguindo o procedimento gatekeeping estendido
A manutenção de efeito da Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) foi avaliada pela medição da porcentagem de falha do tratamento com Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) em comparação com o grupo do placebo ao fim de um período de manutenção de 6 meses (vide Tabela abaixo). Uma vez que a dose de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) foi otimizada no Período 2, cerca de 79% dos pacientes continuaram a manter o controle da doença por um período de pelo menos 6 meses (p<0,0001 vs placebo). Uma razão de probabilidade de 0,3 sugere que pacientes tratados com placebo tiveram uma chance três vezes maior de apresentar uma falha no tratamento em comparação com Cloridrato De Metilfenidato LA (cápsulas de liberação modificada).
Tabela 3: Porcentagem de falhas do tratamento durante o Período 3
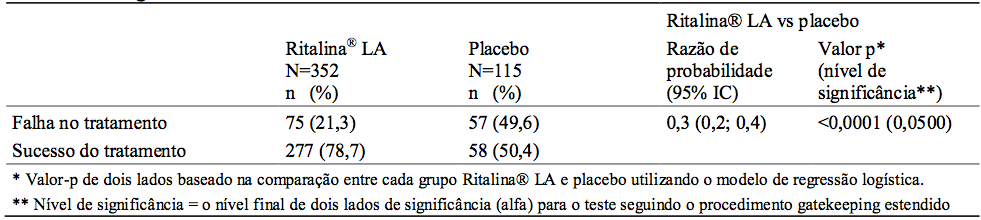 * Valor-p de dois lados baseado na comparação entre cada grupo Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) e placebo utilizando o modelo de regressão logística.
* Valor-p de dois lados baseado na comparação entre cada grupo Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) e placebo utilizando o modelo de regressão logística.
** Nível de significância = o nível final de dois lados de significância (alfa) para o teste seguindo o procedimento gatekeeping estendido
Pacientes que entraram no Período 3 completaram um total de 5 a 14 semanas de tratamento com Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) nos Períodos 1 e 2. Os pacientes do grupo placebo no Período 3 não apresentaram aumento nos sinais de abstinência e rebote em comparação com pacientes que continuaram o tratamento com Cloridrato De Metilfenidato LA (cápsulas de liberação modificada).
O estudo realizado em adultos não sugere diferença na eficácia ou segurança entre os subgrupos de gênero.
A eficácia e segurança de Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) a longo prazo em pacientes adultos foi avaliada em um estudo de extensão aberto, de 26 semanas, com Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) em 298 pacientes adultos com TDAH (RIT124D2302E1). Somando todos os pacientes em ambos os estudos, um total de 354 pacientes receberam Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) continuamente por mais de 6 meses e 136 pacientes, por mais de 12 meses.
O perfil de segurança da Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) não se alterou com a maior duração do tratamento em pacientes adultos com TDAH. O perfil de segurança observado no estudo RIT124D2302E1 foi similar ao observado no estudo RIT124D2302. Nenhuma reação adversa séria inesperada ou reações adversas foram observadas nesta extensão do estudo, e as reações adversas comumente observadas eram esperadas e impulsionadas pela atividade farmacológica.
Além disso, o tratamento com Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) consistentemente demonstrou eficácia clínica durante o estudo, quando utilizado escalas de autoavaliação e escalas de avaliação pelo médico (ou seja, DSM-IV TDAH RS, CGI-I e CGI-S). Os resultados foram consistentemente em favor do tratamento com Cloridrato De Metilfenidato LA (cápsulas de liberação modificada) em todas as avaliações. Os pacientes continuaram a apresentar melhora sintomática e redução no prejuízo funcional ao longo do estudo, demonstradas pela alteração média na pontuação total DSM-IV TDAH de -7,2 pontos e a variação média na pontuação total SDS, de -4,8 pontos, quando avaliado em relação à extensão do basal.
Características Farmacológicas
Grupo farmacoterapêutico: psicoestimulante.
Código ATC: NO6B AO4.
Mecanismo de ação/ farmacodinâmica
A Cloridrato De Metilfenidato é um composto racêmico que consiste de uma mistura 1:1 de d-metilfenidato e l-metilfenidato.
A Cloridrato De Metilfenidato é um fraco estimulante do sistema nervoso central, com efeitos mais evidentes sobre as atividades mentais do que nas ações motoras. Seu mecanismo de ação no homem ainda não foi completamente elucidado, mas acredita-se que seu efeito estimulante seja devido a uma inibição da recaptação de dopamina no estriado, sem disparar a liberação de dopamina.
O mecanismo pelo qual a Cloridrato De Metilfenidato exerce seus efeitos psíquicos e comportamentais em crianças não está claramente estabelecido, nem há evidência conclusiva que demonstre como esses efeitos se relacionam com a condição do sistema nervoso central.
O l-enantiômero parece ser farmacologicamente inativo.
O efeito do tratamento com 40 mg de cloridrato de dexmetilfenidato, o d-enantiômero farmacologicamente ativo de Cloridrato De Metilfenidato, no intervalo QT/QTc foi avaliado em um estudo com 75 voluntários sadios. O prolongamento máximo significativo dos intervalos QTcF foi < 5 ms, e o limite superior no intervalo de confiança de 90% foi inferior a 10 ms para todas as comparações de tempo versus o placebo. Este é inferior ao limiar de preocupação clínica e nenhuma relação de resposta à exposição foi evidente.
Farmacocinética
Absorção
Distribuição
No sangue, o metilfenidato e seus metabólitos são distribuídos entre o plasma (57%) e os eritrócitos (43%). A ligação com as proteínas plasmáticas é baixa (10 a 33%). O volume de distribuição foi 2,65±1,11 L/kg para d-metilfenidato e 1,80±0,91 L/kg para l-metilfenidato.
A excreção de metilfenidato no leite materno foi observada em dois casos relatados onde a dose relativa infantil calculada foi ? 0,2% do peso ajustado à dose materna. Eventos adversos não foram observados em crianças (de 6 meses a 11 meses de idade).
Biotransformação/metabolismo
A biotransformação do metilfenidato pela carboxilesterase CES1A1 é rápida e extensiva. As concentrações plasmáticas máximas do principal metabólito diesterificado, o ácido alfa-fenil-2-piperidino acético (ácido ritalínico), são atingidas aproximadamente 2 horas após a administração e são 30 a 50 vezes mais altas do que as da substância inalterada. A meia-vida do ácido alfa-fenil-2-piperidino acético é cerca de duas vezes a do metilfenidato e seu clearance (depuração) sistêmico médio é de 0,17 L/h/kg. Apenas pequenas quantidades dos metabólitos hidroxilados (ex.: hidroximetilfenidato e ácido hidroxirritalínico) são detectáveis. A atividade terapêutica parece ser exercida principalmente pelo composto precursor.
Eliminação
O metilfenidato é eliminado do plasma com meia-vida média de 2 horas.
O clearance (depuração) sistêmico é 0,40±0,12 L/h/kg para d-metilfenidato e 0,73±0,28 L/h/kg para l-metilfenidato. Após a administração oral, 78 a 97% da dose administrada é excretada pela urina e 1 a 3% pelas fezes sob a forma de metabólitos, em 48 a 96 horas. Apenas pequenas quantidades (<1%) de metilfenidato inalterado aparecem na urina. A maior parte da dose é excretada na urina como ácido alfa-fenil-2-piperidino acético (60-86%).
Populações especiais
Efeito da idade:
Não há diferenças aparentes na farmacocinética do metilfenidato entre crianças hiperativas e voluntários adultos sadios.
Pacientes com insuficiência renal:
Dados de eliminação de pacientes com função renal normal sugerem que a excreção renal do metilfenidato inalterado dificilmente seria diminuída na presença de redução da função renal. Entretanto, a excreção renal do metabólito ácido alfa-fenil-2-piperidino acético pode ser reduzida.
Dados de segurança pré-clínicos
Toxicidade reprodutiva
O metilfenidato é considerado possivelmente teratogênico em coelhos.
Espinha bífida com má rotação nos membros posteriores foi observada em duas diferentes ninhadas em que foi administrada dose de 200 mg/kg/dia. A exposição (AUC) nesta dose foi aproximadamente 5,1 vezes maior do que a exposição extrapolada da dose máxima recomendada humana (MRHD). Em exposição a uma dose inferior seguinte, de 0,7 vezes a exposição extrapolada da MRHD, não foi encontrada espinha bífida. Um segundo estudo foi conduzido com uma dose alta de 300 mg/kg, o qual foi considerado maternalmente tóxico.
Nenhuma espinha bífida foi verificada em 12 ninhadas (92 fetos) sobreviventes. A exposição (AUC) a 300 mg/kg foi de 7,5 vezes a exposição extrapolada na MRHD.
O metilfenidato não é teratogênico em ratos. Toxicidade no desenvolvimento fetal foi observada em uma dose alta de 75 mg/kg (20,9 vezes maior que a exposição (AUC) na MRHD) e consistiu de um aumento em instância de fetos com ossificação retardada do crânio e do hioide tão bem quanto de fetos com a costela supernumerária curta.
O metilfenidato não alterou a fertilidade de camundongos machos ou fêmeas que foram alimentados com dietas contendo o medicamento em um estudo de 18 semanas contínuas de reprodução. O estudo foi conduzido em duas gerações de camundongos que receberam doses de até 160 mg/kg/dia de metilfenidato de forma contínua (cerca de 90 vezes maior do que a MRHD em mg/kg).
Quando o metilfenidato foi administrado em ratos durante a gravidez e lactação, em doses de até 45 mg/kg/dia (cerca de 26 vezes maior do que a MRHD em mg/kg), o ganho de peso corporal da prole foi diminuído com a dose mais elevada, mas não foram observados outros efeitos sobre o desenvolvimento pós-natal.
Carcinogenicidade
Em um estudo de carcinogenicidade ao longo da vida realizado em camundongos B6C3F1, o metilfenidato causou um aumento de adenomas hepatocelulares (tumor benigno) e, somente em machos, levou a um aumento de hepatoblastomas (tumor maligno) em doses diárias de aproximadamente 60 mg/kg/dia, cerca de 35 vezes maior do que a dose máxima recomendada a humanos (MRHD) em mg/kg.
Hepatoblastoma é um tipo de tumor maligno relativamente raro em roedor. Não houve um aumento generalizado no número de tumores hepáticos malignos. A cepa de camundongo utilizada é particularmente sensível ao desenvolvimento de tumores hepáticos. Pensa-se que os hepatoblastomas podem ser devido a mecanismos não genotóxicos, tais como aumento na proliferação de células hepáticas. Isto é consistente com o aumento do peso do fígado observado neste estudo de carcinogenicidade em ratos.
O metilfenidato não causou qualquer aumento de tumores durante o estudo F344 de carcinogenicidade realizado em ratos; a dose mais elevada utilizada foi de aproximadamente 45 mg/kg/dia (cerca de 26 vezes maior do que a MRHD em mg/kg).
Genotoxicidade
Em um estudo com metilfenidato in vitro com uma cultura de células ovarianas de hamsters Chinês observou-se um aumento nas aberrações cromossômicas e na troca das cromátides-irmãs. No entanto, não se observou efeito de genotoxicidade em vários outros estudos, incluindo efeitos mutagênicos em três testes in vitro (teste de mutação reversa de Ames, teste de mutação progressiva de linfomas de camundongos, teste de aberração cromossômica de linfócitos humanos) e não houve evidência de efeitos clastogênicos ou aneugênicos em dois estudo in vivo de micronúcleo da medula óssea de camundongo, com doses superiores a 250 mg/kg. Foram usados em um destes estudos ratos B6C3F1 da mesma cepa que apresentou tumores hepáticos no bioensaio de câncer. Além disso, não houve potencial genotóxico como avaliado pela medição de mutações cII no fígado e nos micronúcleos em reticulócitos periféricos em ratos Big Blue, de micronúcleos em reticulócitos sanguíneo periférico, mutações HPRT e aberrações cromossômicas em linfócitos sanguíneos periféricos de macacos rhesus, mutações no locus pig-A em ratos adolescentes, frequência de reticulócitos de micronúcleos no sangue e danos no DNA nas células do sangue, cérebro e fígado de ratos machos adultos tratados durante 28 dias consecutivos, e através da medição de micronúcleos em eritrócitos sanguíneos periféricos de ratos.
Toxicidade juvenil
Em um estudo convencional conduzido em ratos jovens, o metilfenidato foi administrado por via oral em doses de até 100 mg/kg/dia durante 9 semanas, começando no início do período pós-natal (dia 7 após o nascimento) e continuando até a maturidade sexual (semana 10 pós-natal). Quando os animais foram testados quando adultos (13-14 semanas pós-natal), foi observada uma diminuição da atividade locomotora espontânea em machos e fêmeas tratados previamente com 50 mg/kg/dia ou mais, e um deficit na aquisição de uma tarefa de aprendizagem especifica foi observado em fêmeas expostas a uma dose mais elevada de 100 mg/kg/dia (cerca de 58 vezes maior que a MRHD em mg/Kg). A relevância clínica destas descobertas é desconhecida.
Cuidados de Armazenamento
O produto deve ser conservado em temperatura ambiente (entre 15 e 30ºC). Proteger da umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas:
- Ritalina LA 10 mg: cápsula gelatinosa dura, tampa marrom opaca e corpo branco.
- Ritalina LA 20 mg: cápsula gelatinosa dura, branca opaca.
- Ritalina LA 30 mg: cápsula gelatinosa dura, amarela opaca.
- Ritalina LA 40 mg: cápsula gelatinosa dura, marrom opaca.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Mensagens de Alerta
Este medicamento pode causar dopping.
Atenção diabéticos: contém açúcar.
Venda sob prescrição médica.
Atenção: o medicamento pode causar dependência física ou psíquica.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também a empresa através do seu serviço de atendimento.
Dizeres Legais
MS – 1.0068.0080
Farm. Resp.: Flavia Regina Pegorer – CRF-SP 18.150
Importado por:
Novartis Biociências S.A.
Av. Prof. Vicente Rao, 90 São Paulo - SP
CNPJ: 56.994.502/0001-30
Indústria Brasileira
Fabricado por:
Recro Gainesville, LLC - Gainesville - EUA
Embalado por:
Packaging Coordinators Inc. - Philadelphia - EUA
informações complementares
| Fabricante |
| NOVARTIS |
| Princípio ativo |
| Cloridrato De Metilfenidato |
| Categoria do medicamento |
| Medicamentos de A-Z |
