para o que é indicado e para que serve?
Para que serve Rocefin é usado para tratar infecções causadas por microorganismos sensíveis à ceftriaxona.Continue lendo...
ofertas de
Rocefin - Injetável Intra...
ofertas de Rocefin - Injetável Intra...
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Rocefin é usado para tratar infecções causadas por microorganismos sensíveis à ceftriaxona.
Como Rocefin funciona?
Rocefin pertence a um grupo de medicamentos denominado antibióticos. Sua substância ativa - ceftriaxona - é um antibiótico capaz de eliminar uma grande variedade de microorganismos/bactérias responsáveis por diversos tipos de infecções.
Rocefin IM
A concentração plasmática máxima depois de dose única de 1 g IM é alcançada em 2 - 3 horas após a administração.
Contraindicação
Hipersensibilidade:
Rocefin é contraindicado a pacientes com alergia à ceftriaxona, a qualquer um dos excipientes da formulação ou a qualquer outro cefalosporínicos (como cefalexina, cefazolina e outros). Pacientes com histórico de reações de hipersensibilidade à penicilina (incluindo ampicilina e amoxicilina) e outros agentes betalactâmicos podem apresentar maior risco de hipersensibilidade a Rocefin.
Lidocaína:
Contraindicações à lidocaína devem ser excluídas antes da administração de injeções intramusculares de ceftriaxona, nas quais a solução de lidocaína deve ser utilizada como solvente. Favor consultar as contraindicações descritas na bula da lidocaína.
Neonatos prematuros:
Rocefin é contraindicado a neonatos prematuros com idade pós-menstrual (idade corrigida) de até 41 semanas (idade gestacional + idade cronológica).
Neonatos e soluções intravenosas que contém cálcio:
Rocefin é contraindicado a neonatos (? 28 dias) sob tratamento (ou em previsão de tratamento) com soluções IV que contêm cálcio, incluindo infusão contínua de cálcio como a nutrição parenteral, por causa do risco de formação de compostos insolúveis de ceftriaxona cálcica.
Como usar
Manuseio e aplicação
Administração intramuscular: dissolver Rocefin IM 500 mg em 2 mL e o Rocefin IM 1g em 3,5 mL de uma solução de lidocaína a 1% e injetar profundamente na região glútea ou em outro músculo relativamente grande.
Recomenda-se não injetar mais do que 1 g em cada local.
O diluente de Rocefin IM, composto de uma solução de lidocaína, nunca deve ser administrado na veia. Dessa forma, sempre utilize Rocefin IM somente por via intramuscular, nunca por via intravenosa.
Incompatibilidades
Posologia
Adultos e crianças acima de 12 anos:
A dose usual é de 1 – 2 g de Rocefin em dose única diária (cada 24 horas). Em casos graves ou em infecções causadas por patógenos moderadamente sensíveis, a dose pode ser elevada para 4 g, uma vez ao dia.
Recém-nascidos (abaixo de 14 dias):
Dose única diária de 20 – 50 mg/kg, de acordo com o peso corpóreo. Não ultrapassar 50 mg/kg. Rocefin é contraindicado a neonatos prematuros com idade pós-menstrual (idade gestacional + idade cronológica) de até 41 semanas.
Rocefin também é contraindicado a recém-nascidos (? 28 dias), que requeiram (ou possam requerer) tratamento com soluções que contêm cálcio, incluindo infusão de cálcio contínua como a nutrição parenteral, devido ao risco de precipitação de ceftriaxona cálcica.
Recém-nascidos, lactentes e crianças (15 dias até 12 anos):
Pacientes idosos:
As doses para adultos não precisam ser alteradas para pacientes idosos, desde que o paciente não apresente insuficiência renal e hepática graves.
Duração do tratamento:
O tempo de tratamento varia de acordo com a evolução da doença. Como se recomenda na antibioticoterapia em geral, a administração de Rocefin deve ser mantida durante um período mínimo de 48 a 72 horas após o desaparecimento da febre ou após obter-se evidências de erradicação da bactéria.
Siga a orientação do seu médico porque o tratamento com Rocefin pode mudar em condições específicas. Você deve comunicar ao seu médico se desejar interromper o tratamento.
Terapêutica associada:
Tem sido demonstrado, em condições experimentais, um sinergismo entre Rocefin e aminoglicosídeos, para muitas bactérias Gram-negativas.
Embora não se possa prever sempre um aumento de atividade com essa associação, esse sinergismo deve ser considerado nas infecções graves com risco de morte causadas por microorganismos, como Pseudomonas aeruginosa.
Por causa da incompatibilidade química entre Rocefin e aminoglicosídeos, esses medicamentos devem ser administrados separadamente, nas doses recomendadas.
A incompatibilidade química também foi observada na administração intravenosa da ansacrina, vancomicina e fluconazol com Rocefin.
Instruções posológicas especiais
O que devo fazer quando eu me esquecer de usar Rocefin?
Na eventualidade de perder uma dose, procure tomar o medicamento o mais brevemente possível. Não duplique a dose seguinte para compensar uma dose perdida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Hipersensibilidade:
Assim como para todos os agentes antibacterianos betalactâmicos, reações de hipersensibilidade sérias e, ocasionalmente, fatais foram reportadas em pacientes tratados com Rocefin.
No caso de reações de hipersensibilidade graves, o tratamento com Rocefin deve ser descontinuado imediatamente e medidas de emergência adequadas devem ser iniciadas.
Antes do início do tratamento, seu médico deve concluir se você apresenta histórico de reações de hipersensibilidade à ceftriaxona, outras cefalosporinas ou qualquer outro tipo de medicamento betalactâmico. Deve-se tomar precauções, caso Rocefin seja administrado em pacientes com histórico de hipersensibilidade a outros agentes betalactâmicos.
Anemia hemolítica:
Anemia hemolítica imune mediada (anemia produzida por destruição dos glóbulos vermelhos por anticorpos do próprio paciente) foi observada em pacientes que receberam antibacterianos da classe das cefalosporinas, incluindo Rocefin.
Casos graves de anemia hemolítica, incluindo óbitos, foram relatados durante o tratamento em adultos e crianças. Se você notar sinais de anemia (como palidez, cansaço fácil, falta de ar com pequenos esforços) durante o uso de Rocefin, avise seu médico para que ele possa pesquisar a causa e orientar você da melhor forma. O uso de ceftriaxona deve ser interrompido até que a causa da anemia seja determinada.
Diarreia associada ao Clostridium difficile (CDAD):
CDAD foi relatada com o uso de quase todos os agentes antibacterianos, incluindo Rocefin, e sua gravidade pode variar, de diarreia leve até uma colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon, levando a um crescimento exacerbado do C. difficile, que contribui para o desenvolvimento de CDAD. Se notar diarreia persistente, avise seu médico para que ele possa determinar a causa e adotar as medidas necessárias para o seu tratamento.
Superinfecções:
Superinfecções com os microrganismos não susceptíveis podem ocorrer como com outros agentes antibacterianos.
Precipitados de ceftriaxona cálcica:
Precipitados de ceftriaxona cálcica na vesícula biliar foram observados durante exames de ultrassom em pacientes que estavam recebendo doses de ceftriaxona iguais ou superiores a 1 g/dia.
Os precipitados desaparecem após descontinuação do tratamento com Rocefin e são raramente sintomáticos. Em casos sintomáticos, seu médico deve avaliar o risco-benefício da descontinuação do tratamento com Rocefin e outras medidas necessárias.
Não foram observados casos de precipitações intravasculares em pacientes, exceto em recém-nascidos tratados com ceftriaxona e soluções ou produtos que contenham cálcio.
Pancreatite:
Casos de pancreatite, possivelmente de origem biliar (obstrutiva), foram raramente relatados em pacientes tratados com Rocefin. A maior parte desses pacientes apresentava fatores de risco para estase/aglutinação biliar como tratamento prévio intenso, doença grave e nutrição parenteral total.
O papel de fator desencadeante ou de cofator de Rocefin relacionado à precipitação biliar não pode ser descartado.
Gravidez e amamentação
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe ao seu médico ou cirurgião-dentista se ocorrer gravidez ou iniciar amamentação durante o uso deste medicamento.
Você deve comunicar ao seu médico se estiver grávida ou com intenção de engravidar. Seu médico irá decidir quando você deve usar Rocefin.
Ceftriaxona atravessa a barreira placentária. A segurança durante a gravidez não foi estabelecida em seres humanos.
Apesar dos estudos não demonstrarem defeitos físicos no feto ou indução de mutação genética, é necessário cautela nos três primeiros meses de gestação, a não ser em casos absolutamente necessários.
Recomenda-se cuidado especial em pacientes que amamentam, apesar da baixa concentração de Rocefin excretada no leite.
Uso em idosos
A dose de Rocefin para idosos é a mesma usada para adultos.
Uso em pacientes pediátricos
A segurança e eficácia do Rocefin em recém-nascidos, lactentes e crianças foram estabelecidas para as doses descritas. Estudos mostraram que a ceftriaxona, assim como outras cefalosporinas, pode deslocar a bilirrubina da albumina sérica.
Rocefin não é recomendado para neonatos, especialmente prematuros que apresentem risco de desenvolver encefalopatia por causa de icterícia.
Efeitos sobre a capacidade de dirigir e operar máquinas
Durante o tratamento com Rocefin, efeitos indesejados podem ocorrer (por exemplo, tontura), os quais podem influenciar a habilidade de dirigir e operar máquinas. Os pacientes devem ser cautelosos ao dirigir ou operar máquinas.
Até o momento não há informações de que a ceftriaxona possa causar doping. Em caso de dúvidas, consulte seu médico.
Principais interações medicamentosas
Até o momento, não se observaram alterações da função renal após administração simultânea de doses elevadas de Rocefin e potentes diuréticos, como a furosemida.
Recomenda-se o monitoramento dos níveis de aminoglicosídeos e da função renal, quando administrados em combinação com Rocefin.
Rocefin não apresentou efeito similar ao provocado pelo dissulfiram após administração de álcool. Ceftriaxona não contém o radical N-metiltiotetrazol que está associado a uma possível intolerância ao álcool e a sangramentos observados com outras cefalosporinas.
A probenicida não tem influência sobre a eliminação de Rocefin.
Informe o seu médico se estiver utilizando algum medicamento contendo cloranfenicol, pois podem ocorrer interações entre ele e Rocefin. Em estudos in vitro, efeitos antagônicos foram observados com o uso combinado de cloranfenicol e ceftriaxona.
O uso concomitante de Rocefin com antagonistas da vitamina K pode aumentar o risco de sangramentos. Os parâmetros de coagulação devem ser monitorados frequentemente e a dose do anticoagulante deve ser ajustada adequadamente pelo seu médico durante e após o tratamento com Rocefin.
Interações com exames laboratoriais
Em pacientes tratados com Rocefin, o teste de Coombs pode se tornar falso positivo. Assim como com outros antibióticos, pode ocorrer resultado falso-positivo para galactosemia.
Os métodos não enzimáticos para determinação de glicose na urina podem fornecer resultados falsos positivos. Por esse motivo, a determinação de glicose na urina durante o tratamento com Rocefin deve ser feita por métodos enzimáticos.
A presença da ceftriaxona pode falsamente reduzir os valores estimados de glicose no sangue, quando obtidos a partir de alguns sistemas de monitoramento. Favor consultar as informações de uso para cada sistema utilizado. Métodos de análise alternativos devem ser utilizados, se necessário.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Estudos clínicos
As reações adversas mais frequentemente reportadas para Rocefin são eosinofilia (aumento de um tipo de glóbulos brancos que geralmente indicam alergia ou infestação por vermes), leucopenia (redução de glóbulos brancos), trombocitopenia (redução das plaquetas, elemento do sangue que participa da coagulação), diarreia, erupção cutânea e aumento das enzimas hepáticas (substâncias que indicam lesão do fígado no exame de sangue).
Os dados para determinar a frequência das reações adversas de Rocefin foram obtidos de estudos clínicos.
Pós-comercialização
As reações adversas a seguir foram identificadas durante o período de pós-comercialização de Rocefin. Essas reações foram reportadas por uma população de tamanho incerto, portanto, não é possível estimar com segurança sua frequência e/ou estabelecer uma relação causal com a exposição ao fármaco.
Composição
Rocefin IM
Rocefin IV
Superdosagem
Em casos de administração de uma dose excessiva, não é possível reduzir a concentração da droga através de hemodiálise ou diálise peritoneal. Não há antídoto específico. O tratamento deve ser sintomático.
Em casos de superdose podem aparecer as reações adversas descritas anteriormente. O tratamento é sintomático.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Até o momento, não se observaram alterações da função renal após administração simultânea de doses elevadas de Ceftriaxona e potentes diuréticos, como a furosemida.
Há evidências conflitantes sobre o potencial aumento na toxicidade renal dos aminoglicosídeos, quando administrados com cefalosporinas. O monitoramento dos níveis de aminoglicosídeos e da função renal descritos na prática clínica devem ser rigorosamente cumpridos, quando houver administração em combinação com Ceftriaxona.
Ceftriaxona não apresentou efeito similar ao provocado pelo dissulfiram após administração de álcool.
Ceftriaxona não contém o radical N-metiltiotetrazol, que está associado a uma possível intolerância ao álcool e a sangramentos observados com outras cefalosporinas.
A probenicida não tem influência sobre a eliminação de Ceftriaxona.
Em estudos in vitro, efeitos antagônicos foram observados com o uso combinado de cloranfenicol e ceftriaxona.
Diluentes que contêm cálcio, como as soluções de Ringer ou Hartmann, não devem ser utilizados para a reconstituição de Ceftriaxona ou para diluições posteriores de soluções reconstituídas para administração IV, pois pode ocorrer a formação de precipitado. A precipitação de ceftriaxona cálcica também é possível quando Ceftriaxona é misturado com soluções que contêm cálcio no mesmo acesso de administração IV. Ceftriaxona não deve ser administrado simultaneamente com soluções IV que contêm cálcio, inclusive infusões contínuas que contêm cálcio, tais como as de nutrição parenteral, através de equipo em Y. No entanto, em outros pacientes, exceto em recém-nascidos, Ceftriaxona e soluções que contenham cálcio podem ser administrados sequencialmente, se as linhas de infusão forem bem lavadas com um líquido compatível. Em estudos in vitro que utilizaram plasma adulto e neonatal do sangue do cordão umbilical, foi demonstrado que recém-nascidos apresentam um risco aumentado de precipitação de ceftriaxona cálcica.
O uso concomitante de Ceftriaxona com antagonistas da vitamina K pode aumentar o risco de sangramentos. Os parâmetros de coagulação devem ser monitorados frequentemente e a dose do anticoagulante deve ser ajustada adequadamente durante e após o tratamento com Ceftriaxona.
Interações com exames laboratoriais
Em pacientes tratados com Ceftriaxona, o teste de Coombs pode se tornar falso positivo. Assim como com outros antibióticos, pode ocorrer resultado falso positivo para galactosemia.
Os métodos não enzimáticos para a determinação de glicose na urina podem fornecer resultados falsos positivos. Por esse motivo, a determinação de glicose na urina durante o tratamento com Ceftriaxona deve ser feita por métodos enzimáticos.
A presença da ceftriaxona pode falsamente reduzir os valores estimados de glicose no sangue, quando obtidos a partir de alguns sistemas de monitoramento da glicose sanguínea. Favor consultar as informações de uso para cada sistema utilizado. Métodos de análise alternativos devem ser utilizados, se necessário.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados de eficácia
O tratamento com Ceftriaxona é eficaz em infecções de gravidade variável, incluindo a sepse neonatal e em adultos, causadas por microrganismos sensíveis.
É indicado no tratamento empírico da meningite em crianças acima de 1 ano associado à ampicilina. Sua eficácia em adultos é comparável à da associação ampicilina e cloranfenicol e, em criançasm aos seguintes antibióticos: cloranfenicol, ampicilina (isolados ou em associação), cefepima e cefotaxima, com a vantagem de posologia apenas uma vez ao dia.
No tratamento das infecções respiratórias agudas ou crônicas agudizadas, sua eficácia é observada em crianças, adultos e idosos, na pneumonia comunitária e hospitalar, de gravidade variável, e em casos graves.
Seu uso em dose única no tratamento da otite média aguda em crianças tem eficácia similar à do tratamento com amoxicilina durante 7 a 10 dias, associação amoxicilina e ácido clavulânico e sulfametoxazol e trimetoprima, e tem sua indicação como alternativa quando a aderência ao tratamento for questionável.
Ceftriaxona mostrou-se eficaz no tratamento das infecções renais e do trato urinário não complicadas e complicadas. Sua eficácia e segurança também foram demonstradas em mulheres grávidas, crianças e adolescentes.
No tratamento da peritonite bacteriana espontânea em pacientes cirróticos, ocorre cura bacteriológica de até 100% em 48 horas. Na febre tifoide seu uso é seguro e eficaz, em adultos e crianças, comparável ao cloranfenicol. Nas diarreias causadas por Shigella, Salmonella, E. coli e Campylobacter, em crianças, tem eficácia similar quando comparado ao ciprofloxacino.
Sua eficácia também é observada no tratamento empírico de infecções bacterianas em crianças e adultos imunocomprometidos com neutropenia febril e câncer. Nesses pacientes, o uso de Ceftriaxona diário, uma vez ao dia, é mais custo efetivo do que a ceftazidima, três doses ao dia, ambos em associação à amicacina.
Na profilaxia perioperatória de infecções, sua administração em dose única no pré-operatório tem eficácia superior ou igual a outros antibióticos administrados em múltiplas doses. É superior à associação de gentamicina e metronidazol em cirurgias intestinais e a cefoxitina, em cirurgias abdominais. Em relação a cefepime (este também em dose única), a eficácia nas cirurgias colorretais é semelhante. Nas cirurgias ginecológicas, biliares e cardiovasculares, a eficácia de sua administração em dose única é similar a cefazolina em múltiplas doses. Nas cirurgias mamárias, observou-se menor incidência de infecção pós-operatória, quando comparado a ceftazidima. Nas cirurgias ortopédicas, sua eficácia é semelhante à de cefuroxima.
Na profilaxia de infecção após trauma penetrante, a administração precoce (dentro de 2 horas) de Ceftriaxona 2 g em dose única tem eficácia semelhante ao uso de cefoxitina na dose de 2 g, 3 vezes ao dia por 3 dias, associado a um menor custo de tratamento.
Ceftriaxona em uma única dose é eficaz para o tratamento da gonorreia com resultados de erradicação da bactéria que variam de 98% a 100%. Sua eficácia em dose única no tratamento do cancroide é similar à azitromicina. associação com doxicilina é tão eficaz quanto a inflamatória pélvica.
No tratamento da doença de Lyme, mostra-se superior à penicilina e pode ser considerada droga de escolha.
No tratamento das celulites, sua eficácia é comparável a cefazolina.
Características farmacológicas
Farmacodinâmica
Microbiologia
A atividade bactericida da ceftriaxona deve-se à inibição da síntese da parede celular. A ceftriaxona, in vitro, é ativa contra um amplo espectro de microrganismos Gram-positivos e Gram-negativos, sendo altamente estável à maioria das betalactamases, tanto cefalosporinases quanto penicilinases desses microrganismos. A ceftriaxona é normalmente ativa in vitro contra os seguintes microrganismos e suas respectivas infecções:
Aeróbios Gram-positivos
Staphylococcus aureus (sensíveis à meticilina), Staphylococci coagulase-negativo, Streptococcus pyogenes (Beta-hemolítico grupo A), Streptococcus agalactiae (Beta-hemolítico grupo B), Streptococci beta-hemolítico (grupo não-A ou B), Streptococcus viridans, Streptococcus pneumoniae.
Obs: os estafilococos resistentes à meticilina são resistentes às cefalosporinas, inclusive à ceftriaxona. Em geral, Enterococos faecalis, Enterococos faecium e Listeria monocytogenes também são resistentes.
Aeróbios Gram-negativos
Acinetobacter lwoffi, Acinetobacter anitratus (principalmente Acinetobacter baumanii)*, Aeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans, Bactéria Alcaligenes-like, Borrelia burgdorferi, Capnocytophaga spp., Citrobacter diversus (incluindo C. amalonaticus), Citrobacter freundii*, Escherichia coli, Enterobacter aerogenes*, Enterobacter cloacae*, Enterobacter spp. (outros)*, Haemophilus ducreyi, Haemophilus influenzae, Haemophilus parainfluenzae, Hafnia alvei, Klebsiella oxytoca, Klebsiella pneumoniae**, Moraxella catarrhalis (antiga Branhamella catarrhalis), Moraxella osloensis, Moraxella spp. (outras), Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurella multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus penneri*, Proteus vulgaris*, Pseudomonas fluorescens*, Pseudomonas spp. (outras)*, Providentia rettgeri*, Providentia spp. (outras), Salmonella typhi, Salmonella spp (não tifoide), Serratia marcescens*, Serratia spp. (outras)*, Shigella spp., Vibrio spp., Yersinia enterocolitica, Yersinia spp. (outras).
*Alguns isolados dessas espécies são resistentes à ceftriaxona, principalmente por causa da produção de betalactamase codificada cromossomicamente.
** Alguns isolados dessas espécies são resistentes por causa da produção de betalactamase de espectro ampliado mediada por plasmídio.
Obs: muitas cepas de microrganismos anteriormente mencionados que apresentam resistência a outros antibióticos, como amino e ureidopenicilina, cefalosporinas mais antigas e aminoglicosídeos, são sensíveis à ceftriaxona.
Treponema pallidum é sensível à ceftriaxona in vitro e em experimentação animal. Trabalhos clínicos indicam que tanto a sífilis primária como a secundária respondem bem ao tratamento com ceftriaxona. Com poucas exceções clínicas, isolados de P. aeruginosa são resistentes à ceftriaxona.
Microrganismos anaeróbicos
Bacteroides spp. (sensíveis à bile)*, Clostridium spp.(exceto C. difficile), Fusobacterium nucleatum, Fusobacterium spp (outros), Gaffkia anaerobica (anteriormente Peptococcus), Peptostreptococcus spp.
*Alguns isolados dessa espécie são resistentes por causa da produção de betalactamase.
Obs: muitas cepas de Bacteroides spp. produtoras de betalactamases (especialmente B. fragillis) são resistentes. Clostridium difficile é resistente.
A sensibilidade à ceftriaxona pode ser determinada por meio do teste de difusão com disco ou do teste de diluição com ágar ou caldo que utiliza técnicas padronizadas para testes de sensibilidade como as recomendadas pelo National Committee for Clinical Laboratory Standards (NCCLS). O NCCLS fornece os seguintes parâmetros para a ceftriaxona:
Farmacocinética
A farmacocinética da ceftriaxona não é linear, e todos os parâmetros farmacocinéticos básicos, exceto a meia vida de eliminação, são dependentes da dose se baseados nas concentrações totais do fármaco, aumentando menos do que proporcionalmente com a dose. A não linearidade é devida à saturação da ligação com as proteínas plasmáticas e é observada, portanto, para a ceftriaxona plasmática total, mas não para a ceftriaxona livre (não ligada).
Absorção
A concentração plasmática máxima depois de dose intramuscular única de 1 g é de cerca de 81 mg/L e é alcançada em 2 – 3 horas após administração. As áreas sob as curvas de concentração plasmática x tempo, após administração IM e IV, são equivalentes. Isso significa que a biodisponibilidade da ceftriaxona após administração IM é de 100%. Após a administração intravenosa em bolus de 500 mg e 1 g de ceftriaxona, o pico plasmático médio dos níveis de ceftriaxona é aproximadamente 120 e 200 mg/L, respectivamente. Após infusão intravenosa de 500 mg, 1 g e 2 g de ceftriaxona, os níveis plasmáticos de ceftriaxona são aproximadamente 80, 150 e 250 mg/L, respectivamente. Após injeção intramuscular, o pico plasmático médio dos níveis de ceftriaxona é metade do valor observado após administração intravenosa de uma dose equivalente.
Distribuição
O volume de distribuição da ceftriaxona é de 7 a 12 litros. Ceftriaxona mostrou excelente penetração tissular e nos líquidos orgânicos após dose de 1 – 2 g. Alcança concentrações bem acima da concentração inibitória mínima contra a maioria dos patógenos responsáveis pela infecção e é detectável por mais de 24 horas em mais de 60 tecidos ou líquidos orgânicos, incluindo pulmões, coração, fígado e vias biliares, amígdalas, ouvido médio, mucosa nasal, ossos e fluidos cérebro-espinhal, pleural, prostático e sinovial.
Na administração intravenosa, a ceftriaxona difunde-se rapidamente para o líquido intersticial, onde a concentração bactericida contra organismos sensíveis é mantida por 24 horas.
Ligação proteica
A ceftriaxona liga-se de modo reversível à albumina. A ligação com proteínas plasmáticas é aproximadamente 95% em concentrações plasmáticas menores que 100 mg/L. Essa ligação é saturável e a porção ligada diminui com o aumento da concentração (até 85% em concentrações de 300 mg/L).
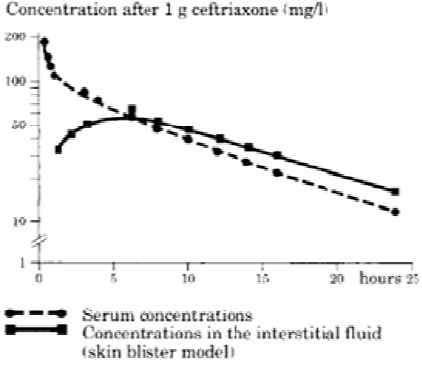
Penetração em tecidos específicos
A ceftriaxona atravessa meninges e essa penetração é maior em meninges inflamadas. A média das concentrações de pico de ceftriaxona no líquido cefalorraquidiano (LCR) reportada corresponde a até 25% dos níveis plasmáticos em pacientes com meningite bacteriana comparada com 2% de níveis plasmáticos em pacientes com meninges não inflamadas. As concentrações de pico de ceftriaxona no LCR são atingidas em, aproximadamente, quatro a seis horas após injeção intravenosa.
A ceftriaxona atravessa a placenta e é excretada pelo leite em baixas concentrações.
Metabolização
A ceftriaxona não é metabolizada sistemicamente, mas convertida a metabólitos microbiologicamente inativos pela flora intestinal.
Eliminação
A depuração total do plasma é 10 – 22 mL/min. A depuração renal é 5 – 12 mL/min.
Em adultos, cerca de 50 – 60% de ceftriaxona é excretada sob a forma inalterada na urina, enquanto 40% – 50% são excretados sob a forma inalterada na bile. A meia-vida de eliminação em adultos sadios é de, aproximadamente, 8 horas.
Farmacocinética em situações clínicas especiais
Crianças
A meia-vida da ceftriaxona é prolongada em neonatos. Em pacientes desde o nascimento até 14 dias de idade, os níveis de ceftriaxona livre podem ser aumentados por fatores como a filtração glomerular reduzida e a ligação proteica alterada. Durante a infância, a meia-vida é menor que em neonatos ou adultos. A depuração plasmática e o volume de distribuição da ceftriaxona total são maiores em neonatos, lactentes e crianças do que em adultos.
Idosos
Em indivíduos idosos, com mais de 75 anos, a média da meia-vida de eliminação é cerca de 2 a 3 vezes mais longa que em pacientes adultos.
Insuficiência renal ou hepática
Em pacientes com insuficiência renal ou hepática, a farmacocinética da ceftriaxona é minimamente alterada, sendo a meia-vida de eliminação apenas discretamente aumentada (menos que duas vezes), mesmo em pacientes com insuficiência renal grave. O modesto aumento na meia-vida em pacientes com insuficiência renal é devido ao aumento compensatório na depuração não renal, originado por uma redução na ligação proteica e por aumento correspondente na depuração não renal da ceftriaxona total.
Em pacientes com insuficiência hepática, a meia-vida de eliminação da ceftriaxona não é aumentada, por causa de um aumento compensatório na depuração renal. Isto ocorre também por causa de um aumento na fração de ceftriaxona livre no plasma, que contribuiu para o aumento paradoxal observado na depuração de ceftriaxona total, paralelamente a um aumento do volume de distribuição.
Cuidados de Armazenamento
Rocefin deve ser mantido em temperatura ambiente (entre 15 e 30 ºC). Manter o frasco-ampola dentro do cartucho.
Número de lote e datas de fabricação e validade: Vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
As soluções reconstituídas permanecem estáveis física e quimicamente por 6 horas em temperatura ambiente (ou durante até 24 horas no refrigerador entre 2°C e 8°C). Entretanto, como regra geral, as soluções devem ser usadas imediatamente após a preparação. A coloração da solução reconstituída varia do amarelo-pálido ao âmbar, dependendo da concentração e do tempo de armazenamento. Isto não tem qualquer significado quanto à tolerabilidade ou eficácia do medicamento.
Após preparo, manter no refrigerador, entre 2°C e 8°C, por até 24 horas ou manter a temperatura ambiente por até 6 horas.
Característica física
Rocefin é constituído de pó cristalino branco a amarelo alaranjado e solução aquosa clara verde amarelada a amarelo alaranjado e não possui características organolépticas marcantes que permitam sua diferenciação em relação a outros pós e soluções.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Descarte de seringas / materiais perfurocortantes
Dizeres Legais
MS-1.0100.0132
Farm. Resp.:
Tatiana Tsiomis Díaz – CRF-RJ nº 6942
Fabricado na Suíça por
F. Hoffmann-La Roche Ltd, Kaiseraugst
Registrado, importado e distribuído no Brasil por
Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2020 CEP 22775-109 - Rio de Janeiro - RJ
CNPJ: 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289
www.roche.com.br
Venda sob prescrição médica. Só pode ser vendido com a retenção da receita.
informações complementares
| Fabricante |
| ROCHE |
| Princípio ativo |
| Ceftriaxona Dissódica Hemieptaidratada |
| Categoria do medicamento |
| Medicamentos de A-Z |
