para o que é indicado e para que serve?
Para que serve Seretide Spray está indicado (para adultos e crianças) no tratamento da asma (doença obstrutiva reversível do trato respiratório).Continue lendo...
ofertas de
Seretide - 25/125Mcg Spra...
ofertas de Seretide - 25/125Mcg Spra...
R$ 112,41
R$ 115,90
R$ 119,91
R$ 120,00
ATENÇÃO: O texto abaixo deve ser utilizado apenas como uma referência secundária. É um registro histórico da bula, rótulo ou manual do produto. Este texto não pode substituir a leitura das informações que acompanha o produto, cujo fabricante podem mudar a formulação, recomendação, modo de uso e alertas legais sem que sejamos previamente comunicados. Apenas as informações contidas na própria bula, rótulo ou manual que acompanha o produto é que devem estar atualizadas de acordo com a versão comercializada porém, no caso de qualquer dúvida, consulte o serviço de atendimento ao consumidor do produto ou nossa equipe.
Para que serve
Seretide Spray está indicado (para adultos e crianças) no tratamento da asma (doença obstrutiva reversível do trato respiratório).
Seretide Spray é indicado para o tratamento regular de doença pulmonar obstrutiva crônica (DPOC), incluindo bronquite crônica e enfisema, e demonstrou reduzir a mortalidade.
Como o Seretide Spray funciona?
Seretide Spray atua, nas doenças dos brônquios, como dilatador de longa duração e como antiinflamatório. Seus efeitos duram aproximadamente 12 horas.
Contraindicação
O uso de Seretide Spray é contraindicado para pacientes com alergia conhecida a qualquer componente da fórmula.
Como usar
Antes de usar Seretide Spray, leia atentamente as instruções abaixo.
Testando seu inalador
Antes de usar o inalador pela primeira vez, ou caso não o utilize há uma semana ou mais, remova o protetor do bocal apertando delicadamente suas laterais.
Em seguida, agite bem o inalador e libere dois jatos de ar para verificar se ele funciona bem.
Usando seu inalador
- Remova a tampa do bocal apertando suavemente suas laterais. Verifique se há partículas estranhas no interior e no exterior do inalador, inclusive no bocal.
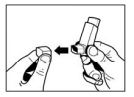
- Agite bem o inalador para remover completamente qualquer partícula estranha e para misturar o conteúdo de maneira uniforme.
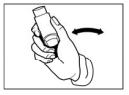
- Segure o inalador na posição vertical, entre o indicador e o polegar, e mantenha o polegar na base, abaixo do bocal. Expire (sopre o ar pela boca) bem devagar até esvaziar totalmente os pulmões.
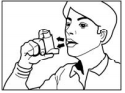
- Coloque o bocal do inalador entre os lábios (ou no espaçador, conforme orientação do seu médico). Ajuste-o bem, mas evite mordê-lo.

- Logo após, comece a inspirar (puxar o ar para dentro dos pulmões) pela boca e pressione firmemente o inalador entre o indicador e o polegar para liberar o aerossol. Inspire regular e profundamente.

- Prenda a respiração quando tirar o inalador da boca. Continue a prendê-la por tanto tempo quanto for confortável para você (cerca de 10 segundos são suficientes).
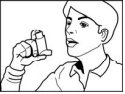
- Para liberar o segundo jato, mantenha o inalador na posição vertical e espere cerca de meio minuto antes de repetir os passos 2 a 4.
- Em seguida, lavar a boca com água e não engolir.
- Recoloque a tampa do bocal, empurrando-a firmemente, e prenda-a na posição correta. A tampa quando corretamente inserida irá travar. Se isso não acontecer, gire-a e tente novamente. Não usar força excessiva.
Importante
Não apresse os passos 3 e 4. É importante que você comece a inspirar o mais lentamente possível imediatamente antes de acionar o inalador. Pratique em frente ao espelho nas primeiras vezes. Se perceber que uma névoa sai do topo do inalador ou dos cantos de sua boca, comece novamente a partir do passo 2.
Se seu médico lhe deu instruções diferentes para usar o inalador – a utilização de espaçadores, por exemplo – siga-as cuidadosamente. Se tiver qualquer dificuldade, fale com seu médico.
Observação
O inalador contém 120 doses. Inicialmente o visor indica 124 doses, o que permite que você faça de dois a quatro disparos de ar para testar o funcionamento do dispositivo. Quando o visor do contador indicar o número 020, isso significa que o inalador contém somente 20 doses.
É recomendável, portanto, que você adquira nova unidade do medicamento para assegurar a continuidade do tratamento de acordo com a prescrição do seu médico. Quando o visor indicar o número 000, você deve interromper o uso do inalador porque não haverá mais doses.
O contador não pode ser alterado, já que está conectado de modo permanente à embalagem do medicamento. Dessa forma, não tente modificar o número indicado nem separar o contador da embalagem.
Crianças
As crianças pequenas podem precisar da ajuda dos adultos para operar o inalador.
Ensine a criança a expirar e acione o inalador assim que ela começar a inspirar. Pratique essa técnica junto com ela.
As crianças maiores e as pessoas fracas devem segurar o inalador com ambas as mãos, colocando os dois indicadores no topo e ambos os polegares na base, abaixo do bocal.
Instruções de limpeza
- Você deve limpar o inalador pelo menos uma vez por semana.
- Remova a tampa do bocal.
- Não retire o recipiente do invólucro de plástico.
- Limpe o interior e o exterior do bocal e o invólucro de plástico com um pano, um lenço de papel ou um chumaço de algodão seco.
- Recoloque a tampa do bocal
Não ponha o recipiente de metal na água.
Seretide Spray só deve ser administrado por via inalatória.
Não utilize este medicamento para tratar um ataque repentino de falta de ar, porque não vai ajudá-lo. Você vai precisar de um tipo diferente de medicamento, que não deve ser confundido com Seretide Spray.
É recomendável que você tenha sempre à mão seu medicamento de resgate de ação rápida. É muito importante usar Seretide Spray regularmente. Não interrompa o tratamento mesmo que você esteja melhor, a menos que seu médico recomende.
Não mude a dose do medicamento, a menos que o médico recomende.
Se você sentir falta de ar, ficar ofegante ou sua respiração estiver mais agitada que o normal, avise seu médico.
Posologia
Asma
Doença pulmonar obstrutiva crônica (DPOC)
O que devo fazer quando eu me esquecer de usar o Seretide Spray?
Caso você esqueça alguma dose, basta tomar a dose seguinte no horário devido.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico.
Precauções
Se você responder sim a qualquer uma das perguntas seguintes, converse com seu médico antes de usar Seretide Spray.
- Você está grávida ou há probabilidade de engravidar em breve?
- Você já está amamentando?
- Já lhe disseram que você tem alergia a Seretide Spray, ao xinafoato de salmeterol ou ao propionato de fluticasona?
- Você já teve placas esbranquiçadas na boca, na parte interna das bochechas, língua ou garganta)?
- Você recebe ou já recebeu tratamento para tuberculose?
- Você está fazendo tratamento para alguma doença da tireoide?
- Você está fazendo tratamento para pressão alta ou para algum problema cardíaco?
- Você está tomando um medicamento chamado cetoconazol, usado para tratar infecções causadas por fungos?
- Você tem histórico de diabates? (aumento de açúcar no sangue) ou é diabético?
- Você possui níveis baixos de potássio no sangue?
Não use Seretide Spray para obter alívio de um ataque súbito de falta de ar ou respiração ofegante. Seu médico deverá orientá-lo sobre como proceder nessas situações.
Se você sentir falta de ar ou respiração ofegante com mais frequência que o normal, fale com o seu médico.
É muito importante usar Seretide Spray regularmente todos os dias. Não interrompa o tratamento ou mude sua dose sem orientação médica.
O médico deverá monitorar regularmente a altura de crianças que estejam em tratamento de longa duração com medicamentos como Seretide Spray.
Seretide Spray contém xinafoato de salmeterol, incluído na lista de substâncias proibidas na prática de esportes da Agência Mundial Antidoping.
Entretanto, de acordo com esta Agência, sua utilização é permitida desde que utilizado na dose recomendada.
Este medicamento pode causar doping.
Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
Estão listadas abaixo todas as reações adversas associadas aos componentes individuais, xinafoato de salmeterol e propionato de fluticasona. Não há reações adversas atribuídas à associação, quando comparado aos perfis de eventos adversos dos componentes individuais.
Os eventos adversos são listados abaixo por frequência. As frequencias são definidas como:
- Muito comuns (> 1/10);
- Comuns (>1/100 a <1/10);
- Incomuns (>1/1000 a <1/100);
- Raras (>1/10,000 a <1/1000);
- Muito raras (<1/10,000).
A maioria das frequências foi determinada a partir do conjunto de ensaios clínicos de 23 estudos com asma e 7 estudos com DPOC. Nem todos os eventos foram reportados em estudos clínicos. Para estes eventos, a frequência foi calculada com base em relatos espontâneos.
Dados de estudos clínicos
Reações muito comuns (ocorrem em mais de 10% dos pacientes que utilizam este medicamento):
- Dor de cabeça.
Reações comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento):
- Candidíase na boca e na garganta (uma infecção causada por fungos, popularmente conhecida como “sapinho”);
- Pneumonia (em pacientes com DPOC);
- Disfonia (rouquidão);
- Câimbras musculares;
- Artralgia (dor nas articulações)
Reações incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento)):
- Reações alérgicas na pele;
- Dispneia (falta de ar);
- Catarata (lesão ocular que torna opaco o cristalino);
- Hiperglicemia (elevado nível de glicose no sangue);
- Ansiedade;
- Distúrbios do sono;
- Tremores;
- Palpitações;
- Taquicardia (aumento dos batimentos do coração);
- Fibrilação atrial (alteração no ritmo cardíaco);
- Irritação na garganta;
- Contusões
Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Reações anafiláticas (reação alérgica sistêmica);
- Glaucoma (pressão intraocular elevada);
- Mudanças de comportamento, incluindo hiperatividade e irritabilidade (predominantemente em crianças);
- Arritmias cardíacas, incluindo taquicardia supraventricular e extra-sistólica;
- Candidíase no esôfago (uma infecção causada por fungos).
Dados pós-comercialização
Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Reações de hipersensibilidade que se manifestaram como angioedema (principalmente edema facial e orofaríngeo) e broncoespasmo (estreitamento da luz do brônquio pulmonar);
- Possíveis efeitos sistêmicos incluindo síndrome de Cushing e suas manifestações (obesidade acima da cintura, com braços e pernas finos, rosto redondo, vermelho e cheio) supressão adrenal (redução da atividade das glândulas supra-renais), retardo do crescimento em crianças e adolescentes, diminuição da densidade mineral óssea;
- Broncoespasmo paradoxal.
Informe ao seu médico ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também a empresa através do Serviço de Atendimento ao Consumidor (SAC) pelo telefone 0800 701 22 33.
População Especial
Efeitos sobre a capacidade de dirigir veículos e de operar máquinas
Atualmente não há dados disponíveis que sugiram influência de Seretide Spray sobre a capacidade de dirigir veículos ou de operar máquinas.
Gravidez e lactação
Seretide Spray só deve ser usado durante a gravidez se o benefício para a mãe justificar o possível risco para o feto.
Este medicamento não deve ser usado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
Cada dose de Seretide Spray 25mcg/50mcg contém:
| Salmeterol | 25mcg (equivalente a 36,3mcg de xinafoato de salmeterol) |
| Propionato de fluticasona | 50mcg |
| Veículo: norflurano (propelente HFA 134A) q.s.p | 75mg |
Cada dose de Seretide Spray 25mcg/125mcg contém:
| Salmeterol | 25mcg (equivalente a 36,3mcg de xinafoato de salmeterol) |
| Propionato de fluticasona | 125mcg |
| Veículo: norflurano (propelente HFA 134A) q.s.p | 75mg |
Cada dose de Seretide Spray 25mcg/250mcg contém:
| Salmeterol | 25mcg (equivalente a 36,3mcg de xinafoato de salmeterol) |
| Propionato de fluticasona | 250mcg |
| Veículo: norflurano (propelente HFA 134A) q.s.p | 75mg |
Superdosagem
Se você tomar acidentalmente uma dose maior que a recomendada de Seretide Spray, seu coração poderá bater mais rápido que o normal e você talvez sinta fraqueza.
Outros sintomas possíveis são dor de cabeça, fraqueza muscular e dores nas articulações. Informe seu médico, o mais depressa possível, se você tomar acidentalmente uma dose maior do que a indicada para seu caso.
Não há um tratamento específico para uma superdose de Seretide Spray.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento se possível. Ligue para 0800 722 6001 se você precisar de mais orientações.
Interação Medicamentosa
Deve-se evitar o uso concomitante de ?-bloqueadores seletivos e não seletivos, a menos que existam razões suficientes para associar esses medicamentos.
Em circunstâncias normais, devido ao extenso metabolismo de primeira passagem e ao alto clearance sistêmico mediado pela CYP3A4 no intestino e no fígado, são baixas as concentrações plasmáticas do propionato de fluticasona atingidas após a inalação da dose. Desse modo, as interações medicamentosas clinicamente significativas mediadas pelo propionato de fluticasona são improváveis.
Um estudo sobre interações medicamentosas feito com indivíduos sadios mostrou que o ritonavir (inibidor potente da CYP3A4) pode aumentar muito as concentrações plasmáticas do propionato de fluticasona, o que resulta em reduções marcantes das concentrações séricas de cortisol. Durante o uso pós-comercialização, houve relatos de interações medicamentosas clinicamente significativas em pacientes sob tratamento com propionato de fluticasona e ritonavir. Tais interações produziram efeitos sistêmicos do corticoide, que incluíram síndrome de Cushing e supressão adrenal. Portanto, o uso concomitante de propionato de fluticasona e ritonavir deve ser evitado, a menos que o benefício potencial para o paciente supere o risco de efeitos colaterais sistêmicos do corticoide.
Estudos demonstraram que outros inibidores da CYP3A4 produzem aumentos insignificantes (eritromicina) e pequenos (cetoconazol) da exposição sistêmica ao propionato de fluticasona sem reduções marcantes das concentrações séricas de cortisol. Não obstante, aconselha-se cautela ao coadministrar inibidores potentes da CYP3A4 (como cetoconazol) devido ao aumento potencial da exposição sistêmica ao propionato de fluticasona. A coadministração de cetoconazol e salmeterol resultou em aumento significativo da concentração plasmática do salmeterol (1,4 vez a Cmáx e 15 vezes a ASC), o que pode levar ao prolongamento do intervalo QTc.
Ação da Substância
Resultado de Eficácia
Estudo clinico multicêntrico sobre salmeterol na asma (SMART)
Um estudo clínico multicêntrico sobre salmeterol na asma (SMART) com duração de 28 semanas realizado nos Estados Unidos avaliou a segurança do salmeterol em comparação com placebo, ambos adicionados à terapia usual em adultos e adolescentes. Embora não tenham sido observadas diferenças significativas no objetivo primário do número combinado de mortes relacionadas à problemas respiratórios e experiências com risco de morte relacionadas à problemas respiratórios, o estudo apresentou aumento significativo no número de mortes relacionadas à asma entre os pacientes que receberam salmeterol (13 mortes dentre 13.176 pacientes tratados com salmeterol versus 3 mortes dentre 13.179 pacientes tratados com placebo). O estudo não foi desenhado para avaliar o impacto do uso concomitante com corticoides inalatórios.
Segurança e eficácia de Fluticasona + Salmeterol (substância ativa) versus propionato de fluticasona em monoterapia na asma
Dois estudos multicêntricos com duração de 26 semanas foram conduzidos a fim de comparar a segurança e eficácia do uso de Fluticasona + Salmeterol (substância ativa) versus propionato de fluticasona em monoterapia. Um dos estudos foi realizado em adultos e adolescentes (AUSTRI) e o outro em crianças com idade entre 4 e 11 anos de idade (VESTRI). Em ambos, os pacientes apresentavam asma persistente moderada à grave com histórico de hospitalização ou exacerbação no ano anterior. O objetivo primário de ambos os estudos era avaliar a não inferioridade da combinação de um ?2-agonista de longa duração e um corticoide inalatório em relação ao tratamento com monoterapia (propionato de fluticasona), para o risco de eventos graves relacionados à asma (hospitalização em decorrência da asma, intubação orotraqueal e morte). Um objetivo secundário de eficácia era avaliar se Fluticasona + Salmeterol (substância ativa) seria superior ao corticoide inalatório em monoterapia, em relação à exacerbação grave da asma (definida por deterioração da asma exigindo o uso de corticoides sistêmicos por pelo menos três dias, internação do paciente ou visita à emergência em decorrência da asma que requer tratamento com corticoide sistêmico).
Um total de 11.679 e 6.208 indivíduos foram randomizados e receberam tratamento nos estudos AUSTRI e VESTRI, respectivamente. Para o objetivo primário de segurança, a não-inferioridade foi atingida em ambos estudos (ver tabela abaixo).
Evento grave relacionado à asma em estudos (AUSTRI e VESTRI) de 26 semanas: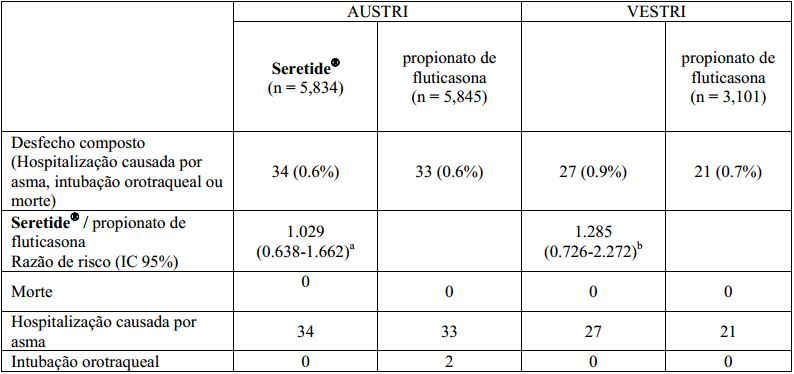 a Se o limite superior do IC 95% do risco relativo for menor que 2,0, conclui-se não inferioridade.
a Se o limite superior do IC 95% do risco relativo for menor que 2,0, conclui-se não inferioridade.
b Se o limite superior do IC 95% do risco relativo for menor que 2,675, conclui-se não inferioridade.
Para o desfecho secundário, foi observada redução no tempo para a primeira exacerbação da asma em ambos os estudos, comparando Fluticasona + Salmeterol (substância ativa) ao propionato de fluticasona, porém somente o estudo AUSTRI apresentou significância estatística: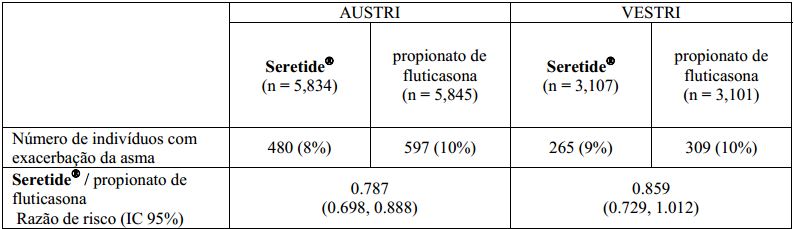
Estudo clínico de 12 meses
Um estudo de grande porte de doze meses de duração (GOAL, Gaining Optimal Asthma ControL) feito com 3.416 pacientes com asma comparou a eficácia e a segurança de Fluticasona + Salmeterol (substância ativa) com os efeitos de um corticoide inalatório, em monoterapia, na obtenção de níveis predefinidos de controle da asma*. Aumentou-se a dose usada a cada doze semanas até que o controle total** (definido no estudo como remissão dos sintomas da asma durante pelo menos sete das últimas oito semanas de tratamento) fosse alcançado ou até que a dose mais alta da medicação fosse atingida.
Doença pulmon ar obstrutiva crônica (DPOC)
Estudo TORCH (TOwards a Revolution in COPD Health – Rumo a uma revolução para a saúde em DPOC)
O estudo TORCH teve duração de 3 anos e foi planejado para avaliar o efeito do tratamento com Fluticasona + Salmeterol (substância ativa) 50mcg/500mcg duas vezes ao dia, comparado com salmeterol 50mcg duas vezes ao dia, com propionato de fluticasona 500mcg duas vezes ao dia ou com placebo, sobre a mortalidade por qualquer causa em pacientes com DPOC. Os pacientes com DPOC moderada a grave, com VEF1 basal (pré-broncodilatador) < 60% do normal previsto, foram randomizados para medicação em esquema duplo-cego. Durante o estudo, os pacientes foram autorizados a receber o tratamento usual para DPOC, com exceção de outros corticoides inalados, broncodilatadores de ação prolongada e corticoides sistêmicos de longo prazo. As condições de sobrevida após 3 anos foram determinadas para todos os pacientes, independentemente da suspensão da medicação do estudo. O ponto final de avaliação primário foi a redução na mortalidade por qualquer causa após 3 anos para Fluticasona + Salmeterol (substância ativa) em comparação com placebo.
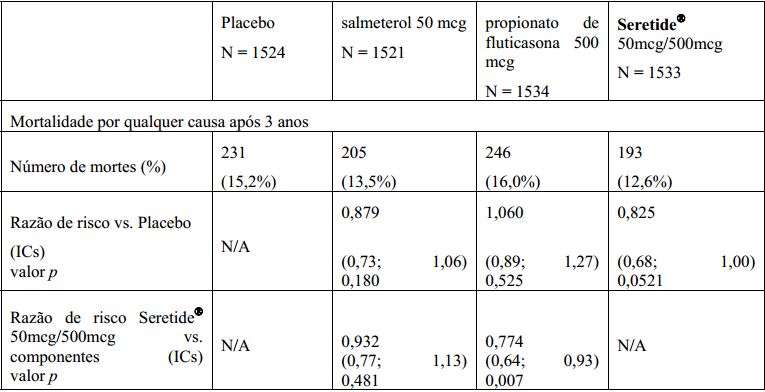
1. Valor p ajustado para duas análises intermediárias da comparação de eficácia primária a partir de uma análise log-rank estratificada por status de tabagismo.
Fluticasona + Salmeterol (substância ativa) reduziu o risco de morte a qualquer tempo durante os 3 anos em 17,5%, em comparação com placebo [razão de risco 0,825 (IC 95%: 0,68; 1,00; p=0,052); todos ajustados para análises intermediárias]. Houve uma redução de 12% no risco de morte a qualquer tempo durante os 3 anos, por qualquer causa, para salmeterol, em comparação com placebo (p=0,180), e um aumento de 6% para propionato de fluticasona, em comparação com placebo (p=0,525).
Uma análise de suporte, usando-se o modelo de Riscos proporcionais de Cox, resultou em uma razão de risco de 0,811 (IC 95%: 0,670; 0,982; p=0,031) para Fluticasona + Salmeterol (substância ativa) vs. placebo, o que representou uma redução de 19% no risco de morte a qualquer tempo durante 3 anos. O modelo foi ajustado para fatores importantes (status de tabagismo, idade, sexo, região, VEF1 basal e índice de massa corpórea). Não houve evidências de que os efeitos do tratamento tenham variado para esses fatores.
A porcentagem de pacientes que morreram durante 3 anos por causas relacionadas à DPOC foi de 6,0% para placebo, 6,1% para salmeterol, 6,9% para propionato de fluticasona e 4,7% para Fluticasona + Salmeterol (substância ativa).
Fluticasona + Salmeterol (substância ativa) reduziu a taxa de exacerbações moderadas à graves em 25% (IC 95%: 19% a 31%; p<0,001), quando comparado a placebo. Fluticasona + Salmeterol (substância ativa) reduziu a taxa de exacerbações em 12%, em comparação com salmeterol (IC 95%: 5% a 19%; p=0,002), e em 9%, quando comparado a propionato de fluticasona (IC 95%: 1% a 16%; p=0,024). Salmeterol e propionato de fluticasona reduziram significativamente as taxas de exacerbação, em comparação com placebo, em 15% (IC 95%: 7% a 22%; p<0,001) e 18% (IC 95%: 11% a 24%; p<0,001), respectivamente.
A Qualidade de Vida Relacionada à Saúde, medida pelo Questionário Respiratório St. George (SGRQ) melhorou com todos os tratamentos ativos, em comparação com placebo. A melhora média durante três anos para Fluticasona + Salmeterol (substância ativa), em comparação com placebo, foi de -3,1 unidades (IC 95%: -4,1 a -2,1; p<0,001), em comparação com salmeterol foi de -2,2 unidades (p<0,001) e em comparação com propionato de fluticasona foi de -1,2 unidades (p=0,017).
Durante o período de tratamento de 3 anos, os valores de VEF1 foram maiores em indivíduos tratados com Fluticasona + Salmeterol (substância ativa) do que naqueles que receberam placebo (diferença média durante 3 anos: 92mL; IC 95%: 75 a 108mL; p<0,001). Fluticasona + Salmeterol (substância ativa) também foi mais eficaz do que salmeterol ou propionato de fluticasona em melhorar o VEF1 (diferença média de 50mL; p<0,001 para salmeterol, e 44 mL; p<0,001 para propionato de fluticasona).
A estimativa de probabilidade em 3 anos para a ocorrência de pneumonia relatada como evento adverso foi de 12,3% para placebo, 13,3% para salmeterol, 18,3% para propionato de fluticasona e 19,6% para Fluticasona + Salmeterol (substância ativa) (razão de risco para Fluticasona + Salmeterol (substância ativa) em comparação com placebo: 1,64; IC 95%: 1,33 a 2,01; p<0,001). Não houve aumento no número de mortes relacionadas à pneumonia. As mortes durante o tratamento consideradas como ocasionadas principalmente por pneumonia foram 7 para placebo, 9 para salmeterol, 13 para propionato de fluticasona e 8 para Fluticasona + Salmeterol (substância ativa). Não houve diferença significativa na probabilidade de fraturas ósseas (5,1% para placebo, 5,1% para salmeterol, 5,4% para propionato de fluticasona e 6,3% para Fluticasona + Salmeterol (substância ativa); razão de risco para Fluticasona + Salmeterol (substância ativa) vs. placebo: 1,22; IC 95%: 0,87 a 1,72; p=0,248). A incidência de eventos adversos de distúrbios oculares, ósseos e do eixo HPA foi baixa e não foram observadas diferenças entre os tratamentos. Não houve indícios de aumento na incidência de eventos adversos cardíacos nos grupos de tratamento que receberam salmeterol.
Medicamentos contendo propionato de fluticasona na asma durante a gravidez
Um estudo epidemiológico retrospectivo observacional de coorte utilizando registros eletrônicos de saúde do Reino Unido foi utilizado para avaliar o risco de malformações congênitas maiores (MFCs) após a exposição ao propionato de fluticasona por via inalatória no primeiro trimestre e propionato de fluticasona + salmeterol em relação ao corticoide inalatório sem propionato de fluticasona. Nenhum comparador placebo foi incluído neste estudo.
Dentro do grupo de asma de 5362 grávidas expostas a corticoides inalatórios no primeiro trimestre, foram encontrados 131 MFCs; 1612 (30%) foram expostas ao propionato de fluticasona ou salmeterol + propionato de fluticasona, das quais foram encontrados 42 MFCs diagnosticados. A odds ratio ajustada para MFCs diagnosticadas por 1 um ano foi 1,1 (95% IC: 0,5 – 2.3) para mulheres com asma moderada expostas ao propionato de fluticasona versus mulheres expostas a corticoides inalatórios sem propionato de fluticasona e 1,2 (95% IC: 0,7 – 2,0) para mulheres com asma importante a grave. Não foi encontrada diferença no risco de MFCs após a exposição no primeiro trimestre ao propionato de fluticasona isolado versus xinafoato de salmeterol/ propionato de fluticasona. Riscos absolutos de MFMs ao longo de todos os estratos de gravidade variaram de 2,0 a 2,9 a cada 100 grávidas expostas ao propionato de fluticasona o que é comparável aos resultados de um estudo com 15.840 grávidas não expostas às terapias de asma na General Practice Research Database. (2,8 eventos de MFCs a cada 100 grávidas).
Características farmacológicas
Propriedades farmacodinâmicas
Propionato de fluticasona
Quando é inalado nas doses recomendadas, o propionato de fluticasona apresenta potente ação anti-inflamatória pulmonar, que resulta na redução dos sintomas e da exacerbação da asma sem a ocorrência dos efeitos adversos observados quando os corticoides são administrados por via sistêmica.
Durante o tratamento crônico com propionato de fluticasona inalatório, a produção diária de hormônios adrenocorticais geralmente se mantém dentro da faixa normal, inclusive quando se administram doses mais altas recomendadas para crianças e adultos. Após a transferência de outros corticoides inalatórios, a produção diária melhora gradualmente mesmo com o uso intermitente de corticoides orais; isso demonstra o retorno da função adrenal ao normal com o uso de propionato de fluticasona inalatório. A reserva adrenal também se mantém dentro da normalidade durante o tratamento crônico, como se verificou pelo aumento normal em um teste de estimulação. Entretanto, qualquer comprometimento residual da reserva adrenal oriundo de tratamento prévio pode persistir por tempo considerável e deve ser levado em consideração.
Propriedades farmacocinéticas
Não existem evidências de que a administração conjunta de salmeterol e propionato de fluticasona, por via inalatória, altera a farmacocinética de cada droga. Portanto, para fins farmacocinéticos, cada droga será
considerada separadamente.
Em um estudo sobre interação medicamentosa controlado com placebo, cruzado, realizado com 15 indivíduos sadios, a coadministração, durante sete dias, de salmeterol (50mcg duas vezes ao dia por via inalatória) e de cetoconazol (400 mg uma vez ao dia por via oral), inibidor da CYP3A4 resultou em aumento significativo da concentração plasmática do salmeterol (1,4 vez a Cmáx e 15 vezes a ASC). Não houve aumento de acumulação do salmeterol durante a administração repetida. Retirou-se, no caso de três indivíduos da pesquisa, a coadministração de salmeterol e de cetoconazol devido ao prolongamento do intervalo QTc ou palpitações com taquicardia sinusal. Nos doze indivíduos da pesquisa restantes, a coadministração de salmeterol e de cetoconazol não resultou em efeito clinicamente significativo sobre o ritmo cardíaco, os níveis séricos de potássio nem a duração do QTc.
Cuidados de Armazenamento
Mantenha o medicamento na embalagem original e em temperatura ambiente (abaixo de 30°C).
Proteger da luz e do congelamento.
A lata do produto não deve ser quebrada, perfurada, nem queimada, mesmo quando estiver vazia.
Como ocorre com a maioria dos medicamentos inalatórios acondicionados em recipientes pressurizados, o efeito terapêutico pode diminuir quando a lata está fria.
Após o uso, recoloque a tampa do bocal firmemente e prenda-a na posição correta.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com prazo de validade vencido.
Guarde-o em sua embalagem original.
Aspecto físico/características organolépticas
Recipiente metálico com base côncava, acoplado a uma válvula medidora. O recipiente metálico é equipado com um medidor de doses.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte médico e o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Venda sob prescrição médica.
Nº do lote e datas de fabricação e validade: vide cartucho.
MS: 1.0107.0230
Farm. Resp.:
Edinilson da Silva Oliveira
CRF-RJ n°18875
Fabricado por:
Glaxo Wellcome S.A.
Avda. de Extremadura, 3-09400 – Aranda de Duero - Espanha
ou
Glaxo Wellcome Production
23, rue Lavoisier, Zone Industrielle no 2, 27000, Evreux - França
Registrado e importado por:
GlaxoSmithKline Brasil Ltda.
Estrada dos Bandeirantes, 8464 – Rio de Janeiro – RJ
CNPJ: 33.247.743/0001-10
informações complementares
| Fabricante |
| GSK GLAXO |
| Princípio ativo |
| Propionato De Fluticasona + Hidroxinaftoato De Salmeterol |
| Categoria do medicamento |
| Medicamentos de A-Z |
