CUTENOX - 60 MG SOL INJ CT 2 SER VD INC PREENCHIDA X 0,6 MLÂ+ SIST SEGURANÃA na Farmaclass Medicamentos Especiais
Cutenox - 60Mg 6Mlc 2

CUTENOX - 60 MG SOL INJ CT 2 SER VD INC PREENCHIDA X 0,6 MLÂ+ SIST SEGURANÃA na Farmaclass Medicamentos Especiais
Não encontramos este produto para a Farmaclass Medicamentos Especiais no Cliquefarma.
Confira os menores preços para Cutenox - 60Mg 6Mlc 2

Cutenox - 60Mg 6Mlc 2
55.03%
R$ 89,90
OncoExpresso Medicamentos
R$ 199,90
Para que serve
- Coagulação intravascular disseminada.
- Tromboembolismo pulmonar e profilatico.
- Trombose venosa.
- Coagulação intravascular disseminada.
- Tromboembolismo pulmonar e profilatico.
- Trombose venosa.
- Coagulação intravascular disseminada.
- Tromboembolismo pulmonar e profilatico.
- Trombose venosa.
Contraindicação
- Durante a Gravidez e Amamentação
- Não utilizar este produto para pacientes com alterações no sangue, coagulopatia grave, problemas hepático ou renais grave, endocardite bacteriana, hipertensão arterial grave.
- Durante a Gravidez e Amamentação
- Não utilizar este produto para pacientes com alterações no sangue, coagulopatia grave, problemas hepático ou renais grave, endocardite bacteriana, hipertensão arterial grave.
Como usar
Uso Injetável
Atenção: As doses e os intervalos entre elas são estabelecidos pelas provas de coagulação.
Adultos
- Profilaxia do embolismo: 5000 UI, via subcutânea 2 hs antes da cirurgia e a seguir a cada 12 hs, por aproximadamente 7 dias.
- Coagulação intravascular: 50 a 100 UI por Kg de peso corporal, via Intravenosa, a cada 4 hs.
Crianças
- Coagulação intravascular disseminada: 25 a 50 UI por Kg de peso corporal, VI, a cada 4 hs.
Precauções
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO Recomenda-se cuidado na utilização de CUTENOX® em pacientes com insuficiência hepática (no fígado), alterações da coagulação, história de úlcera péptica (estômago), acidente vascular cerebral (AVC) hemorrágico recente, hipertensão arterial grave sem tratamento (pressão alta), retinopatia diabética (visão dificultada causada por diabetes) e cirurgia recente no cérebro ou nos olhos Não é recomendada a utilização de CUTENOX® com medicamentos que afetam a hemostase (equilíbrio sanguíneo), tais como: Salicilatos sistêmicos, ácido acetilsalicílico e outros AINES (anti-inflamatórios não esteroidais), incluindo o cetorolaco; Dextran 40, ticlopidina e clopidogrel; Glicocorticóides sistêmicos; Agentes trombolíticos e anticoagulantes; Outros agentes antiplaquetários, incluindo os antagonistas de glicoproteína IIb/IIIa Em casos de indicação do uso de qualquer uma destas associações, deve-se utilizar CUTENOX® sob monitoramento clínico e laboratorial apropriados Informe ao médico se você está fazendo uso de algum outro medicamento Informe ao médico o aparecimento de reações indesejáveis BioChimico® 2 Não use medicamento sem o conhecimento do seu médico Pode ser perigoso para a sua saúde 5
Reações Adversas
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR REAÇÕES DESAGRADÁVEIS: informe ao médico o aparecimento de reações desagradáveis Podem ocorrer reações locais incluindo dor, hematomas (acúmulo de sangue nos tecidos logo abaixo da pele, causando uma mancha arroxeada) e irritação local leve após a administração subcutânea de enoxaparina sódica Raramente observa-se no local de aplicação da enoxaparina sódica a presença de nódulos endurecidos, que desaparecem após alguns dias e não devem ser motivo de interrupção do tratamento Foram relatados casos excepcionais de necrose (morte de tecidos) subcutânea no local de administração de heparina e heparinas de baixo peso molecular Reações alérgicas cutâneas consistindo em erupções bolhosas ou sistêmicas incluindo reações anafilactóides grave e potencialmente fatal) Em alguns casos, pode ser necessária a interrupção do tratamento Informe ao seu médico, cirurgião dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento Informe a empresa sobre o aparecimento de reações indesejáveis e problemas com este medicamento, entrando em contato através do SABIO – Serviço de Atendimento BioChimico (0800 023 89 99) 9
Composição
COMPOSIÇÃO CUTENOX® 20 mg: Cada seringa contém 20 mg de enoxaparina sódica e veículo (água para injeção) qsp 0,2 mL CUTENOX® 40 mg: Cada seringa contém 40 mg de enoxaparina sódica e veículo (água para injeção) qsp 0,4 mL CUTENOX® 60 mg: Cada seringa contém 60 mg de enoxaparina sódica e veículo (água para injeção) qsp 0,6 mL CUTENOX® 80 mg: Cada seringa contém 80 mg de enoxaparina sódica e veículo (água para injeção) qsp 0,8 mL II INFORMAÇÕES AO PACIENTE 1 PARA QUÊ ESTE MEDICAMENTO É INDICADO CUTENOX® é um medicamento que previne ou trata as doenças tromboembólicas, isto é, doenças em que o sangue coagula dentro das veias ou artérias, quando deveria manter-se fluido Situações como hospitalização prolongada ou diminuição da atividade física, associadas a fatores de risco, podem facilitar episódios de trombose venosa em membros inferiores ou de tromboembolia pulmonar Além disso, a trombose secundária aos eventos decorrentes de síndromes coronarianas agudas, isto é, angina instável ou alguns tipos de infarto agudo do miocárdio, podem ser minimizados pelo uso de enoxaparina 2
Superdosagem
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO A superdosagem acidental após a administração intravenosa, extracorporal ou subcutânea de CUTENOX complicações hemorrágicas Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações sobre como proceder III
Interação Medicamentosa
Medicamento-medicamento
Recomenda-se a interrupção do uso de medicamentos que afetam a hemostasia antes do início do tratamento com enoxaparina sódica (substância ativa deste medicamento), a menos que seu uso seja estritamente indicado. Tais medicamentos incluem:
- Salicilatos sistêmicos, ácido acetilsalicílico e outros AINEs, incluindo o cetorolaco;
- Dextrana 40, ticlopidina e clopidogrel;
- Glicocorticoides sistêmicos;
- Agentes trombolíticos e anticoagulantes;
- Outros agentes antiplaquetários, incluindo os antagonistas de glicoproteína IIb/IIIa.
Em caso de indicação do uso de qualquer uma destas associações, deve-se utilizar enoxaparina sódica (substância ativa deste medicamento) sob cuidadoso monitoramento clínico e laboratorial quando apropriado.
Medicamento-exame laboratorial
Nas doses utilizadas na profilaxia do tromboembolismo venoso, enoxaparina sódica (substância ativa deste medicamento) não influencia significativamente o tempo de sangramento e os testes de coagulação sanguínea global, nem afeta a agregação plaquetária ou a ligação do fibrinogênio às plaquetas.
Pode ocorrer aumento do tempo de tromboplastina parcial ativada (TTPa) e do tempo de coagulação ativada (TCA) com a administração de doses mais altas. Aumentos no TTPa e TCA não estão linearmente correlacionados ao aumento da atividade antitrombótica de enoxaparina sódica (substância ativa deste medicamento), sendo, portanto, inadequados e inseguros para monitoramento da atividade de enoxaparina sódica (substância ativa deste medicamento).
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados de eficácia
Cirurgia abdominal
Em um estudo duplo-cego em pacientes submetidos à cirurgia eletiva de tumores gastrointestinais, urológicos, ou do trato ginecológico, um total de 1116 pacientes foram incluídos e 1115 receberam profilaxia de TEV.
Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC, uma vez ao dia, começando 2h antes da cirurgia e continuado por um período de no máximo 12 dias após a cirurgia, teve sua eficácia comparada a da heparina não fracionada (HNF) 5000 U SC a cada 8h na redução do risco de trombose venosa profunda (TVP). Os dados de eficácia são apresentados abaixo [ver tabela 1] (Bergqvist et al, 1997).
Tabela 1 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após cirurgia abdominal
| Indicação | Regime | |
|
Enoxaparina sódica (substância ativa deste medicamento) | Heparina 5000 U SC cada 8h n (%) | |
| Todos os pacientes submetidos à cirurgia abdominal que receberam profilaxia | 555 (100) | 560 (100) |
| TEV total1 (%) | 56 (10,1) (95% IC2: 8 a 13) | 63 (11,3) (95% IC: 9 a 14) |
| Somente TVP (%) | 54 (9,7) (95% IC: 7 a 12) | 61 (10,9) (95% IC: 8 a 13) |
1 TEV: tromboembolismo venoso incluíram TVP, EP e óbitos considerados de causa tromboembólica.
2 IC: Intervalo de Confiança.
Em outro estudo duplo-cego, enoxaparina sódica (substância ativa deste medicamento) 40 mg SC uma vez ao dia foi comparado com HNF 5000 U SC a cada 8h, em pacientes submetidos à cirurgia colorretal (um terço deles com câncer).
Um total de 1347 pacientes foi incluído no estudo e todos receberam tratamento. A profilaxia foi iniciada aproximadamente 2h antes da cirurgia e continuada por aproximadamente 7 a 10 dias após a cirurgia. Os dados de eficácia são apresentados abaixo [ver tabela 2] (MacLeod RS et al, 2001).
Tabela 2 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após cirurgia de câncer colorretal
| Indicação | Regime | |
| Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC cada 24h n (%) | Heparina 5000 U SC cada 8h n (%) | |
| Todos os pacientes submetidos à cirurgia abdominal que receberam profilaxia | 555 (100) | 674 (100) |
| TEV total1 (%) | 48 (7,1) (95% IC2: 5 a 9) | 45 (6,7) (95% IC: 5 a 9) |
| Somente TVP (%) | 47 (7,0) (95% IC: 5 a 9) | 44 (6,5) (95% IC: 5 a 8) |
1 TEV: tromboembolismo venoso incluíram TVP, EP e óbitos considerados de causa tromboembólica.
2 IC: Intervalo de Confiança.
Artroplastia de quadril
Em um estudo duplo-cego, randomizado, enoxaparina sódica (substância ativa deste medicamento) 40 mg SC uma vez ao dia foi comparado com HNF 5000 U SC a cada 8h, após artroplastia total de quadril. A profilaxia foi iniciada 12h antes da cirurgia, no caso da enoxaparina, e 2h antes da cirurgia, no caso da heparina. Um total de 237 pacientes foram randomizados no estudo e receberam profilaxia. Os resultados de eficácia são mostrados na tabela abaixo [ver tabela 3] (Planes et al 1988).
Tabela 3 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após artroplastia total de quadril
| Indicação | Regime | |
| Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC cada 24h | Heparina 5000 U SC cada 8h | |
| TVP total | 12,5%1 | 25% |
| TVP proximal (%) | 7,5%2 | 18,5% |
1 Valor de p versus heparina: 0,03; redução de risco relativo de 50%.
2 Valor de p versus heparina: 0,014; redução de risco relativo de 59%.
Um estudo duplo-cego, multicêntrico, comparou três regimes de dose de enoxaparina sódica (substância ativa deste medicamento) em pacientes submetidos à artroplastia de quadril. Um total de 572 pacientes foram randomizados e 568 receberam a profilaxia proposta.
Profilaxia com enoxaparina sódica (substância ativa deste medicamento) foi iniciada 2 dias após a cirurgia e continuou por 7 a 11 dias após a cirurgia. Os dados de eficácia são fornecidos abaixo [ver tabela 4] (Spiro et al, 1994).
Tabela 4 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de TVP após cirurgia de artroplastia de quadril


1 Valor de p versus enoxaparina sódica (substância ativa deste medicamento) 10 mg cada 24h: 0,0008.
2 Valor de p versus enoxaparina sódica (substância ativa deste medicamento) 10 mg cada 24h: 0,0168.
Não houve diferença significativa entre os regimes de 30 mg cada 12h e 40 mg cada 24h.
Em um estudo de profilaxia estendida para pacientes submetidos à artroplastia de quadril, os pacientes receberam durante a internação, enoxaparina sódica (substância ativa deste medicamento) 40 mg SC iniciado 12h antes da cirurgia para prevenir TVP pósoperatória.
Ao final do período perioperatório, todos os pacientes foram submetidos à venografia bilateral.
Seguindo um desenho duplo-cego, todos os pacientes sem evidência de doença tromboembólica foram randomizados para um regime pós-alta de enoxaparina sódica (substância ativa deste medicamento) 40 mg (n = 90) por via SC, uma vez ao dia ou de placebo (n = 89) por 3 semanas. Nessa população de pacientes, a incidência de TVP durante a fase de profilaxia estendida foi significativamente mais baixa no grupo que recebeu enoxaparina sódica (substância ativa deste medicamento) comparado ao placebo. Os dados de eficácia são apresentados na tabela abaixo [ver tabela 5] (Planes et al 1996).
Tabela 5 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia estendida de TVP após artroplastia de quadril
| Indicação (Pós-alta) | Regime pós-alta | |
| Enoxaparina sódica (substância ativa deste medicamento) 40 mg SC cada 24h n (%) | Placebo SC cada 24h n (%) | |
| Todos os pacientes com profilaxia estendida | 90 (100) | 89 (100) |
| TVP total (%) | 6 (7)1 (95% IC2: 3 a 14) | 18 (20) (95% IC: 12 a 30) |
| TVP proximal (%) | 5 (6)3 (95% IC: 2 a 13) | 7 (8) (95% IC: 3 a 16) |
1 Valor de p versus placebo: 0,008.
2 IC: Intervalo de confiança.
3 Valor de p versus placebo: 0,537.
Em um segundo estudo, pacientes submetidos à artroplastia de quadril receberam durante a hospitalização enoxaparina sódica (substância ativa deste medicamento) 40 mg SC, iniciado 12h antes da cirurgia. Todos os pacientes foram examinados em busca de sinais e sintomas de doença tromboembólica. Pacientes sem qualquer sinal de TEV foram randomizados para um regime pós-alta com enoxaparina sódica (substância ativa deste medicamento) 40 mg SC uma vez ao dia (n = 131) ou placebo (n = 131) por 3 semanas. Um total de 262 pacientes foram randomizados nessa fase duplo-cega. De modo semelhante ao primeiro estudo, a incidência de TVP durante a profilaxia estendida foi significativamente menor com enoxaparina sódica (substância ativa deste medicamento) quando comparado ao placebo, com diferença estatisticamente significativa tanto na incidência TVP total (enoxaparina sódica (substância ativa deste medicamento) [16%] versus placebo 45 [34%]; p = 0,001) quanto na de TVP proximal (enoxaparina sódica (substância ativa deste medicamento) 8 [6%] versus placebo 28 [21%]; p = <0,001) (Bergqvist et al, 1996).
Artroplastia de joelho
Um total de 132 pacientes foram randomizados no estudo e 131 receberam profilaxia. Após hemostasia, profilaxia foi iniciada 12 a 24h após a cirurgia e continuada por até 15 dias. A incidência de TVP total e proximal após cirurgia foi significativamente mais baixa no grupo que recebeu enoxaparina sódica (substância ativa deste medicamento) comparado ao placebo. Os dados de eficácia são mostrados abaixo [ver tabela 6] (Leclerc et al, 1992).
Tabela 6 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) na profilaxia de trombose venosa profunda após artroplastia total de joelho
| Indicação | Regime | |
|
Enoxaparina sódica (substância ativa deste medicamento) 30 mg n (%) |
Placebo q12h SC n (%) | |
| Todos os pacientes submetidos a artroplastia de joelho | 47 (100) | 52 (100) |
| TVP Total (%) | 5 (11)1 (95% IC2: 1 a 21) | 32 (62) (95% IC: 47 a 76) |
| TVP proximal (%) | 0 (0)3 (95% LC superior4: 5) | 7 (13) (95% IC: 3 a 24) |
1 Valor de p versus placebo: 0,0001.
2 IC: Intervalo de Confiança.
3 Valor de p versus placebo: 0,013.
4 LC: Limite de Confiança.
Ainda em artroplastia eletiva de joelho, outro estudo clínico aberto, de grupos paralelos, randomizado, comparou enoxaparina sódica (substância ativa deste medicamento) 30 mg SC a cada 12h com heparina 5000 U SC a cada 8h. Um total de 453 pacientes foram randomizados e todos receberam profilaxia conforme o grupo designado. A profilaxia iniciou-se após a cirurgia e continuou até 14 dias. A incidência de trombose venosa profunda foi significativamente menor com enoxaparina sódica (substância ativa deste medicamento), comparada com heparina (Cowell et al, 1995).
Profilaxia de tromboembolismo em pacientes clínicos com mobilidade reduzida durante doença aguda
Em um estudo multicêntrico, duplo-cego, de grupos paralelos, enoxaparina sódica (substância ativa deste medicamento) 20 mg ou 40 mg SC uma vez ao dia foi comparado com placebo na profilaxia de TVP em pacientes clínicos com mobilidade restrita durante uma doença aguda (definida como distância percorrida <10 metros em tempo ? 3 dias).
Esse estudo incluiu pacientes com insuficiência cardíaca (NYHA Classe funcional III ou IV); insuficiência respiratória aguda ou insuficiência respiratória crônica complicada (sem necessidade de suporte ventilatório): infecção aguda (exceto choque séptico) ou doença reumatológica aguda. Um total de 1102 pacientes foi incluído no estudo, e 1073 pacientes receberam profilaxia. A terapia foi continuada por até 14 dias (media de duração de 7 dias). Quando administrado numa dose de 40 mg SC 1x/dia, enoxaparina sódica (substância ativa deste medicamento) reduziu significativamente a incidência de TVP comparado ao placebo. Dados de eficácia são mostrados abaixo [ver tabela 7] (Samama et al, 1999).
Tabela 7 - Eficácia do enoxaparina sódica (substância ativa deste medicamento) em pacientes clínicos com mobilidade reduzida durante doença aguda
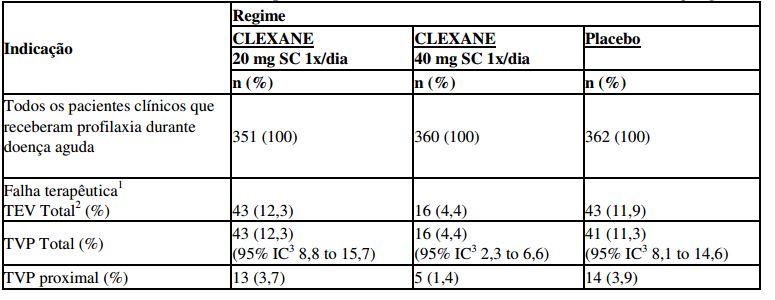
1 Falha terapêutica durante os dias 1 e 14.
2 TEV: Eventos tromboembólicos, os quais incluem TVP, EP e óbito considerado de origem embólica.
3 IC: Intervalo de Confiança
O tratamento profilático com enoxaparina sódica (substância ativa deste medicamento) 40 mg SC ao dia reduziu em 63% o risco de TEV. Em aproximadamente 3 meses após a inclusão, a incidência de tromboembolismo permaneceu significativamente mais baixa no grupo que recebeu enoxaparina sódica (substância ativa deste medicamento) 40 mg versus o grupo placebo.
Tratamento de trombose venosa profunda (TVP) com ou sem embolia pulmonar (EP)
Em um estudo multicêntrico, de grupos paralelos, 900 pacientes com TVP aguda de membro inferior associada ou não à embolia pulmonar foram randomizados para tratamento hospitalar com enoxaparina sódica (substância ativa deste medicamento) 1,5 mg/kg SC 1x/dia, enoxaparina sódica (substância ativa deste medicamento) 1 mg/kg SC cada 12h ou heparina em bolus (5000 UI) seguido de infusão contínua (administrada até atingir um TTPa de 55 a 85 segundos). Todos os pacientes receberam tratamento. Todos os pacientes também receberam varfarina sódica (dose ajustada de acordo com o TP para atingir um RNI (relação normatizada internacional) entre 2 e 3), a partir de 72h do início da terapia com enoxaparina sódica (substância ativa deste medicamento) ou HNF. Enoxaparina sódica (substância ativa deste medicamento) ou HNF foram administrados por no mínimo 5 dias e até que o RNI desejado fosse atingido.
Ambos os regimes de enoxaparina sódica (substância ativa deste medicamento) foram equivalentes à terapia com HNF em reduzir o risco de TEV recorrente. Os dados de eficácia são mostrados abaixo [ver tabela 8] (Merli et al, 2001).
Tabela 8 - Eficácia de enoxaparina sódica (substância ativa deste medicamento) no tratamento da trombose venosa profunda com ou sem embolia pulmonar
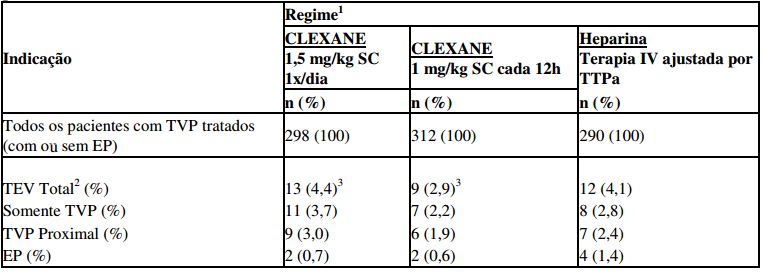
1 Todos os pacientes também foram tratados com varfarina sódica a partir de 72h do início do tratamento com enoxaparina sódica (substância ativa deste medicamento) ou heparina padrão.
2 TEV: evento tromboembólico (trombose venosa profunda [TVP] e/ou embolia pulmonar [EP]).
Os intervalos de confiança de 95% para a diferença de tratamento no TEV total foram: Enoxaparina Sódica (substância ativa deste medicamento) 1x/dia versus heparina (-3,0 a 3,5).
Enoxaparina Sódica (substância ativa deste medicamento) cada 12h versus heparina (-4,2 a 1,7).
Hemodiálise
Em um estudo, pacientes com insuficiência renal terminal (n=36) fazendo hemodiálise 3 vezes por semana, receberam Enoxaparina Sódica (substância ativa deste medicamento) ou HNF e depois foram trocados para o outro tratamento, a cada 12 semanas.
Enoxaparina 1 mg/kg foi administrada na forma de bolus dentro da linha arterial antes da diálise. Doses subsequentes de enoxaparina eram reduzidas para 0,2 mg/kg caso ocorresse sangramento. HNF 50 UI/kg foi administrada na forma de bolus dentro da linha arterial, seguida por uma dose de manutenção de 1000 UI/hora.
As linhas e filtros de diálise ficaram significativamente mais limpas (sem coágulos) com Enoxaparina Sódica (substância ativa deste medicamento) em comparação com HNF (p<0,001) (Saltissi et al, 1999).
Tratamento de angina instável e infarto do miocárdio (IM) sem elevação do segmento ST (Cohen et al, 1997)
Em um grande estudo multicêntrico, 3171 pacientes incluídos na fase aguda de angina instável ou IM sem elevação do segmento ST foram randomizados para receber, em associação com ácido acetilsalicílico (100 a 325 mg, uma vez ao dia), 1 mg/kg de enoxaparina sódica em injeção subcutânea a cada 12 horas, ou HNF por administração IV, ajustada com base no tempo de tromboplastina parcial ativada (TTPa). Os pacientes foram tratados em ambiente hospitalar por um período mínimo de 2 e máximo de 8 dias, até estabilização clínica, procedimentos de revascularização ou alta hospitalar. Os pacientes foram acompanhados por 30 dias. A enoxaparina sódica, em comparação à HNF, diminuiu significativamente a incidência de angina recorrente, IM e óbito, com redução do risco relativo de 16,2% no 14º dia, sustentado durante o período de 30 dias. Além disto, um número menor de pacientes do grupo tratado com enoxaparina sódica foi submetido à revascularização por angioplastia coronariana transluminal percutânea (ACTP) ou por enxerto de ponte arterial coronariana (15,8% de redução do risco relativo no 30º dia).
Tratamento do IM com elevação do segmento ST (Antman et al, 2006)
Em um grande estudo multicêntrico, 20479 pacientes diagnosticados com IM com elevação do segmento ST, elegíveis para receber terapia fibrinolítica, foram randomizados para receber: 1) enoxaparina sódica em bolus IV único de 30 mg acompanhado de 1 mg/kg por via SC, seguido de doses SC de 1 mg/kg a cada 12 horas; ou, 2) HNF por administração IV, ajustada com base no tempo de TTPa por 48 horas. Todos os pacientes também foram tratados com ácido acetilsalicílico por um período mínimo de 30 dias. A estratégia posológica de enoxaparina foi ajustada para pacientes acometidos por insuficiência renal severa e para pacientes idosos com idade maior ou igual a 75 anos. As injeções SC de enoxaparina foram administradas por um período máximo de 8 dias ou até que o paciente recebesse alta do hospital (considerando o que ocorresse primeiro).
Em um subgrupo deste mesmo estudo, 4716 pacientes foram submetidos à intervenção coronariana percutânea (ICP) recebendo suporte antitrombótico com fármaco do estudo de modo cego. Portanto, para pacientes que utilizaram a enoxaparina, a ICP foi realizada com enoxaparina (sem troca) utilizando-se o regime estabelecido em estudos prévios, ou seja, caso a última dose SC tenha sido administrada há menos de 8 horas antes de o balão ser inflado, não se administra dose adicional e caso a última dose subcutânea tenha sido administrada há mais de 8 horas antes de o balão ser inflado, administra-se uma dose adicional de 0,3 mg/kg através de bolus intravenoso.
A enoxaparina sódica quando comparada com a HNF reduziu significativamente a incidência do desfecho primário, uma combinação de morte por qualquer causa ou reinfarto do miocárdio nos primeiros 30 dias após a randomização [9,9% no grupo tratado com enoxaparina, comparado a 12,0% no grupo tratado com heparina nãofracionada] com uma redução relativa do risco igual a 17% (P<0,001).
Os benefícios do tratamento com enoxaparina, evidenciados por uma série de resultados de eficácia, surgiram em 48 horas, tempo no qual houve uma redução de 35% do risco relativo de reinfarto do miocárdio, quando comparado com o tratamento com HNF (P<0,001).
O efeito benéfico da enoxaparina no desfecho primário foi consistente entre os subgrupos principais do estudo, incluindo idade, sexo, local do infarto, histórico de diabetes, histórico de infarto do miocárdio anterior, tipo do fibrinolítico administrado e tempo para tratamento com o fármaco em estudo.
Houve um benefício significativo do tratamento com enoxaparina, quando comparado com o tratamento com HNF, em pacientes submetidos à ICP dentro de 30 dias após a randomização (23% de redução do risco relativo) ou em pacientes tratados com terapia medicamentosa (15% de redução do risco relativo, P = 0,27 para interação).
A incidência do desfecho composto de morte, reinfarto do miocárdio ou hemorragia intracraniana (uma medida do benefício clínico líquido), considerando-se os 30 primeiros dias, foi significativamente menor (p<0,0001) no grupo tratado com enoxaparina (10,1%) quando comparado com o grupo tratado com HNF (12,2%), representando uma redução de 17% do risco relativo em favor do tratamento com Enoxaparina Sódica (substância ativa deste medicamento).
O efeito benéfico da enoxaparina no desfecho primário, observado durante os primeiros 30 dias, foi mantido por um período de acompanhamento de 12 meses.
Características farmacológicas
Propriedades farmacodinâmicas
O princípio ativo de enoxaparina sódica (substância ativa deste medicamento) é a enoxaparina sódica. Trata-se de uma heparina de baixo peso molecular com peso médio de 4.500 dáltons. A enoxaparina sódica é um sal de sódio. A distribuição do peso molecular é:
| < 2000 dáltons | ? 20% |
| 2000 a 8000 dáltons | ? 68% |
| > 8000 dáltons | ? 18% |
A enoxaparina sódica é obtida pela despolimerização alcalina do éster benzil heparina derivado da mucosa intestinal suína. Sua estrutura é caracterizada por um grupo ácido 2-O-sulfo-4 enepiranosurônico no final não redutor da cadeia e um 2-N, 6-O-dissulfo-D-glicosamina no final redutor da cadeia. Aproximadamente 20% (variando entre 15% e 25%) da estrutura da enoxaparina contêm um derivado 1,6 anidro no final redutor da cadeia polissacarídica.
Em um sistema purificado in vitro, a enoxaparina sódica apresenta alta atividade anti-Xa (aproximadamente 100 UI/mg) e baixa atividade anti-IIa ou antitrombina (aproximadamente 28 UI/mg).
Estas atividades anticoagulantes são mediadas por antitrombina III (ATIII) resultando em atividade antitrombótica em humanos.
Além da sua atividade anti-Xa/IIa, as propriedades antitrombótica e anti-inflamatória da enoxaparina foram identificadas em indivíduos saudáveis e em pacientes, bem como em modelos não clínicos.
Estes incluem inibição ATIII-dependente de outros fatores de coagulação, como fator VIIa, indução da liberação do inibidor da Via do Fator Tecidual endógeno, assim como uma liberação reduzida de fator de von Willebrand do endotélio vascular para a circulação sanguínea. Estes fatores são conhecidos por contribuir para o efeito antitrombótico global da enoxaparina.
Propriedades farmacocinéticas:
Características gerais
Os parâmetros farmacocinéticos da enoxaparina sódica foram estudados principalmente com relação ao tempo da atividade plasmática anti-Xa e também com relação à atividade anti-IIa, nos intervalos de dose recomendados após administrações subcutâneas únicas e repetidas e após administração intravenosa única.
A determinação quantitativa das atividades farmacocinéticas anti-Xa e anti-IIa foi realizada por métodos amidolíticos validados com substratos específicos e com a enoxaparina padrão calibrada contra o padrão internacional para heparinas de baixo peso molecular (NIBSC).
Biodisponibilidade e absorção
A biodisponibilidade absoluta da enoxaparina sódica após administração subcutânea, baseada na atividade anti-Xa, é próxima de 100%. Os volumes de injeção e concentração de doses no intervalo de 100–200 mg/mL não afetam os parâmetros farmacocinéticos em voluntários saudáveis.
A máxima atividade anti-Xa plasmática média é observada 3 a 5 horas após administração subcutânea alcançando, aproximadamente, 0,2; 0,4; 1,0 e 1,3 UI anti-Xa/mL após administração subcutânea de doses únicas de 20 mg, 40 mg, 1 mg e 1,5 mg/kg, respectivamente.
Um bolus intravenoso de 30 mg seguido imediatamente por uma dose subcutânea de 1 mg/kg a cada 12 horas forneceu um pico inicial de níveis de fator anti-Xa igual a 1,16 UI/mL (n = 16) e uma exposição média correspondente a 88% dos níveis do estado de equilíbrio. O estado de equilíbrio é alcançado no segundo dia de tratamento.
A farmacocinética da enoxaparina parece ser linear nos intervalos de dose recomendados. A variabilidade intra e interpacientes é baixa. Após repetidas administrações subcutâneas de 40 mg, uma vez ao dia, e de 1,5 mg/kg uma vez ao dia, em voluntários saudáveis, o estado de equilíbrio é alcançado no 2° dia, com uma taxa de exposição média aproximadamente 15% maior do que após a administração de dose única. O nível de atividade da enoxaparina no estado de equilíbrio é bem previsível pela farmacocinética de dose única. Após administrações subcutâneas repetidas de 1 mg/kg, num regime de 2 vezes ao dia, o estado de equilíbrio é alcançado entre o 3° e o 4° dia, com uma exposição média aproximadamente 65% maior do que após administração de dose única, e as concentrações máxima e mínima médias de aproximadamente 1,2 e 0,52 UI/mL, respectivamente. Baseada na farmacocinética da enoxaparina sódica, esta diferença no estado de equilíbrio é esperada e está dentro do intervalo terapêutico.
A atividade plasmática anti-IIa após a administração subcutânea é aproximadamente 10 vezes menor do que a atividade anti-Xa. A máxima atividade anti-IIa média é observada aproximadamente 3-4 horas após administração subcutânea e alcança 0,13 UI/mL e 0,19 UI/mL após administração repetida de 1 mg/kg, duas vezes ao dia e de 1,5 mg/kg, uma vez ao dia, respectivamente.
Distribuição
O volume de distribuição da atividade anti-Xa da enoxaparina sódica é de aproximadamente 5 L e é próximo do volume sanguíneo.
Metabolismo
A enoxaparina é metabolizada principalmente no fígado por dessulfatação e/ou despolimerização formando moléculas de peso menor, que apresentam potência biológica muito reduzida.
Eliminação
A enoxaparina sódica é um fármaco de baixa depuração, com média de clearance plasmático anti-Xa de 0,74 L/h após infusão intravenosa de 1,5 mg/kg em 6 horas.
A eliminação parece ser monofásica, com meia-vida de aproximadamente 4 horas após uma dose subcutânea única, e até aproximadamente 7 horas após doses repetidas.
O clearance renal dos fragmentos ativos representa aproximadamente 10% da dose administrada e a excreção renal total dos fragmentos ativos e não-ativos é de 40% da dose.
Características em Populações Especiais:
Idosos
Com base nos resultados da análise farmacocinética populacional, o perfil cinético da enoxaparina sódica não é diferente em voluntários idosos comparados a voluntários jovens quando a função renal é normal.
Entretanto, como é conhecido que a função renal diminui com o aumento da idade, pacientes idosos podem apresentar retardo na eliminação da enoxaparina sódica.
Insuficiência renal
Observou-se uma relação linear entre o clearance plasmático de anti-Xa e o clearance de creatinina no estado de equilíbrio, o que indica um decréscimo do clearance da enoxaparina sódica em pacientes com função renal reduzida. A exposição anti-Xa representada pela AUC (área sob a curva), no estado de equilíbrio, é levemente aumentada na insuficiência renal leve (clearance decreatinina 50 – 80 mL/min) e moderada (clearance de creatinina 30 – 50 mL/min) após repetidas doses subcutâneas de 40 mg, uma vez ao dia.
Em pacientes com insuficiência renal severa (clearance de creatinina < 30 mL/min), a AUC no estado de equilíbrio é significativamente aumentada em média em 65% após repetidas doses únicas diárias subcutâneas de 40 mg.
Peso
Após repetidas doses subcutâneas de 1,5 mg/kg, uma vez ao dia, a AUC média de atividade anti-Xa é levemente maior no estado de equilíbrio em voluntários saudáveis obesos (IMC 30 – 48 kg/m2) em comparação aos voluntários controle não-obesos, embora a atividade máxima observada não tenha aumentado. Há menor clearance ajustado ao peso em voluntários obesos tratados com doses subcutâneas.
Quando se administram doses não ajustadas ao peso, a exposição da atividade anti-Xa é 52% maior em mulheres de peso baixo (< 45 kg) e 27% maior em homens de peso baixo (< 57 kg), após uma dose subcutânea única de 40 mg, quando comparada aos voluntários controle com peso normal.
Hemodiálise
Em um único estudo, a taxa de eliminação apresentou-se semelhante, porém a AUC foi duas vezes maior que na população controle, após uma dose intravenosa única de 0,25 ou 0,50 mg/kg.
Interações farmacocinéticas
Não foram observadas interações farmacocinéticas entre a enoxaparina e trombolíticos quando administrados concomitantemente.
Dados de Segurança Pré-Clínicos
Não foram realizados estudos de longa duração em animais para avaliar o potencial carcinogênico da enoxaparina.
A enoxaparina não se mostrou mutagênica em testes in vitro, incluindo o teste Ames, o teste de mutação de células de linfoma em camundongos, o teste de aberração cromossômica linfocítica em humanos e os testes in vivo de aberração cromossômica na medula óssea de ratos.
Demonstrou-se que a enoxaparina não tem nenhum efeito na fertilidade ou no desempenho reprodutivo de ratos machos e fêmeas em doses subcutâneas de até 20 mg/kg/dia. Estudos teratológicos foram conduzidos em ratas e coelhas prenhes em doses subcutâneas de enoxaparina de até 30 mg/kg/dia. Não houve nenhuma evidência de efeitos teratogênicos ou fetotoxicidade devido à enoxaparina.
Além dos efeitos anticoagulantes da enoxaparina, não houve evidência de efeitos adversos em doses de 15 mg/kg/dia em 13 semanas de estudos de toxicidade subcutânea, ambos em ratos e cães e em doses de 10 mg/kg/dia em 26 semanas de estudos de toxicidade subcutânea e intravenosa ambos em ratos e macacos.
Cuidados de Armazenamento
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO CUTENOX® deve ser conservado dentro da embalagem original, em temperatura ambiente (entre 15° e 30°C) e protegido da luz Prazo de validade: 24 meses a partir da data de fabricação Não utilize CUTENOX® caso haja sinais de violação da embalagem externa Antes de usar, observe o aspecto do medicamento, CUTENOX® apresenta-se como uma solução límpida que pode variar de incolor a levemente amarelada Caso você observe alguma mudança no aspecto do medicamento que ainda esteja no prazo de validade, consulte o médico ou o farmacêutico para saber se poderá utilizá-lo Não use medicamento com prazo de validade vencido Número de lote e datas de fabricação e validade: vide embalagem TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS 6
Dizeres Legais
DIZERES LEGAIS Registro MS 1 0063 0188 Farm Resp: Rafael Nunes Princesval - CRF- RJ Fabricado por: Gland Pharma Ltd , Hyderabad, Andhra Pradesh Importado por: Instituto BioChimico Ind Farm Limitada Rua Antonio João, 168, 194 e 218 – Cordovil CNPJ: 33258401/0001-03 – Indústria Brasileira SABIO – Serviço Atendimento BioChimico: 0800 023 89 99 sábio@biochimico ind br VENDA SOB PRESCRIÇÃO MÉDICA 400 5092-16 17295 - Índia – Rio de Janeiro / RJ BioChimico® 4 (reação alérgica ® pode causar