Filgrastim 300mcg, caixa com 5 frascos-ampola com 1mL de solução na Pharmed
Filgrastim - Filgrastima 300Mcg 1Ml C 5

Filgrastim 300mcg, caixa com 5 frascos-ampola com 1mL de solução na Pharmed
Não encontramos este produto para a Pharmed no Cliquefarma.
Confira os menores preços para Filgrastim - Filgrastima 300Mcg 1Ml C 5

Filgrastim - Filgrastima 300Mcg 1Ml C 5
83.70%
R$ 743,70
Life Medicamentos
83.70%
R$ 743,70
Imune Farma Medicamentos Especiais
83.70%
R$ 743,80
Farma Ame
83.69%
R$ 743,85
Aliria Medicamentos Especiais
83.64%
R$ 746,25
Para que serve
Filgrastim está indicado:
- em pacientes com câncer que recebem quimioterapia mielossupressora, ou seja, que afeta a produção de células sanguíneas na medula;
- em pacientes com câncer submetidos a transplante de medula óssea;
- em pacientes com neutropenia crônica grave (neutropenia congênita grave, neutropenia cíclica ou neutropenia idiopática), ou seja, com diminuição crônica das células de defesa do sangue;
- na neutropenia (diminuição das células de defesa do sangue) associada a AIDS.
COMO ESTE MEDICAMENTO FUNCIONA?
O filgrastim é um estimulante do sangue que auxilia a produção de células brancas sanguíneas, o que irá ajudar a prevenir infecções durante o tratamento do câncer (quimioterapia).
O filgrastim aumenta consideravelmente o número de células brancas chamadas neutrófilos no sangue periférico 24 horas após sua administração.
Contraindicação
O filgrastim não deve ser administrado em pacientes com alergia ao filgrastim, a proteínas derivadas da E. coli e/ou a qualquer outro componente do medicamento.
Não deve ser administrado em pacientes portadores de neutropenia congênita grave (Síndrome de Kostman) que apresentam anomalias citogenéticas.
Não deve administrado 24 horas (1 dia) antes ou após a quimioterapia ou radioterapia.
Como usar
Instruções de uso
Seu médico irá prescrever a dose exata e irá lhe dizer com que frequência você deve tomá-la.
O filgrastim pode ser administrado por injeção intravenosa ou subcutânea. Uma enfermeira, você ou outra pessoa treinada pode ser responsável pela aplicação da injeção.
Para ser eficaz, este produto deve ser utilizado seguindo todas as recomendações de seu médico, principalmente quanto ao modo de usar e duração do tratamento.
Se você for fazer a aplicação, certifique-se que entendeu corretamente as instruções de como o filgrastim deve ser aplicado:
- Não use maior quantidade ou mais frequentemente que o recomendado pelo seu médico.
- Aplique o medicamento sempre em locais diferentes do seu corpo.
- Não agite o frasco. Não utilize o medicamento caso você observe alguma partícula dentro do frasco.
- Troque sempre a seringa a cada aplicação. Você não deve utilizar a seringa e a agulha mais de uma vez.
- Não reutilizar o frasco-ampola após retirar a dose a ser administrada. Desprezar o resto do produto.
Instruções de diluição
Se necessário, o filgrastim pode ser diluído em solução de glicose a 5%. Uma vez diluído, o produto pode ser adsorvido por vidro ou materiais plásticos. Entretanto, se a diluição for realizada conforme as instruções a seguir, o preparado é compatível com vidro e com uma variedade de materiais plásticos, como PVC, poliolefina (copolímero do polipropileno e polietileno) e polipropileno.
Quando o produto for diluído a uma concentração inferior a 1,5 MUI/ml (15 mcg/ml) de filgrastim, deve- se adicionar albumina sérica humana até uma concentração final de 2 mg/ml.
Por exemplo: para um volume de injeção final de 20 ml, deve-se adicionar 0,2 ml de uma solução de albumina humana a 20% a doses de filgrastim inferiores a 30 MUI (300 mcg).
Não se recomenda diluir a uma concentração final inferior a 0,2 MUI/ml (2 mcg/ml).
Nunca diluir o produto com solução salina, já que pode precipitar.
Não reutilizar o frasco-ampola após retirar a dose a ser administrada. Desprezar o resto do produto. Incompatibilidade: não se deve diluir o fligrastim em soluções salinas.
Posologia
Pacientes submetidos a quimioterapia mielossupressora
A dose recomendada de filgrastim é de 0,5 MUI (5 mcg)/kg/dia. A dose inicial de filgrastim deve ser administrada apenas 24 horas após a quimioterapia citotóxica. O filgrastim é administrado por via subcutânea ou infusão intravenosa (30 minutos). Deve-se continuar a administração diária de filgrastim até que a contagem de neutrófilos tenha se normalizado após superar o nadir de neutrófilos esperado. Em geral o tempo de tratamento é de 14 dias, podendo variar de acordo com o tipo, dose e protocolo da quimioterapia citotóxica aplicada. Os pacientes submetidos a quimioterapia citotóxica apresentam um aumento típico e transitório dos neutrófilos 1-2 dias após o início do tratamento com filgrastim. Entretanto, para manter a resposta terapêutica, o tratamento com filgrastim não deve ser interrompido até que a contagem de neutrófilos tenha se normalizado após superar o nadir de neutrófilos esperado. A descontinuação prematura do tratamento com filgrastim antes de alcançar o nadir neutrofílico não é recomendada.
Se necessário, pode-se aumentar a dose em incrementos de 5 mcg/kg por cada ciclo de quimioterapia.
Pacientes submetidos a transplante autólogo de medula óssea
A dose inicial recomendada de filgrastim é de 1,0 MUI (10 mcg)/kg/dia, por infusão intravenosa (foram utilizadas diversas durações: cerca de 30 minutos, 4 horas ou 24 horas) ou subcutânea (24 horas), usualmente por até 21 dias, começando 2 a 4 horas após a infusão da medula óssea mas não antes de 24 horas após a última dose de quimioterapia. Não se conhece a eficácia e segurança da administração de filgrastim durante períodos superiores a 28 dias neste grupo de pacientes.
Uma vez superado a contagem mais baixa das células de defesa, quando a mesma retorna a níveis de 1,0 x 109/l, a dose diária de filgrastim pode ser reduzida para 0,5 MUI (5 mcg)/kg/dia.
Se a contagem dos neutrófilos exceder 1,0 x 109/l por mais de três dias consecutivos, a terapia com filgrastim deve ser descontinuada. Se a contagem de neutrófilos diminuir para abaixo deste valor, pode-se manter a dose em 5 mcg/kg/ dia.
Se a contagem de neutrófilos diminuir para menos de 1,0 x 109/l, enquanto o paciente recebe uma dose de 5 mcg/kg/dia, esta pode aumentada para 1,0 MUI (10 mcg)/kg/dia.
Pacientes com neutropenia crônica grave
Neutropenia congênita
A dose recomendada é de 1,2 MUI (12 mcg)/kg/dia em uma única dose ou em doses divididas por via subcutânea. Ajustar de acordo com a resposta obtida.
Neutropenia cíclica ou idiopática
A dose recomendada é de 0,5 MUI (5 mcg)/kg/dia. É necessário realizar ajustes periódicos da dose para manter a contagem de neutrófilos entre 1.500 e 10.000 neutrófilos/mm3.
Pacientes com neutropenia associada a AIDS
A dose inicial recomendada é de 0,1 MUI (1 mcg)/kg/dia, aumentando, se necessário, até que a contagem de neutrófilos alcance valores normais (usualmente até um máximo de 0,4 MUI/kg/dia). Em seguida, ajustar a dose até manter a contagem de neutrófilos dentro dos valores normais.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
É importante que você receba cada dose deste medicamento de acordo com o esquema posológico. Avise seu médico, farmacêutico, clínica ou enfermeira para instruções se você esqueceu uma dose.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Avise seu médico se você possui alguma doença do sangue ou problemas de pele como psoríase.
Este medicamento pode causar reações alérgicas graves que podem ameaçar a vidar e necessitar de intervenção médica imediata.
Avise seu médico imediatamente se você apresentar rash (vermelhidão), coceira, inchaço da face, língua e garganta, dificuldade para respirar ou dor no peito após a injeção.
Você deverá fazer exames de sangue rotineiramente enquanto estiver usando este medicamento.
Esse medicamento pode causar ruptura no baço em raras ocasiões. Avise seu médico imediatamente caso você apresente dor na parte superior esquerda da barriga, ou dor no ombro/costas do lado esquerdo, pois podem ser sinais de aumento do baço ou ruptura.
Em pacientes com anemia falciforme, o uso de filgrastim pode gerar a manifestação de crises graves de falcização.
Este medicamento algumas vezes é usado para auxiliar a prevenção de infecções durante o tratamento do câncer.
Se você acha que tem uma infecção ou apresenta febre, avise seu médico imediatamente. Alguns sinais de infecção são febre, calafrios, cansaço, fraqueza ou dor de garganta.
Reações Adversas
Avise seu médico imediatamente se você observar qualquer um destes eventos adversos:
- Reações alérgicas: coceira ou urticária, inchaço na face ou mãos, inchaço ou formigamento da boca ou garganta, aperto no peito, dificuldade para respirar.
- Língua ou unhas azuis.
- Alteração na quantidade ou frequencia que você urina.
- Dor no peito.
- Batimentos cardíacos rápidos, lentos ou irregulares.
- Febre.
- Atordoamento ou desmaio.
- Dor no lado esquerdo ou ombro ou sensação de sentir-se cheio.
- Urina vermelha ou marrom-escura.
- Respiração lenta ou curta ou tosse com sangue.
- Dor no estômago.
- Inchaço nas mãos, tornozelos ou pés.
- Sangramentos incomuns, machucados ou fraqueza.
- Amarelamento da pele ou do branco dos olhos.
Avise seu médico se você observar estes eventos adversos menos graves:
- Dor nos ossos, articulações ou músculos.
- Queda de cabelo.
- Dor de cabeça.
- Náusea, vômito.
- Dor, vermelhidão, coceira, queimação, inchaço ou caroço embaixo da sua pela no lugar da aplicação.
- Rash cutâneo ou coceira.
Avise seu médico se você observar outros eventos adversos que você acha que foram causados por este medicamento.
Os eventos adversos relatados com maior frequência foram febre, fadiga, dor de cabeça e dor muscular. A febre e a fadiga foram geralmente reversíveis após 72 horas da interrupção do tratamento. As reações adversas listadas na Tabela 1 baseiam-se na experiência em estudos clínicos e pós-comercialização. A seguinte convenção foi utilizada para classificar as frequências: muito comum (ocorre em 10% dos pacientes que utilizam este medicamento); comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento); rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento); muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento); desconhecida. Os eventos adversos são apresentados por ordem decrescente de gravidade dentro de cada classe de frequência.
|
Tabela 1 - Reações adversas notificadas durante estudos clínicos ou pós- comercialização do filgrastim | |
|
Classe de sistema de órgãos |
Reações adversas |
|
Afecções hematológicas e do sistema linfático Muito comum: Desconhecida: |
Anemia, leucocitose, síndrome mielodisplásica, trombocitopenia Crise de falcização em pacientes predispostos, histiocitose |
|
Afecções do sistema imunológico Rara: Desconhecida: |
Reação alérgica ao filgrastim Anafilaxia |
|
Afecções do sistema endócrino Comum: Desconhecida: |
Hiperuricemia (aumento do ácido úrico) Hipotireoidismo (diminuição da função da tireóide) |
|
Afecções do sistema nervoso Muito comum: Desconhecida: |
Dor de cabeça Leucoencefalopatia |
|
Sistema Cardiovascular Desconhecida: |
Arritmia cardíaca, pressão baixa, infarto agudo do miocárdio, alteração eletrocardiográfica (alteração ST), desmaio |
|
Afecções respiratórias, torácicas e do mediastino Desconhecida: |
Epistaxe (sangramento nasal) Síndrome do desconforto respiratório agudo, hemoptise (sangue no escarro), hemorragia pulmonar, toxicidade pulmonar |
|
Afecções gastrintestinais Muito comum: Rara: |
Náuseas e vômitos Alteração de paladar |
|
Afecções hepato-biliares Comum: Desconhecida: |
Aumento de DHL e fosfatase alcalina Hepatotoxicidade |
|
Afecções dos tecidos cutâneos e subcutâneos Desconhecida: |
Abscesso, eritema nodoso, foliculite, erupção liquenóide, celulite, psoríase, pioderma gangrenoso, rash, vasculite da pele |
|
Afecções músculo-esqueléticas e dos tecidos conjuntivos Muito comum: Desconhecida: |
Dor óssea Osteopenia (perda de cálcio nos ossos) |
|
Afecções renais e urinárias Desconhecida: |
Falência renal, glomerulonefrite rapidamente progressiva |
|
Afecções gerais Muito comum: Desconhecida: |
Febre Esplenomegalia (aumento do baço), ruptura de baço |
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
População Especial
Uso em crianças
Não foram realizados estudos adequados sobre a relação entre a idade e o uso do filgrastim em crianças. Os estudos realizados em crianças não mostraram diferenças na farmacocinética do filgrastim comparados com os resultados obtidos a partir de estudos em adultos.
Uso em idosos
Não foram realizados estudos sobre a relação entre a idade e o uso do filgrastim em pacientes idosos. No entanto, os estudos normalmente incluem pacientes idosos e não foram observados problemas específicos da idade que limitem o uso deste medicamento em pessoas idosas.
Gravidez e lactação
Não é conhecido se filgrastim é excretado no leite materno. A administração durante a amamentação não é recomendada.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
APRESENTAÇÕES
Solução injetável 300 mcg: embalagens com 5 frascos-ampola.
USO SUBCUTÂNEO OU INTRAVENOSO USO ADULTO
COMPOSIÇÃO
Cada frasco-ampola de filgrastim contém:
- filgrastim - 300 mcg
- Excipientes: sorbitol, polissorbato 80, ácido acético, hidróxido de sódio e água para injeção.
Superdosagem
Em pacientes com câncer que recebem filgrastim como complemento da quimioterapia mielossupressora, recomenda-se evitar o risco potencial de leucocitose excessiva. Deve-se descontinuar o filgrastim se a contagem das células de defesa superar os 10 x 109/l, após ter alcançado o ponto de maior redução das células de defesa induzido por quimioterapia. O uso de filgrastim além de 10 x 109/l, pode não resultar em nenhum benefício clínico adicional.
Não foi determinada a dose máxima tolerada de filgrastim. Em alguns casos, a administração de doses de até 70 mcg/kg/dia de filgrastim foram eficazes e bem toleradas.
Efeitos clínicos da superdose
Não são conhecidos os efeitos da superdose de filgrastim.
Baseados na sua relevância clínica foram selecionados os seguintes efeitos potenciais (possíveis sinais e sintomas entre parênteses):
Agudos e crônicos
Calafrios; dispnéia (falta de ar); leucocitose excessiva - geralmente assintomática; febre; dor de cabeça; mal estar; náuseas; erupção cutânea; taquicardia (batimentos acelerados).
Tratamento da superdose
Em geral, a interrupção do tratamento com filgrastim é acompanhada de uma diminuição de 5% das células de defesa circulantes em um período de 1 a 2 dias, com normalização em um período de 1 a 7 dias.
Devem ser realizados estudos da função respiratória e contagem de leucócitos. Diante de uma eventual superdose procurar o hospital mais próximo ou se comunicar com o CEATOX.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações sobre como proceder.
Interação Medicamentosa
Não foram ainda estabelecidas a segurança e a eficácia de Filgrastim (substância ativa) quando administrado no mesmo dia que a quimioterapia citotóxica mielossupressora. Tendo em vista a sensibilidade da rapidez da divisão das células mieloides à quimioterapia citotóxica mielossupressora, a utilização de Filgrastim (substância ativa) não é recomendada no período que decorre entre as 24 horas anteriores e às 24 horas posteriores à quimioterapia. Evidências preliminares obtidas a partir de um grupo pequeno de pacientes tratados concomitantemente com Filgrastim (substância ativa) e 5-fluoruracila indicam que a gravidade da neutropenia pode ser exacerbada.
Nos estudos clínicos conduzidos não foram investigadas as possíveis interações do Filgrastim (substância ativa) com outros fatores de crescimento hematopoiéticos e com citocinas.
Considerando que o lítio promove a liberação de neutrófilos, é provável que possa potencializar o efeito de Filgrastim (substância ativa). No entanto, esta interação não foi formalmente investigada e não existe qualquer evidência de que tal interação possa ser prejudicial.
Ação da Substância
Resultados de eficácia
A eficácia e segurança clínica do Filgrastim (substância ativa) foram avaliadas em três estudos clínicos fase III.
Câncer de mama
Estudo clínico fase III, multinacional, multicêntrico, randomizado e controlado de comparação entre Filgrastim (substância ativa) vs. comparador vs. placebo, conduzido em 348 pacientes com câncer de mama tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 4 ciclos de docetaxel 75mg/m2 IV e doxorrubicina 60mg/m2 IV no 1° dia.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN): a duração de neutropenia severa no ciclo 1 foi de 1,1 dias (faixa de 0 a 5) para pacientes tratados com o Filgrastim (substância ativa) e o medicamento comparador e 3,8 dias (faixa de 0 a 9) em pacientes que utilizaram o placebo.
Os resultados foram similares no total de pacientes tratados, confirmando a comparabilidade de Filgrastim (substância ativa) e o medicamento comparador.
Incidência de neutropenia febril (FN): no ciclo 1, a incidência de neutropenia febril observada ou definida em protocolo foi consideravelmente menor nos grupos tratados com Filgrastim (substância ativa) e com o medicamento comparador, comparado aos grupos que receberam o placebo (12,1% vs. 12,5% vs. 36,1%). Não houve diferenças significativas entre o Filgrastim (substância ativa) e o medicamento comparador na incidência de neutropenia febril no ciclo 1 ou nos demais ciclos.
Contagem absoluta de neutrófilos (ANC): no ciclo 1, grupos que receberam Filgrastim (substância ativa) e o medicamento comparador apresentaram um aumento significativo de ANC após o 2° dia de tratamento, atingindo contagem máxima no 3° dia de tratamento.
Em seguida, os grupos demonstraram diminuição de ANC a 0,7 x 109/L no 7° dia e alcançaram novamente uma contagem máxima no 11° dia. No grupo que recebeu placebo, não houve aumento inicial de ANC, sendo observada diminuição constante a partir do 2° dia, atingindo um nível consideravelmente baixo (0,2 x 109/L) no 11° dia.
No ciclo 1, o tempo médio de recuperação na contagem absoluta de neutrófilos foi similar nos grupos de que receberam o Filgrastim (substância ativa) e o medicamento comparador (8 dias) e consideravelmente maior no grupo que recebeu placebo (15 dias).
Nos ciclos 2 a 4, o ANC foi similar para todos os grupos (~1,0 x 109/L) e o tempo médio de recuperação na contagem absoluta de neutrófilos foi de 8 dias para todos os grupos.
Neste estudo clínico fase III, conduzido com pacientes de alto-risco ou com câncer de mama avançado, Filgrastim (substância ativa) demonstrou ser superior ao placebo, e com eficácia comparável à do medicamento comparador na redução da duração de neutropenia severa induzida pela quimioterapia, no aumento da contagem absoluta de neutrófilos e na redução do tempo de recuperação da contagem absoluta de neutrófilos. O Filgrastim (substância ativa) e o medicamento comparador também demonstraram eficácia equivalente na redução da incidência de neutropenia febril quando comparados ao placebo.
Os resultados de eficácia deste estudo são sumarizados na tabela a seguir: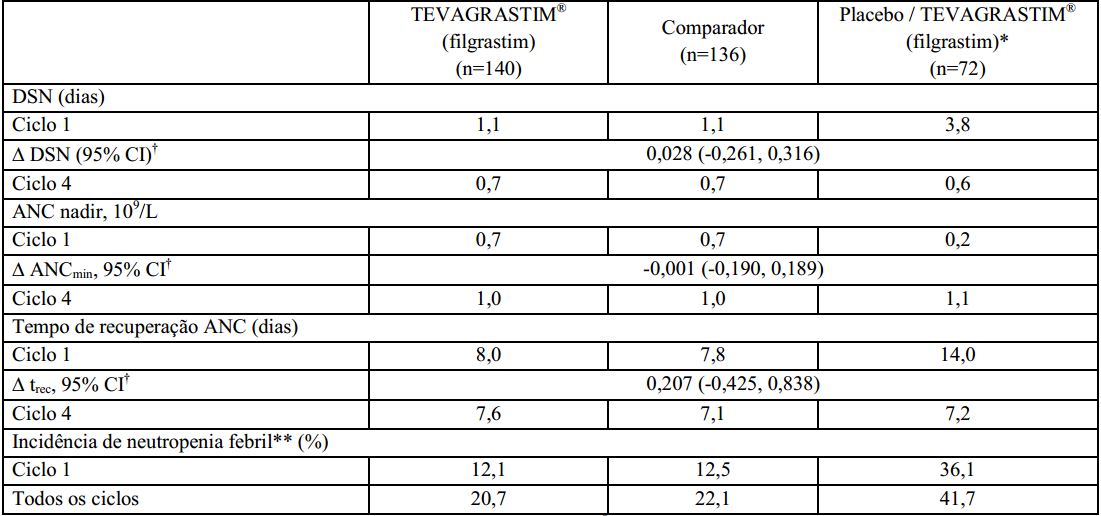 *Pacientes deste grupo receberam placebo no ciclo 1 e Filgrastim (substância ativa) nos ciclos de 2 a 4;
*Pacientes deste grupo receberam placebo no ciclo 1 e Filgrastim (substância ativa) nos ciclos de 2 a 4;
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
**Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
trec: Tempo para recuperação da contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril.
Câncer de pulmão
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em 240 pacientes com câncer de pulmão tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 6 ciclos com derivados de platina. O regime de terapia mais comum utilizado foi cisplatina + etoposídeo ou gencitabina em 49% e 15% dos pacientes, respectivamente. Outros regimes incluíram cisplatina + vinorelbina e combinações de carboplatina + vinorelbina, etoposídeo, gencitabina ou paclitaxel.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN): a duração de neutropenia severa no ciclo 1 foi de 0,5 dias para pacientes tratados com o Filgrastim (substância ativa) e 0,3 dias para os pacientes tratados com o medicamento comparador. A estimativa de análise de covariância (ANCOVA) entre o Filgrastim (substância ativa) e o medicamento comparador foi de 0,157 dias. O intervalo de confiança de 95% (-0,114 a 0,428 dias) foi incluído na faixa pré-definida de equivalência (-1 a 1 dia), indicando que a duração de neutropenia severa (DSN) não foi diferente para o Filgrastim (substância ativa) e o medicamento comparador.
Contagem absoluta de neutrófilos (ANC): o perfil de contagem absoluta de neutrófilos foi similar em todos os ciclos para o medicamento comparador e o Filgrastim (substância ativa). Houve um aumento inicial de ANC significativo atingindo contagem máxima no 5° dia e subsequente diminuição nos 11° e 12° dias. ANC atingiu uma segunda contagem máxima no 14° dia e retornou próxima a contagem basal, gradualmente, até o 21° dia. A contagem absoluta de neutrófilos foi comparável entre os grupos que receberam o medicamento comparador e Filgrastim (substância ativa) no ciclo 1 (2,1 vs. 2,9 x 109/L) e após migrarem do medicamento comparador para Filgrastim (substância ativa) no ciclo 4 (2,3 vs. 3,2 x 109/L). No tempo médio de recuperação na contagem absoluta de neutrófilos houve diferenças mínimas entre os grupos no ciclo 1 (6,3 vs. 4,5 dias) que persistiu até o ciclo 4 quando Filgrastim (substância ativa) foi administrado em ambos os grupos (6,4 vs. 4,5 dias).
Incidência de neutropenia febril (FN):
No ciclo 1, a incidência observada ou definida em protocolo foi de 15,0% no grupo que recebeu o Filgrastim (substância ativa) e 8,8% no grupo que recebeu o medicamento comparador. Estatisticamente, esta diferença não é significativa (p=0,23). No ciclo 4, após os pacientes migrarem do medicamento comparador para Filgrastim (substância ativa), a incidência de neutropenia febril foi de 4,3% e 3,3%, respectivamente (p=0.90). Nos outros ciclos, a incidência de neutropenia febril foi de 33,1% e 23,8% nos pacientes sob tratamento com o Filgrastim (substância ativa) e o medicamento comparador, respectivamente.
Neste estudo clínico fase III, conduzido com pacientes com câncer de pulmão sob tratamento quimioterápico citotóxico, a profilaxia primária com Filgrastim (substância ativa) e o medicamento comparador demonstraram eficácia e segurança equivalentes. O perfil de contagem absoluta de neutrófilos, incluindo a duração de neutropenia severa foi similar entre ambos os medicamentos. Diferenças estatisticamente não significativas entre o Filgrastim (substância ativa) e o medicamento comparador na incidência de neutropenia febril podem ser atribuídas às diferentes características dos pacientes.
Os resultados de eficácia deste estudo são sumarizados na tabela a seguir:
| Filgrastim (substância ativa) (n=160) | Comparador * (n=80) | |
| DSN (dias) | ||
| Ciclo 1 | 0,5 | 0,3 |
| ? DSN, dias (95% CI)* | 0,157 (-0,114, 0,428) | |
| Ciclo 4 | 0,4 | 0,3** |
| ANC nadir, 109/L | ||
| Ciclo 1 | 2,1 | 2,9 |
| Ciclo 4 | 2,3 | 3,2** |
| Tempo de recuperação ANC (dias) | ||
| Ciclo 1 | 6,3 | 4,5 |
| Ciclo 4 | 6,4 | 4,5** |
| Incidência de neutropenia febril‡ (%) | ||
| Ciclo 1 | 15,0 | 8,8 |
| Ciclo 4 | 4,3 | 3,3** |
| Todos os ciclos | 33,1 | 23,8 |
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
*Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
**Após migrar do medicamento comparador para o Filgrastim (substância ativa);
‡ Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril.
Linfomas Não-Hodgkin
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em pacientes com linfoma não-Hodgkin. Durante o estudo, os pacientes estavam sob tratamento quimioterápico, de no máximo 6 ciclos, com ciclofosfamida, doxorrubicina, vincristina e prednisona (CHOP). Tratamento adicional com rituximabe (anticorpo monoclonal anti-CD20) foi utilizado a critério de médico.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN):
A duração de neutropenia severa no ciclo 1 foi de 0,5 dias para pacientes tratados com o Filgrastim (substância ativa) e 0,9 dias para os pacientes tratados com o medicamento comparador. A estimativa de análise de covariância (ANCOVA) entre o Filgrastim (substância ativa) e o medicamento comparador foi de -0,378 dias. O intervalo de confiança de 95% (-0,837 a 0,081 dias) foi incluído na faixa pré-definida de equivalência (-1 a 1 dia), indicando que a duração de neutropenia severa (DSN) foi similar para o Filgrastim (substância ativa) e o medicamento comparador (p=0.11). A duração de neutropenia severa (DSN) no ciclo 4, após os pacientes migrarem do Filgrastim (substância ativa) para o medicamento comparador foi de, respectivamente, 0,2 e 0,7 dias para o grupo que recebeu Filgrastim (substância ativa) e o grupo que recebeu o medicamento comparador.
Contagem absoluta de neutrófilos (ANC):
O perfil de contagem absoluta de neutrófilos foi similar em todos os ciclos para o medicamento comparador e o Filgrastim (substância ativa). No ciclo 1, houve um aumento inicial de ANC significativo atingindo contagem máxima no 4° dia e subsequente diminuição no 9° dia. O ANC atingiu uma segunda contagem máxima no 11° dia e retornou próxima a contagem basal, gradualmente, até o 21° dia. A contagem absoluta de neutrófilos foi comparável entre os grupos que receberam o medicamento comparador e o Filgrastim (substância ativa) no ciclo 1 (1,7 vs. 1,1 x 109/L) e após migrarem do Filgrastim (substância ativa) para o medicamento comparador no ciclo 4 (2,1 vs. 1,8 x 109/L). O tempo médio de recuperação na contagem absoluta de neutrófilos nos pacientes que receberam o Filgrastim (substância ativa) e o medicamento comparador foi respectivamente de 6,0 e 6,7 dias no ciclo 1, e 4,9 e 6,1 dias no ciclo 4.
Incidência de neutropenia febril (FN):
No ciclo 1, a incidência observada ou definida em protocolo foi de 11,1% no grupo que recebeu o Filgrastim (substância ativa) e 20,7% no grupo que recebeu o medicamento comparador (p=0.12). As taxas de incidência no ciclo 4 foram respectivamente 31,7% e 41,4% (p=0.21).
Este estudo clínico fase III foi conduzido em pacientes com linfoma não-Hodgkin tratados com o regime quimioterápico CHOP, com ou sem rituximabe. Os resultados do estudo confirmaram que a profilaxia primária com o Filgrastim (substância ativa) é tão eficaz quanto com o medicamento comparador na redução da duração de neutropenia severa e na incidência de neutropenia febril. O perfil de contagem absoluta de neutrófilos foi similar entre ambos os medicamentos no ciclo 1.
Os resultados de eficácia resumidos estão demonstrados a seguir:?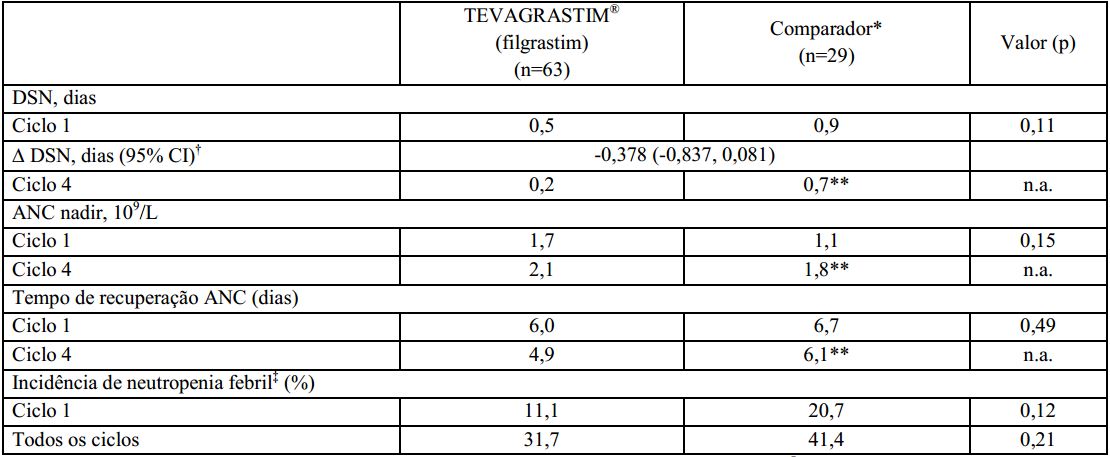 *Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
*Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
**Após migrar do medicamento comparador para o Filgrastim (substância ativa);
‡ Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril;
n.a.: Não avaliado
Característias Farmacológicas
Grupo Farmacoterapêutico:
Imunoestimuladores, Fatores Estimuladores de Colônias.
Código ATC: L03AA02.
Propriedades farmacodinâmicas
Filgrastim (substância ativa), é uma glicoproteína que regula a produção e a liberação de neutrófilos funcionais da medula óssea. O Filgrastim (substância ativa) provoca, em um período de 24 horas, um aumento significativo da contagem de neutrófilos no sangue periférico, com pequenos aumentos de monócitos. Em alguns pacientes com neutropenia crônica grave, o Filgrastim (substância ativa) pode também induzir um pequeno aumento do número de eosinófilos e basófilos circulantes em relação aos valores basais; alguns destes pacientes podem apresentar eosinofilia ou basofilia antes do tratamento. Elevações nas contagens de neutrófilos são dosedependentes nas doses recomendadas. Os neutrófilos produzidos em resposta ao Filgrastim (substância ativa) apresentam função normal ou aumentada, conforme demonstrado em testes de funções fagocítica e quimiostática. Após o término do tratamento com Filgrastim (substância ativa), a contagem de neutrófilos circulantes diminui em 50% dentro de 1 a 2 dias, e para níveis normais dentro de 1 a 7 dias.
O uso de Filgrastim (substância ativa) em pacientes submetidos à quimioterapia citotóxica leva a reduções significativas na incidência, gravidade e duração da neutropenia e da neutropenia febril. O tratamento com Filgrastim (substância ativa) reduz significativamente a duração da neutropenia febril, a utilização de antibióticos e o tempo de hospitalização após quimioterapia de indução para leucemia mieloide aguda ou terapia mieloablativa seguida de transplante de medula óssea. A incidência de relatos de febre e infecções não foi reduzida em nenhum destes quadros clínicos. A duração da febre não diminuiu nos pacientes que receberam terapia mieloablativa seguida de transplante de medula óssea.
A utilização de Filgrastim (substância ativa), isoladamente ou após quimioterapia, mobiliza as células progenitoras hematopoiéticas para o sangue periférico. Estas células progenitoras do sangue periférico (CPSP) autólogas podem ser coletadas e infundidas após terapia citotóxica de dose elevada, em substituição ou em adição ao transplante de medula óssea. A infusão de CPSP acelera a recuperação hematopoiética, reduzindo a duração do risco de complicações hemorrágicas e a necessidade de transfusões de plaquetas.
Os receptores de CPSP alogênicas mobilizadas com Filgrastim (substância ativa) tiveram uma recuperação hematológica significativamente mais rápida, levando a uma diminuição significativa do tempo de recuperação de plaquetas quando comparado com o transplante alogênico de medula óssea.
Um estudo Europeu retrospectivo que avaliou o uso de fator estimulador de colônias de granulócitos (G-CSF) após transplante alogênico de medula óssea em pacientes com leucemia aguda sugeriu risco aumentado de doença do enxerto contra hospedeiro (graft-versus-host disease - GVHD), mortalidade relacionada ao tratamento (TRM) e mortalidade quando o G-CSF foi administrado. Outro estudo retrospectivo internacional, conduzido em pacientes com leucemias mieloides aguda e crônica, não foi observado risco de GVHD, TRM e mortalidade. Uma metanálise de estudos de transplantes alogênicos, incluindo resultados de nove estudos randomizados prospectivos, 8 estudos retrospectivos e 1 estudo de caso-controle, não detectou efeito sobre o risco de GVHD aguda, GVHD crônica ou mortalidade relacionada ao tratamento.
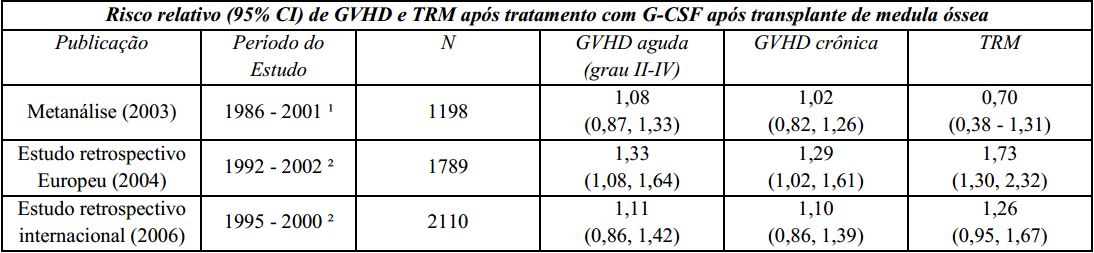 GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
TRM: mortalidade relacionada ao tratamento;
G-CSF: fator estimulador de colônias de granulócitos;
¹ A análise incluiu estudos envolvendo transplante de medula óssea durante este período; alguns estudos utilizaram GM-CSF (fator estimulador de colônias de macrófagos e granulócitos);
² A análise incluiu pacientes recebendo transplante de medula óssea durante este período.
Previamente ao transplante de CPSP alogênicas, a utilização de Filgrastim (substância ativa) para a mobilização de CPSP em doadores saudáveis permite um cultivo de 4 x 106 células CD34+ /kg de peso corporal do receptor na maioria dos doadores, após duas leucaféreses. Para estes doadores saudáveis é dada uma dose de 10 mcg/kg/dia, administrada por via subcutânea durante 4 a 5 dias consecutivos.
O uso de Filgrastim (substância ativa) em pacientes com neutropenia crônica grave (neutropenia congênita grave, neutropenia cíclica e neutropenia idiopática), induz um aumento sustentado das contagens absolutas de neutrófilos no sangue periférico e uma redução das infecções e eventos relacionados.
O Filgrastim (substância ativa), assim como com outros fatores de crescimento hematopoiéticos, demonstrou in vitro propriedades estimuladoras sobre as células endoteliais humanas.
Propriedades Farmacocinéticas
A depuração de Filgrastim (substância ativa), tanto após administração subcutânea como intravenosa, demonstrou seguir uma farmacocinética de primeira ordem. A meia-vida de eliminação sérica do Filgrastim (substância ativa) é de aproximadamente 3,5 horas, com uma taxa de depuração de aproximadamente 0,6mL/min/kg. A infusão contínua com Filgrastim (substância ativa) durante um período de até 28 dias, em pacientes em recuperação de transplante autólogo de medula óssea, não apresentou evidência de acumulação do fármaco e de meias-vidas comparáveis. Há uma correlação linear positiva entre a dose e a concentração sérica de Filgrastim (substância ativa), se administrado por via intravenosa ou por via subcutânea. Após administração subcutânea das doses recomendadas, as concentrações séricas mantiveramse acima dos 10 ng/mL, durante 8 a 16 horas. O volume de distribuição no sangue é aproximadamente de 150mL/kg.
Em pacientes com câncer, o perfil farmacocinético do Filgrastim (substância ativa) e do medicamento comparador foi comparável após administração única e após administrações múltiplas por via subcutânea.
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram risco especial para humanos com base em estudos convencionais de segurança farmacológica, genotoxicidade e tolerância local.
Os dados pré-clínicos de estudos convencionais de toxicidade de doses múltiplas demonstraram os efeitos farmacológicos esperados, incluindo aumento da contagem leucocitária, hiperplasia mieloide da medula óssea, hematopoiese extramedular e dilatação esplênica.
Não foram observados efeitos sobre a fertilidade de ratos do sexo masculino e feminino, assim como sobre a gestação em ratos. Não existe evidência a partir dos estudos conduzidos em ratos e coelhos de que o Filgrastim (substância ativa) seja teratogênico. Foi observada incidência aumentada de perda embrionária em coelhos, porém não foi observada má formação.
Cuidados de Armazenamento
Filgrastim solução injetável é um líquido límpido e incolor.
Conservar sob refrigeração (entre 2 e 8°C). Não congelar.
Não reutilizar o frasco-ampola após retirar a dose a ser administrada. Desprezar o resto do produto. Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS - 1.1213.0176
Farmacêutico Responsável: Alberto Jorge Garcia Guimarães - CRF-SP no 12.449
Importado e embalado por:
Biosintética Farmacêutica Ltda.
Av. das Nações Unidas, 22.428 São Paulo - SP
CNPJ 53.162.095/0001-06 Indústria Brasileira
Fabricado por:
Bio Sidus S.A.
Buenos Aires - Argentina
Venda sob prescrição médica