Filgrastine Filgrastim 300mcg/mL caixa com 1 frasco-ampola com 1ml de na ProGoods Medicamentos Especiais e Oncológicos
Filgrastine - Solução Injetável 300Ug C 1 Frasco-Ampola De 1Ml Refrigerado Uso Restrito A Hospitais

Filgrastine Filgrastim 300mcg/mL caixa com 1 frasco-ampola com 1ml de na ProGoods Medicamentos Especiais e Oncológicos
Não encontramos este produto para a ProGoods Medicamentos Especiais e Oncológicos no Cliquefarma.
Confira os menores preços para Filgrastine - Solução Injetável 300Ug C 1 Frasco-Ampola De 1Ml Refrigerado Uso Restrito A Hospitais

Filgrastine - Solução Injetável 300Ug C 1 Frasco-Ampola De 1Ml Refrigerado Uso Restrito A Hospitais
93.03%
R$ 41,69
Oncolog Medicamentos Especiais
92.99%
R$ 41,90
Drogarias Pacheco
92.81%
R$ 42,99
Maranata Medicamentos
91.64%
R$ 49,99
Agille Medicamentos
90.29%
R$ 58,10
Para que serve
PARA QUE ESTE MEDICAMENTO É INDICADO O FILGRASTINE ® é destinado para a reversão ou prevenção da diminuição de glóbulos brancos de origem distinta, em particular associada à toxicidade de drogas empregadas no tratamento quimioterápico do câncer Seu uso é indicado para doenças que diminuem os glóbulos brancos, quimioterapia do câncer e transplante de medula óssea 2
Contraindicação
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO Não deve ser usado em pacientes com história de reações alérgicas a qualquer um dos componentes deste medicamento Também está contraindicado em pacientes com história de púrpura trombocitopênica auto-imune (que é o aparecimento na pele de inúmeras manchas vermelhas causadas por hemorragias cutâneas e é acompanhada de anemia hemolítica, convulsões, febre e outros sintomas neurológicos) Filgrastine ® é contraindicado na faixa etária inferior à 18 anos 4
Como usar
COMO DEVO USAR ESTE MEDICAMENTO Como usar A injeção deve ser aplicada por via subcutânea ou por via intravenosa Não é recomendável repetir injeções no mesmo local Siga as instruções abaixo: 1) Deixar o medicamento fora da geladeira por 15 minutos antes de utilizá-lo Respeitar as regras de higiene habituais 2) Retirar o lacre de plástico do frasco-ampola da solução injetável 3) Fazer a limpeza da superfície da tampa com algodão umedecido com álcool 4) Retirar com o auxílio da seringa a solução e aplicar a injeção Posologia Blau Farmacêutica S/A A dose recomendada do filgrastim (rHu G-CSF) é de 0,5 M U I /Kg/dia (5 ?g/Kg/dia) correspondendo a 16,6 ?L de solução injetável por dia O conteúdo de um frasco único do filgrastim (rHu G-CSF) com 30 milhões de unidades fornece, portanto, a dose diária necessária para um paciente com 60 Kg Pacientes tratados com quimioterapia e transplante de medula óssea autólogo A dose inicial recomendada é de 2,0 M U I /Kg/dia (20 ?g/Kg/dia) por administração contínua subcutânea ou 3,0 M U I /Kg/dia (30 ?g/Kg/dia) por infusão intravenosa contínua Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento Não interrompa o tratamento sem o conhecimento do seu médico 7
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO Nunca tome duas doses ao mesmo tempo Caso você esqueça de administrar uma dose, esta deverá ser administrada assim que possível, respeitando e seguindo, o intervalo determinado pelo seu médico Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista 8
Precauções
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO FILGRASTINE ® não é recomendado nas 24 horas que antecedem o tratamento quimioterápico, bem como nas 24 horas subsequentes à quimioterapia Durante o tratamento com FILGRASTINE ® devem ser feitos exames de sangue duas vezes por semana para contar o número de glóbulos brancos Deve-se ter grande cuidado quando usar FILGRASTINE ® em pacientes que tenham leucemia grave Não ingerir bebida alcoólica durante o tratamento Blau Farmacêutica S/A Gravidez e lactação Durante a gestação e amamentação, este medicamento deverá ser administrado somente em casos de extrema necessidade Não se tem conhecimento dos efeitos da administração de filgrastim (rHu G-CSF) durante este período sobre o feto ou lactente, ou sobre a capacidade reprodutiva Categoria de risco na gravidez: C Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião- dentista Uso para pessoas de mais de 65 anos de idade FILGRASTINE ® poderá ser usado por pacientes com idade acima de 65 anos, desde que observada as precauções comuns ao produto Crianças A segurança e eficácia do uso de filgrastim (rHu G-CSF) em crianças não foram estabelecidas Cuidados na interrupção do tratamento Informar ao médico o aparecimento de reações desagradáveis como febre, cansaço, dores musculares, dores de cabeça que possam ser associadas ao uso do medicamento
Reações Adversas
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR Os efeitos indesejáveis são apresentados por ordem decrescente de gravidade dentro de cada classe de frequência Em doentes com neoplasias Frequência Aparelho/Sistema Efeitos adversos Muito frequentes (>10%) Gastrintestinal nauseas / vômitos Hepático elevação dos níveis de gama-GT Metabólico / Nutrição elevação dos níveis de fosfatase alcalina, elevação dos níveis de LDH e elevação dos níveis de ácido úrico SNC / SNP cefaleia Hematológico leucocitose, trombocitopenia Musculoesquelético dor musculoesquelético Frequentes (1 – 10%) Geral fadiga, fraqueza generalizada SNC / SNP cefaleia Gastrintestinal constipação, anorexia, diarreia e mucosite Musculoesquelético dor no peito e dor musculoesquelético Respiratório tosse e inflamação da garganta Cutâneo alopecia e exantema Metabólico / Nutrição elevação dos níveis de fosfatase alcalina elevação dos níveis de LDH Pouco frequentes (< 1%) Geral dor inespecífica, reações alérgicas graves Hematológico disfunções esplênicas Metabólico / Nutrição elevação dos níveis de TGO, hiperuricemia Musculoesquelético artrite reumatóide, exacerbação Raros (< 0,1%) Respiratório acontecimentos adversos, pulmonares Cutâneo síndrome de Sweet Muito raros (< 0,01%) Geral reações alérgicas Musculoesquelético artrite reumatóide, exacerbação e pseudogota Respiratório infiltrações pulmonares Cutâneo vasculite cutânea Urinário perturbações urinárias Na neutropenia crônica grave (NCG) Frequência Aparelho/Sistema Efeitos adversos Muito frequentes (>10%) Hematológico anemia, esplenomegalia Metabólico / Nutrição diminuição dos níveis de glicose, elevação dos níveis de Blau Farmacêutica S/A fosfatase alcalina, elevação dos níveis de LDH, hiperuricemia Musculoesquelético dor musculoesquelético Respiratório epistaxe Frequentes (1 – 10%) SNC / SNP cefaleia Gastrintestinal diarreia Hematológico trombocitopenia Hepático hepatomegalia Musculoesquelético osteoporose Cutâneo alopecia, vasculite cutânea, dor no local de injeção, exantema Pouco frequentes (< 1%) Hematológico disfunções esplênicas, hematúria Urinário proteinúria Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento Informe também à empresa através do seu serviço de atendimento 9
Composição
COMPOSIÇÃO FILGRASTINE ® frasco-ampola e ampola de 1,0 mL: filgrastim (rHu G-CSF) 300 µg excipientes*: q s p 1,0 mL *acetato de sódio, polissorbato 80, manitol e água para injetáveis FILGRASTINE ® seringa preenchida 0,5 mL: filgrastim (rHu G-CSF) 300 µg excipientes*: q s p 0,5 mL *acetato de sódio, polissorbato 80, manitol e água para injetáveis FILGRASTINE ® seringa preenchida 1,0 mL: filgrastim (rHu G-CSF) 300 µg excipientes*: q s p 1,0 mL *acetato de sódio, polissorbato 80, manitol e água para injetáveis I) INFORMAÇÕES AO PACIENTE 1
Superdosagem
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO Os efeitos de doses excessivas do filgrastim (rHu G-CSF) não são bem conhecidos Porém a terapia pode ser descontinuada, geralmente resultando em queda dos neutrófilos circulantes Em caso de uso de grande quantidade desde medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível Ligue para 0800 722 6001, se você precisar de mais orientações
Interação Medicamentosa
Não foram ainda estabelecidas a segurança e a eficácia de Filgrastim (substância ativa) quando administrado no mesmo dia que a quimioterapia citotóxica mielossupressora. Tendo em vista a sensibilidade da rapidez da divisão das células mieloides à quimioterapia citotóxica mielossupressora, a utilização de Filgrastim (substância ativa) não é recomendada no período que decorre entre as 24 horas anteriores e às 24 horas posteriores à quimioterapia. Evidências preliminares obtidas a partir de um grupo pequeno de pacientes tratados concomitantemente com Filgrastim (substância ativa) e 5-fluoruracila indicam que a gravidade da neutropenia pode ser exacerbada.
Nos estudos clínicos conduzidos não foram investigadas as possíveis interações do Filgrastim (substância ativa) com outros fatores de crescimento hematopoiéticos e com citocinas.
Considerando que o lítio promove a liberação de neutrófilos, é provável que possa potencializar o efeito de Filgrastim (substância ativa). No entanto, esta interação não foi formalmente investigada e não existe qualquer evidência de que tal interação possa ser prejudicial.
Ação da Substância
Resultados de eficácia
A eficácia e segurança clínica do Filgrastim (substância ativa) foram avaliadas em três estudos clínicos fase III.
Câncer de mama
Estudo clínico fase III, multinacional, multicêntrico, randomizado e controlado de comparação entre Filgrastim (substância ativa) vs. comparador vs. placebo, conduzido em 348 pacientes com câncer de mama tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 4 ciclos de docetaxel 75mg/m2 IV e doxorrubicina 60mg/m2 IV no 1° dia.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN): a duração de neutropenia severa no ciclo 1 foi de 1,1 dias (faixa de 0 a 5) para pacientes tratados com o Filgrastim (substância ativa) e o medicamento comparador e 3,8 dias (faixa de 0 a 9) em pacientes que utilizaram o placebo.
Os resultados foram similares no total de pacientes tratados, confirmando a comparabilidade de Filgrastim (substância ativa) e o medicamento comparador.
Incidência de neutropenia febril (FN): no ciclo 1, a incidência de neutropenia febril observada ou definida em protocolo foi consideravelmente menor nos grupos tratados com Filgrastim (substância ativa) e com o medicamento comparador, comparado aos grupos que receberam o placebo (12,1% vs. 12,5% vs. 36,1%). Não houve diferenças significativas entre o Filgrastim (substância ativa) e o medicamento comparador na incidência de neutropenia febril no ciclo 1 ou nos demais ciclos.
Contagem absoluta de neutrófilos (ANC): no ciclo 1, grupos que receberam Filgrastim (substância ativa) e o medicamento comparador apresentaram um aumento significativo de ANC após o 2° dia de tratamento, atingindo contagem máxima no 3° dia de tratamento.
Em seguida, os grupos demonstraram diminuição de ANC a 0,7 x 109/L no 7° dia e alcançaram novamente uma contagem máxima no 11° dia. No grupo que recebeu placebo, não houve aumento inicial de ANC, sendo observada diminuição constante a partir do 2° dia, atingindo um nível consideravelmente baixo (0,2 x 109/L) no 11° dia.
No ciclo 1, o tempo médio de recuperação na contagem absoluta de neutrófilos foi similar nos grupos de que receberam o Filgrastim (substância ativa) e o medicamento comparador (8 dias) e consideravelmente maior no grupo que recebeu placebo (15 dias).
Nos ciclos 2 a 4, o ANC foi similar para todos os grupos (~1,0 x 109/L) e o tempo médio de recuperação na contagem absoluta de neutrófilos foi de 8 dias para todos os grupos.
Neste estudo clínico fase III, conduzido com pacientes de alto-risco ou com câncer de mama avançado, Filgrastim (substância ativa) demonstrou ser superior ao placebo, e com eficácia comparável à do medicamento comparador na redução da duração de neutropenia severa induzida pela quimioterapia, no aumento da contagem absoluta de neutrófilos e na redução do tempo de recuperação da contagem absoluta de neutrófilos. O Filgrastim (substância ativa) e o medicamento comparador também demonstraram eficácia equivalente na redução da incidência de neutropenia febril quando comparados ao placebo.
Os resultados de eficácia deste estudo são sumarizados na tabela a seguir: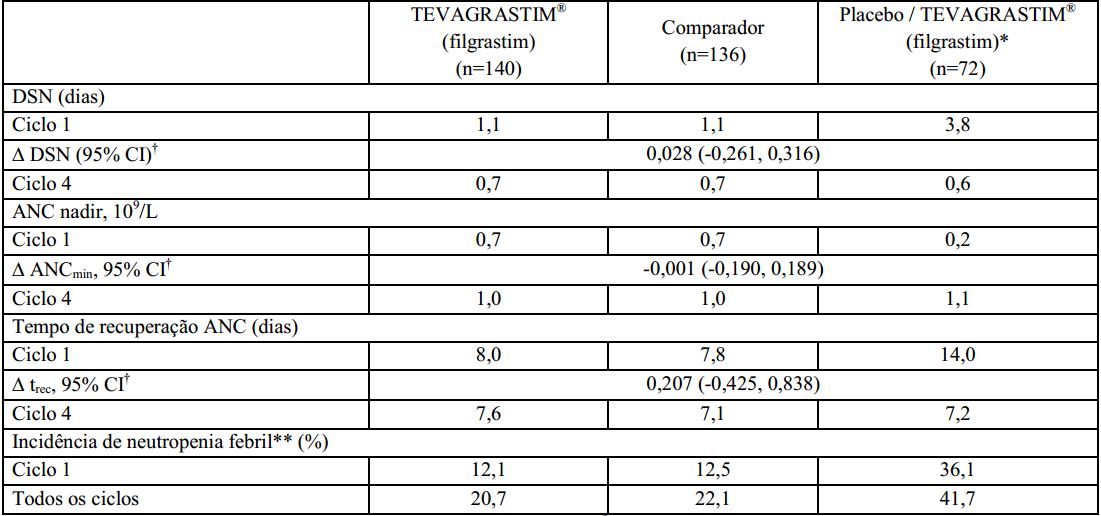 *Pacientes deste grupo receberam placebo no ciclo 1 e Filgrastim (substância ativa) nos ciclos de 2 a 4;
*Pacientes deste grupo receberam placebo no ciclo 1 e Filgrastim (substância ativa) nos ciclos de 2 a 4;
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
**Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
trec: Tempo para recuperação da contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril.
Câncer de pulmão
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em 240 pacientes com câncer de pulmão tratados com quimioterapia citotóxica. Durante o estudo, os voluntários estavam sob tratamento quimioterápico de no máximo 6 ciclos com derivados de platina. O regime de terapia mais comum utilizado foi cisplatina + etoposídeo ou gencitabina em 49% e 15% dos pacientes, respectivamente. Outros regimes incluíram cisplatina + vinorelbina e combinações de carboplatina + vinorelbina, etoposídeo, gencitabina ou paclitaxel.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN): a duração de neutropenia severa no ciclo 1 foi de 0,5 dias para pacientes tratados com o Filgrastim (substância ativa) e 0,3 dias para os pacientes tratados com o medicamento comparador. A estimativa de análise de covariância (ANCOVA) entre o Filgrastim (substância ativa) e o medicamento comparador foi de 0,157 dias. O intervalo de confiança de 95% (-0,114 a 0,428 dias) foi incluído na faixa pré-definida de equivalência (-1 a 1 dia), indicando que a duração de neutropenia severa (DSN) não foi diferente para o Filgrastim (substância ativa) e o medicamento comparador.
Contagem absoluta de neutrófilos (ANC): o perfil de contagem absoluta de neutrófilos foi similar em todos os ciclos para o medicamento comparador e o Filgrastim (substância ativa). Houve um aumento inicial de ANC significativo atingindo contagem máxima no 5° dia e subsequente diminuição nos 11° e 12° dias. ANC atingiu uma segunda contagem máxima no 14° dia e retornou próxima a contagem basal, gradualmente, até o 21° dia. A contagem absoluta de neutrófilos foi comparável entre os grupos que receberam o medicamento comparador e Filgrastim (substância ativa) no ciclo 1 (2,1 vs. 2,9 x 109/L) e após migrarem do medicamento comparador para Filgrastim (substância ativa) no ciclo 4 (2,3 vs. 3,2 x 109/L). No tempo médio de recuperação na contagem absoluta de neutrófilos houve diferenças mínimas entre os grupos no ciclo 1 (6,3 vs. 4,5 dias) que persistiu até o ciclo 4 quando Filgrastim (substância ativa) foi administrado em ambos os grupos (6,4 vs. 4,5 dias).
Incidência de neutropenia febril (FN):
No ciclo 1, a incidência observada ou definida em protocolo foi de 15,0% no grupo que recebeu o Filgrastim (substância ativa) e 8,8% no grupo que recebeu o medicamento comparador. Estatisticamente, esta diferença não é significativa (p=0,23). No ciclo 4, após os pacientes migrarem do medicamento comparador para Filgrastim (substância ativa), a incidência de neutropenia febril foi de 4,3% e 3,3%, respectivamente (p=0.90). Nos outros ciclos, a incidência de neutropenia febril foi de 33,1% e 23,8% nos pacientes sob tratamento com o Filgrastim (substância ativa) e o medicamento comparador, respectivamente.
Neste estudo clínico fase III, conduzido com pacientes com câncer de pulmão sob tratamento quimioterápico citotóxico, a profilaxia primária com Filgrastim (substância ativa) e o medicamento comparador demonstraram eficácia e segurança equivalentes. O perfil de contagem absoluta de neutrófilos, incluindo a duração de neutropenia severa foi similar entre ambos os medicamentos. Diferenças estatisticamente não significativas entre o Filgrastim (substância ativa) e o medicamento comparador na incidência de neutropenia febril podem ser atribuídas às diferentes características dos pacientes.
Os resultados de eficácia deste estudo são sumarizados na tabela a seguir:
| Filgrastim (substância ativa) (n=160) | Comparador * (n=80) | |
| DSN (dias) | ||
| Ciclo 1 | 0,5 | 0,3 |
| ? DSN, dias (95% CI)* | 0,157 (-0,114, 0,428) | |
| Ciclo 4 | 0,4 | 0,3** |
| ANC nadir, 109/L | ||
| Ciclo 1 | 2,1 | 2,9 |
| Ciclo 4 | 2,3 | 3,2** |
| Tempo de recuperação ANC (dias) | ||
| Ciclo 1 | 6,3 | 4,5 |
| Ciclo 4 | 6,4 | 4,5** |
| Incidência de neutropenia febril‡ (%) | ||
| Ciclo 1 | 15,0 | 8,8 |
| Ciclo 4 | 4,3 | 3,3** |
| Todos os ciclos | 33,1 | 23,8 |
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
*Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
**Após migrar do medicamento comparador para o Filgrastim (substância ativa);
‡ Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril.
Linfomas Não-Hodgkin
Estudo clínico fase III, multinacional, multicêntrico e randomizado, de comparação entre Filgrastim (substância ativa) e medicamento comparador, conduzido em pacientes com linfoma não-Hodgkin. Durante o estudo, os pacientes estavam sob tratamento quimioterápico, de no máximo 6 ciclos, com ciclofosfamida, doxorrubicina, vincristina e prednisona (CHOP). Tratamento adicional com rituximabe (anticorpo monoclonal anti-CD20) foi utilizado a critério de médico.
Os resultados de eficácia basearam-se nas seguintes determinações:
Duração de neutropenia severa (DSN):
A duração de neutropenia severa no ciclo 1 foi de 0,5 dias para pacientes tratados com o Filgrastim (substância ativa) e 0,9 dias para os pacientes tratados com o medicamento comparador. A estimativa de análise de covariância (ANCOVA) entre o Filgrastim (substância ativa) e o medicamento comparador foi de -0,378 dias. O intervalo de confiança de 95% (-0,837 a 0,081 dias) foi incluído na faixa pré-definida de equivalência (-1 a 1 dia), indicando que a duração de neutropenia severa (DSN) foi similar para o Filgrastim (substância ativa) e o medicamento comparador (p=0.11). A duração de neutropenia severa (DSN) no ciclo 4, após os pacientes migrarem do Filgrastim (substância ativa) para o medicamento comparador foi de, respectivamente, 0,2 e 0,7 dias para o grupo que recebeu Filgrastim (substância ativa) e o grupo que recebeu o medicamento comparador.
Contagem absoluta de neutrófilos (ANC):
O perfil de contagem absoluta de neutrófilos foi similar em todos os ciclos para o medicamento comparador e o Filgrastim (substância ativa). No ciclo 1, houve um aumento inicial de ANC significativo atingindo contagem máxima no 4° dia e subsequente diminuição no 9° dia. O ANC atingiu uma segunda contagem máxima no 11° dia e retornou próxima a contagem basal, gradualmente, até o 21° dia. A contagem absoluta de neutrófilos foi comparável entre os grupos que receberam o medicamento comparador e o Filgrastim (substância ativa) no ciclo 1 (1,7 vs. 1,1 x 109/L) e após migrarem do Filgrastim (substância ativa) para o medicamento comparador no ciclo 4 (2,1 vs. 1,8 x 109/L). O tempo médio de recuperação na contagem absoluta de neutrófilos nos pacientes que receberam o Filgrastim (substância ativa) e o medicamento comparador foi respectivamente de 6,0 e 6,7 dias no ciclo 1, e 4,9 e 6,1 dias no ciclo 4.
Incidência de neutropenia febril (FN):
No ciclo 1, a incidência observada ou definida em protocolo foi de 11,1% no grupo que recebeu o Filgrastim (substância ativa) e 20,7% no grupo que recebeu o medicamento comparador (p=0.12). As taxas de incidência no ciclo 4 foram respectivamente 31,7% e 41,4% (p=0.21).
Este estudo clínico fase III foi conduzido em pacientes com linfoma não-Hodgkin tratados com o regime quimioterápico CHOP, com ou sem rituximabe. Os resultados do estudo confirmaram que a profilaxia primária com o Filgrastim (substância ativa) é tão eficaz quanto com o medicamento comparador na redução da duração de neutropenia severa e na incidência de neutropenia febril. O perfil de contagem absoluta de neutrófilos foi similar entre ambos os medicamentos no ciclo 1.
Os resultados de eficácia resumidos estão demonstrados a seguir:?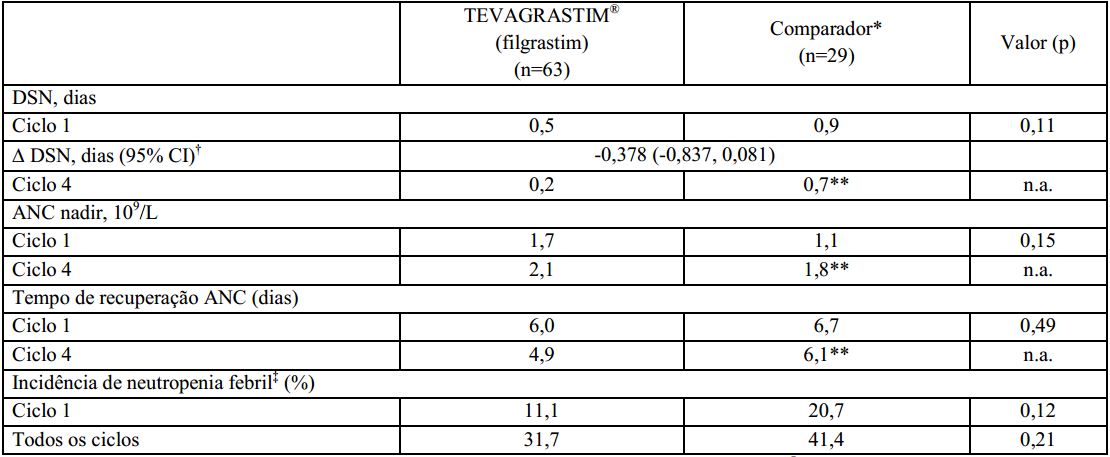 *Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
*Pacientes deste grupo receberam o medicamento comparador no ciclo 1 e o Filgrastim (substância ativa) nos ciclos seguintes;
† Estimativa de análise de covariância (ANCOVA) e o intervalo de confiança de 95% para a diferença entre o Filgrastim (substância ativa) e o medicamento comparador no ciclo 1;
**Após migrar do medicamento comparador para o Filgrastim (substância ativa);
‡ Observado ou definido em protocolo;
DSN: Duração de neutropenia severa;
ANC: Contagem absoluta de neutrófilos;
FN: Incidência de neutropenia febril;
n.a.: Não avaliado
Característias Farmacológicas
Grupo Farmacoterapêutico:
Imunoestimuladores, Fatores Estimuladores de Colônias.
Código ATC: L03AA02.
Propriedades farmacodinâmicas
Filgrastim (substância ativa), é uma glicoproteína que regula a produção e a liberação de neutrófilos funcionais da medula óssea. O Filgrastim (substância ativa) provoca, em um período de 24 horas, um aumento significativo da contagem de neutrófilos no sangue periférico, com pequenos aumentos de monócitos. Em alguns pacientes com neutropenia crônica grave, o Filgrastim (substância ativa) pode também induzir um pequeno aumento do número de eosinófilos e basófilos circulantes em relação aos valores basais; alguns destes pacientes podem apresentar eosinofilia ou basofilia antes do tratamento. Elevações nas contagens de neutrófilos são dosedependentes nas doses recomendadas. Os neutrófilos produzidos em resposta ao Filgrastim (substância ativa) apresentam função normal ou aumentada, conforme demonstrado em testes de funções fagocítica e quimiostática. Após o término do tratamento com Filgrastim (substância ativa), a contagem de neutrófilos circulantes diminui em 50% dentro de 1 a 2 dias, e para níveis normais dentro de 1 a 7 dias.
O uso de Filgrastim (substância ativa) em pacientes submetidos à quimioterapia citotóxica leva a reduções significativas na incidência, gravidade e duração da neutropenia e da neutropenia febril. O tratamento com Filgrastim (substância ativa) reduz significativamente a duração da neutropenia febril, a utilização de antibióticos e o tempo de hospitalização após quimioterapia de indução para leucemia mieloide aguda ou terapia mieloablativa seguida de transplante de medula óssea. A incidência de relatos de febre e infecções não foi reduzida em nenhum destes quadros clínicos. A duração da febre não diminuiu nos pacientes que receberam terapia mieloablativa seguida de transplante de medula óssea.
A utilização de Filgrastim (substância ativa), isoladamente ou após quimioterapia, mobiliza as células progenitoras hematopoiéticas para o sangue periférico. Estas células progenitoras do sangue periférico (CPSP) autólogas podem ser coletadas e infundidas após terapia citotóxica de dose elevada, em substituição ou em adição ao transplante de medula óssea. A infusão de CPSP acelera a recuperação hematopoiética, reduzindo a duração do risco de complicações hemorrágicas e a necessidade de transfusões de plaquetas.
Os receptores de CPSP alogênicas mobilizadas com Filgrastim (substância ativa) tiveram uma recuperação hematológica significativamente mais rápida, levando a uma diminuição significativa do tempo de recuperação de plaquetas quando comparado com o transplante alogênico de medula óssea.
Um estudo Europeu retrospectivo que avaliou o uso de fator estimulador de colônias de granulócitos (G-CSF) após transplante alogênico de medula óssea em pacientes com leucemia aguda sugeriu risco aumentado de doença do enxerto contra hospedeiro (graft-versus-host disease - GVHD), mortalidade relacionada ao tratamento (TRM) e mortalidade quando o G-CSF foi administrado. Outro estudo retrospectivo internacional, conduzido em pacientes com leucemias mieloides aguda e crônica, não foi observado risco de GVHD, TRM e mortalidade. Uma metanálise de estudos de transplantes alogênicos, incluindo resultados de nove estudos randomizados prospectivos, 8 estudos retrospectivos e 1 estudo de caso-controle, não detectou efeito sobre o risco de GVHD aguda, GVHD crônica ou mortalidade relacionada ao tratamento.
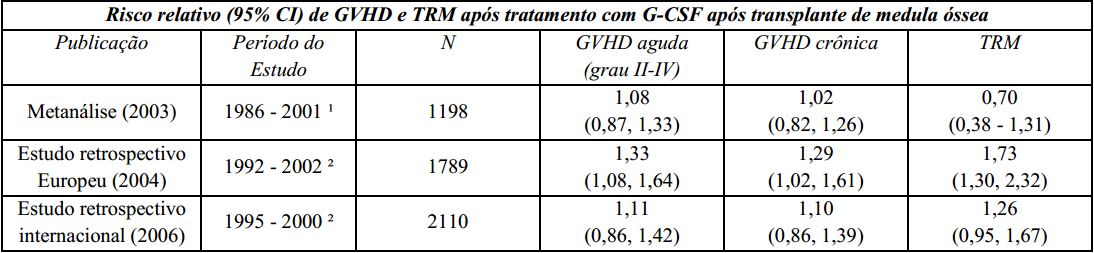 GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
GVHD: doença do enxerto contra hospedeiro (graft-versus-host disease);
TRM: mortalidade relacionada ao tratamento;
G-CSF: fator estimulador de colônias de granulócitos;
¹ A análise incluiu estudos envolvendo transplante de medula óssea durante este período; alguns estudos utilizaram GM-CSF (fator estimulador de colônias de macrófagos e granulócitos);
² A análise incluiu pacientes recebendo transplante de medula óssea durante este período.
Previamente ao transplante de CPSP alogênicas, a utilização de Filgrastim (substância ativa) para a mobilização de CPSP em doadores saudáveis permite um cultivo de 4 x 106 células CD34+ /kg de peso corporal do receptor na maioria dos doadores, após duas leucaféreses. Para estes doadores saudáveis é dada uma dose de 10 mcg/kg/dia, administrada por via subcutânea durante 4 a 5 dias consecutivos.
O uso de Filgrastim (substância ativa) em pacientes com neutropenia crônica grave (neutropenia congênita grave, neutropenia cíclica e neutropenia idiopática), induz um aumento sustentado das contagens absolutas de neutrófilos no sangue periférico e uma redução das infecções e eventos relacionados.
O Filgrastim (substância ativa), assim como com outros fatores de crescimento hematopoiéticos, demonstrou in vitro propriedades estimuladoras sobre as células endoteliais humanas.
Propriedades Farmacocinéticas
A depuração de Filgrastim (substância ativa), tanto após administração subcutânea como intravenosa, demonstrou seguir uma farmacocinética de primeira ordem. A meia-vida de eliminação sérica do Filgrastim (substância ativa) é de aproximadamente 3,5 horas, com uma taxa de depuração de aproximadamente 0,6mL/min/kg. A infusão contínua com Filgrastim (substância ativa) durante um período de até 28 dias, em pacientes em recuperação de transplante autólogo de medula óssea, não apresentou evidência de acumulação do fármaco e de meias-vidas comparáveis. Há uma correlação linear positiva entre a dose e a concentração sérica de Filgrastim (substância ativa), se administrado por via intravenosa ou por via subcutânea. Após administração subcutânea das doses recomendadas, as concentrações séricas mantiveramse acima dos 10 ng/mL, durante 8 a 16 horas. O volume de distribuição no sangue é aproximadamente de 150mL/kg.
Em pacientes com câncer, o perfil farmacocinético do Filgrastim (substância ativa) e do medicamento comparador foi comparável após administração única e após administrações múltiplas por via subcutânea.
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram risco especial para humanos com base em estudos convencionais de segurança farmacológica, genotoxicidade e tolerância local.
Os dados pré-clínicos de estudos convencionais de toxicidade de doses múltiplas demonstraram os efeitos farmacológicos esperados, incluindo aumento da contagem leucocitária, hiperplasia mieloide da medula óssea, hematopoiese extramedular e dilatação esplênica.
Não foram observados efeitos sobre a fertilidade de ratos do sexo masculino e feminino, assim como sobre a gestação em ratos. Não existe evidência a partir dos estudos conduzidos em ratos e coelhos de que o Filgrastim (substância ativa) seja teratogênico. Foi observada incidência aumentada de perda embrionária em coelhos, porém não foi observada má formação.
Cuidados de Armazenamento
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO Conservar sob refrigeração entre 2°C e 8° C e ao abrigo da luz Não congelar Qualquer solução remanescente deverá ser descartada Prazo de validade: 24 meses a partir da data de fabricação Número de lote e datas de fabricação e validade: vide embalagem Não use medicamento com o prazo de validade vencido Guarde-o em sua embalagem original Características do medicamento Solução injetável límpida, incolor ou levemente opalescente Antes de usar, observe o aspecto do medicamento Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo Todo medicamento deve ser mantido fora do alcance das crianças 6
Dizeres Legais
II) DIZERES LEGAIS Farm Resp : Satoro Tabuchi - CRF-SP n° 4 931 Reg MS nº 1 1637 0058 Fabricado por: Blau Farmacêutica S A CNPJ 58 430 828/0005-93 Rodovia Raposo Tavares km 30,5 –nº 2833 – Prédio 200 CEP: 06705-030 - Cotia – SP Indústria Brasileira Registrado por: Blau Farmacêutica S A CNPJ 58 430 828/0001-60 Rodovia Raposo Tavares Km 30,5 n° 2833 - Prédio 100 CEP 06705-030 Cotia – SP Indústria Brasileira www blau com br Venda sob prescrição médica 7003381-00 Blau Farmacêutica S/A Histórico de Alteração da Bula Dados da submissão eletrônica Dados da petição/notificação que altera bula Dados das alterações de bulas Data do expediente N° do expediente Assunto Data do expediente N° do expediente Assunto Data de aprovação Itens de bula Versões (VP/VPS)