Comparamos o preço de Evotaxel - 6Mg/Ml Solução Injetável 100Mg Em 16,7 Ml, veja o menor preço

R$ 190,00
SSimilar
2
ofertasMelhores preços a partir de R$ 190,00 até R$ 190,00
Menor preço
vendido por OncoExpresso Medicamentos
R$ 190,00
Menor preço
vendido por Onco Express Medicamentos Especiais e Oncológicos
R$ 190,00
Farmácia de medicamentos oncológicos. Parcelamos em até 6 x sem juros.
Para que serve
é eficaz na redução da pressão intra-ocular e está indicado para o tratamento da hipertensão ocular e glaucoma crônico de ângulo aberto. Pode ser usado isolado ou em combinação com outras drogas antiglaucomatosas.
Contraindicação
Hipersensibilidade ao componente da fórmula. Bradicardia sinusal, maior do que o bloqueio atrioventricular de primeiro grau, choque cardiogênico ou pacientes com insuficiência cardíaca comprovada.
Como usar
A dose recomendada é uma ou duas gotas no(s) olho(s) afetado(s) duas vezes por dia. Como acontece ao se administrar uma medicação nova, recomenda-se o acompanhamento cuidadoso dos pacientes. Se a pressão intra-ocular do paciente não estiver adequadamente controlada com este tratamento, pode-se instituir terapêutica concomitante com pilocarpina , outros mióticos, epinefrina ou inibidores da anidrase carbônica.
Precauções
O paclitaxel (substância ativa) deve ser administrado sob a supervisão de um médico com experiência na utilização de agentes quimioterápicos.
O paclitaxel (substância ativa) deve ser administrado como infusão após diluição. Os pacientes devem ser tratados com corticosteroides, anti-histamínicos e antagonistas H2 antes da administração de paclitaxel (substância ativa).
O paclitaxel (substância ativa) deverá ser administrado antes do composto de platina quando este for dado em combinação com um composto de platina.
Anafilaxia e Reações Graves de Hipersensibilidade
Anafilaxia e reações graves de hipersensibilidade ocorreram comumente em pacientes recebendo paclitaxel (substância ativa). São Caracterizadas por dispneia requerendo broncodilatadores, hipotensão necessitando de tratamento, angioedema ou urticária generalizada.
Estas reações são provavelmente mediadas por histamina. Raras reações fatais ocorreram em alguns pacientes, apesar do pré-tratamento. Todos os pacientes devem ser pré-tratados com corticosteroides, difenidramina e antagonistas H2. Em caso de reação de hipersensibilidade grave, a infusão de paclitaxel (substância ativa) deve ser descontinuada imediatamente e o paciente não deve ser submetido a novas infusões de paclitaxel (substância ativa).
Toxicidade Hematológica
A depressão da medula óssea (principalmente neutropenia) é dependente da dose e do esquema posológico e é a principal toxicidade dose-limitante dentro de um regime.
A monitorização frequente do hemograma deve ser instituída durante o tratamento com paclitaxel (substância ativa). O paclitaxel (substância ativa) não deve ser administrado a pacientes com contagem basal de neutrófilos < 1.500 células/mm (<1.000 células/mm para pacientes com sarcoma de Kaposi).
Em caso de neutropenia grave (< 500 células/mm) durante um ciclo de tratamento com o medicamento, recomenda-se uma redução de 20% da dose em ciclos subsequentes.
Toxicidade Cardiovascular
Foram observados casos de hipotensão, hipertensão e bradicardia durante a administração de paclitaxel (substância ativa). Os pacientes geralmente permanecem assintomáticos e não requerem tratamento. Em casos graves, pode ser necessária a interrupção ou a descontinuação das infusões de paclitaxel (substância ativa) a critério médico. Recomenda-se a monitorização frequente dos sinais vitais, particularmente durante a primeira hora de infusão de paclitaxel (substância ativa).
A monitorização eletrocardiográfica contínua não é necessária, exceto para os pacientes com distúrbios sérios de condução. Quando paclitaxel (substância ativa) for utilizado em combinação com trastuzumabe ou doxorrubicina para tratamento de câncer de mama metastático, é recomendado monitoramento da função cardíaca.
Sistema Nervoso
A ocorrência de neuropatia periférica é frequente, mas normalmente não é grave. Recomenda-se uma redução da dose de 20% nos ciclos subsequentes de paclitaxel (substância ativa) nos casos de neuropatia grave.
paclitaxel (substância ativa) contém álcool desidratado.
Devem ser considerados os possíveis efeitos do etanol no SNC e seus outros efeitos, em todos os pacientes. Crianças podem ser mais sensíveis aos efeitos do etanol que os adultos.
Reação no local da injeção
Até o momento, se desconhece um tratamento específico para as reações devidas ao extravasamento. Dada a possibilidade de extravasamento, é aconselhável monitorar rigorosamente o local da infusão quanto a uma possível infiltração durante a administração da droga.
Uso pediátrico
A segurança e a eficácia de paclitaxel (substância ativa) em pacientes pediátricos não foram estabelecidas. Relataram-se casos de toxicidade do sistema nervoso central (SNC) (raramente associada à morte) em um estudo clínico em pacientes pediátricos nos quais se administrou paclitaxel (substância ativa) por infusão intravenosa durante 3 horas com doses entre 350 mg/m e 420 mg/m . A toxicidade é provavelmente devida à alta dose de etanol, veículo constituinte do paclitaxel (substância ativa), administrado em um curto período de infusão.
O uso concomitante de anti-histamínicos pode intensificar este efeito.
Embora um efeito direto do paclitaxel (substância ativa) não possa ser descartado, as altas doses utilizadas neste estudo (duas vezes acima da dose recomendada para adultos) devem ser consideradas na avaliação da segurança de paclitaxel (substância ativa) para uso nesta população.
Uso Geriátrico
Dos 2228 pacientes que receberam paclitaxel (substância ativa) em oito estudos clínicos que avaliaram sua segurança e eficácia no tratamento de câncer de ovário avançado, carcinoma de mama ou câncer de não pequenas células do pulmão, e 1570 pacientes que foram randomizados para receber paclitaxel (substância ativa) em um estudo de câncer adjuvante de mama, 649 pacientes (17%) tinham 65 anos ou mais, incluindo 49 pacientes (1%) com 75 anos ou mais.
Na maioria dos estudos, a mielossupressão grave foi mais frequente em pacientes idosos; em alguns estudos, neuropatia grave foi mais comum.
Em dois estudos clínicos em câncer de não-pequenas células de pulmão, os pacientes idosos tratados com paclitaxel (substância ativa) apresentaram uma maior incidência de eventos cardiovasculares. A avaliação de eficácia pareceu similar em pacientes idosos e jovens; entretanto, a eficácia comparativa não pôde ser determinada com confiança devido ao pequeno número de pacientes idosos estudados.
Em um estudo de tratamento de primeira linha de câncer de ovário, pacientes idosos apresentaram menor sobrevida mediana que pacientes jovens, mas nenhum outro parâmetro de eficácia favoreceu o grupo jovem.
Insuficiência Hepática
Pacientes com insuficiência hepática podem apresentar risco de toxicidade aumentado, particularmente mielossupressão graus III-IV. O ajuste de dose é recomendado. Os pacientes devem ser bem monitorados quanto ao desenvolvimento de mielossupressão profunda.
Carcinogênese, Mutagênese, Comprometimento da Fertilidade
O potencial carcinogênico do produto não foi estudado. Demonstrou-se que paclitaxel (substância ativa) é clastogênico in vitro (aberrações cromossômicas em linfócitos humanos) e in vivo (teste de micronúcleo em camundongos). paclitaxel (substância ativa) não foi mutagênico no teste de AMES ou no teste de mutação genética CHO/HGPRT. Ocorreu redução da fertilidade e do número de implantações e fetos vivos em ratos que receberam paclitaxel (substância ativa).
O produto mostrou-se embriotóxico e fetotóxico em coelhos que receberam a droga durante a organogênese.
Gravidez
paclitaxel (substância ativa) poderá causar danos fetais quando administrado a mulheres grávidas. O fármaco mostrou ser embriotóxico e fetotóxico em coelhos, além de diminuir a fertilidade em ratos. Não existem estudos em mulheres grávidas.
Mulheres em idade reprodutiva devem evitar a gravidez durante a terapia com). Se paclitaxel (substância ativa) for utilizado durante a gestação ou se a paciente ficar grávida enquanto em tratamento com a droga, a paciente deverá ser informada sobre os perigos potenciais.
Categoria de risco na gravidez: D.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Lactação
Não se sabe se o paclitaxel (substância ativa) é excretado no leite humano. Recomenda-se descontinuar a amamentação enquanto durar a terapia com paclitaxel (substância ativa).
Fertilidade
Dado o potencial mutagênico de paclitaxel (substância ativa), é necessária uma contracepção efetiva para pacientes do sexo masculino e feminino durante o tratamento e até 6 meses após o fim do tratamento. Como paclitaxel (substância ativa) pode diminuir a fertilidade masculina, a preservação do esperma pode ser considerada com o propósito de fecundidade posterior.
Imunizações
O uso concomitante de paclitaxel (substância ativa) com vacina de vírus vivos pode potencializar a replicação do vírus da vacina e/ou pode aumentar a reação adversa do vírus da vacina porque os mecanismos de defesa natural podem ser suprimidos pelo paclitaxel (substância ativa). A vacinação com vacinas de vírus vivos em pacientes recebendo paclitaxel (substância ativa) pode resultar em infecção grave. A resposta dos anticorpos destes pacientes a vacinas pode estar diminuída. O uso de vacinas vivas deve ser evitado e o conselho de um especialista deve ser considerado.
Reações Adversas
A frequência e a gravidade dos eventos adversos são geralmente similares entre os pacientes que receberam paclitaxel para o tratamento de câncer de ovário, mama, não-pequenas células de pulmão ou sarcoma de Kaposi. Entretanto, pacientes com sarcoma de Kaposi relacionado à AIDS podem sofrer com maior frequência e gravidade toxicidade hematológica, infecções e neutropenia febril. Estes pacientes necessitam de uma redução na intensidade da dose e de cuidados de suporte.
Análise Agrupada dos Eventos Adversos Ocorridos em Estudos com o Agente Único
Toxicidade Hematológica
Supressão da medula óssea foi a principal toxicidade dose-limitante de paclitaxel. Neutropenia, a mais importante toxicidade hematológica, foi dependente da dose e do esquema posológico e, em geral, rapidamente reversível.
Entre as pacientes tratadas em um estudo FASE III no câncer de ovário como terapia de segunda linha, com infusão de três horas, a contagem de neutrófilos reduziu-se abaixo de 500 células/mm3 em 14% dos pacientes tratados com uma dose de 135 mg/ m2, comparado a 27% com uma dose de 175 mg/m2 (p= 0,05). Neutropenia grave (< 500 células/ mm3) foi mais frequente com infusão de 24 horas do que com infusão de 3 horas; a duração da infusão teve um maior impacto na mielodepressão do que a dose.
A neutropenia não pareceu aumentar com a exposição cumulativa e não pareceu ser mais frequente ou mais grave em pacientes que haviam se submetido à radioterapia anterior.
Ocorreu febre com frequência (12% de todos os ciclos de tratamento).
Episódios infecciosos ocorreram frequentemente e foram fatais em 1% de todos os pacientes e incluíram sepse, pneumonia e peritonite. Infecções no trato urinário e no trato respiratório superior foram as complicações infecciosas relatadas com maior frequência.
Na população de pacientes imunodeprimidos com estágio avançado da doença por HIV e sarcoma de Kaposi relacionado à AIDS de pior risco, 61% dos pacientes relataram pelo menos uma infecção oportunista. O uso de terapia adjuvante, incluindo o G-CSF, é recomendado para pacientes que sofrem de neutropenia grave.
20% dos pacientes apresentaram queda na contagem de plaquetas abaixo de 100.000 células/mm3 pelo menos uma vez durante o tratamento; 7% tiveram uma contagem de plaquetas < 50.000 células/mm3 no seu pior nadir.
Episódios de hemorragia foram relatados em 4% de todos os ciclos e por 14% de todos os pacientes, mas a maioria dos episódios hemorrágicos era localizada e a frequência desses eventos não foi relacionada à dose ou ao esquema posológico de paclitaxel.
Observou-se anemia (Hb <11 g/dL) em 78% dos pacientes, considerada grave (Hb <8 g/dL) em 16% dos casos. Não se observou nenhuma relação consistente entre a dose ou o esquema posológico e a frequência de anemia.
Reações de Hipersensibilidade
Todos os pacientes receberam pré-medicação antes da administração de paclitaxel (vide ADVERTÊNCIAS). A dose ou o esquema posológico de paclitaxel não interfere na frequência e gravidade das reações de hipersensibilidade. No estudo FASE III para o tratamento de segunda linha do câncer de ovário, a infusão em 3 horas não foi associada a maior incidência de reações de hipersensibilidade, quando comparada a infusão de 24 horas.
Reações de hipersensibilidade foram observadas em 20% dos ciclos e em 41% dos pacientes. Essas reações foram graves em menos de 2% dos pacientes e 1% dos ciclos.
Os sintomas mais frequentes observados durante essas reações graves foram dispneia, rubor, dor no peito e taquicardia. Dor abdominal, dor nas extremidades, diaforese e hipertensão também são notadas.
Reações de hipersensibilidade menores, principalmente rubor e reações cutâneas, não necessitaram de tratamento e não requereram a interrupção da terapia. Calafrios e dores nas costas em associação com reações de hipersensibilidade foram reportados.
Cardiovasculares
Ocorreu hipotensão, durante as 3 primeiras horas de infusão, em 12% dos pacientes e em 3 % de todos os ciclos administrados. Ocorreu bradicardia, durante as três primeiras horas de infusão, em 3% dos pacientes e 1% de todos os ciclos.
Anormalidades de condução cardíaca grave foram reportadas em <1% dos pacientes durante o tratamento com paclitaxel. Estes eventos incluíram síncope, anormalidades do ritmo cardíaco, hipotensão e trombose venosa.
Se os pacientes desenvolverem anormalidades significativas de condução durante a administração de paclitaxel, terapia apropriada deve ser instituída e monitoramento eletrocardiográfico contínuo deve ser realizado durante a terapia subsequente com paclitaxel.
Fibrilação atrial e taquicardia supraventricular foram reportadas.
Respiratórias
Pneumonia intersticial, fibrose pulmonar e embolismo pulmonar foram reportadas.
Neurológicas
A frequência e severidade de manifestações neurológicas foram influenciadas por terapias prévia e concomitante com agentes neurológicos. Em geral, a frequência e a gravidade das manifestações neurológicas foram dose dependentes em pacientes recebendo paclitaxel como agente único. A frequência da neuropatia periférica aumenta com a dose cumulativa.
Parestesia ocorre comumente na forma de hiperestesia. A neuropatia periférica foi a causa da descontinuação de paclitaxel em 1% de todos os pacientes. Sintomas sensoriais normalmente melhoraram ou desapareceram em alguns meses após a interrupção do medicamento. Neuropatias pré-existentes resultando de terapias anteriores não são uma contraindicação para a terapia com paclitaxel.
Outros eventos neurológicos graves relatados após a administração de paclitaxel, além da neuropatia periférica) foram raros (<1%) e incluíram epilepsia do tipo grande mal, síncope, ataxia e encefalopatia. Neuropatia autonômica resultando em íleo paralítico foi reportada. Foram relatados também distúrbios do nervo óptico e/ou visuais (escotomas cintilantes), em particular nos pacientes que receberam doses mais altas que as recomendadas. Estes efeitos foram, em geral, reversíveis.
Raros relatos na literatura sobre a anormalidade visual potencial em pacientes tem sugerido lesão persistente do nervo óptico. Ocorreram relatos pós-comercialização de ototoxicidade (perda de audição e tinitus).
Artralgia/ Mialgia
Não há relação consistente entre dose ou esquema de tratamento com paclitaxel e a frequência ou gravidade de artralgia/mialgia. Sessenta por cento dos pacientes tratados apresentaram artralgia/mialgia; 8% apresentaram sintomas graves. Geralmente os sintomas foram transitórios e ocorreram dois ou três dias após administração de paclitaxel e cessaram dentro de poucos dias. A frequência e gravidade de sintomas musculoesqueléticos permaneceram inalterados durante o período de tratamento.
Hepáticas
Necrose hepática e encefalopatia hepática foram relatados.
Gastrintestinais
Náuseas/vômitos, diarreia e mucosite de leves a moderadas foram relatados muito comumente por todos os pacientes. Mucosite é dependente do esquema posológico e ocorre com maior freqüência com infusões de 24 horas do que com infusões de 3 horas.
Obstrução gastrintestinal, perfuração intestinal, pancreatite, colite isquêmica e desidratação, esofagite, constipação e ascites foram reportados.
Relatos raros de enterocolite neutropênica (tiflite), apesar da co-administração do G-CSF, foram observados em pacientes tratados com paclitaxel isolado e em combinação com outros agentes quimioterápicos.
Reações no Local da Injeção
Durante a administração intravenosa, as reações no local da injeção foram normalmente leves e consistiram de edema, dor, eritema, flacidez, e endurecimento localizados; ocasionalmente extravasamento pode resultar em celulite. Descamação da pele e/ou peeling foram relatados, algumas vezes relacionados a extravasamento. Descoloração da pele também pode ocorrer.
Estas reações foram observadas com maior frequência com infusões de 24 horas do que com infusões de 3 horas. A recorrência de reações cutâneas no local de um extravasamento anterior após a administração de paclitaxel em um outro acesso venoso foi raramente relatada.
Eventos mais graves, como flebite, celulite, endurecimento, esfoliação da pele, necrose e fibrose foram raros reportados.
Em alguns casos a ocorrência de reação no local da injeção deu-se durante uma infusão prolongada ou surgiu dentro de 1 semana a 10 dias após a infusão.
Outros Eventos Clínicos
A alopecia foi observada em quase todos os pacientes (87%).
Foram observadas alterações transitórias na pele resultante da reação de hipersensibilidade relacionadas ao paclitaxel, porém nenhuma outra toxicidade cutânea foi significativamente associada à administração de paclitaxel. Alterações nas unhas (mudanças de pigmentação ou descoloração do leito ungueal) foram incomuns (2%).
Edema foi relatado em 21% dos pacientes (17% deles sem edema basal); somente 1% apresentou edema grave e nenhum paciente necessitou de descontinuação do tratamento. O edema era usualmente focal e relacionado à doença. Observou-se edema em 5% dos ciclos nos pacientes normais e não se registrou aumento com o tempo no estudo.
Anormalidades cutâneas relacionados à radiação assim como relatos de erupção maculopapulosa, prurido, síndrome de Stevens- Johnson, e necrose epidérmica tóxica foram reportados.
Relatos de astenia e mal-estar também foram recebidos como parte da contínua análise de segurança de paclitaxel.
Terapia combinada
Paclitaxel + trastuzumabe
Quando paclitaxel foi administrado com uma infusão de 3 horas em combinação com trastuzumabe para tratamento de primeira linha de pacientes com câncer de mama metastático, os seguintes eventos (sem levar em consideração a relação com paclitaxel ou trastuzumabe) foram relatados mais frequentemente do que em relação ao paclitaxel administrado como agente único: insuficiência cardíaca, infecção, calafrios, febre, tosse, rash, artralgia, taquicardia, diarreia, hipertonia, epostase, acne, herpes simplex, ferimento acidental, insônia, rinite, sinusite, e reação no local da injeção.
Algumas destas diferenças na frequência podem ser devido ao número e duração aumentados de tratamentos com a combinação paclitaxel / trastuzumabe vs. paclitaxel como agente único. Eventos graves foram relatados a taxas similares para paclitaxel / trastuzumabe e paclitaxel como agente único.
A administração de trastuzumabe em combinação com paclitaxel em pacientes previamente tratados com antraciclinas resultou em frequência e gravidade aumentadas de disfunção cardíaca em comparação com pacientes tratados com paclitaxel como agente único e raramente foi associada com morte. Em tudo com exceção destes casos raros, pacientes responderam ao tratamento médico apropriado.
Paclitaxel + cisplatina
Quando administrado por uma infusão de 3 horas para quimioterapia de primeira linha para o câncer de ovário, neurotoxicidade, artralgia/mialgia, e hipersensibilidade foram relatados como mais frequentes e graves por pacientes tratados com paclitaxel seguido de cisplatina do que por pacientes tratados com ciclofosfamida seguida de cisplatina.
Comparação de neurotoxicidade em estudos cruzados (CA139-209 e CA139-022) indicaram que, quando paclitaxel é administrado em combinação com cisplatina 75 mg/m2, a incidência de neurotoxicidade grave é mais comum quando a dose de paclitaxel for 175 mg/m2 em infusão de 3 horas (21%) do que com a dose de 135 mg/m2 realizada em infusão de 24 horas (3%).
Paclitaxel + doxorubicin
Insuficiência cardíaca congestiva foi relatada na terapia combinada de paclitaxel e doxorrubicina em pacientes com câncer de mama metastático sem tratamento prévio e sem quimioterapia anterior.
Casos de infarto do miocárdio foram raramente relatados. Disfunção cardíaca e redução da fração de ejeção ventricular esquerda ou falha ventricular são relatadas tipicamente em pacientes em tratamento com paclitaxel que receberam outras quimioterapias, principalmente com antraciclinas.
Paclitaxel + radioterapia
Pneumonite por radiação foi relatado em pacientes recebendo radioterapia concomitante.
Eventos adversos por frequência
A frequência dos eventos adversos listada abaixo é definida usando o seguinte:
- Muito comum (?10%);
- Comum (? 1%, < 10%);
- Incomum (? 0,1%, < 1%);
- Raro (? 0,01%, < 0,1%);
- Muito raro (< 0,01%);
- Não conhecido (não pode ser estimado com base nos dados disponíveis).
Infecções e infestações
Muito comum:
Infecção.
Incomum:
Choque séptico.
Raro:
Pneumonia, sepse.
Desordens do sangue e do sistema linfático
Muito comum:
Mielossupressão, neutropenia, anemia, trombocitopenia, leucopenia, febre, sangramento.
Raro:
Neutropenia febril.
Muito raro:
Leucemia mieloide aguda, síndrome mielodisplásica.
Desordens do sistema imunológico
Muito comum:
Reações menores de hipersensibilidade (principalmente vermelhidão e erupção cutânea).
Incomum:
Reações significantes de hipersensibilidade requerendo tratamento (ex: hipotensão, edema angioneurótico, desconforto respiratório, urticária generalizada, edema, dor nas costas, calafrios).
Raro:
Reações anafiláticas (seguida de morte).
Muito raro:
Choque anafilático.
Desordens no metabolismo e nutrição
Muito raro:
Anorexia.
Não conhecido:
Síndrome de lise tumoral.
Desordens psiquiátricas
Muito raro:
Estado de confusão.
Desordens do sistema nervoso
Muito comum:
Neurotoxicidade (principalmente: neuropatia periférica).
Raro:
Neuropatia motora (com resultante fraqueza menor distal).
Muito raro:
Neuropatia autonômica (resultando em íleo paralítico e hipotensão ortostática), epilepsia do tipo grande mal, convulsões, encefalopatia, tontura, cefaleia, ataxia.
Desordens nos olhos
Muito raro:
Distúrbios reversíveis do nervo óptico e/ou visuais (escotomas cintilantes), particularmente em pacientes que tenham recebido doses maiores que as recomendadas, fotopsia, embaçamento visual.
Não conhecido:
Edema macular.
Desordens no ouvido e labirinto
Muito raro:
Perda da audição, tinitus vertigem, ototoxicidade.
Desordens cardíacas
Muito comum:
ECG anormal.
Comum:
Bradicardia.
Incomum:
Cardiomiopatia, taquicardia ventricular assintomática, taquicardia com bigeminismo, bloqueio AV e síncope, infarto do miocárdio.
Muito raro:
Fibrilação atrial, taquicardia supraventricular.
Desordens vasculares
Muito comum:
Hipotensão.
Incomum:
Hipertensão, trombose, tromboflebite.
Muito raro:
Choque.
Desordens respiratórias, torácicas e do mediastino
Raro:
Dispneia, derrame pleural, insuficiência respiratória, pneumonia intersticial, fibrose pulmonar, embolia pulmonar.
Muito raro:
Tosse.
Desordens gastrointestinais
Muito comum:
Náusea, vômito, diarreia, mucosite.
Raro:
Obstrução intestinal, perfuração intestinal, colite isquêmica, pancreatite.
Muito raro:
Trombose mesentérica, colite pseudomembranosa, esofagite, constipação, ascite.
Desordens hepato-biliares:
Muito raro:
Necrose hepática (seguida de morte), encefalopatia hepática (seguida de morte).
Desordens do tecido subcutâneo e da pele
Muito comum:
Alopecia.
Comum:
Alterações transientes e moderadas na pele e unhas.
Raro:
Prurido, erupção cutânea, eritema, flebite, celulite, esfoliação da pele, necrose e fibrose, radiation recall.
Muito raro:
Síndrome de Stevens-Johnson, necrólise epidérmica, eritema multiforme, dermatite esfoliativa, urticária, oncólifse (pacientes em tratamento devem usar protetor solar nas mãos e nos pés).
Não conhecido:
Esclerodermia, lupus eritematoso cutâneo.
Desordens musculo-esqueléticas, nos ossos e tecidos de conexão
Muito comum:
Artralgia, mialgia.
Não conhecido:
Lupus eritematoso sistêmico.
Desordens gerais e condições do local da administração
Comum:
Reações no local da injeção (incluindo edema localizado, dor, eritema, endurecimento, o extrvasamento pode resultar em celulite).
Raro:
Astenia, mal-estar, pirexia, desidratação, edema.
Investigações
Comum:
Elevação grave no AST (SGOT), elevação grave na fosfatase alcalina.
Incomum:
Elevação grave na bilirrubina.
Raro:
Aumento da creatinina no sangue.
Em casos de eventos adversos, notifique ao Sistema de Notificações da Vigilância Sanitária - NOTIVISA ou para Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
Cisplatina
Em estudos clínicos combinados, a mielossupressão foi mais acentuada e o clearance do paclitaxel (substância ativa) foi reduzido em cerca de 20% quando se administrou paclitaxel (substância ativa) após a cisplatina, comparativamente a paclitaxel (substância ativa) administrado antes da cisplatina.
Substratos, Indutores, Inibidores do Citocromo P450 2C8 e 3A4
O metabolismo de paclitaxel (substância ativa) é catalisado pelo citocromo P450, isoenzimas CYP2C8 e CYP3A4. Deve-se ter cuidado quando da administração de paclitaxel (substância ativa) concomitantemente com conhecidos substratos, indutores (ex. rifampicina, carbamazepina, fenitoína, enfavirenz, nevirapina) ou inibidores (ex. eritromicina, fluxetina, genfibrozil) do citocromo P450, isoenzimas CYP2C8 e CYP3A4.
Doxorrubicina
Efeitos relacionados a administração sequencial, caracterizados por episódios mais acentuados de neutropenia e estomatite foram observados com o uso combinado de paclitaxel (substância ativa) e doxorrubicina quando se administrou paclitaxel (substância ativa) antes da doxorrubicina e por períodos de infusão mais longos do que os recomendados. Os níveis plasmáticos de doxorrubicina (e de seu metabólito ativo doxorrubicinol) podem aumentar quando paclitaxel (substância ativa) e doxorrubicina são utilizados em combinação. Entretanto, dados de um estudo utilizando doxorrubicina in bolus e infusão de paclitaxel (substância ativa) por 3 horas não mostraram efeitos sequenciais nos padrões de toxicidade.
Outras interações
Há um risco aumentado de doença sistêmica fatal por vacina com o uso concomitante com vacinas vivas. Vacinas vivas não são recomendadas em pacientes imunodeprimidos.
Ação da Substância
Resultados da eficácia
Carcinoma de ovário
Terapia de primeira linha:
A segurança e eficácia do paclitaxel acompanhado por cisplatina em pacientes com carcinoma de ovário avançado e sem quimioterapia prévia foram avaliadas em 2 estudos FASE III multicêntricos, randomizados e controlados.
Em um estudo do intergrupo conduzido pela Organização Europeia de Pesquisa e Tratamento de Câncer que envolvem o Grupo Escandinavo Nocova, o Instituto Nacional de Câncer do Canadá e o Grupo Escocês, 680 pacientes com estágio da doença IIB–C, III, ou IV (ressecção ampla ótima ou não ótima) receberam infusão de paclitaxel 175 mg/m em um período de 3 horas seguida por cisplatina 75 mg/m (Tc) ou ciclofosfamida 750 mg/ m seguidos por cisplatina 75 mg/m (Cc) por uma mediana de seis ciclos.
Embora o protocolo permitisse uma terapia adicional, somente 15% dos pacientes receberam ambas as drogas por nove ou mais ciclos. Em um estudo conduzido pelo Grupo de Oncologia Ginecológica (GOG), 410 pacientes com Estágio III ou IV da doença (> 1 cm de doença residual após laparotomia para estadiamento ou metástase à distância) receberam infusão de paclitaxel 135 mg/m num período de 24 horas seguido por cisplatina 75 mg/m ou, senão ciclofosfamida 750 mg/m seguido por cisplatina 75 mg/m por 6 ciclos.
Em ambos os estudos, pacientes tratados com paclitaxel em combinação com cisplatina tiveram um taxa de resposta significativamente maior, um tempo maior para progressão e um tempo de sobrevida maior, comparado com a terapia padrão. Estas diferenças também foram significativas para o subgrupo de pacientes no estudo do Intergrupo com doença não otimamente ressecada, embora o estudo não tenha sido totalmente capacitado para análise de subgrupo (Tabelas 1 e 2).
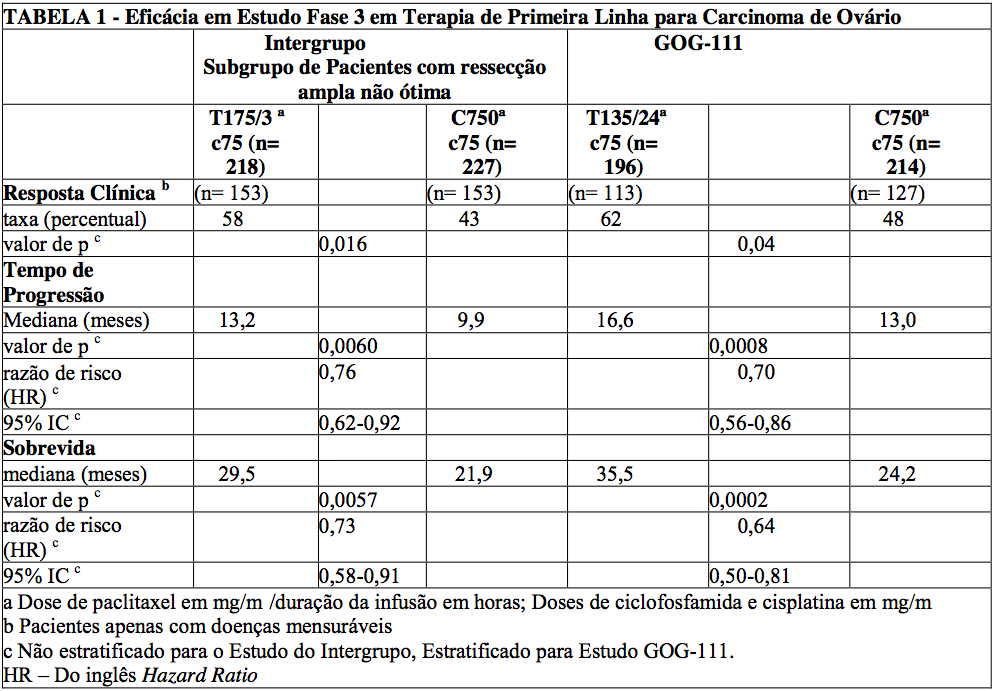
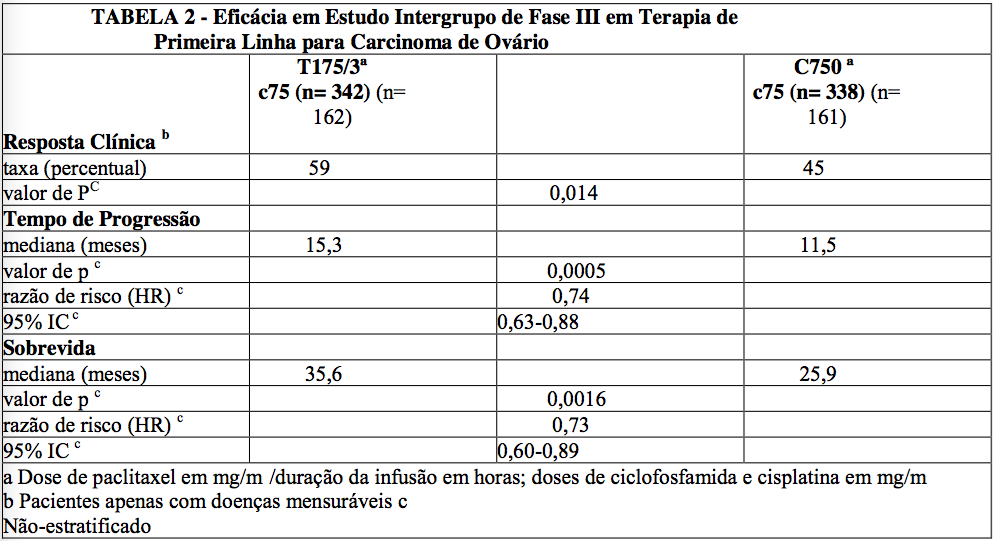
O perfil de eventos adversos para os pacientes que receberam paclitaxel, em combinação com cisplatina nestes estudos, foi qualitativamente consistente com o que foi observado na análise dos dados dos 812 pacientes tratados unicamente com paclitaxel em 10 estudos clínicos.
Terapia de segunda linha:
Dados de cinco estudos clínicos fase I e II (189 pacientes), um estudo de FASE III multicêntrico, randomizado (407 pacientes), assim como a análise dos dados de mais de 300 pacientes envolvidos em um programa de tratamento de um centro de referência foram usados para sustentar o uso de paclitaxel nos pacientes que tiveram falha inicial ou subsequente da quimioterapia para carcinoma de ovário metastático.
Dois dos estudos FASE II (92 pacientes) utilizaram uma dose inicial de 135 a 170 mg/ m na maioria dos pacientes (> 90%), que receberam infusão contínua num período de 24 horas. As taxas de resposta destes dois estudos foram 22% (lC de 95%: 11 a 37%) e 30% (lC de 95%: 18 a 46%) com um total de 6 respostas completas e 18 parciais em 92 pacientes. A duração mediana da resposta global nestes dois estudos medidos no primeiro dia do tratamento foi de 7,2 meses (faixa: 3,5-15,8 meses) e 7,5 meses (faixa: 5,3-17,4 meses), respectivamente.
A sobrevida mediana foi de 8,1 meses (faixa: 0,2-36,7 meses) e 15,9 meses (faixa: 1,8-34,5+ meses).
O estudo de FASE III teve um desenho bi-fatorial e comparou a eficácia e segurança do paclitaxel, administrado em 2 diferentes doses (135 ou 175 mg/m2) e programações (3 ou 24 horas de infusão).
A taxa de resposta global para 407 pacientes foi 16,2% (95% lC: 12,8 a 20,2%), com 6 respostas completas e 60 respostas parciais. A duração da resposta medida no primeiro dia de tratamento foi de 8,3 meses (faixa: 3,2-21,6 meses).
O tempo mediano da progressão foi de 3,7 meses (faixa: 0,1+- 25,1+ meses). A sobrevida mediana foi de 11,5 meses (faixa: 0,2-26,3+ meses). As taxas de resposta, a sobrevida mediana e o tempo mediano de progressão para os 4 braços estão na tabela a seguir.
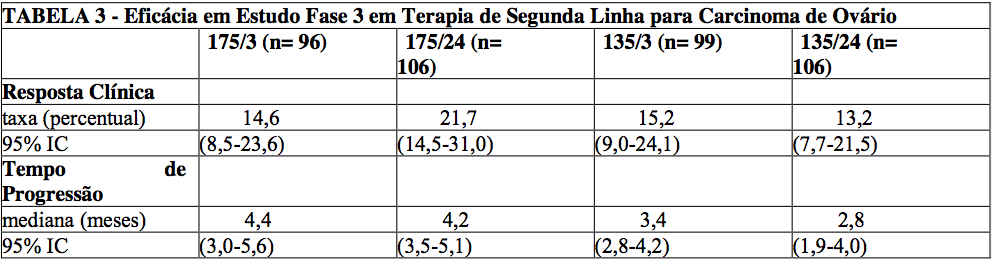

Análises foram realizadas conforme planejado no desenho do estudo bi-fatorial descrito no protocolo, comparando as duas doses (135 ou 175 mg/m ), independentemente do esquema (3 ou 24 horas) e os dois esquemas indepentemente da dose.
Os pacientes que receberam a dose de 175 mg/ m tiveram uma taxa de resposta similar aos que receberam a dose de 135 mg/m 18% vs. 14% (p=0,28). Não foi detectada nenhuma diferença na taxa de resposta quando comparado o período de infusão de 3 horas com o período de 24 horas: 15% vs.17% (p=0,50).
Pacientes que receberam a dose de 175 mg/m de paclitaxel tiveram um maior tempo de progressão do que aqueles que receberam a dose de 135 mg/ m de paclitaxel: mediana de 4,2 contra 3,1 meses (p= 0,03). O tempo mediano de progressão para os pacientes que receberam infusão de 3 horas contra 24 horas foi de 4,0 meses contra 3,7 meses, respectivamente.
A sobrevida mediana foi de 11,6 meses em pacientes que receberam dose de 175 mg/m de paclitaxel e 11,0 meses em pacientes que receberam a dose de 135 mg/m (p=0,92). A sobrevida mediana foi de 11,7 meses em pacientes que receberam infusão de paclitaxel em um período de 3 horas de infusão e 11,2 meses em pacientes que receberam infusão em um período de 24 horas (p=0,91).
Estas análises estatísticas devem ser vistas com cautela devido às múltiplas comparações realizadas. Paclitaxel permaneceu eficaz em pacientes que desenvolveram resistência à terapia com platina (definido como tumor progressivo ou reincidência do tumor dentro de 6 meses após conclusão de terapia com platina), com taxas de respostas de 14% na FASE III e 31% nas Fases I e II dos estudos clínicos.
O perfil dos eventos adversos neste estudo FASE III foi consistente com aquele observado na análise de dados dos 812 pacientes tratados em 10 estudos clínicos. Os resultados deste estudo randomizado suportam o uso de paclitaxel nas doses de 135 a 175 mg/m , administrados por infusão intravenosa num período de 3 horas. Estas doses administradas por infusão num período de 24 horas demonstraram maior toxicidade. Entretanto, o estudo não tinha poder suficiente para avaliar se uma determinada dose e esquema produziram eficácia superior.
Câncer de mama
Terapia Adjuvante
Um estudo Intergrupo de FASE III (Cancer and Leukemia Group B [CALGB], Eastern Cooperative Oncology Group [ECOG], North Central Cancer Treatment Group [NCCTG] e o Southwest Oncology Group [SWOG]) randomizou 3170 pacientes com carcinoma de mama linfonodo positivo para terapia adjuvante com paclitaxel ou sem quimioterapia adicional após quatro ciclos de doxorrubicina e ciclofosfamida (AC).
Esteestudo multicêntrico foi conduzido em mulheres com linfonodos histologicamente positivos após mastectomia ou mastectomia segmentada e dissecação linfonodal O estudo fatorial 3 x 2 foi projetado para avaliar a eficácia e segurança de três níveis diferentes de doses de doxorrubicina (A) e para avaliar o efeito da adição de paclitaxel administrado após o término da terapia (AC).
Após estratificação do número de linfonodos positivos (1-3, 4-9, ou 10+), os pacientes foram randomizados para receber 600 mg/m2 de ciclofosfamida e doxorrubicina na dose de 60 mg/m (no dia 1), 75 mg m2 (em duas doses divididas nos dias 1 e 2) ou 90 mg/ m2 (em duas doses divididas nos dias 1 e 2 com suporte profilático de G-CSF e ciprofloxacina) a cada 3 semanas por quatro ciclos e paclitaxel 175 mg m2 com infusão de 3 horas a cada 3 semanas por quatro ciclos adicionais ou sem quimioterapia adicional. Os pacientes com tumores positivos para receptores hormonais receberam tratamento subsequente com tamoxifeno (20 mg por dia por 5 anos); pacientes que passaram por mastectomia segmentada antes do início do estudo, receberam tratamento radioterápico na mama após a recuperação das toxicidades relacionadas ao tratamento.
Por ocasião desta análise, o acompanhamento mediano foi de 30,1 meses. Dos 2066 pacientes com receptor hormonal positivo, 93% receberam tamoxifeno. As análises primárias de sobrevida livre de doença e sobrevida global empregaram modelos Cox multivariados, nos quais incluíram os seguintes fatores: administração de paclitaxel, dose de doxorrubicina, número de linfonodos positivos, tamanho do tumor, menopausa e presença de receptores de estrogênio.
Baseado no modelo de sobrevida livre de doença, os pacientes que receberam tratamento AC seguido por paclitaxel e tiveram uma redução de 22% no risco de recorrência da doença comparado aos pacientes randomizados com apenas o tratamento AC (Razão de risco [HR] = 0,78, 95% IC 0,67-0,91, p=0,0022). Os pacientes também tiveram uma redução de 26% no risco de morte (HR = 0,74, 95% IC 0,60- 0,92, p=0,0065).
Para sobrevida livre de doença e sobrevida global, os valores de p não foram ajustados para análises intermediárias. O aumento da dose de doxorrubicina acima de 60 mg/ m2 não alterou o efeito na sobrevida livre de doença ou na sobrevida global.
Análise dos subgrupos
Os subgrupos foram definidos através de variáveis de importância prognóstica conhecida no carcinoma de mama, incluindo número de linfonodos positivos, tamanho do tumor, status dos receptores hormonais e status da menopausa.
Estas análises devem ser interpretadas com cuidado, uma vez que o achado mais seguro é o resultado do estudo global.
Em geral, uma redução do risco similar à redução global foi observada com paclitaxel, tanto para a sobrevida livre de doença quanto para a sobrevida global em todos os maiores subgrupos com apenas uma exceção, pacientes com tumores com receptores hormonais positivos apresentaram uma menor redução no risco (HR =0,92) para sobrevida livre de doença com paclitaxel do que outros grupos.
Os resultados de análises do subgrupo estão demonstrados na tabela a seguir
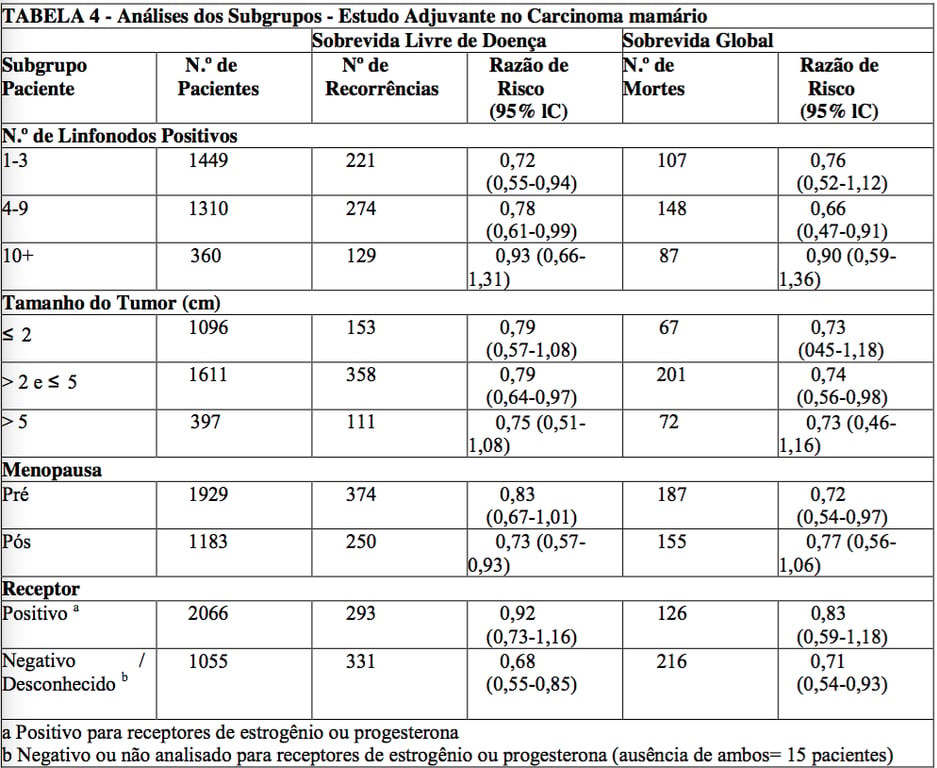
As análises retrospectivas dos subgrupos sugerem que o efeito benéfico do paclitaxel foi claramente estabelecido em subgrupos receptores-negativos, mas o beneficio em pacientes receptores-positivos ainda não está claro. Em relação à menopausa, o benefício do paclitaxel é consistente (vide Tabela 4).
O perfil dos eventos adversos para pacientes que receberam paclitaxel após terapia AC foi consistente com o observado na análise dos dados dos 812 pacientes tratados apenas com paclitaxel em 10 estudos clínicos.
Após falha da quimioterapia inicial
Dados de 83 pacientes avaliados em 3 estudos abertos FASE II e de 471 pacientes incluídos em um estudo randomizado FASE III foram utilizadas para sustentar o uso de paclitaxel em pacientes com carcinoma de mama metastático.
Estudos FASE II abertos:
Dois estudos foram conduzidos com 53 pacientes previamente tratados com no máximo um regime quimioterápico anterior. O paclitaxel foi administrado nestes dois estudos com infusão de 24 horas com doses iniciais de 250 mg m2 (com suporte G-CSF) ou 200 mg/ m2.
As taxas de respostas foram 57% (95% IC: 37 a 75%) e 52% (95% IC: 32 a 72%), respectivamente. O terceiro estudo FASE II foi conduzido em pacientes pré-tratados extensivamente que apresentaram falha na terapia com medicamentos da classe das antraciclinas que tinham recebido um mínimo de dois regimes de quimioterapia para o tratamento de doença metastática. A dose de paclitaxel foi de 200 mg/m2 com infusão de 24 horas de suporte G-CSF. Nove dos 30 pacientes apresentaram uma resposta parcial, para uma taxa de resposta de 30 % (95% IC: 15 a 50%).
Estudo FASE III randomizado:
Este estudo multicêntrico foi conduzido em pacientes previamente tratados com um ou dois regimes quimioterápicos. Os pacientes foram randomizados para receber paclitaxel na dose de 175 mg/m2 ou 135 mg/m2 administrados num período de infusão de 3 horas. Em 471 pacientes envolvidos na pesquisa, 60% apresentaram doenças sintomáticas com estado de desempenho insuficiente por ocasião do início do estudo (performance status) e 73% pacientes apresentavam metástase visceral.
Estes pacientes apresentavam falha na quimioterapia anterior tanto no tratamento adjuvante (30%), como para a doença metastática (39%) ou a ambos (31%). Sessenta e seis por cento dos pacientes apresentavam exposição prévia a medicamentos da classe das antraciclinas e 23% deles apresentavam resistência considerável da doença à esta classe de agentes.
A taxa de resposta global para os 454 pacientes avaliáveis foi de 26% (95% IC: 22 a 30%), com 17 respostas completas e 99 respostas parciais. A duração mediana da resposta avaliada desde o primeiro dia de tratamento foi de 8,1 meses (faixa: 3,4–18,1meses). No total de 471 pacientes, o tempo mediano de progressão foi de 3,5 meses (faixa: 0,03–17,1 meses). A sobrevida mediana foi de 11,7 meses (faixa: 0-18,9 meses).
As taxas de resposta, sobrevida mediana e tempo mediano de progressão para os 2 braços do estudo estão demonstrados na tabela a seguir
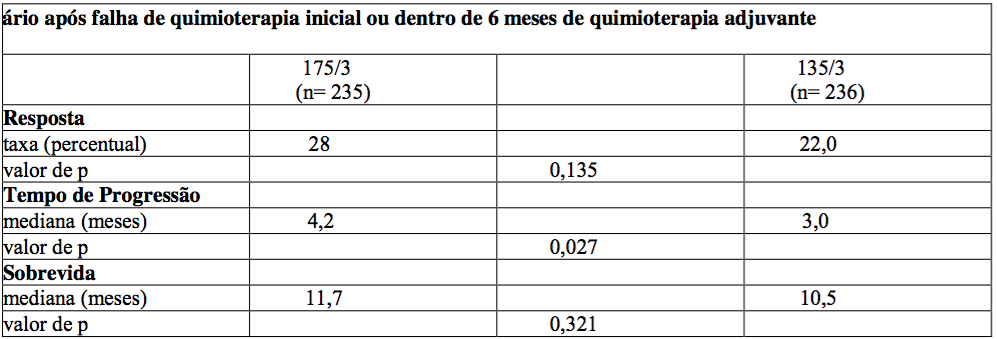
O perfil dos eventos adversos dos pacientes que receberam apenas paclitaxel no estudo FASE III foi consistente com o perfil observado na análise de dados dos 812 pacientes tratados em 10 estudos clínicos.
Terapia de primeira linha em câncer avançado ou metastático de mama, em combinação com trastuzumabe, em pacientes com super expressão do HER-2 em níveis de 2+ e 3+ como determinado por imuno-histoquímica
Há evidências suficientes de que a eficácia observada com a combinação de trastuzumabe e paclitaxel na terapia de primeira linha da doença metastática resulta de uma contribuição significativa tanto do trastuzumabe quanto do paclitaxel.
Os benefícios superam os riscos desta terapia em pacientes com câncer de mama metastático com super expressão de HER2. Isso é demonstrado através de uma melhora significativa na eficácia em comparação ao paclitaxel isolado e aos dados históricos sobre o agente isolado trastuzumabe.
Todos os subgrupos clinicamente estudados pareceram se beneficiar do tratamento com a associação do trastuzumabe em termos de taxa de resposta tumoral e tempo para a progressão da doença. Entretanto, os pacientes que têm um escore de 3+ de super expressão de HER-2 apresentaram maior benefício que aqueles que têm um escore de 2+.
Câncer de Não-pequenas Células do Pulmão (CNPCP)
Em estudo Fase III, aberto, randomizado e conduzido pelo ECOG, 599 pacientes foram randomizados com paclitaxel (T) na dosagem de 135 mg/m2 com infusão de 24 horas em combinação com cisplatina (c) 75 mg/m2, com paclitaxel (T) na dosagem de 250 mg/m2 com infusão de 24 horas em combinação com cisplatina (c) 75 mg/m2 com suporte G-CSF, ou cisplatina (c) 75 mg/m2 no dia 1, seguido por etoposídeo (VP) 100 mg/m2 nos dias 1, 2, e 3 (controle).
As taxas de resposta, o tempo mediano para progressão, a sobrevida mediana e as taxas de 1 ano de sobrevida estão descritos na tabela a seguir. Os valores de p fornecidos não foram ajustados para múltiplas comparações. Houve diferenças estatisticamente significativas a favor de cada um dos braços de paclitaxel + cisplatina, para a taxa de resposta e tempo de progressão da doença.
Não houve diferenças estatisticamente significativas na sobrevida entre o braço paclitaxel + cisplatina e o braço cisplatina + etoposídeo.
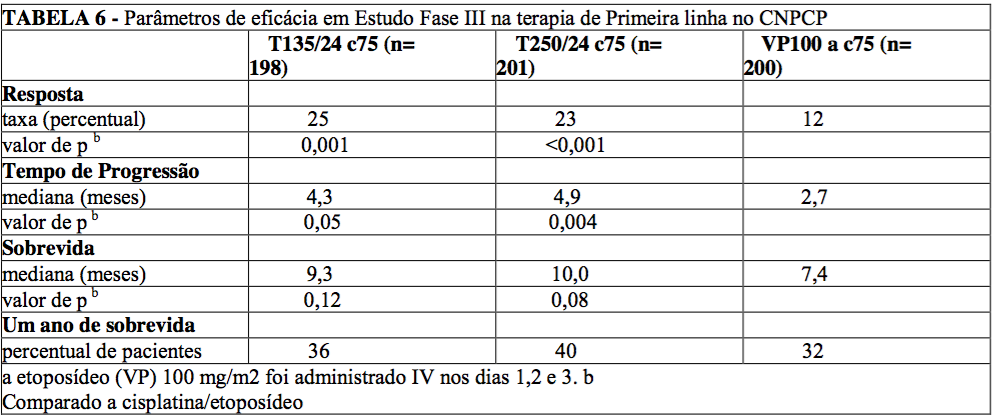
No estudo ECOG, o questionário da Avaliação Funcional da Terapia de Câncer do Pulmão (FACT-L) teve sete sub- escalas que mediram a avaliação subjetiva do tratamento. Das sete, a sub-escala dos sintomas específicos do câncer de pulmão favoreceu o braço paclitaxel 135 mg/m2 (24 horas) + cisplatina, comparado ao braço cisplatina + etoposídeo. Para todos os outros fatores, não houve diferença entre os grupos de tratamento.
O perfil dos eventos adversos dos pacientes que receberam paclitaxel em combinação com cisplatina no estudo em geral foi consistente com o perfil observado na análise de dados dos 812 pacientes tratados apenas com paclitaxel, em 10 estudos clínicos realizados.
Sarcoma de Kaposi Relacionado à AIDS
Dados de dois estudos abertos FASE II suportam o uso de paclitaxel como segunda linha de tratamento em pacientes com sarcoma de Kaposi Relacionado à AIDS. Cinquenta e nove dos 85 pacientes envolvidos nestes estudos receberam previamente terapia sistêmica, incluindo Interferon Alfa (32%), DaunoXome (31%), DOXIL(2%) e quimioterapia com doxorrubicina ( 42%), sendo que 64 % haviam recebido medicamentos da classe das antraciclinas. Oitenta e cinco por cento dos pacientes pré-tratados progrediram ou não toleraram a terapia sistêmica prévia.
No estudo CA 139-174, os pacientes receberam paclitaxel 135 mg/m2 com infusão de 3 horas a cada 3 semanas (intensidade da dose pretendida 45 mg/m /semana). Os pacientes receberam 155 mg/m2 e 175 mg/m2 em ciclos subsequentes, caso nenhuma toxicidade dose limitante fosse observada.
Fatores de crescimento hematopoiético não foram utilizados inicialmente. No estudo CA 139-281 os pacientes receberam paclitaxel 100 mg/m2 com infusão de 3 horas a cada 2 semanas (intensidade da dose pretendida 50 mg/m /semana). Neste estudo os pacientes poderiam receber suporte hematopoiético antes de iniciar a terapia com paclitaxel, ou este suporte poderia ser iniciado como indicado; a dose de paclitaxel não foi aumentada. A intensidade da dose de paclitaxel utilizado nesta população foi menor do que a intensidade da dose recomendada para outros tumores sólidos.
Todos os pacientes apresentavam doenças disseminadas e de baixo risco. Aplicando os critérios da escala (ACTG) para os pacientes submetidos à terapia sistêmica prévia, 93 % eram de baixo risco em relação à extensão da doença (T1), 88 % com a contagem de CD4 <200 células/mm3 (I1) e considerando respectivas doenças sistêmicas 97 % apresentavam baixo risco (S1).
Todos os pacientes no estudo CA 139-174 apresentavam um status do desempenho Karnofsky de 80 ou 90 no valor basal; no estudo CA 139-281, havia 26 (46%) pacientes com um status do desempenho Karnofsky de 70 ou pior no valor basal.
| TABELA 7 - Extensão da Doença no Início do Estudo -Percentual de Pacientes | |
| Visceral ±edema ± oral ± cutâneo | Terapia Sistêmica Prévia (n= 59) 42 |
| Edema ou linfonodo ± oral ± cutâneo | 41 |
| Oral ± cutâneo | 10 |
| Somente Cutâneo | 7 |
Embora a intensidade da dose planejada em dois estudos tenha sido ligeiramente diferente (45 mg/m2/semana no estudo CA 139-174 e 50 mg/m2/semana no estudo CA 139-281), a intensidade da dose administrada foi de 38-39 mg/m2/ semana em ambos estudos, com uma variação similar (20-24 a 51-61).
Eficácia
A eficácia do paclitaxel foi avaliada através da resposta tumoral cutânea, de acordo com os critérios da Emenda da ACTG e também através da busca de evidências de benefícios clínicos aos pacientes em 6 domínios de sintomas e/ou condições que estivessem comumente relacionadas ao sarcoma de Kaposi relacionado à AIDS.
Resposta tumoral cutânea
O objetivo da taxa de resposta era de 59% (95% IC: 46% a 72%) (35 de 59 pacientes) em pacientes com terapia sistêmica prévia. As respostas cutâneas foram primariamente definidas como rebaixamento de mais de 50% das lesões previamente levantadas.
| TABELA 8 - Melhor Resposta Global (Critério da Emenda ACTG) -Percentual de Pacientes | |
| Resposta Completa | Terapia Sistêmica Prévia (n= 59) 3 |
| Resposta Parcial | 56 |
| Doença estável | 29 |
| Progressão | 8 |
| Morte precoce / Toxicidade | 3 |
O tempo mediano de resposta foi de 8,1 semanas e a duração mediana da resposta medida no primeiro dia de tratamento foi de 10,4 meses (95% IC: 7,0 a 11,0 meses) para os pacientes que previamente receberam terapia sistêmica. O tempo mediano de progressão foi de 6,2 meses (95% lC: 4,6 a 8,7 meses).
Benefícios Clínicos Adicionais
A maioria dos dados dos pacientes beneficiados foi avaliada retrospectivamente (planos para esta análise não foram incluídos nos protocolos dos estudos). No entanto, as descrições clínicas e fotográficas indicaram benefícios claros em alguns pacientes, incluindo melhora da função pulmonar em pacientes com comprometimento pulmonar, melhora na deambulação, resolução de úlceras e diminuição de necessidade de analgésicos em pacientes com Sarcoma de Kaposi nos pés e melhora de lesões faciais e edema em pacientes com SK na face, extremidades e genitália.
Segurança
O perfil dos eventos adversos apresentados pelos pacientes com AIDS avançada ou de baixo risco de Sarcoma de Kaposi relacionado à AIDS que receberam paclitaxel foi, em geral, semelhante ao observado na análise de dados dos 812 pacientes com tumores sólidos.
Nos pacientes imunossuprimidos, entretanto, é recomendada uma menor intensidade de dose de paclitaxel e terapia de apoio, incluindo fatores de crescimento hematopoiético em pacientes com neutropenia grave. Pacientes com Sarcoma de Kaposi relacionado à AIDS podem apresentar toxicidade hematológica mais severa do que em pacientes com tumores sólidos.
Características Farmacológicas
O paclitaxel possui atividade antitumoral.
Mecanismo de ação
O paclitaxel é um novo agente antimicrotúbulo que promove a agregação dos microtúbulos a partir dos dímeros de tubulina. Ele estabiliza os microtúbulos prevenindo a despolimerização, resultando na inibição da dinâmica normal de reorganização da rede de microtúbulos essencial para as funções celulares. O paclitaxel também induz a formação anormal ou feixe de microtúbulos durante o ciclo celular e múltiplos ásteres de microtúbulos durante a mitose.
Farmacocinética
A farmacocinética do paclitaxel foi avaliada em uma série de doses, até 300 mg/m2, e esquemas de infusão, variando de 3 a 24 horas e demonstrou ser não-linear e saturável com um aumento desproporcionalmente grande dos valores de concentração máxima (Cmáx) e área sob a curva (AUC) com o aumento da dose, acompanhado por uma diminuição aparente, relacionada à dose, do clearance corpóreo total.
Após a administração intravenosa, o paclitaxel mostra um declínio bifásico das concentrações plasmáticas. O declínio rápido inicial representa a distribuição para os compartimentos periféricos e a eliminação da droga. A última fase deve-se, em parte, a um efluxo relativamente lento do paclitaxel do compartimento periférico. Em pacientes tratados com doses de 135 e 175 mg/m2 administrados por infusões de 3 e 24 horas, a meia-vida final média variou de 13,1 a 52,7 horas e o clearance corpóreo total variou de 12,2 a 23,8 L/h/m . O volume médio de distribuição no estado de equilíbrio variou de 198 a 688 L/m , indicando uma distribuição extravascular extensa e/ou ligação do paclitaxel aos tecidos.
A variabilidade na exposição sistêmica do paclitaxel, avaliada pela AUC(o-oo) para ciclos de tratamento sucessivos é mínima; não há evidências de acúmulo do paclitaxel quando administrado em múltiplos ciclos de tratamento.
Distribuição
Em média, 89% da droga encontra-se ligada às proteínas séricas; a presença de cimetidina, ranitidina, dexametasona ou difenidramina não altera a taxa de ligação protéica do paclitaxel.
Metabolismo
Estudos in vitro com microssomos hepáticos humanos e pedaços de tecidos demonstraram que o paclitaxel é metabolizado fundamentalmente ao 6?-hidroxipaclitaxel pelo citocromo P450 isoenzima CYP2C8; e a dois metabólitos menores, o 3-p-hidroxipaclitaxel e o 6?,3'-p-diidroxipaclitaxel pelo CYP3A4. In vitro, o metabolismo do paclitaxel a 6?-hidroxipaclitaxel foi inibido por vários agentes. O efeito da disfunção renal sobre a disposição do paclitaxel não foi estudado.
Excreção
Após administração intravenosa de doses de 15 a 275 mg/m2 de paclitaxel por 1, 6 ou 24 horas de infusão, os valores médios de recuperação urinária cumulativa da droga inalterada variaram de 1,3% a 12,6% da dose. Isto indica um clearance não-renal extenso de paclitaxel. Em 5 pacientes que receberam doses radio marcadas de 225 ou 250 mg/m2 de paclitaxel por infusão de 3 horas, 14% da radioatividade foi recuperada na urina e 71% foi excretada nas fezes em 120 horas. A recuperação total da radioatividade variou de 56% a 101% da dose. O paclitaxel representou uma média de 5% da radioatividade recuperada nas fezes, enquanto que os metabólitos, principalmente o 6?-hidroxipaclitaxel, responderam pelo restante.
Insuficiência Hepática
A disposição e toxicidade da infusão de 3 horas de paclitaxel foi avaliada em 35 pacientes com variados graus de função hepática. Em comparação com os pacientes com bilirrubina normal, a exposição plasmática ao paclitaxel em pacientes com nível de bilirrubina sérica anormal menor ou igual a 2 vezes o limite superior da normalidade (LSN), que receberam 175 mg/m2, foi aumentada, mas não com aumento aparente na frequência ou severidade da toxicidade.
Em cinco pacientes com nível de bilirrubina sérica total maior que 2 vezes LSN, houve uma incidência maior estatisticamente não significativa de mielossupressão grave, mesmo com dose reduzida (110 mg/m2), mas não foi observado aumento na exposição plasmática.