Comparamos o preço de Tarfic 0,03Mg Pomada 10G, veja o menor preço

R$ 75,41
ISimilar Intercambiável
14
ofertasMelhores preços a partir de R$ 69,28 até R$ 91,37
Oferta patrocinada
vendido por Drogaria Nova Esperança
economize
17.47%
R$ 75,41
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
Oferta patrocinada
vendido por Drogarias Pacheco
economize
12.83%
R$ 79,65
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Oferta patrocinada
vendido por Drogaria São Paulo
economize
5.54%
R$ 86,31
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Preço Popular
economize
24.18%
R$ 69,28
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogaria Vera Cruz
economize
19.00%
R$ 74,01
Entregas para todo o Brasil. Clique e confira!
vendido por Farmácia Indiana
economize
17.04%
R$ 75,80
vendido por Drogão Net
economize
15.58%
R$ 77,13
vendido por Drogaria Araújo
economize
14.64%
R$ 77,99
vendido por Panvel Farmácias
economize
13.86%
R$ 78,71
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogaria Catarinense
economize
10.40%
R$ 81,87
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Online Farmagora
economize
10.26%
R$ 82,00
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Drogaria Primus
economize
7.76%
R$ 84,28
vendido por Pague Menos
economize
5.89%
R$ 85,99
vendido por Promofarma
R$ 91,37
Para que serve
Tarfic possui efeito nas células do sistema imune e está indicado para:
- Tratamento de dermatite atópica (também chamada de eczema) em pacientes que não apresentam boa resposta ou são intolerantes aos tratamentos convencionais;
- Promover alívio dos sintomas e controlar os surtos;
- Manutenção do tratamento de dermatite atópica para prevenção de surtos dos sintomas e para prolongar os intervalos livres de surtos em pacientes que possuem alta frequência de piora da doença (isto é, que ocorra 4 ou mais vezes por ano) e que tiveram uma resposta inicial a um tratamento máximo de 6 semanas, 2 vezes ao dia, com tacrolimo pomada (lesões que desapareceram, lesões que quase desapareceram ou áreas levemente afetadas).
Tarfic 0,03% está indicado para uso em crianças de 2 a 15 anos de idade e adultos.
Tarfic 0,1% está indicado para uso em indivíduos acima de 16 anos de idade.
Como Tarfic funciona?
Na dermatite atópica, uma reação anormal do sistema imune da pele causa inflamação caracterizada por coceira, vermelhidão e ressecamento.
Tarfic altera a resposta imune anormal e alivia as inflamações na pele e a coceira.
A melhora é geralmente verificada dentro de uma semana.
Contraindicação
Não use Tarfic se você for alérgico (hipersensível) ao tacrolimo ou qualquer um dos componentes da fórmula ou à antibióticos macrolídeos (tais como, azitromicina, claritromicina, eritromicina).
Este medicamento é contraindicado para menores de 2 anos.
Este medicamento não deve ser utilizado por mulheres que estão amamentando sem orientação médica ou do cirurgião-dentista.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Como usar
Sempre utilize Tarfic exatamente como seu médico prescreveu.
Em caso de qualquer dúvida, verifique com seu médico ou farmacêutico.
Aplique Tarfic como uma fina camada nas áreas afetadas de sua pele.
Tarfic pode ser utilizado na maioria das partes do corpo, incluindo a face, pescoço, nas dobras do cotovelo e joelhos.
Evite utilizar a pomada dentro de seu nariz ou boca ou dentro dos olhos. Se a pomada atingir qualquer uma dessas áreas, ela deve ser retirada imediatamente e/ou enxaguada com água.
Não cubra a pele que está sendo tratada com bandagens ou qualquer tipo de envoltório.
Lave suas mãos após aplicar Tarfic, a menos que suas mãos também estejam em tratamento.
Antes de aplicar Tarfic após o banho, certifique-se que sua pele está completamente seca.
Tratamento inicial
Crianças de 2 anos a 15 anos:
Aplique Tarfic 0,03% duas vezes ao dia durante 3 semanas, uma vez pela manhã e uma vez à noite.
Após este período, a pomada deve ser utilizada uma vez ao dia em cada região afetada da pele até que o eczema tenha desaparecido.
Adultos (16 anos de idade ou mais):
Duas concentrações de Tarfic (Tarfic 0,03% e Tarfic 0,1% pomada) estão disponíveis para pacientes adultos.
Seu médico irá decidir qual a melhor concentração para você.
Geralmente, o tratamento é iniciado com Tarfic 0,1% pomada duas vezes ao dia, uma vez pela manhã e uma vez à noite, até que o eczema desapareça.
Se os sintomas reaparecerem, o tratamento com Tarfic 0,1% deve ser reiniciado. Dependendo da resposta de seu eczema, seu médico irá decidir pela redução da frequência das aplicações ou pela utilização da menor concentração, Tarfic 0,03%, pode ser utilizado.
Trate cada região afetada de sua pele até que o eczema tenha desaparecido.
A melhora é geralmente verificada dentro de uma semana. Se você não notar nenhuma melhora após 2 semanas, verifique com seu médico sobre outras possibilidades de tratamento.
O tratamento com Tarfic pode ser repetido se os sintomas reaparecerem.
Estudos específicos não foram conduzidos em pacientes idosos. Entretanto, a experiência clínica disponível nesta população de pacientes não demonstra necessidade de qualquer ajuste de dosagem.
Indicação de manutenção
Você pode ser orientado pelo seu médico a utilizar Tarfic pomada 2 vezes por semana, desde que o surto de dermatite atópica tenha desaparecido ou quase desaparecido (Tarfic 0,03% para adultos e crianças e 0,1% para adultos).
Tarfic pomada deve ser aplicado uma vez ao dia duas vezes por semana (por exemplo, segunda e quinta-feira) nas áreas de seu corpo comumente afetadas pela dermatite atópica.
Entre as aplicações deve haver 2 a 3 dias sem o tratamento com Tarfic.
Se os sintomas reaparecerem, você deve voltar a utilizar Tarfic duas vezes ao dia, conforme indicado acima, e consultar seu médico para revisar seu tratamento.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento de seu médico.
O que devo fazer quando eu me esquecer de usar Tarfic?
Caso você esqueça de aplicar a pomada no horário determinado, aplique assim que você lembrar e então continue conforme prescrito.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico ou cirurgião-dentista.
Precauções
A segurança de uso de Tarfic por um longo período não é conhecida.
Um pequeno número de pessoas que utilizaram pomada contendo tacrolimo desenvolveu câncer (tais como, de pele ou linfoma). Entretanto, não foi estabelecida uma relação direta com o uso da pomada.
Se você possui lesões infecciosas, não aplique a pomada na pele lesionada.
Se você possui insuficiência hepática, consulte seu médico antes de fazer uso de Tarfic.
Converse com seu médico antes de utilizar Tarfic se você tiver qualquer câncer de pele (tumor) ou se você possui um sistema imune fraco (imunocomprometimento) por algum motivo.
Se você possui uma doença hereditária que comprometa a barreira de sua pele, tal como síndrome de Netherton, ou se você sofre de eritroderma generalizado (inflamação com vermelhidão e descamação de toda a pele), converse com seu médico antes de utilizar Tarfic.
Você deve informar seu médico se você apresentar íngua (inchaço nos linfonodos) no início do tratamento.
Se os seus linfonodos incharem ao longo do tratamento com Tarfic, consulte seu médico.
Antes de tomar uma vacina, informe seu médico que você está fazendo uso de Tarfic. Vacinas não devem ser aplicadas durante o tratamento e por um certo período após o tratamento com Tarfic.
Para vacinas atenuadas (tais como, sarampo, caxumba, rubéola ou poliomielite oral) o período de espera deve ser de 28 dias após a vacinação; para vacinas inativadas (tais como tétano, difteria, coqueluche ou gripe) é de 14 dias após a vacinação.
Evite exposição da pele por longos períodos ao sol ou luz artificial, tal como, câmara de bronzeamento.
Se você ficar muito tempo exposto em lugares abertos após aplicar Tarfic, use protetor solar e roupas soltas que protejam a pele do sol.
Além disso, peça conselhos ao seu médico sobre outros métodos de proteção solar apropriados.
Se for prescrita a você terapia de luz, informe seu médico que você está fazendo uso de Tarfic, já que não é recomendada esta terapia e o uso do medicamento ao mesmo tempo.
Evite o contato com olhos e mucosas (dentro do nariz ou boca).
Se o seu médico lhe indicar Tarfic duas vezes por semana para manter sua dermatite atópica controlada, sua condição deve ser revista pelo seu médico a cada 12 meses, mesmo que a doença permaneça sob controle.
Durante o uso de Tarfic, a ingestão de bebidas alcoólicas pode causar rubor, vermelhidão ou calor na pele ou face.
Você deve utilizar cremes e loções hidratantes durante o tratamento com Tarfic, mas estes produtos não devem ser utilizados dentro de duas horas após a aplicação de Tarfic.
O uso de Tarfic concomitantemente a outras preparações para serem utilizadas na pele ou durante o uso de corticosteroides via oral (como cortisona) ou medicamentos que afetem o sistema imune, não foi estudado.
Informe seu medico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
Assim como todos os medicamentos, Tarfic pode causar efeitos colaterais, embora nem todas as pessoas os manifestem.
Aproximadamente metade dos pacientes que utilizaram Tarfic apresentou algum tipo de irritação na pele onde eles aplicaram a pomada.
Reações muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
Sensação de queimação e coceira no local da aplicação.
Estes sintomas são comumente leves a moderados e geralmente desaparecem após uma semana de uso de Tarfic.
Reação comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
As seguintes reações ocorrem no local de aplicação: aquecimento, vermelhidão, dor, irritação, parestesia (aumento da sensibilidade da pele ao frio, calor, sensação de formigamento e/ou pressão), dermatite (inflamação da pele), infecção incluindo, mas não limitado a, eczema herpético (lesão de pele causada por herpes), foliculite, herpes simples, lesão similar à varicela, impetigo (infecção superficial de pele).
Prurido (coceira), hiperestesia e disestesia (distúrbios neurológicos caracterizados pela alteração na sensibilidade de um sentido ou órgão a estímulos), sensação de queimação, intolerância ao álcool (rubor facial ou irritação na pele após o consumo de bebida alcoólica).
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
Acne.
Reação com incidência desconhecida:
Rosácea (doença de pele localizada na face e que se caracteriza por manchas avermelhadas e inflamações do tecido vascular do rosto).
Para pacientes que fazem uso sistêmico de tacrolimo e possuem algum defeito na barreira da pele, foi observado aumento dos níveis de tacrolimo no sangue.
Tratamento de manutenção:
Seguindo um tratamento de duas vezes por semana em crianças e adultos, foram relatadas infecções superficiais de pele no local de aplicação.
Desde a liberação ao comércio, uma pequena quantidade de pessoas que tem utilizado pomada contendo tacrolimo desenvolveu câncer (por exemplo, pele e linfoma).
Entretanto, não foi estabelecida uma relação direta desta doença com o uso da pomada.
Se alguns desses efeitos colaterais se tornarem graves, ou se você notar qualquer efeito colateral não informado nesta bula, por favor, entre em contato com seu médico ou farmacêutico.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe também à empresa através de seu serviço de atendimento.
População Especial
Crianças
Este medicamento é contraindicado para menores de 2 anos.
Gravidez e lactação
Este medicamento não deve ser utilizado por mulheres que estão amamentando sem orientação médica ou do cirurgião-dentista.
Durante o período de aleitamento materno ou doação de leite humano, só utilize medicamentos com o conhecimento do seu médico ou cirurgião-dentista, pois alguns medicamentos podem ser excretados no leite humano, causando reações indesejáveis no bebê.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
Tarfic 0,03%:
Cada 1 g de pomada contém
0,307 mg de tacrolimo monoidratado (equivalente a 0,300 mg de tacrolimo).
Excipientes: petrolato amarelo, petrolato líquido, carbonato de propileno, cera branca de abelha e parafina branca.
Tarfic 0,1%:
Cada 1 g de pomada contém
1,022 mg de tacrolimo monoidratado (equivalente a 1,000 mg de tacrolimo).
Excipientes: petrolato amarelo, petrolato líquido, carbonato de propileno, cera branca de abelha e parafina branca.
Superdosagem
Se você engolir acidentalmente a pomada, consulte um médico ou farmacêutico assim que possível.
Não tente induzir o vômito.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Interação Medicamentosa
Devido ao potencial de insuficiência renal aditiva ou sinérgica, deve-se tomar cuidado ao administrar Tacrolimo monoidratado (substância ativa) com medicamentos que podem estar relacionados com disfunção renal. Esses medicamentos incluem, mas não estão limitados a, aminoglicosídeos, anfotericina B e cisplatina. Experimentos clínicos iniciais com a coadministração de Tacrolimo monoidratado (substância ativa) e ciclosporina resultaram em nefrotoxicidade aditiva/sinérgica.
Os pacientes que trocarem de ciclosporina para Tacrolimo monoidratado (substância ativa) não devem receber a primeira dose do mesmo antes de 24 horas depois da última dose de ciclosporina. A administração de Tacrolimo monoidratado (substância ativa) deve ser adiada na presença de níveis elevados de ciclosporina.
Fármacos que podem alterar as concentrações de tacrolimo
Como tacrolimo é metabolizado principalmente pelo sistema enzimático CYP3A, substâncias que inibem estas enzimas podem reduzir o metabolismo ou aumentar a biodisponibilidade de tacrolimo resultando em aumento nas concentrações plasmáticas ou no sangue total. Drogas que induzem estes sistemas enzimáticos podem aumentar o metabolismo ou diminuir a biodisponibilidade de tacrolimo, resultando em redução das concentrações no sangue total ou plasma. Monitoramento das concentrações sanguíneas e ajustes de dose são essenciais quando tais drogas são usadas concomitantemente:
Fármacos que podem aumentar as concentrações de tacrolimo no sangue:
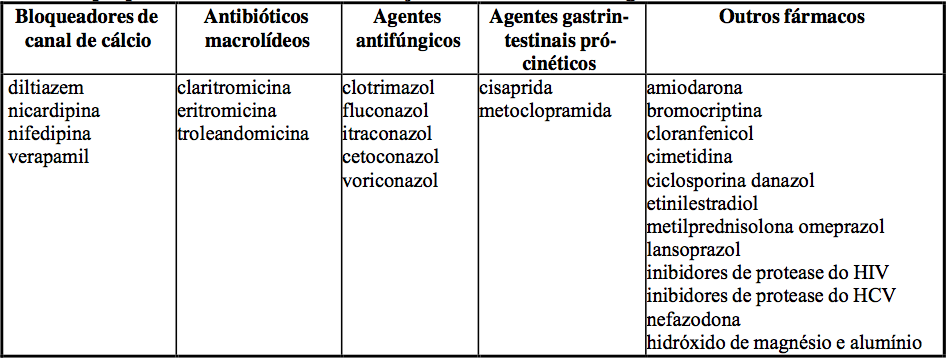
Em um estudo com 6 voluntários sadios, foi observado um aumento significante na biodisponibilidade oral do tacrolimo (de 14±5% para 30±8%) após o uso concomitante com cetoconazol (200 mg). A depuração aparente do tacrolimo administrado por via oral juntamente com cetoconazol diminuiu significativamente quando comparado com o tacrolimo administrado isoladamente (de 0,430±0,129 L/h/kg vs. 0,148±0,043 L/h/kg).
De modo geral, a administração por via IV não teve a depuração significativamente alterada pela coadministração com cetoconazol, no entanto houve uma grande variação entre os pacientes.
O lansoprazol (CYP2C19, substrato de CYP3A4) tem o potencial de inibir o metabolismo do tacrolimo mediado por CYP3A4 e, portanto, aumentar consideravelmente as concentrações de tacrolimo no sangue total, especialmente em pacientes transplantados que são metabolizadores deficientes ou intermediários de CYP2C19, em comparação aos pacientes que metabolizam CYP2C19 de forma eficiente.
A maioria dos inibidores de protease inibe as enzimas de CYP3A e pode aumentar as concentrações de tacrolimo no sangue total. Recomenda-se evitar o uso concomitante de tacrolimo com nelfinavir, a menos que os benefícios justifiquem os riscos. As concentrações de tacrolimo no sangue total são acentuadamente elevadas quando há coadministração de telaprevir ou boceprevir.
Recomenda-se o monitoramento das concentrações de tacrolimo no sangue total e das reações adversas associadas a tacrolimo, além de ajustes adequados no esquema de dose de tacrolimo quando tacrolimo e inibidores de protease (por exemplo, ritonavir, telaprevir, boceprevir) são usados concomitantemente.
Telaprevir
Em um estudo de dose única em 9 voluntários saudáveis, a coadministração de tacrolimo (dose única de 0,5 mg) com telaprevir (750 mg três vezes por dia por 13 dias) elevou a Cmáx de tacrolimo normalizado por dose em 9,3 vezes e a AUC em 70 vezes em comparação ao tacrolimo isolado.
Boceprevir
Em um estudo de dose única em 12 sujeitos de estudo, a coadministração de tacrolimo (dose única de 0,5 mg) com boceprevir (800 mg três vezes por dia por 11 dias) elevou a Cmáx de tacrolimo em 9,9 vezes e a AUC em 17 vezes em comparação ao tacrolimo em monoterapia.
Nelfinavir
Com base em um estudo clínico com 5 receptores de transplante hepático, a coadministração de tacrolimo e nelfinavir aumentou as concentrações de tacrolimo no sangue de forma significativa e, como resultado, uma redução de 16 vezes, em média, da dose de tacrolimo foi necessária para manter as concentrações médias de vale de tacrolimo de 9,7 ng/mL. Recomenda-se evitar o uso concomitante de Tacrolimo monoidratado (substância ativa) com nelfinavir, a menos que os benefícios justifiquem os riscos.
Fármacos que podem diminuir a concentração do tacrolimo no sangue:

A Erva de São João (Hypericum perforatum) induz o citocromo CYP3A4 e a glicoproteína P. Uma vez que o tacrolimo é substrato para o citocromo CYP3A4, há um potencial de que o uso da Erva de São João em pacientes recebendo Tacrolimo monoidratado (substância ativa) possa resultar na redução dos níveis de tacrolimo.
Em um estudo cruzado de dose única em pacientes sadios com coadministração oral de tacrolimo e hidróxido de alumínio e magnésio resultou em um aumento de 21% na AUC média do tacrolimo, e numa redução de 10% na Cmáx média de tacrolimo com relação a sua administração oral isolado.
Em um estudo com 6 voluntários normais observou-se uma significante redução na biodisponibilidade oral de tacrolimo (de 14±6% para 7±3%) quando administrado concomitantemente com rifampicina (600 mg). Além disso, houve um aumento significante da depuração do tacrolimo (de 0,036±0,008 L/h/kg para 0,053±0,010 L/h/kg) em administração concomitante com rifampicina.
Após a administração concomitante de tacrolimo e sirolimo (2 ou 5 mg/dia) em pacientes receptores de transplante renal estáveis, a AUC0-12 média e a Cmín reduziram em aproximadamente 30% com relação ao tacrolimo administrado isoladamente. Após a administração concomitante de tacrolimo e 1 mg/dia de sirolimo a
AUC0-12 média e a Cmín reduziram em aproximadamente 3% e 11%, respectivamente. A segurança e eficácia do uso do tacrolimo em combinação com o sirolimo para prevenção da rejeição a enxerto não foram estabelecidas, e seu uso não é recomendado.
Outras Interações Medicamentosas
Os imunossupressores podem afetar a vacinação. Portanto, durante o tratamento com Tacrolimo monoidratado (substância ativa), a vacinação pode ser menos eficaz. O uso de vacinas vivas deve ser evitado; vacinas vivas incluem, mas não são limitadas a sarampo, caxumba, rubéola, poliomielite, BCG, febre amarela e tifoide TY21a.
Ação da Substância
Resultados da eficácia
Transplante Hepático
A segurança e eficácia da imunossupressão baseada em Tacrolimo monoidratado (substância ativa) após transplante ortotópico de fígado foram avaliadas em dois estudos prospectivos, multicêntricos, abertos e randomizados. O grupo controle ativo foi tratado com regime de imunossupressão baseado em ciclosporina. Ambos os estudos utilizaram concomitantemente corticosteroides adrenais como parte do regime imunossupressor. Tais estudos foram desenhados com o objetivo de avaliar se os regimes imunossupressores eram equivalentes, tendo como desfecho primário a sobrevida de 12 meses após o transplante do paciente e do enxerto. A terapia de imunossupressão baseada em Tacrolimo monoidratado (substância ativa) se mostrou equivalente ao regime imunossupressor baseado em ciclosporina.
Em um ensaio envolvendo 529 pacientes em 12 centros nos Estados Unidos, antes da cirurgia 263 pacientes foram randomizados para o tratamento baseado em Tacrolimo monoidratado (substância ativa), enquanto 266 para o regime imunossupressor baseado em ciclosporina (CBIR). Em 10 dos 12 centros o mesmo protocolo de CBIR foi utilizado, enquanto 2 centros utilizaram protocolos diferentes.
Este ensaio clínico excluiu pacientes com disfunção renal, falência hepática fulminante com encefalopatia estágio IV e câncer. Foi permitida a inclusão de pacientes pediátricos (idade ? 12 anos).
Em um segundo ensaio clínico, 545 pacientes foram incluídos em 8 centros na Europa, antes da cirurgia 270 pacientes foram randomizados para o tratamento baseado em Tacrolimo monoidratado (substância ativa), enquanto 275 para CBIR. Neste estudo cada centro utilizou o próprio protocolo padrão de CBIR no braço controle-ativo. Não foram incluídos pacientes pediátricos, mas permitia a inclusão de indivíduos com disfunção renal, falência hepática fulminante com encefalopatia estágio IV e outros cânceres com metástases além do primário hepático.
As sobrevidas do paciente e do enxerto após 1 ano do transplante no grupo com regime imunossupressor baseado em Tacrolimo monoidratado (substância ativa) são equivalentes àquelas observadas nos grupos tratados com CBIR em ambos os estudos. A sobrevida geral do paciente (grupos recebendo regime imunossupressor baseado em Tacrolimo monoidratado (substância ativa) e CBIR combinados) foi de 88% no estudo americano e 78% no estudo europeu.
A sobrevida geral do enxerto após 1 ano do transplante (grupos recebendo regime imunossupressor baseado em Tacrolimo monoidratado (substância ativa) e CBIR combinados) foi de 81% no estudo americano e 73% no estudo europeu. Nos dois estudos a mediana de tempo de conversão da via de administração do Tacrolimo monoidratado (substância ativa) de IV para oral foi de 2 dias.
Devido a natureza e desenho dos estudos, a comparação de desfechos secundários, como incidência de rejeição aguda, rejeição refratária ou uso de OKT3 para rejeição esteroide-resistente, não pôde ser realizada adequadamente.
Transplante Renal
Foi realizado um estudo clínico de fase III, prospectivo, randomizado, aberto, multicêntrico, com imunossupressão baseada em Tacrolimo monoidratado (substância ativa) após transplante renal. Foram incluídos 412 pacientes receptores de transplante renal em 19 centros de estudo nos Estados Unidos. A terapia iniciou-se assim que a função renal foi estabelecida, como indicado pela creatinina sérica ? 4 mg/dL (mediana de 4 dias após o transplante, intervalo de 1 a 14 dias). Pacientes com menos de 6 anos de idade foram excluídos do ensaio.
Neste estudo foram incluídos 205 pacientes no grupo que recebeu imunossupressão baseada em Tacrolimo monoidratado (substância ativa), enquanto 207 pacientes foram randomizados para o grupo recebendo regime de imunossupressão com ciclosporina. Todos os pacientes receberam terapia de indução profilática, composta de uma preparação de anticorpos antilinfócito, corticosteroides e azatioprina.
As sobrevidas gerais de 1 ano dos pacientes e do enxerto foram de 96,1% e 89,6%, respectivamente, e foram equivalentes entre os dois tratamentos do estudo.
Devido a natureza do desenho dos estudos, a comparação de desfechos secundários, como incidência de rejeição aguda, rejeição refratária ou uso de OKT-3 para rejeição esteroide-resistente, não pôde ser realizada adequadamente.
Características Farmacológicas
Propriedades Farmacodinâmicas
O Tacrolimo monoidratado (substância ativa) prolonga a sobrevivência do hospedeiro e órgãos transplantados em modelos animais de transplantes de fígado, rins, coração, medula óssea, intestino delgado e pâncreas, pulmão e traqueia, pele, córnea e membros. Em animais, demonstrou-se que Tacrolimo monoidratado (substância ativa) causa supressão da imunidade humoral e, com maior extensão, as reações mediadas por células tais como a rejeição alográfica, hipersensibilidade do tipo tardia, artrite induzida por colágeno, encefalomielite alérgica experimental e doença do hospedeiro versus enxerto.
O Tacrolimo monoidratado (substância ativa) inibe a ativação do linfócito-T, apesar de seu exato mecanismo de ação não ser conhecido. Evidências experimentais sugerem que o Tacrolimo monoidratado (substância ativa) se liga a uma proteína intracelular, FKBP-12. Um complexo de Tacrolimo monoidratado (substância ativa)-FKBP-12, cálcio, calmodulina e calcineurina então se forma e a ação da fosfatase da calcineurina é inibida. Esse efeito pode impedir a desfosforilação e translocação do fator nuclear das células T-ativadas (NF-AT), um componente nuclear que inicia a transcrição genética para a formação de linfocinas (tais como interleucina-2, interferon gama). O resultado do mecanismo é a inibição da ativação do linfócito-T (isto é, imunossupressão).
Propriedades Farmacocinéticas
A atividade do Tacrolimo monoidratado (substância ativa) é primariamente devida ao fármaco. Os parâmetros farmacocinéticos do Tacrolimo monoidratado (substância ativa) foram determinados após administração intravenosa e oral em voluntários sadios, e em pacientes receptores de transplante renal e pacientes receptores de transplante hepático.
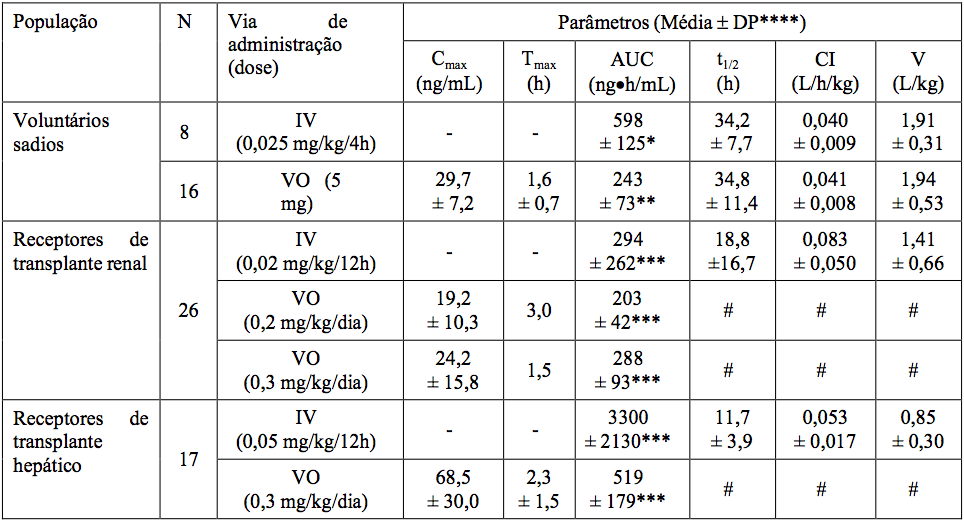
Corrigido para biodisponibilidade individual.
* AUC0-120.
**AUC0-72.
***AUC0-inf.
****DP.
= Desvio Padrão.
- Não aplicável.
# Dado indisponível.
Devido à variabilidade interindividual na farmacocinética do Tacrolimo monoidratado (substância ativa), é necessária a individualização da posologia para a otimização da terapia.
Os dados farmacocinéticos indicam que as concentrações no sangue total mais que as concentrações plasmáticas representam o compartimento de amostragem mais apropriado para descrever a farmacocinética do Tacrolimo monoidratado (substância ativa).
Absorção
A absorção de Tacrolimo monoidratado (substância ativa) a partir do trato gastrintestinal após a administração oral é incompleta e variável. A biodisponibilidade absoluta de Tacrolimo monoidratado (substância ativa) foi de 17±10% em pacientes adultos receptores de transplante renal (N=26), 22±6% em pacientes adultos receptores de transplante hepático (N=17) e 18±5% em voluntários sadios (N=16).
Um estudo com doses únicas conduzido em 32 voluntários sadios estabeleceu a bioequivalência de cápsulas com 1 mg e 5 mg. Em outro estudo com doses únicas em 32 voluntários sadios estabeleceu a bioequivalência entre as cápsulas de 0,5 mg e 1 mg de Tacrolimo monoidratado (substância ativa). A concentração máxima de Tacrolimo monoidratado (substância ativa) no sangue (Cmáx) e a área sob a curva (AUC) apresentaram um aumento proporcional à dose em 18 voluntários sadios em jejum que receberam uma dose única oral de 3,7 e 10 mg.
Em 18 pacientes receptores de transplante renal, concentrações mínimas de Tacrolimo monoidratado (substância ativa) de 3 a 30 ng/mL medidas 10 a 12 horas após a administração (Cmín) tiveram boa correlação com a AUC (coeficiente de correlação 0,93).
Em 24 pacientes receptores de transplante hepático em uma faixa de concentração de 10 a 60 ng/mL, o coeficiente de correlação foi 0,94.
Distribuição
A ligação de Tacrolimo monoidratado (substância ativa) às proteínas plasmáticas é de aproximadamente 99% e é independente da concentração dentro da faixa de 5 a 50 ng/mL.
O Tacrolimo monoidratado (substância ativa) é ligado principalmente à albumina e à alfa-1-glicoproteína ácida, e possui um elevado nível de associação com eritrócitos. A distribuição do Tacrolimo monoidratado (substância ativa) entre o sangue total e plasma depende de alguns fatores como hematócrito, temperatura no momento da separação do plasma, concentração do fármaco e a concentração de proteínas plasmáticas. Em um estudo norte-americano, a razão entre a concentração no sangue total e a concentração no plasma foi de 35 (intervalo de 12 a 67).
Metabolismo
O Tacrolimo monoidratado (substância ativa) é extensivamente metabolizado pelo sistema de oxidase de função mista, primariamente o sistema citocromo P-450 (CPY3A). Foi proposto um caminho metabólico que leva à formação de 8 metabólitos possíveis. A desmetilação e a hidroxilação foram identificadas como os mecanismos primários de biotransformação in vitro. O metabólito principal identificado em incubações com microssomas hepáticos humanos é o 13-desmetil Tacrolimo monoidratado (substância ativa). Em estudos in vitro, foi relatado que um metabólito 31-desmetil possui a mesma atividade do Tacrolimo monoidratado (substância ativa).
Excreção
A depuração média após administração intravenosa de Tacrolimo monoidratado (substância ativa) em voluntários sadios, pacientes adultos submetidos a transplante de rim e pacientes adultos submetidos a transplante de fígado é 0,040; 0,083 e 0,053 L/h/kg, respectivamente. Em humanos, menos de 1% da dose administrada foi excretada inalterada na urina. Em um estudo de balanço de massa com Tacrolimo monoidratado (substância ativa) radiomarcado administrado via intravenosa em 6 voluntários sadios, a recuperação média de material radiomarcado foi de 77,8±12,7%.
A eliminação fecal foi responsável por 92,4±1,0% e a meia-vida de eliminação baseada na radioatividade foi de 48,1±15,9 horas, enquanto que a meia-vida baseada na concentração de Tacrolimo monoidratado (substância ativa) foi 43,5±11,6 horas. A depuração média do Tacrolimo monoidratado (substância ativa) radiomarcado foi de 0,029±0,015 L/h/kg e a depuração média de Tacrolimo monoidratado (substância ativa) não marcado foi de 0,029±0,009 L/h/kg. Quando administrado via oral, a recuperação média de Tacrolimo monoidratado (substância ativa) radiomarcado foi 94,9±30,7%. A eliminação fecal foi responsável por 92,6±30,7%, a eliminação urinária por 2,3±1,1% e a meia-vida de eliminação baseada na radioatividade foi de 31,9±10,5 horas, enquanto que a baseada na concentração de Tacrolimo monoidratado (substância ativa) foi de 48,4±12,3 horas. A depuração média do Tacrolimo monoidratado (substância ativa) radiomarcado foi 0,226±0,116 L/h/kg e a depuração do Tacrolimo monoidratado (substância ativa) não marcado foi 0,172±0,088 L/h/kg.
Populações especiais
Pacientes Pediátricos
A farmacocinética de Tacrolimo monoidratado (substância ativa) foi estudada em pacientes receptores de transplante hepático, com idades entre 0,7 e 13,2 anos. Após administração via intravenosa de uma dose de 0,037 mg/kg/dia em 12 pacientes pediátricos, a meia-vida terminal média, o volume de distribuição médio e a depuração média foram de 11,5±3,8 horas, 2,6±2,1 L/kg e 0,138±0,071 L/h/kg, respectivamente.
Após administração oral em 9 pacientes, a AUC e a Cmáx médias foram 337±167 ng•h/mL e 43,4±27,9 ng/mL, respectivamente. A biodisponibilidade absoluta foi 31±21%.
As concentrações mínimas no sangue total de 31 pacientes com menos de 12 anos de idade mostraram que pacientes pediátricos necessitam de doses mais elevadas que os adultos para alcançar uma concentração mínima similar de Tacrolimo monoidratado (substância ativa).
Pacientes com Insuficiência Hepática e Renal
As médias dos parâmetros farmacocinéticos do Tacrolimo monoidratado (substância ativa), após administração única em pacientes com insuficiência hepática e renal, são dadas na seguinte tabela.
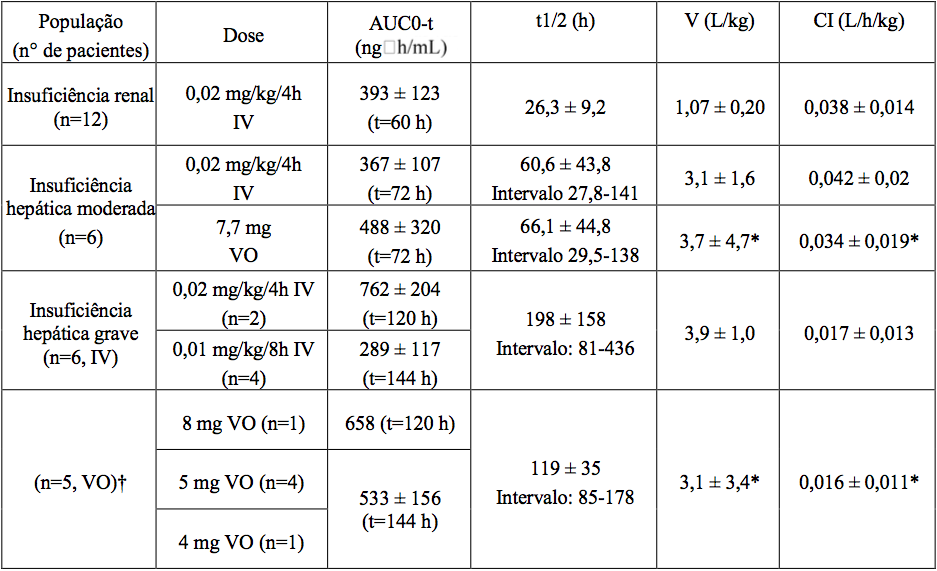 * corrigida para biodisponibilidade
* corrigida para biodisponibilidade
† 1 paciente não recebeu a dose por via oral
Pacientes com Insuficiência Renal
A farmacocinética do Tacrolimo monoidratado (substância ativa) após a administração de dose única intravenosa foi determinada em 12 pacientes (7 não estavam em diálise e 5 em diálise, creatinina sérica de 3,9±1,6 e 12,0±2,4 mg/dL, respectivamente) anteriormente ao transplante renal. Os parâmetros farmacocinéticos obtidos foram similares em ambos os grupos.
A depuração média de Tacrolimo monoidratado (substância ativa) em pacientes com disfunção renal foi similar a de voluntários normais.
Pacientes com Insuficiência Hepática
A farmacocinética do Tacrolimo monoidratado (substância ativa) foi determinada em 6 pacientes com leve disfunção hepática (escala Pugh média: 6,2) após administração de dose única via oral e intravenosa. A depuração média de Tacrolimo monoidratado (substância ativa) em pacientes com disfunção hepática leve não foi substancialmente diferente da depuração de voluntários normais. A farmacocinética do Tacrolimo monoidratado (substância ativa) foi estudada em 6 pacientes com disfunção hepática grave (média do escore de Pugh > 10). A média da depuração foi substancialmente menor nos pacientes com disfunção hepática, sem considerar a via de administração.
Raça
Não foi conduzido nenhum estudo formal para avaliar a disposição da farmacocinética do Tacrolimo monoidratado (substância ativa) em pacientes negros transplantados. No entanto, uma comparação retrospectiva entre pacientes negros e caucasianos receptores de transplante renal indicou que pacientes negros requerem doses mais altas de Tacrolimo monoidratado (substância ativa) para atingir concentrações mínimas similares.
Sexo
Não foi conduzido estudo formal para avaliar o efeito do sexo na farmacocinética de Tacrolimo monoidratado (substância ativa). No entanto, não se observa diferença na dosagem por sexo nos estudos clínicos envolvendo transplante renal. Uma comparação retrospectiva da farmacocinética em voluntários sadios, pacientes receptores de transplante renal e pacientes receptores de transplante hepático indicam que não há diferenças relacionadas ao sexo.
Cuidados de Armazenamento
Este medicamento deve ser armazenado em temperatura ambiente (entre 15°C e 30°C), protegido da luz e umidade.
Evite expor o medicamento a altas temperaturas, como por exemplo, mantê-lo dentro do porta-luvas no carro.
Assegure-se que a tampa da bisnaga esteja firmemente fechada.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido.
Guarde-o em sua embalagem original.
Características físicas:
Tarfic é uma pomada esbranquiçada, homogênea e com odor característico.
Antes de usar, observe o aspecto do medicamento.
Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS nº: 1.0033.0160
Farmacêutica Responsável:
Cintia Delphino de Andrade – CRF-SP nº 25.125
Registrado por:
Libbs Farmacêutica Ltda.
Rua Josef Kryss, 250 – São Paulo – SP
CNPJ: 61.230.314/0001-75
Fabricado por:
Libbs Farmacêutica Ltda.
Rua Alberto Correia Francfort, 88 – Embu das Artes – SP
Indústria Brasileira
www.libbs.com.br