Comparamos o preço de Avamys - Spray 120 Doses, veja o menor preço

R$ 51,39
RReferência
21
ofertasMelhores preços a partir de R$ 49,85 até R$ 73,92
Oferta patrocinada
vendido por Drogaria Nova Esperança
economize
30.48%
R$ 51,39
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
Oferta patrocinada
vendido por Farmácia Preço Popular
economize
18.97%
R$ 59,90
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Oferta patrocinada
vendido por Pague Menos
economize
14.11%
R$ 63,49
Oferta patrocinada
vendido por Drogaria São Paulo
economize
11.27%
R$ 65,59
Oferta patrocinada
vendido por Drogarias Pacheco
economize
10.73%
R$ 65,99
vendido por AAZ Farma
economize
32.56%
R$ 49,85
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria!
vendido por Farmácia Super Droga 10
economize
28.31%
R$ 52,99
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Resilifarma
economize
27.08%
R$ 53,90
Desde 1972, 5 lojas físicas - parcele em até 6x sem juros. Frete reduzido.
vendido por Farma Prime
economize
20.32%
R$ 58,90
vendido por Drogaria Soares
economize
19.99%
R$ 59,14
Enviamos para todo o Brasil. Clique e confira!
vendido por Drogaria Vera Cruz
economize
15.00%
R$ 62,83
Entregas para todo o Brasil. Clique e confira!
vendido por Drogaria Primus
economize
12.74%
R$ 64,50
Entregas em todo Brasil, parcelamentos até 6x sem juros!
vendido por Promofarma
economize
12.59%
R$ 64,61
vendido por Drogaria Araújo
economize
10.73%
R$ 65,99
vendido por Drogaria HD
economize
4.99%
R$ 70,23
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Agille Medicamentos
economize
4.32%
R$ 70,73
Preço Válido para compra em Boleto
vendido por Oncolog Medicamentos Especiais
economize
1.79%
R$ 72,60
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farmácia Online Farmagora
economize
1.35%
R$ 72,92
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Drogaria Catarinense
economize
1.35%
R$ 72,92
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Panvel Farmácias
economize
0.04%
R$ 73,89
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farmanita Drogaria
R$ 73,92
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Adultos/adolescentes (a partir de 12 anos de idade)
Avamys Spray Nasal é indicado para o tratamento dos sintomas nasais, como rinorreia (secreção nasal), congestão (nariz entupido), prurido (coceira no nariz) e espirros, e dos sintomas oculares (que afetam os olhos), tais como prurido/ardência (coceira/ardor), lacrimejamento e vermelhidão, da rinite alérgica sazonal ou seja, que ocorre em determinadas épocas do ano.
Também é indicado para o tratamento dos sintomas nasais (rinorreia, congestão nasal, prurido nasal e espirros) da rinite alérgica crônica (que ocorre durante todo o ano).
Crianças (de 2 a 11 anos)
Tratamento dos sintomas nasais (rinorreia, congestão nasal, prurido nasal e espirros) da rinite alérgica sazonal e crônica.
Como o Avamys funciona?
O furoato de fluticasona é um corticosteroide com potente ação anti-inflamatória.
Sua ação tem início a partir de 8 horas após a primeira administração. Podem ser necessários vários dias de tratamento para que se obtenha o benefício máximo.
Contraindicação
Avamys Spray Nasal é contraindicado para pacientes com alergia a qualquer um dos ingredientes do produto.
Este medicamento é contraindicado para menores de 2 anos.
Como usar
Avamys Spray Nasal deve ser administrado somente por via nasal.
-
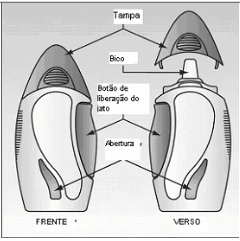
Spray nasal
- O medicamento é fornecido em um frasco de vidro dentro de um estojo plástico;
- Uma abertura na lateral do estojo permite que você veja quanto medicamento resta na embalagem;
- Quando você pressiona o botão lateral com firmeza, um jato do medicamento é liberado através do bico do frasco;
- O bico do frasco é protegido por uma tampa removível;
- O dispositivo deve ser preparado antes da primeira utilização ou caso fique destampado e pareça não funcionar direito (ver Figura A).
Figura A:
- Preparo do spray nasal
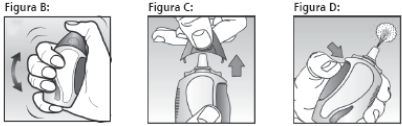
Na primeira vez que utilizar o produto, você deve prepará-lo de forma correta, conforme as instruções abaixo:
- Agite vigorosamente o spray tampado por cerca de 10 segundos (ver Figura B);
- Para remover a tampa azul, aperte delicadamente suas laterais com o polegar e o indicador e puxe-a para fora (ver Figura C);
- Vire o bocal na direção oposta a você e pressione firmemente o botão da lateral do dispositivo (cerca de seis vezes) até que um jato fino seja liberado no ar (ver Figura D).
O spray nasal agora está pronto para uso.
- Como usar o spray nasal
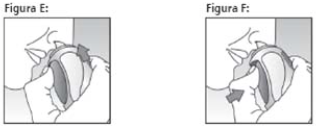
- Agite o spray nasal vigorosamente;
- Retire a tampa;
- Assoe o nariz para limpar as narinas e depois incline um pouco a cabeça para a frente;
- Segure o spray nasal na posição vertical e coloque o bico pulverizador cuidadosamente em uma das narinas (ver Figura E);
- Encoste o bico pulverizador na parede da narina oposta à divisão central do nariz. Isso ajuda a dirigir o medicamento para a parte correta do nariz;
- Respire pelo nariz e pressione o botão uma vez, firmemente, até o fim (ver Figura F);
- Tome cuidado para que o jato não atinja seus olhos. Se isso ocorrer, lave-os bem com água;
- Afaste o bico pulverizador do nariz e solte o ar pela boca;
- Se seu médico lhe disse para aplicar dois jatos em cada narina, repita os passos anteriores;
- Repita os passos anteriores na outra narina.
- Como limpar o spray nasal
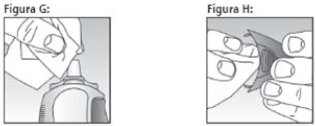
Após cada uso:
- Limpe o bico pulverizador e a parte interna da tampa (ver figuras G e H). Não use água, e sim um pano seco e limpo;
- Recoloque a tampa no lugar para evitar a entrada de poeira, conservar a pressão e impedir que o bico pulverizador fique entupido;
- Nunca use alfinete ou qualquer outro objeto pontiagudo para tentar desobstruir ou aumentar o orifício do bico pulverizador; nem para limpá-lo.
Se você achar que o dispositivo não funciona corretamente:
- Verifique se ainda há medicamento conferindo o nível do líquido pela janela. Se estiver muito baixo, pode não haver medicamento suficiente para fazer o dispositivo funcionar;
- Verifique se há algum dano no dispositivo.
?Posologia
Avamys Spray Nasal deve ser administrado somente por via nasal. Para obter benefício terapêutico completo, ou seja, o total alívio dos sintomas, use-o regularmente. Sua ação tem início a partir de 8 horas após a primeira administração. Podem ser necessários vários dias de tratamento para que se obtenha o benefício máximo.
Populações
Para o tratamento de rinite alérgica sazonal e perene.
Adultos/adolescentes (a partir de 12 anos de idade)
A dose inicial recomendada é de dois jatos (27,5mcg por jato) em cada narina uma vez ao dia (dose diária total: 110mcg).
Após o controle adequado dos sintomas, pode-se obter manutenção eficaz reduzindo-se a dose para um jato em cada narina uma vez ao dia (dose diária total: 55mcg).
Crianças (de 2 a 11 anos de idade)
A dose inicial recomendada é de um jato (27,5mcg por jato) em cada narina uma vez ao dia (dose diária total: 55mcg).
Os pacientes que não apresentarem melhora adequada após usar um jato em cada narina uma vez ao dia (dose diária total: 55mcg) podem passar a aplicar dois jatos em cada narina uma vez ao dia (dose diária total: 110mcg). Após o controle dos sintomas, recomenda-se a redução da dose para um jato em cada narina uma vez ao dia (dose diária total: 55mcg).
Crianças (menores de 2 anos de idade)
Não há dados que recomendem o uso de Avamys Spray Nasal no tratamento de rinite alérgica sazonal ou perene em crianças menores de 2 anos de idade.
Idosos/insuficiência renal
Não é necessário nenhum ajuste de dose.
Insuficiência hepática
Não é necessário nenhum ajuste de dose para pacientes com insuficiência hepática.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento de seu médico.
O que devo fazer quando eu me esquecer de usar o Avamys?
Se você deixar de aplicar uma dose, aplique-a quando se lembrar.
Mas se estiver perto da hora da dose seguinte, espere. Não aplique doses duplas.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico ou cirurgião-dentista.
Precauções
Não é recomendado o uso de ritonavir (usado em pacientes com HIV) ou cetoconazol (usado para tratar infecções causadas por fungos) com Avamys Spray Nasal.
Reações Adversas
Reação muito comum (ocorre em 10% dos pacientes que utilizam este medicamento):
Sangramento nasal.
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
Dor de cabeça, ulceração nasal que pode causar irritação ou desconforto no nariz. Você também pode obter estrias de sangue quando se assoa o nariz.
Reações incomuns (ocorrem de 0,1% a 1%):
Dor, queimação, irritação, dor ou secura no interior do nariz.
Reações raras (ocorrem de 0,01% a 0,1% dos pacientes que utilizam este medicamento):
Manifestações alérgicas graves, como anafilaxia (reações alérgicas graves), angioedema (inchaço similar a urticária que ocorre debaixo da pele), inchaço e coceira.
Reações muito raras (ocorrem em menos de 0,01% dos pacientes que utilizam este medicamento):
Perfuração do septo nasal
Reações desconhecidas (a ocorrência não pode ser estimada a partir dos dados disponíveis):
Retardo do crescimento em crianças, infecções por Candida albicans, dificuldades de cicatrização, catarata, glaucoma, imunossupressão (redução da atividade do sistema imunológico), dor faringolaríngea, dor nas costas, nasofaringite (resfriado), pirexia (febre) e tosse.
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Nesse caso, informe seu médico.
População Especial
Gravidez e lactação
Avamys Spray Nasal somente deve ser usado na gravidez se os benefícios para a mãe forem superiores aos riscos potenciais para o feto.
Este medicamento não deve ser usado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Composição
Cada dose contém:
| Furoato de fluticasona | 27,5mcg |
| Excipientes* q.s.p | 1 dose |
*Glicose anidra, celulose dispersível, polissorbato 80, solução de cloreto de benzalcônio, edetato dissódico e água purificada.
Superdosagem
Sinais e sintomas
Não se observou nenhum sintoma após a administração de altas doses do produto (aplicações intranasais de até 24 vezes a dose diária recomendada para adultos foram estudadas durante três dias).
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento se possível. Ligue para 0800 722 6001 se você precisar de mais orientações.
Interação Medicamentosa
Fluticasona é rapidamente eliminado por extenso metabolismo de primeira passagem mediado pelo citocromo P450 3A4. Em um estudo sobre interações medicamentosas do fluticasona e do cetoconazol, um potente inibidor da CYP3A4, houve mais pacientes com concentrações plasmáticas mensuráveis de furoato de fluticasona no grupo do cetoconazol (seis dentre 20 participantes) em comparação com placebo (um dentre 20 participantes). Esse pequeno aumento da exposição não resultou em diferença estatisticamente significativa dos níveis séricos de cortisol entre os dois grupos durante 24 horas.
Os dados disponíveis sobre indução e inibição de enzimas indicam não haver base teórica para prever, com doses intranasais, interações metabólicas clinicamente relevantes entre o furoato de fluticasona e o metabolismo mediado pelo citocromo P450 de outros compostos. Portanto, não se conduziu nenhum estudo clínico para investigar interações do furoato de fluticasona com outros fármacos.
Ação da Substância
Resultados de eficácia
Rinite alérgica sazonal em adultos e adolescentes
Uma dose de fluticasona de 110 mcg uma vez ao dia resultou em melhora significativa, em comparação com placebo, das pontuações totais de sintomas nasais pré-dose (rTNSS e iTNSS, que consistem em rinorreia, congestão nasal, espirros e prurido) subjetivos diários e objetivos e das pontuações totais de sintomas oculares (rTOSS, que consistem em prurido/ardência, lacrimejamento e vermelhidão) subjetivos diários e objetivos em comparação com placebo (ver tabela abaixo). Os sintomas subjetivos representam a forma como o paciente se sentiu durante as 12 horas anteriores e os sintomas objetivos a forma como se sentiu na ocasião da avaliação. A melhora dos sintomas nasais e oculares se manteve ao longo de todo o período de 24 horas decorrido após a administração de uma dose diária.
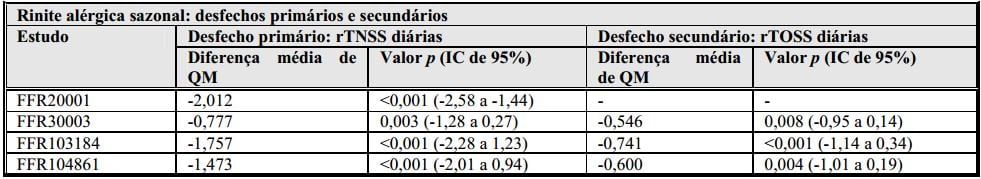 rTNSS = Pontuações totais de sintomas nasais subjetivos.
rTNSS = Pontuações totais de sintomas nasais subjetivos.
rTOSS = Pontuações totais de sintomas oculares subjetivos.
QM = Quadrados mínimos.
Diferença média de QM = alteração média de QM em relação à avaliação inicial do fármaco ativo menos a alteração média de QM em relação à avaliação inicial do placebo.
IC = Intervalo de confiança.
A distribuição da percepção dos pacientes sobre a resposta global ao tratamento (segundo uma escala de 7 pontos que varia de significativamente melhor a significativamente pior) favoreceu fluticasona 110 mcg em relação ao placebo, com diferença de tratamento estatisticamente significativa. Observou-se o início da ação já a partir de 8 horas após a primeira administração em dois estudos. Uma melhora significativa dos sintomas foi registrada nas primeiras 24 horas em quatro estudos e continuou a aumentar ao longo de vários dias.
A qualidade de vida dos pacientes, avaliada pelo Questionário de Qualidade de Vida Relativa à Rinoconjuntivite (RQLQ), melhorou significativamente em relação à avaliação inicial com fluticasona em comparação com placebo (diferença mínima relevante em todos os estudos = melhora de pelo menos -0,5 em relação ao placebo; diferença entre os tratamentos de -0,690; p<0,001; IC de 95%: -0,84 a -0,54).
Rinite alérgica perene em adultos e adolescentes
Fluticasona 110 mcg uma vez ao dia resultou em melhora significativa da rTNSS diária (diferença média de QM=-0,706; p=0,005; IC de 95%: -1,20 a -0,21). A melhora dos sintomas nasais se manteve ao longo de todo o período de 24 horas decorrido após a administração de uma dose diária. A distribuição da percepção dos pacientes sobre a resposta global ao tratamento também melhorou significativamente em comparação com o placebo.
Em um estudo de dois anos destinado a avaliar a segurança ocular do furoato de fluticasona spray intranasal (110 microgramas uma vez por dia), adultos e adolescentes com rinite alérgica perene receberam ou furoato de fluticasona (n = 367) ou placebo (n = 181). Os resultados primários [tempo para aumento da opacidade subcapsular posterior (> 0,3 do valor inicial do Lens Sistema de Classificação de Opacidades, Versão III (LOCS grau III)) e tempo de aumento da pressão intra-ocular (PIO; > 7 mmHg da linha de base)] não foram estatisticamente significativos entre os dois grupos. Aumento da opacidade subscapsular posterior (> 0,3 da linha de base) foram mais frequentes em indivíduos tratados com 110 microgramas de furoato de fluticasona [14 (4%)] versus placebo [4 (2%)] e foram de natureza transitória por dez indivíduos do grupo do furoato de fluticasona e dois indivíduos no grupo placebo.
Aumento da pressão intra-ocular (mmHg > 7 da linha de base) foram mais frequentes em indivíduos tratados com 110 microgramas de furoato de fluticasona: 7 (2%) para de furoato de fluticasona 110 microgramas uma vez por dia e 1 (<1%) para o placebo. Estes eventos foram de natureza transitória em 6 indivíduos no grupo furoato de fluticasona e 1 indivíduo que recebeu placebo. Nas semanas 52 e 104, 95% dos indivíduos de ambos os grupos de tratamento tiveram valores de opacidade subcapsular posterior ± 0,1 dos valores de referência para cada olho e, na semana 104, ? 1% dos indivíduos de ambos os grupos de tratamento tiveram aumento de 0,3 > da linha de base opacidade subcapsular posterior. Nas semanas 52 e 104, a maioria dos indivíduos (> 95%) apresentaram valores de pressão intra-ocular dentro de ± 5mmHg do valor basal. Aumento da opacidade subcapsular posterior ou PIO não foram acompanhadas de quaisquer eventos adversos, como catarata ou glaucoma.
Crianças
A posologia pediátrica baseia-se na avaliação dos dados de eficácia na população infantil com rinite alérgica. Em um estudo sobre rinite alérgica sazonal em crianças, a administração de fluticasona 110 mcg durante duas semanas foi eficaz no desfecho nasal primário (diferença média de QM na rTNSS diária=-0,616; p=0,025; IC de 95%: -1,15 a -0,08) e em todos os desfechos nasais secundários, exceto na pontuação subjetiva individual de rinorreia. Não se observou diferença significativa entre a dose de 55 mcg de fluticasona e placebo em nenhum dos desfechos de avaliação.
Em um estudo sobre rinite alérgica perene, fluticasona 55 mcg mostrou-se eficaz na melhora da rTNSS diária (diferença média de QM=-0,754; p=0,003; IC de 95%: -1,24 a -0,27). Embora tenha havido uma tendência de melhora da rTNSS com a dose de 100 mcg, essa melhora não atingiu significância estatística (diferença média de QM=-0,452; p=0,073; IC de 95%: -1,24 a -0,04). A análise post-hoc dos dados de eficácia ao longo de 6 e 12 semanas desse estudo e um ensaio de segurança de seis semanas do eixo HPA mostraram que a melhora da rTNSS com futicasona 110 mcg em relação ao placebo foi estatisticamente significativa.
Em um estudo randomizado, duplo-cego, de grupos paralelos, multicêntrico, de um ano de duração e placebo-controlado avaliou-se o efeito de 110 microgramas diários de furoato de fluticasona spray nasal sobre a velocidade de crescimento em 474 crianças pré-púberes (5 a 7,5 anos de idade para as meninas e 5-8,5 anos de idade para os meninos) com estadiometria. A média de velocidade de crescimento durante o período de tratamento de 52 semanas foi menor nos pacientes que receberam o furoato de fluticasona (5,19 cm/ano) em comparação com placebo (5,46 cm/ano). A diferença média do tratamento foi -0,27 cm por ano [95% CI -0,48 para -0,06].
Características farmacológicas
Mecanismo de ação
O furoato de fluticasona é um corticosteroide trifluorado sintético que tem afinidade muito grande com o receptor de glicocorticoides e potente ação anti-inflamatória.
Farmacocinética
Absorção
O furoato de fluticasona sofre extenso metabolismo de primeira passagem e absorção incompleta no fígado e nos intestinos, o que resulta em exposição sistêmica insignificante. A dosagem intranasal de 110 mcg uma vez ao dia normalmente não gera concentrações plasmáticas mensuráveis (>10 picogramas/mL). A biodisponibilidade absoluta do furoato de fluticasona administrado na dose de 880 mcg três vezes ao dia (dose diária total de 2.640 mcg) é de 0,50%.
Distribuição
A ligação do furoato de fluticasona às proteínas plasmáticas é superior a 99%. Sua distribuição é ampla, com um volume de distribuição no estado de equilíbrio de 608 litros em média.
Metabolismo
O furoato de fluticasona é rapidamente eliminado (clearance plasmático total de 58,7 litros por hora) da circulação sistêmica, principalmente por metabolismo hepático para um metabólito 17beta-carboxílico inativo (GW694301X), pela enzima CYP3A4 do citocromo P450. A principal via de metabolismo foi a hidrólise da função de S-fluorometil carbotioato para formar o metabólito de ácido 17beta-carboxílico. Estudos in vivo não revelaram nenhuma evidência de clivagem da porção furoato para formar fluticasona.
Eliminação
A eliminação ocorre principalmente por via fecal, após administração oral e intravenosa, o que indica excreção do furoato de fluticasona e de seus metabólitos através da bile.
Após administração intravenosa, a meia-vida da fase de eliminação foi, em média, de 15,1 horas. A excreção urinária contribui, respectivamente, com cerca de 1% e 2% da dose administrada por via oral e intravenosa.
Populações especiais de pacientes
Idosos
Dados farmacocinéticos foram obtidos de um pequeno número de pacientes idosos (n=23/872; 2,6%). Não houve evidências de uma incidência mais alta de pacientes com concentrações quantificáveis de furoato de fluticasona na população de idosos em comparação com indivíduos mais jovens.
Crianças
O furoato de fluticasona, de modo geral, não é quantificável (>10 picrogramas/mL) após administração intranasal de 110 mcg uma vez ao dia. Observaram-se níveis quantificáveis em menos de 16% dos pacientes pediátricos após administração intranasal de 110 mcg uma vez ao dia e em menos de 7% dos pacientes pediátricos após o uso de 55 mcg uma vez ao dia. Não houve evidências de uma incidência mais alta de níveis quantificáveis de furoato de fluticasona em crianças mais jovens (menores de 6 anos de idade).
Insuficiência renal
O furoato de fluticasona não é detectável na urina de voluntários sadios após administração intranasal. Menos de 1% de material relacionado à dose é eliminado na urina e, portanto, não se espera que a insuficiência renal afete a farmacocinética do furoato de fluticasona.
Insuficiência hepática
Não há dados em furoato de fluticasona intranasal em pacientes com insuficiência hepática. Os dados estão disponíveis após administração inalatória de furoato de fluticasona (como furoato de fluticasona ou furoato de fluticasona / vilanterol) para indivíduos com insuficiência hepática que também são aplicáveis para uso intranasal. Um estudo feito com uma dose única de 400 mcg de furoato de fluticasona inalado por via oral em pacientes com insuficiência hepática moderada (Child Pugh B) resultou em aumento de Cmáx (42%) e AUC0-? (172%) em comparação com indivíduos sadios.
Após a repetição da dose de furoato de fluticasona / vilanterol inalado por via oral por 7 dias, houve um aumento na exposição sistêmica de furoato de fluticasona (Child Pugh B ou C) comparado com indivíduos saudáveis. O aumento na exposição sistêmica de furoato de fluticasona em indivíduos com insuficiência hepática moderada (furoato de fluticasona / vilanterol 200/25 mg) foi associado com uma redução média de 34% no cortisol sérico comparado aos indivíduos saudáveis.
Não houve efeito no cortisol sérico de indivíduos com insuficiência hepática grave (furoato de fluticasona / vilanterol 100/12,5mg). Baseado nessas evidências, não se espera que a exposição média prevista de 110 mcg de furoato de fluticasona intranasal nessa população de pacientes, resulte em supressão do cortisol.
Outros aspectos farmacocinéticos
O furoato de fluticasona não é normalmente quantificável (menos que 10 picogramas/mL) após administração nasal de 110 microgramas uma vez ao dia. Observaram-se níveis quantificáveis em menos de 31% dos pacientes com 12 anos de idade ou mais e em menos de 16% dos pacientes pediátricos após administração intranasal de 110 mcg uma vez ao dia.
Não houve evidências de influência de sexo, idade (incluindo-se pacientes pediátricos) nem de etnia em indivíduos que apresentavam níveis quantificáveis em comparação com aqueles que não tinham concentrações quantificáveis do fármaco.
Cuidados de Armazenamento
Conservar em temperatura ambiente (entre 15ºC e 30ºC). Não refrigerar nem congelar.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspecto físico/características organolépticas
Avamys Spray Nasal é uma suspensão branca uniforme.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja dentro do prazo de validade e você observe alguma mudança, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS: 1.0107.0271
Farm. Resp.:
Edinilson da Silva Oliveira
CRF-RJ Nº 18875
Fabricado por:
Glaxo Operations UK Limited
Hamire Road, Durham - DL12 8DT – Barnard Castle – Inglaterra
Fabricado por:
Glaxo Wellcome S.A.
Avda. de Extremadura, 3. 09400 – Aranda de Duero – Burgos – Espanha
Registrado e Importado por: GlaxoSmithKline Brasil Ltda.
Estrada dos Bandeirantes, 8464, Rio de Janeiro, RJ
CNPJ: 33.247.743/0001-10
Venda sob prescrição médica.