Comparamos o preço de Baraclude - 0,5 Mg 30 Comprimidos, veja o menor preço

R$ 1.329,99
RReferência
1
ofertasMelhores preços a partir de R$ 1.329,99 até R$ 1.329,99
Oferta patrocinada
vendido por Pague Menos
R$ 1.329,99
Para que serve
Baraclude é indicado para o tratamento de infecção crônica pelo vírus da hepatite B (VHB) em adultos com evidência da multiplicação do vírus e também com evidência de elevações persistentes das aminotransferases séricas ALT e AST (enzimas produzidas pelo fígado) ou doença histologicamente ativa (alteração na estrutura celular do fígado).
Como Baraclude funciona?
Baraclude é um medicamento utilizado para o tratamento de adultos com infecção crônica pelo vírus da hepatite B (VHB). Baraclude pode diminuir a quantidade de VHB no corpo, podendo diminuir a habilidade do vírus para multiplicar-se e infectar novas células do fígado. A terapia com Baraclude também pode melhorar a condição do seu fígado.
É importante permanecer sob o cuidado do seu médico enquanto utiliza o medicamento.
Contraindicação
Você não deve utilizar Baraclude se for alérgico ao entecavir ou a qualquer componente da formulação.
Como usar
Baraclude deve ser administrado oralmente, com estômago vazio (ou seja, pelo menos duas horas após as refeições ou duas horas antes da próxima refeição).
Para segurança e eficácia desta apresentação, Baraclude não deve ser administrado por vias não recomendadas. A administração deve ser somente pela via oral.
Posologia
Doença hepática compensada
A dose recomendada de Baracludepara infecção crônica pelo vírus da hepatite B em pacientes adultos e adolescentes de 16 anos ou mais, virgens de tratamento por nucleosídeos, é de 0,5 mg (1 comprimido de 0,5mg), uma vez ao dia.
A dose recomendada de Baraclude para pacientes adultos e adolescentes de 16 anos ou mais, com história de viremia durante a terapia com lamivudina, ou com presença de mutações de resistência à lamivudina ou telbivudina é de 1 mg uma vez ao dia.
Doença hepática descompensada
A dose recomendada de Baraclude para infecção crônica pelo vírus da hepatite B em adultos e adolescentes de 16 anos ou mais, com doença hepática descompensada, é de 1 mg, uma vez ao dia.
Pacientes com Insuficiência Renal
Se você apresentar insuficiência renal (depuração de creatinina menor que 50 mL/min), seu médico pode indicar um ajuste de dose. Seu médico também pode indicar ajuste de dose se você estiver fazendo hemodiálise ou diálise peritoneal ambulatorial contínua (DPAC). O ajuste de dose deve ser realizado de acordo com o resultado do seu exame de depuração de creatinina.
Pacientes com Insuficiência Hepática
Não é necessário nenhum ajuste de dose para pacientes com insuficiência hepática.
Pacientes Pediátricos e Adolescentes
A segurança e eficácia de entecavir em pacientes com menos de 16 anos de idade não foram estabelecidas.
Pacientes Geriátricos
Nenhum ajuste de dose é necessário em função da idade.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar Baraclude?
Caso você se esqueça de tomar Baraclude, tome assim que lembrar e a próxima dose deve ser tomada no horário habitual. Caso esteja perto do horário da próxima dose, pule a dose que foi esquecida. Não tome duas doses ao mesmo tempo.
Em caso de dúvidas, procure orientação de seu médico.
Precauções
Atenção: o tratamento com Baraclude não diminui o risco de transmissão do VHB para outras pessoas através da relação sexual, compartilhamento de agulhas ou exposição ao sangue. Converse com seu médico sobre prática de relações sexuais seguras para proteger o seu parceiro. Nunca compartilhe agulhas. Não divida itens pessoais que possam conter sangue ou fluidos corpóreos, como escovas de dente ou lâminas de barbear.
Exacerbações da Hepatite após Descontinuação do Tratamento
Exacerbações agudas de hepatite foram relatadas em pacientes que descontinuaram o tratamento para Hepatite B, incluindo a terapia com Baraclude. Pode ocorrer piora da condição hepática se você descontinuar a terapia com o produto.
Pacientes Coinfectados com HIV
Baraclude não foi avaliado em pacientes coinfectados por HIV e VHB que não estivessem recebendo simultaneamente algum tipo de tratamento para HIV. Avise seu médico se você tem ou contraiu HIV. Se você estiver utilizando Baraclude para tratar hepatite B crônica e não está utilizando outros medicamentos para o HIV ao mesmo tempo, a atividade futura dos tratamentos para HIV pode ser reduzida. Aconselhamos que você realize um teste de HIV antes de começar o tratamento com Baraclude e a qualquer momento após você ter tido chance de estar exposto ao HIV. Baraclude não lhe auxiliará na infecção por HIV.
Acidose Láctica e Hepatoxicidade
Acidose láctica (distúrbio que leva a acidificação do sangue) e hepatomegalia (fígado com o tamanho aumentado) grave com esteatose, incluindo casos fatais, foram relatados com o uso de nucleosídeos análogos isolados ou em combinação com antirretrovirais.
Alguns pacientes que utilizam medicamentos do tipo de Baraclude podem apresentar uma condição séria chamada acidose láctica. Acidose láctica deve ser tratada no hospital.
Procure o seu médico caso você apresente algum dos seguintes sinais de acidose láctica:
Fraqueza, cansaço, dor muscular incomum, problema respiratório, dor de estômago acompanhada de náusea e vômito, frio especialmente nos braços e pernas, tontura, batimento rápido ou irregular do coração.
Alguns pacientes podem também desenvolver problemas sérios de fígado chamados de hepatotoxicidade com aumento do fígado (hepatomegalia) e gordura no fígado (esteatose).
Procure o seu médico caso você apresente algum dos seguintes sinais de problemas no fígado:
Pele ou olhos amarelados (icterícia), urina escura, não sentir vontade de comer por alguns dias, sentir náusea, dor abdominal baixa.
Pacientes com Insuficiência Renal
Fale para o seu médico se você tem insuficiência renal. Você pode precisar de um ajuste da dose de Baraclude.
Pacientes que Receberam Transplante de Fígado
Antes de iniciar a terapia com Baraclud e durante a terapia, o paciente que recebeu transplante de fígado e está sob tratamento com ciclosporina ou tacrolimo, deve ter a função renal cuidadosamente avaliada.
Gravidez e Amamentação
Não se sabe se o uso de Baraclude é seguro durante a gravidez.
Baraclude deve ser utilizado durante a gravidez apenas se o benefício justificar o risco em potencial ao feto. Não há dados em relação ao efeito que entecavir pode causar na transmissão de VHB da mãe à criança. Portanto, devem-se fazer as intervenções apropriadas para prevenir a infecção do bebê pelo VHB.
Não é conhecido se entecavir é excretado no leite humano. A amamentação não é recomendada em pacientes sob tratamento com Baraclude.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Uso Pediátrico
A segurança e eficácia de entecavir em pacientes com menos de 16 anos de idade não foram estabelecidas.
Interações medicamentosas
Medicamentos
Como entecavir é predominantemente eliminado pelos rins, o uso de medicamentos que reduzem a função renal ou que competem por secreção tubular ativa, juntamente com Baraclude, pode aumentar as concentrações destes medicamentos no sangue. A coadministração de Baraclude com lamivudina, adefovir dipivoxila ou fumarato de tenofovir desoproxila não resultou em significante interação medicamentosa. Os efeitos que estas associações podem resultar não foram avaliados. Os pacientes que estiverem utilizando associações destes medicamentos devem ser cuidadosamente acompanhados.
Alimentos
A presença de alimentos diminui a absorção de entecavir.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Em 2 estudos clínicos, entre os pacientes tratados com Baraclude que nunca receberam terapia com nucleosídeos (Baraclude também pertence a esta classe de medicamento) os eventos adversos mais comuns para qualquer severidade com pelo menos uma relação possível com Baraclude estão listados a seguir.
A frequência é definida como muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento); comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento); incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento).
Distúrbios Psiquiátricos:
Incomum:
Insônia.
Distúrbios do Sistema Nervoso:
Comum:
Cefaleia (dor de cabeça).
Incomum:
Tontura, sonolência.
Distúrbios Gastrointestinais:
Incomum:
Náusea, diarreia, dispepsia (indigestão), vômito.
Geral:
Comum:
Fadiga.
Em 2 estudos clínicos, em pacientes resistentes à lamivudina, os eventos adversos mais comuns para qualquer seriedade com pelo menos uma relação possível com Baraclude estão listados a seguir.
A frequência é definida como:
- Muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento);
- Comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento);
- Incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento).
Distúrbios do Sistema Nervoso:
Comum:
Cefaleia.
Distúrbios Gastrointestinais:
Comum:
Diarreia, dispepsia.
Geral:
Comum:
Fadiga.
Populações especiais
Reações adversas adicionais nos estudos, em pacientes com hepatite B crônica e doença hepática descompensada, incluem diminuição de bicarbonato sanguíneo (2%) e falência renal (< 1%).
No estudo, a taxa de morte cumulativa foi 23%, e as causas de óbito foram geralmente relacionadas ao fígado, como esperado nesta população. No estudo, a taxa cumulativa de carcinoma de fígado foi 12%.
Experiência pós-comercialização
As reações adversas a seguir foram reportadas voluntariamente por uma população de tamanho desconhecido, portanto, não se sabe a possibilidade real estimada da frequência ou estabelecer uma relação causal ao uso de Baraclude.
Distúrbios do sistema imune:
Reação anafilactóide (reação alérgica grave).
Distúrbios do metabolismo e alimentares:
Acidose láctica (distúrbio que leva a acidificação do sangue) tem sido relatada, muitas vezes em associação com descompensação hepática, outras condições médicas graves ou exposição à medicamentos. Pacientes com cirrose descompensada podem ter maior risco para acidose láctica.
Distúrbios hepatobiliares:
Aumento de transaminases (aumento de enzimas do fígado).
Distúrbios da pele e tecidos subcutâneos:
Alopecia (queda dos cabelos), erupção da pele.
Testes laboratoriais
Em alguns pacientes, os resultados de testes sanguíneos que verificam como o fígado e pâncreas estão trabalhando, podem piorar.
Informe ao seu médico ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe também à empresa através do seu serviço de atendimento.
Composição
Cada comprimido revestido contém:
0,5 mg de entecavir.
Excipientes: lactose monoidratada, celulose microcristalina, crospovidona, povidona e estearato de magnésio.
O revestimento do comprimido contém dióxido de titânio, hipromelose, macrogol, polissorbato 80.
Superdosagem
Existe um número limitado de relatos de superdose com Baraclude. Voluntários sadios que receberam doses únicas de até 40 mg ou doses múltiplas de até 20 mg/dia por até 14 dias, não apresentaram aumento ou eventos adversos inesperados. Se ocorrer superdose, procure o médico imediatamente, a fim de ser cuidadosamente monitorado em relação à evidência de toxicidade e receber tratamento de suporte padrão, se necessário.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Como Entecavir (substância ativa) é predominantemente eliminado pelos rins, a coadministração de Entecavir (substância ativa) com medicamentos que reduzem a função renal ou que competem pela secreção tubular ativa pode aumentar as concentrações dos dois medicamentos no sangue.
A coadministração de Entecavir (substância ativa) com lamivudina, adefovir dipivoxila ou fumarato de tenofovir desoproxila resultou em interações medicamentosas não significantes.
Os efeitos da coadministração de Entecavir (substância ativa) com outros medicamentos que são excretados pelos rins ou que afetam a função renal não foram avaliados.
Pacientes devem ser cuidadosamente monitorados quanto a eventos adversos, quando Entecavir (substância ativa) é coadministrado com estes medicamentos.
Interação Alimentícia
A presença de alimentos diminui a absorção de Entecavir (substância ativa).
Ação da Substância
Resultados de eficácia
Desfechos na semana 48
A segurança e a eficácia de Entecavir (substância ativa) foram avaliadas em três estudos Fase III de controle ativo. Esses estudos incluíram 1.633 pacientes com 16 anos de idade, ou mais, com infecção crônica por hepatite B (HBsAg-positivo sérico durante pelo menos 6 meses) acompanhada por evidência de replicação viral (DNA do VHB sérico detectável, medido pela hibridização do bDNA ou por ensaio PCR). Os pacientes apresentaram níveis de ALT persistentemente elevados ao menos 1,3 vezes o limite superior da normalidade (LSN) e inflamação crônica na biópsia do fígado, compatível com um diagnóstico de hepatite viral crônica.
A segurança e a eficácia de Entecavir (substância ativa) também foram avaliadas em um estudo de 191 pacientes com doença hepática descompensada infectados com VHB e em um estudo de 68 pacientes coinfectados com VHB e HIV.
Pacientes Virgens de Nucleosídeo com Doença Hepática Compensada
HBeAg-positivo
O AI 463022 foi um estudo multicêntrico, randomizado, duplo-cego de Entecavir (substância ativa) 0,5mg uma vez ao dia versus lamivudina 100mg uma vez ao dia, por no mínimo 52 semanas, em 709 pacientes virgens de nucleosídeo (de 715 randomizados) com infecção crônica por hepatite B e HBeAg detectável. A idade média dos pacientes foi de 35 anos, 75% eram do sexo masculino; 57% eram asiáticos, 40% eram caucasianos e 13% haviam recebido anteriormente tratamento com interferon-?. No basal, os pacientes apresentaram uma média do Índice Necroinflamatório de Knodell de nível 7,8, de DNA de VHB sérico médio, avaliado através do ensaio Roche.
Amplicor PCR, de 9,66 log10 cópias/mL e nível de ALT sérico médio de 143 U/L.
Amostras de biópsia do fígado foram avaliadas em 89% dos pacientes.
HBeAg-negativo (anti-HBe positivo/DNA do VHB positivo):
O AI 463027 foi um estudo multicêntrico, randomizado, duplo-cego de Entecavir (substância ativa) 0,5mg uma vez ao dia versus lamivudina 100mg uma vez ao dia, por no mínimo 52 semanas em 638 pacientes virgens de nucleosídeo (de 648 randomizados), com infecção crônica por hepatite B HBeAg-negativo (HBeAb-positivo). A idade média dos pacientes foi de 44 anos e 76% eram do sexo masculino, 39% eram asiáticos e 58% eram caucasianos; 13% haviam recebido anteriormente tratamento com interferon-?.
No basal, os pacientes apresentaram uma média do Índice Necroinflamatório de Knodell de nível 7,8 de DNA de VHB sérico médio, avaliado através do ensaio Roche.
Amplicor PCR, de 7,58 log10 cópias/mL e um nível médio de ALT sérica de 142 U/L.
Amostras de biópsia do fígado foram avaliadas em 88% dos pacientes.
Nos Estudos AI 463022 e AI 463027, o Entecavir (substância ativa) foi superior à lamivudina no objetivo primário da eficácia de Melhora Histológica, definida como 2 pontos ou mais de redução no Índice Necroinflamatório de Knodell, sem piora no Índice de Fibrose de Knodell na semana 48 e no objetivo secundário de avaliações de eficácia de redução na carga viral e normalização ALT. A Melhora Histológica e a alteração no Índice de Fibrose de Ishak são mostradas na Tabela 1. Avaliações dos resultados bioquímicos, virológicos e sorológicos são mostradas na Tabela 2.
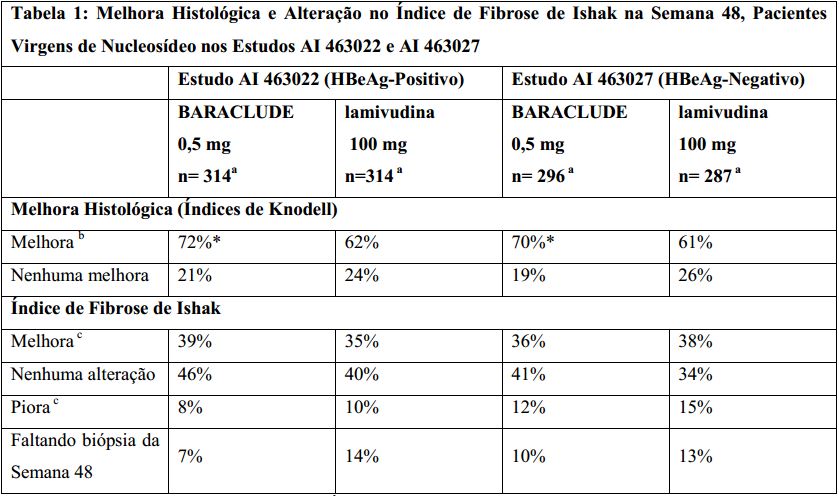 a Pacientes com histologia basal avaliável (Índice Necroinflamatório de Knodell basal ? 2).
a Pacientes com histologia basal avaliável (Índice Necroinflamatório de Knodell basal ? 2).
b ? 2 pontos de diminuição no Índice Necroinflamatório de Knodell, desde os valores basais, sem piora do Índice de Fibrose de Knodell.
c Para o Índice de Fibrose de Ishak, melhora = ? 1 ponto de diminuição desde o valor basal, e piora = ? 1 ponto de aumento desde o valor basal.
* p< 0,05.
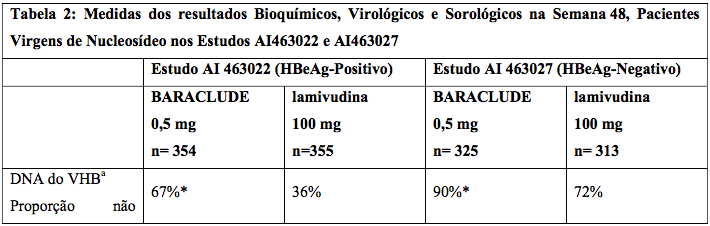
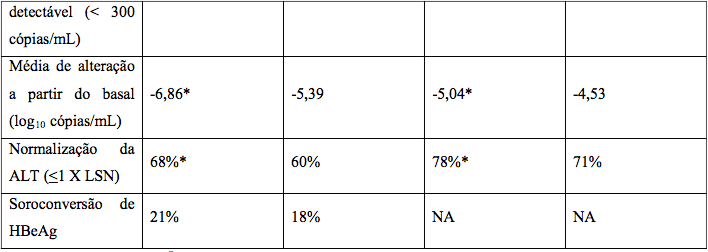 a Ensaio roche amplicor PCR (LLOQ= 300 cópias/mL).
a Ensaio roche amplicor PCR (LLOQ= 300 cópias/mL).
*p<0,05.
A melhora histológica foi independente dos níveis basais de DNA de VHB ou ALT.
Pacientes resistentes à lamivudina com doença hepática compensada
O AI 463026 foi um estudo multicêntrico, randomizado, duplo-cego de Entecavir (substância ativa) em 286 pacientes (de 293 randomizados) com infecção crônica por hepatite B resistente à lamivudina. Os pacientes que estavam recebendo lamivudina na admissão ao estudo trocaram pelo Entecavir (substância ativa) 1mg uma vez ao dia (sem um período de washout ou de sobreposição), ou continuaram com a lamivudina 100mg por no mínimo 52 semanas. A idade média dos pacientes foi de 39 anos e 76% eram do sexo masculino; 37% eram asiáticos e 62% eram caucasianos e 52% haviam recebido anteriormente tratamento com interferon-?. A média de duração da terapia anterior com lamivudina foi 2,7 anos e 85% apresentavam mutações de resistência à lamivudina no basal em um exame investigacional. No basal, os pacientes apresentaram uma média de Índice Necroinflamatório de Knodell de nível 6,5, de DNA de VHB sérico médio, medido pelo ensaio Roche Amplicor PCR, de 9,36 log10 cópias/mL e um nível sérico de ALT de 128 U/l. Amostras de biópsia do fígado foram coletadas em 87% dos pacientes.
Entecavir (substância ativa) foi superior à lamivudina nas avaliações primárias de Melhora Histológica (utilizando o Índice de Knodell na Semana 48). Esses resultados e a alteração no índice de Fibrose de Ishak estão apresentados na Tabela 3. A Tabela 4 apresenta os resultados bioquímicos, virológicos e sorológicos.
| Tabela 3: Melhora Histológica e Alteração no Índice de Fibrose de Ishak na Semana 48, Pacientes resistentes à lamivudina no estudo AI 463026 | ||
| Entecavir (substância ativa) 1mg n = 124a | Lamivudina 100mg n = 116a | |
| Melhora Histológica (Índices de Knodell) | ||
| Melhorab | 55%* | 28% |
| Sem melhora | 34% | 57% |
| Índice de Fibrose de Ishak | ||
| Melhorac | 34%* | 16% |
| Sem alteração | 44% | 42% |
| Piorac | 11% | 26% |
| Faltou a biópsia da Semana 48 | 11% | 16% |
a Pacientes com histologia basal avaliável (Índice Necroinflamatório de Knodell basal ? 2).
b ? 2 pontos de diminuição no Índice Necroinflamatório de Knodell, desde os valores basais, sem piora do Índice de Fibrose de Knodell.
c Para o índice de fibrose de Ishak, melhora é igual a? 1 ponto de diminuição do basal e piora é igual a ? 1 ponto de aumento do basal.
* p < 0,01.
| Tabela 4: Resultados Finais Bioquímicos, Virológicos e Solorógicos na Semana48, Pacientes Resistentes à lamivudina no Estudo AI463026 | ||
| Entecavir (substância ativa) 1mg n = 141 | Lamivudina 100mg n = 145 | |
| DNA do VHBa Porção não detectável (< 300 cópias/mL) | 19%* | 1% |
| Alteração média dos valores basais (log10 cópias/mL) | -5,11* | -0,48 |
| Normalização da ALT (<1 X LSN) | 61%* | 15% |
| Soroconversão de HBeAg | 8% | 3% |
a Ensaio Roche Amplicor PCR.
* p < 0,0001.
Desfechos além da semana 48
A duração ideal de terapia com Entecavir (substância ativa) é desconhecida. De acordo com os critérios dos protocolos dos estudos de fase III, os pacientes descontinuaram o tratamento com Entecavir (substância ativa) ou lamivudina após 52 semanas de acordo com a definição de resposta baseada na supressão virológica do VHB (<0,7 MEq/mL por ensaio de bDNA) e perda de HBeAg (em pacientes HBeAg positivos) ou diminuição de ALT <1,25 X LSN (em pacientes HBeAg negativos) na semana 48.
Pacientes que atingiram supressão virológica, mas não resposta sorológica (HBeAg positivos) ou não atingiram ALT <1,25 X LSN (HBeAg negativos) continuaram recebendo dose cega por 96 semanas ou até a resposta ser atingida. Estes guias de gerenciamento específicos para pacientes de protocolo não são destinados como guias de práticas clínicas.
Pacientes virgens de tratamento com nucleosídeo
Entre pacientes HBeAg-positivo, virgens de tratamento (Estudo AI463022), 243 (69%) dos pacientes tratados com Entecavir (substância ativa) e 164 (46%) tratados com lamivudina, continuaram em tratamento cego por até 96 semanas. Entre os pacientes que continuaram em tratamento cego no segundo ano, 180 (74%) e 60 (37%) dos pacientes tratados com Entecavir (substância ativa) e lamivudina, respectivamente, atingiram DNA de VHB <300 cópias/mL por PCR no final do tratamento (até 96 semanas). 193 (79%) dos pacientes tratados com Entecavir (substância ativa) atingiram ALT ? 1 X LSN, comparado a 112 (68%) dos pacientes tratados com lamivudina, e soroconversão de HBeAg ocorreu em 26 (11%) e em 20 (12%) dos pacientes tratados com Entecavir (substância ativa) e lamivudina, respectivamente.
Entre pacientes HBeAg-positivo, virgens de tratamento, 74 (21%) dos que receberam terapia com Entecavir (substância ativa) e 67 (19%) dos pacientes tratados com lamivudina, definiram resposta na 48o semana, descontinuaram o uso do medicamento e foram acompanhados sem tratamento por 24 semanas. Entre os responsivos ao Entecavir (substância ativa), 26 (35%) dos pacientes tiveram DNA de VHB < 300 cópias/mL, 55 (74%) tiveram ALT ? 1 X LSN e, 56 (76%) sustentaram soroconversão de HBeAg até o fim do acompanhamento. Entre os responsivos à lamivudina, 20 (30%) dos pacientes apresentaram DNA de VHB < 300 cópias/mL, 41 (61%) apresentaram ALT ? 1 X LSN, e 47 (70%) dos pacientes sustentaram soroconversão de HBeAg até o fim do acompanhamento.
Entre pacientes HBeAg-negativo (Estudo AI463027),virgens de tratamento, 26 (8%) e 28 (9%) dos pacientes tratados com Entecavir (substância ativa) ou lamivudina, respectivamente, continuaram em tratamento cego por até 96 semanas. Neste pequeno tratamento contínuo de coorte no ano dois, 22 pacientes tratados com Entecavir (substância ativa) e 16 com lamivudina, apresentaram DNA de VHB < 300 cópias/mL por PCR, e 7 e 6 pacientes, respectivamente, apresentaram ALT ? 1 X LSN no fim do tratamento (até 96 semanas).
Entre pacientes HBeAg-negativo, virgens de tratamento, 275 (85%) dos tratados com Entecavir (substância ativa) e 245 (78%) dos tratados com lamivudina definiram resposta na 48o semana, descontinuaram o tratamento e foram acompanhados sem tratamento por 24 semanas. Neste coorte, poucos pacientes em cada braço do tratamento tinham DNA de VHB < 300 cópias/mL por PCR no final do acompanhamento. No fim do acompanhamento, 126 (46%) dos pacientes tratados com Entecavir (substância ativa) e 84 (34%) daqueles tratados com lamivudina apresentaram ALT ? 1 X LSN.
Pacientes resistentes à lamivudina
Entre os pacientes resistentes à lamivudina (Estudo AI463026), 77 (55%) dos tratados com Entecavir (substância ativa) e 3 (2%) tratados com lamivudina continuaram em tratamento cego por até 96 semanas. Neste coorte de pacientes tratados com Entecavir (substância ativa), 31 (40%) atingiram DNA de VHB < 300 cópias/mL, 62 (81%) dos pacientes tiveram ALT? 1 X LSN, e 8 (10%) demonstraram soroconversão de HBeAg no fim do tratamento.
Populações Especiais
Pacientes com doença hepática descompensada
Em um estudo randomizado aberto, 191 pacientes com infecção crônica por VHB com HBeAg-positivo ou negativo, com evidência de descompensação hepática, definida como uma pontuação de Child-Turcotte-Pugh (CTP) de 7 ou maior, receberam Entecavir (substância ativa) 1mg uma vez ao dia ou adefovir dipivoxila 10mg uma vez ao dia. Os pacientes eram ou virgens de tratamento para VHB ou previamente tratados (excluindo pré-tratamento com Entecavir (substância ativa), adefovir dipivoxila ou fumarato de tenofovir desoproxila). Entecavir (substância ativa) foi superior ao adefovir dipivoxila no desfecho de eficácia primário de alteração média do valor basal no DNA de VHB sérico por PCR, na semana 24. Resultados para os desfechos selecionados do estudo, na semana 24 e 48, são apresentados na tabela 5.
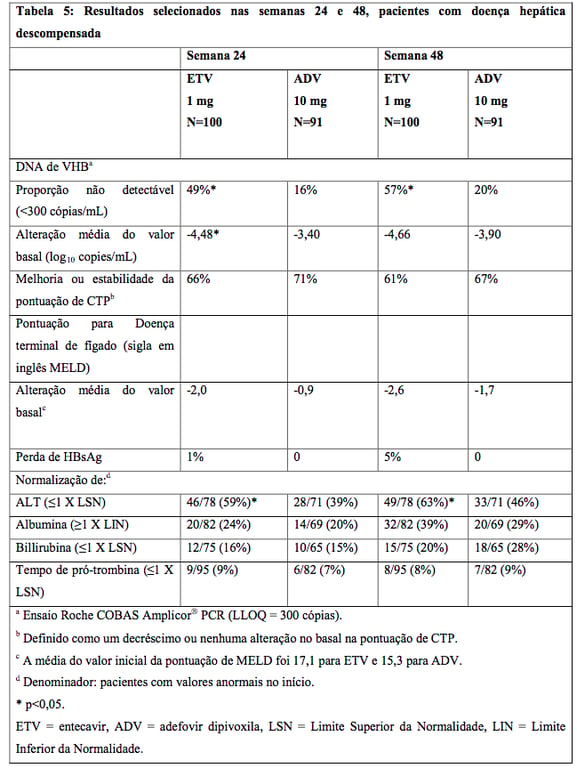
O tempo para início de carcinoma hepatocelular ou morte (qualquer um que ocorra primeiro) foi comparável nos dois grupos de tratamento.
Pacientes coinfectados com HIV e VHB
O AI 463038 foi um estudo randomizado, duplo-cego, controlado com placebo de Entecavir (substância ativa) versus placebo, em 68 pacientes coinfectados com HIV e VHB, que apresentaram recorrência de viremia de VHB enquanto recebiam um regime HAART (highly active antiretroviral therapy) [terapia antirretroviral altamente ativa] contendo lamivudina. Os pacientes continuaram com seu regime HAART contendo lamivudina (300mg/dia) e foram designados para acrescentar 1mg de Entecavir (substância ativa) uma vez ao dia (51 pacientes) ou placebo (17 pacientes), durante 24 semanas, seguidas por uma fase aberta, por um período adicional de 24 semanas, em que todos os pacientes receberam Entecavir (substância ativa). No basal, os pacientes apresentaram um nível sérico médio de DNA do VHB, por PCR, de 9,13 log10 cópias/mL. 99% dos pacientes eram HBeAg-positivos no basal, com um nível basal médio de ALT de 71,5 U/l.
Os níveis médios de RNA de HIV permaneceram estáveis em aproximadamente 2 log10 cópias/mL até a semana 24 da terapia cega. Os resultados bioquímicos e virológicos na semana 24 são apresentados na Tabela 6. Não há dados em pacientes coinfectados com HIV e VHB, que não receberam terapia prévia com lamivudina.
Entecavir (substância ativa) não foi avaliado em pacientes coinfectados com HIV e VHB que não estivessem recebendo simultaneamente tratamento efetivo para HIV.
| Tabela 6: Resultados Bioquímicos e Virológicos na Semana 24, Estudo AI463038 | ||
| Entecavir (substância ativa) 1mga n = 51 | Placeboa n = 17 | |
| DNA de VHBb | ||
| Proporção não detectável (<300 cópias/mL) | 6% | 0 |
| Alteração média desde valores basais (log10cópias/mL) | - 3,65* | 0,11 |
| Normalização da ALT (<1 X LSN) | 34%c | 8%c |
a Todos os pacientes também receberam um regime HAART contendo lamivudina.
b Ensaio Roche Amplicor PCR (LLOQ = 300 cópias).
c Porcentagem de pacientes com ALT anormal (> 1 X LSN) no basal que atingiram normalização ALT (n= 35 para Entecavir (substância ativa) e n= 12 para placebo).
* p < 0,0001.
Para pacientes originalmente determinados para Entecavir (substância ativa), no fim da fase aberta (semana 48), 8% dos pacientes tinham DNA de VHB < 300 cópias/mL por PCR, a principal alteração do basal de DNA de VHB por PCR foi de – 4,20 log10 cópias/mL, e 37% dos pacientes com ALT anormal no basal tiveram normalização ALT (< 1 X LSN).
Pacientes que receberam transplante de fígado
A segurança e eficácia de Entecavir (substância ativa) 1mg uma vez ao dia foram avaliadas em um estudo aberto, braço único, com 65 pacientes que haviam recebido transplante de fígado devido a complicações decorrentes de infecção crônica por VHB e com DNA de VHB < 172 UI/mL (aproximadamente 1000 cópias/ml) no momento do transplante. A população do estudo era composta por 82% do sexo masculino, 39% caucasianos e 37% asiáticos, com idade média de 49 anos; 89% eram HBeAg-negativos no momento do transplante. Dos 61 pacientes avaliados quanto a eficácia (recebendo Entecavir (substância ativa) por pelo menos 1 mês), 60 receberam também imunoglobulina anti-hepatite B, como parte do regime de profilaxia pós-transplante. Na semana 72 pós-transplante, nenhum dos pacientes avaliados apresentou recorrência de VHB [definida como DNA de VHB ? 50 UI/mL (cerca de 300 cópias/ml)] pela análise da última observação realizada (LOCF). A frequência e a natureza dos eventos adversos encontrados neste estudo foram consistentes com aqueles esperados para pacientes fígado transplantados e também com o perfil de segurança já conhecido para Entecavir (substância ativa).
Grupos raciais/étnicos
A segurança e eficácia de Entecavir (substância ativa) 0,5mg uma vez por dia foram avaliadas em um estudo aberto, braço único, em pacientes com infecção crônica por VHB, HBeAg-positivo ou negativo, virgem de nucleosídeos, negros/afroamericanos (n = 40) e hispânicos (n = 6). Neste estudo, 76% dos pacientes eram do sexo masculino, com idade média de 42 anos; 57% HBeAg-positivo, com valor basal médio de DNA de VHB de 7,0 log10 UI/mL e valor basal médio de ALT de 162 U/L. Na semana 48, 32 de 46 pacientes (70%) tiveram DNA de VHB <50 UI/mL (cerca de 300 cópias/ml), 31 dos 46 pacientes (67%) apresentaram normalização da ALT (? 1 vez LSN) e 12 de 26 (46%) de HBeAg-positivos tiveram soroconversão do HBe.
Características farmacológicas
Entecavir (substância ativa) é um análogo de nucleosídeo guanosino, com atividade seletiva contra o vírus da hepatite B (VHB). O nome químico do Entecavir (substância ativa) é 2-amino-1,9-diidro-9-[(1S,3R,4S)-4-hidróxi-3-(hidroximetil)-2-metileno-ciclopentil]-6H-purina-6-ona, monoidratado. Sua fórmula molecular é C 12 H 15 N 5 O 3 •H 2 O, que corresponde a um peso molecular de 295,3.
O Entecavir (substância ativa) apresenta a seguinte fórmula estrutural:
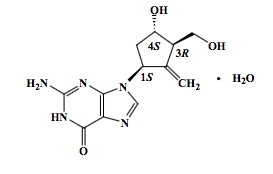
Farmacodinâmica
Mecanismo de Ação
O Entecavir (substância ativa) é um análogo de nucleosídeo guanosino, com uma atividade contra a polimerase do VHB. Ele é eficientemente fosforilado na forma ativa de trifosfato (TP), que tem uma meia-vida intracelular de 15 horas. Através da competição com o substrato natural deoxiguanosina TP, Entecavir (substância ativa)-TP inibe funcionalmente todas as três atividades da polimerase viral (transcriptase reversa, rt): (1) atividade principal da polimerase VHB, (2) transcrição reversa da fita negativa do mensageiro pregenômico do RNA, e (3) síntese da fita positiva de DNA do VHB. Entecavir (substância ativa)-TP é um inibidor fraco das polimerases de DNA celular?, ?, e ? e da polimerase de DNA mitocondrial ? com valores de Ki variando de 18 a >160?M.
Atividade antiviral
A concentração de Entecavir (substância ativa) que inibiu 50% da síntese do DNA viral (EC50) foi de 0,004 ?m em células humanas HepG2 transfectadas com o tipo selvagem de VHB. O valor médio de EC50 para Entecavir (substância ativa) contra VHB resistentes à lamivudina (rtL180M, rtM204V) foi de 0,026 ?M (entre 0,010 -0,059?M).
A coadministração de inibidores da transcriptase reversa de nucleosídeo (ITRNs) de HIV com o Entecavir (substância ativa) não tem a probabilidade de reduzir a eficácia antiviral do Entecavir (substância ativa) contra o VHB, ou de nenhum desses agentes contra o HIV. Em ensaios de combinação do VHB in vitro, a atividade antiviral do Entecavir (substância ativa), não foi afetada pela presença de abacavir, didanosina, lamivudina, estavudina, tenofovir ou zidovudina. Em ensaios antivirais do HIV, o Entecavir (substância ativa) não apresentou efeito sobre a atividade anti-HIV in vitro destes seis ITRNs ou emtricitabina em concentrações > 100 vezes a Cmáx de Entecavir (substância ativa) com 1mg de dose.
Atividade antiviral contra o HIV
Uma análise abrangente da atividade inibitória do Entecavir (substância ativa) em isolados laboratoriais e clínicos do HIV tipo 1 (HIV-1), utilizando-se uma variedade de células e condições de ensaio, resultou em valores de EC50 que variaram de 0,026 a > 10 ?M. Os valores mais baixos de EC50 foram observados quando houve diminuição da carga viral utilizada no ensaio. Em cultura de células, o Entecavir (substância ativa) selecionou para uma substituição M184I na transcriptase reversa do HIV, em concentrações micromolares, confirmando sua pressão inibitória em concentrações elevadas. Variantes do HIV, com substituição M184V, apresentaram perda de sensibilidade ao Entecavir (substância ativa).
Resistência ao fármaco
In vitro
Em ensaios baseados em células, reduções de 8 a 30 vezes na sensibilidade fenotípica do Entecavir (substância ativa) foram observadas para as cepas resistentes à lamivudina.
Para reduções adicionais (>70 vezes) na sensibilidade fenotípica do Entecavir (substância ativa), foi necessária a presença de substituições aminoácidas no rtM204I/V com ou sem alteração em rtL180M, e substituições adicionais nos resíduos rtT184, rtS202, ou rtM250 ou a combinação destas substituições com ou sem uma substituição rtI169 na transcriptase reversa do VHB.
Estudos clínicos
Pacientes virgens de tratamento com nucleosídeo:
Avaliações genotípicas foram realizadas em amostras (>300 cópias/mL de soro com DNA de VHB) de 562 pacientes tratados com Entecavir (substância ativa) por até 96 semanas em estudos com pacientes virgens de tratamento com nucleosídeo (AI463022, AI463027, e estudo de extensão AI463901). Na semana 96, a evidência de substituição de aminoácido na rtS202G, com substituições na rtM204V e rtL180M, foi detectada em VHB de 2 pacientes (2/562 = <1%), e um deles apresentou rebote virológico (?1 log de aumento sobre nadir).
Além disso, substituições de aminoácido na rtM204I/V e rtL180M, rtL80I, ou rtV173L, que levaram à diminuição da sensibilidade fenotípica ao Entecavir (substância ativa) na ausência de mudanças na rtT184, rtS202, ou rtM250, foram detectados no VHB de 3 pacientes (3 / 562 = <1%) que apresentaram rebote virológico. Para pacientes que continuaram o tratamento após 48 semanas, 75% (202/269) tiveram DNA de VHB <300 cópias /mL no final do tratamento (até 96 semanas). Pacientes virgens de tratamento HBeAg-positivo (n=243) e HBeAg-negativo (n=39), que falharam para atingir a resposta completa definida do estudo em 96 semanas, continuaram o tratamento com Entecavir (substância ativa) em um estudo de extensão.
A resposta completa para HBeAg-positivo foi <0,7 MEq/mL (aproximadamente 7 x 105 cópias/mL) de DNA de VHB sérico e perda de HBeAg e, para HBeAg-negativo foi <0,7 MEq/mL de DNA de VHB e normalização ALT. Pacientes receberam 1mg de Entecavir (substância ativa) uma vez ao dia por um período adicional de até 144 semanas. Desses 282 pacientes, 141 pacientes HBeAg-positivo e 8 pacientes HBeAg-negativo entraram no estudo de extensão de acompanhamento de longa duração e foram avaliados para resistência ao Entecavir (substância ativa). Entre os 149 pacientes que entraram no estudo extensão, 88% (131/149), 92% (137/149) e 92% (137/149) atingiram DNA de VHB sérico <300 cópias/mL nas semanas 144, 192 e 240 (incluindo final do tratamento), respectivamente. Nenhuma nova substituição associada à resistência ao Entecavir (substância ativa) foi identificada na comparação dos genótipos dos isolados avaliados com seus respectivos isolados basais. A probabilidade cumulativa de desenvolvimento das substituições relacionadas à resistência ao Entecavir (substância ativa) em rtT184, rtS202, ou rtM250 (na presença das substituições em rtM204V e rtL180M) nas semanas 48, 96, 144, 192 e 240 foi 0,2%; 0,5%; 1,2%, 1,2% e 1,2%, respectivamente.
Pacientes resistentes à lamivudina
Avaliações genotípicas foram realizadas em amostras disponíveis de 190 pacientes tratados com Entecavir (substância ativa) por até 96 semanas em estudos de VHB resistente à lamivudina (AI463026, AI463014, AI463015, e estudo de extensão AI463901). Na semana 96, substituições de aminoácidos associadas à resistência em rtS202, rtT184, -ou rtM250, com ou sem alterações em rtI169, na presença de substituições aminoácidas em rtM204I/V com ou sem rtL180M, rtL80V ou rtV173L/M surgiram no VHB de 22 pacientes (22/190 = 12%), sendo que 16 apresentaram rebote virológico? (1 log10 de aumento sobre nadir) e 4 nunca tiveram supressão viral <300 cópias/mL.
O VHB de 4 desses pacientes possuía substituições de resistência ao Entecavir (substância ativa) no basal e adquiriu alterações no tratamento com Entecavir (substância ativa). Além dos 22 pacientes, 3 outros apresentaram rebote virológico com o surgimento de rtM204I/V e rtL180M, rtL80V, ou rtV173L/M. Para isolados de pacientes que apresentaram rebote virológico com o aparecimento de substituições de resistência (n=19), a média de alteração nos valores de EC50 do Entecavir (substância ativa) quando comparado à referência, foi 19 vezes no basal e 106 vezes no período de rebote virológico. Para pacientes que continuaram o tratamento além das 48 semanas, 40% (31/77) tinha DNA de VHB <300 cópias/mL no final do tratamento (até 96 semanas).
Pacientes resistentes à lamivudina (n=157), que falharam para atingir resposta completa definida do estudo na semana 96, continuaram o tratamento com Entecavir (substância ativa).
Os pacientes receberam 1mg de Entecavir (substância ativa) uma vez ao dia por um período adicional de até 144 semanas. Desses pacientes, 80 entraram no estudo de acompanhamento de longa duração e foram avaliados para a resistência ao Entecavir (substância ativa). Nas semanas 144, 192 e 240 (incluindo o final do tratamento), 34% (27/80), 35% (28/80), e 36% (29/80), respectivamente, atingiram DNA de VHB < 300 cópias/mL. A probabilidade cumulativa de desenvolvimento de substituições rtT184, rtS202, ou rtM250 associadas à resistência ao Entecavir (substância ativa) (na presença de substituições rtM204I/V com ou sem rtL180M) nas semanas 48, 96, 144, 192 e 240 foi 6,2%, 15%, 36,3%, 46,6% e 51,5%, respectivamente. O VHB de 6 pacientes desenvolveu substituições de aminoácidos na rtA181C/G/S/T enquanto eram tratados com Entecavir (substância ativa), e desses, 4 desenvolveram substituições de resistência ao Entecavir (substância ativa) nas rtT184, rtS202, ou rtM250 e um tinha uma substituição na rtT184S no basal. Dos 7 pacientes cujo VHB tinha uma substituição na rtA181 no basal, 2 pacientes também tinham substituições na rtT184, rtS202, ou rtM250 no basal e outros 2 pacientes desenvolveram-nas enquanto estavam sob tratamento com Entecavir (substância ativa).
Resistência Cruzada
Resistência cruzada foi observada entre análogos de nucleosídeos de VHB. Em ensaios baseados em células, Entecavir (substância ativa) apresentou inibição de 8 a 30 vezes menor na síntese do DNA de VHB para o VHB contendo substituições de resistência à lamivudina e telbivudina rtM204I/V com ou sem rtL180M em relação ao vírus selvagem de VHB. Substituições rtM204I/V com ou sem rtL180M, rtL80I/V,ou rtV173L, que estão associadas com resistência à lamivudina e telbivudina, também decrescem a sensibilidade fenotípica ao Entecavir (substância ativa). A eficácia de Entecavir (substância ativa) contra VHB com substituições associadas à resistência ao adefovir não foram estabelecidas nos estudos clínicos. Isolados de VHB de pacientes resistentes à lamivudina com falha na terapia com Entecavir (substância ativa), foram susceptíveis ao adefovir em cultura celular, mas permaneceram resistentes à lamivudina. Genomas recombinantes de VHB codificando substituições associadas à resistência ao adefovir em rtN236T ou rtA181V, apresentaram 0,3 e 1,1 vezes de alteração na susceptibilidade ao Entecavir (substância ativa) em cultura celular, respectivamente.
Farmacocinética
As farmacocinéticas de dose única e múltipla de Entecavir (substância ativa) foram avaliadas em voluntários sadios e pacientes com infecção crônica de hepatite B.
Absorção
Em voluntários sadios, Entecavir (substância ativa) foi rapidamente absorvido com pico de concentração plasmática ocorrendo entre 0,5 e 1,5 horas após administração oral. Houve um aumento proporcional a dose nos valores de pico de concentração plasmática (Cmáx) e área sobre a curva (ASC) no estado de equilíbrio de acordo com doses múltiplas diárias entre 0,1 e 1mg. O estado de equilíbrio foi atingido após 6-10 dias da administração de uma dose única diária com acúmulo aproximado de 2 vezes a concentração. Cmáx e concentração plasmática no estado de equilíbrio foram de 4,2 e 0,3 ng/mL, respectivamente, para a dose de 0,5mg, e 8,2 e 0,5 ng/mL, respectivamente, para dose de 1mg.
Efeitos da alimentação na absorção oral: A administração oral de Entecavir (substância ativa) 0,5mg com refeição padrão gordurosa (945 kcal, 54,6 g de gordura) ou refeição leve (379 kcal, 8,2 g de gordura) resultou em atraso na absorção (1-1,5 hora alimentado vs. 0,75 hora em jejum), diminuição no Cmáx de 44-46%, e diminuição no ASC de 18-20%.
Distribuição
Baseando-se no perfil farmacocinético de Entecavir (substância ativa) após administração oral, o volume aparente de distribuição estimado para Entecavir (substância ativa), está em excesso no total de água presente no corpo, sugerindo que Entecavir (substância ativa) é distribuído extensivamente nos tecidos.
A ligação de Entecavir (substância ativa) às proteínas plasmáticas humanas in vitro, foi aproximadamente 13%.
Metabolismo e eliminação
Após a administração de 14C-Entecavir (substância ativa) em humanos e ratos, nenhum metabólito oxidativo ou acetilado foi observado. Quantidade mínima de metabólitos de fase II (conjugados de glucuronida e sulfato) foi observada.
Entecavir (substância ativa) não é um substrato, inibidor ou indutor do sistema enzimático CYP450.
Após atingir níveis de pico, as concentrações plasmáticas de Entecavir (substância ativa) diminuíram de maneira biexponencial com meia-vida de eliminação terminal de aproximadamente 128-149 horas. O índice de acúmulo observado de fármaco é aproximadamente 2 vezes maior com dose única diária, sugerindo um tempo de meia-vida efetivo do acúmulo de aproximadamente 24 horas.
Entecavir (substância ativa) é predominantemente eliminado pelos rins com recuperação urinária do fármaco inalterado no estado de equilíbrio variando de 62%-73% da dose administrada. A depuração renal é independente da dose e varia entre 360 e 471mL/min sugerindo que Entecavir (substância ativa) passa tanto por filtração glomerular quanto por secreção da rede tubular.
Pacientes com Insuficiência Renal
A farmacocinética do Entecavir (substância ativa) após uma dose única de 1mg foi estudada em pacientes (sem infecção crônica por hepatite B) com graus selecionados de insuficiência renal, incluindo pacientes cuja insuficiência renal era controlada por hemodiálise ou por diálise peritoneal ambulatorial contínua (DPAC). Os resultados são apresentados na Tabela 7:
Tabela 7: Parâmetros farmacocinéticos em individuos com graus selecionados de função renal:
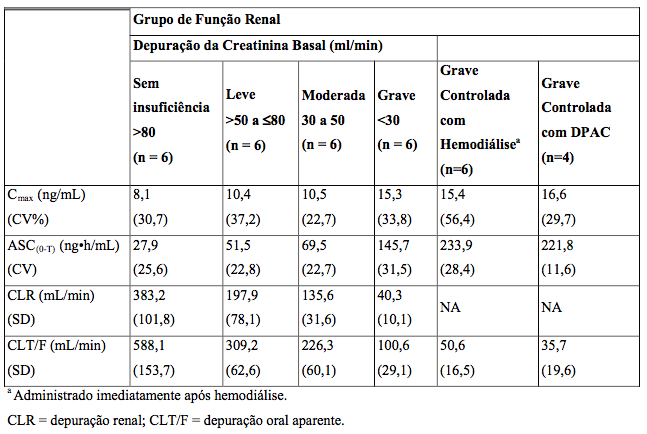
Após uma dose única de 1mg de Entecavir (substância ativa) administrado 2 horas antes da sessão de hemodiálise, foi removida aproximadamente 13% da dose de Entecavir (substância ativa) durante 4 horas de hemodiálise. DPAC removeu aproximadamente 0,3% da dose, durante 7 dias.
Pacientes com Insuficiência Hepática
A farmacocinética do Entecavir (substância ativa) após uma dose única de 1mg foi estudada em pacientes (sem infecção crônica por hepatite B) com insuficiência hepática moderada e grave (Child-Pugh classe B ou C). A farmacocinética do Entecavir (substância ativa) foi semelhante entre os pacientes com insuficiência hepática e indivíduos saudáveis de controle; portanto, nenhum ajuste na dosagem de Entecavir (substância ativa) é recomendado para pacientes com insuficiência hepática.
Pacientes que Receberam Transplante de Fígado
Existem dados limitados sobre a eficácia e segurança de Entecavir (substância ativa) em pacientes que receberam transplante de fígado. Em um pequeno estudo piloto de uso de Entecavir (substância ativa) em receptores de transplante de fígado, infectados por VHB, com uma dose estável de ciclosporina A (n=5) ou de tacrolimo (n = 4), a exposição ao Entecavir (substância ativa) foi de aproximadamente 2 vezes a exposição em indivíduos saudáveis, com função renal normal. A função renal alterada contribuiu para o aumento da exposição ao Entecavir (substância ativa) nesses pacientes. O potencial de interações farmacocinéticas entre Entecavir (substância ativa) e ciclosporina A ou tacrolimo não foi formalmente avaliado.
Pacientes Geriátricos
O efeito da idade na farmacocinética do Entecavir (substância ativa) foi avaliado através da administração de uma dose única oral de 1mg em voluntários jovens e idosos sadios. A ASC de Entecavir (substância ativa) foi de 29,3% maior em voluntários idosos em relação aos jovens.
A disparidade na exposição entre voluntários jovens e idosos foi provavelmente atribuída a diferenças na função renal. O ajuste de dose de Entecavir (substância ativa) deve ser baseado na função renal do paciente e não na idade.
Sexo/Raça
Sexo ou raça não interfere no perfil farmacocinético de Entecavir (substância ativa).
Interações medicamentosas
O metabolismo de Entecavir (substância ativa) foi avaliado em estudos in vitro e in vivo. Entecavir (substância ativa) não é um substrato, inibidor ou indutor do sistema enzimático citocromo P450 (CYP450). Em concentrações de até aproximadamente 10.000 vezes maiores que aquelas obtidas em humanos, Entecavir (substância ativa) não inibiu nenhuma das principais enzimas do CYP450 1A2, 2C9, 2C19, 2D6, 3A4, 2B6 e 2E1. Em concentrações de até aproximadamente 340 vezes maiores que aquelas observadas em humanos, Entecavir (substância ativa) não induziu as enzimas humanas do CYP450 1A2, 2C9, 2C19, 3A4, 3A5 e 2B6.
É improvável que a farmacocinética do Entecavir (substância ativa) seja afetada pela coadministração de agentes que também sejam metabolizados pelo sistema CYP450, induzem ou inibem o sistema CYP450. Da mesma maneira, é improvável que a farmacocinética de conhecidos substratos de CYP seja afetada pela coadministração de Entecavir (substância ativa).
O estado de equilíbrio farmacocinético de Entecavir (substância ativa) e medicamentos coadministrados não foi alterado em estudos de interação de Entecavir (substância ativa) com lamivudina, adefovir dipivoxila e fumarato de tenofovir desoproxila.
Cuidados de Armazenamento
Conservar o frasco bem fechado em temperatura ambiente (entre 15 e 30ºC). Manter o produto dentro do cartucho para proteger da luz
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
Baraclude 0,5 mg:
Comprimido revestido com filme de cor branca a esbranquiçada, triangular, com “BMS” gravado em um lado e “1611” gravado no outro lado.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Reg. MS – 1.0180.0377
Responsável Técnico:
Dra. Elizabeth M. Oliveira - CRF-SP nº 12.529
Fabricado por:
AstraZeneca Pharmaceuticals LP 4601 Highway 62 East
Mount Vernon – Indiana – EUA
Importado por:
Bristol-Myers Squibb Farmacêutica LTDA.
Rua Verbo Divino, 1711 – Chácara Santo Antônio - São Paulo - SP
CNPJ 56.998.982/0001-07
Venda sob prescrição médica.