Comparamos o preço de Bromidrato De Citalopram - 20 Mg 30 Comprimidos Revestidos Teuto Genérico, veja o menor preço

R$ 8,95
GGenérico
5
ofertasMelhores preços a partir de R$ 8,95 até R$ 26,07
Menor preço
vendido por Drogaria Nova Esperança
economize
65.67%
R$ 8,95
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
vendido por Drogarias Pacheco
economize
20.25%
R$ 20,79
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Drogaria São Paulo
economize
20.25%
R$ 20,79
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Drogaria Catarinense
economize
18.26%
R$ 21,31
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Preço Popular
R$ 26,07
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Bromidrato de Citalopram (substância ativa) é usado para tratar a depressão e, após a melhora, para prevenir a recorrência desses sintomas.
Bromidrato de Citalopram (substância ativa) é usado em tratamentos de longo prazo para prevenir a recorrência de novos episódios depressivos em pacientes que tem depressão recorrente.
Bromidrato de Citalopram (substância ativa) é eficaz também para o tratamento de pacientes com transtorno do pânico com ou sem agorafobia e para o tratamento de pacientes com transtorno obsessivo compulsivo (TOC).
Contraindicação
O Bromidrato de Citalopram (substância ativa) é contraindicado em pacientes que apresentam hipersensibilidade ao Citalopram (substância ativa) ou a qualquer um de seus componentes.
O tratamento concomitante com IMAO (inibidores da monoaminoxidase) e pimozida é contraindicado.
O Bromidrato de Citalopram (substância ativa) não deve ser dado a pacientes recebendo Inibidores da Monoaminoxidase (IMAOs) incluindo selegilina em doses diárias que excedam 10mg/dia. O Bromidrato de Citalopram (substância ativa) não deve ser administrado por até catorze dias após a descontinuação de um IMAO irreversível ou pelo tempo especificado após a descontinuação de um IMAO reversível (RIMA) como descrito no texto de bula do RIMA. IMAOs não devem ser introduzidos antes de sete dias após descontinuação do Citalopram (substância ativa).
O Bromidrato de Citalopram (substância ativa) é contraindicado para uso concomitante com linezolida a menos que seja possível monitorar de perto a pressão sanguínea do paciente.
Citalopram (substância ativa) é contraindicado em pacientes que apresentam prolongamento do intervalo QT ou síndrome congênita do prolongamento QT.
Gravidez
Categoria de risco B: não há dados clínicos disponíveis do Citalopram (substância ativa) sobre a exposição durante a gravidez.
Uma grande quantidade de dados de mulheres grávidas (mais do que 2500 exposições relatadas) indicou não haver malformação do feto ou toxicidade neonatal. Entretanto, o Citalopram (substância ativa) não deve ser usado durante a gravidez a menos que seja claramente necessário e somente após uma avaliação criteriosa do benefício/risco.
Recém-nascidos devem ser observados se o uso materno de Bromidrato de Citalopram (substância ativa) continua nas fases finais da gravidez, especialmente no terceiro trimestre. A descontinuação abrupta deve ser evitada durante a gravidez.
Os seguintes sintomas podem ocorrer nos neonatos após uso maternal de ISRS / uso SNRI nos estágios mais avançados da gravidez: dificuldade respiratória, cianose, apneia, convulsões, instabilidade térmica, dificuldade de alimentação, vômitos, hipoglicemia, hipertonia, hipotonia, hiperreflexia, tremor, agitação, irritabilidade, letargia, choro constante, sonolência e dificuldade para dormir. Estes sintomas podem ser devido a efeitos serotoninérgicos ou sintomas de descontinuação. Na maioria dos casos, as complicações iniciam-se imediatamente ou brevemente (<24 horas) após o parto.
Dados epidemiológicos sugerem que o uso de ISRS durante a gravidez, especialmente no final da gravidez, podem aumentar o risco de hipertensão pulmonar persistente do recém-nascido (HPP). O risco observado foi de cerca de 5 casos por 1.000 gestações. Na população geral 1-2 casos de HPP por 1000 gestações ocorrem.
Baseado em dados de estudos de toxicidade reprodutiva (segmento I, II e III) não há nenhuma razão para ter preocupação especial com o uso de Citalopram (substância ativa) em mulheres em idade fértil.
Lactação
O Citalopram (substância ativa) é excretado no leite materno em baixas concentrações. Estima-se que o lactente receberá cerca de 5% do peso da dose diária materna relacionados (emmg/kg). Nenhuma ou apenas pequenos eventos têm sido observados em lactentes. No entanto, a informação existente é insuficiente para a avaliação do risco para a criança. Recomenda-se precaução.
Fertilidade
Dados de estudos em animais mostraram que o Citalopram (substância ativa) pode afetar a qualidade do esperma.
Relatos de casos em humanos com alguns ISRSs mostram que este efeito na qualidade do esperma é reversível. Até o momento não foi observado impacto na fertilidade humana.
Não usar Bromidrato de Citalopram (substância ativa) durante a gravidez, a menos que a necessidade seja clara e seja avaliado cuidadosamente o risco-benefício do uso deste medicamento.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Como usar
Os comprimidos de Bromidrato de Citalopram (substância ativa) são administrados por via oral, uma única vez ao dia. Os comprimidos de Bromidrato de Citalopram (substância ativa) podem ser tomados em qualquer momento do dia, com ou sem alimentos. Engolir os comprimidos com água, sem mastigá-los.
Tratamento da depressão
Administrar o Bromidrato de Citalopram (substância ativa) na forma de uma dose oral única de 20mg por dia. Dependendo da resposta individual do paciente e da gravidade da depressão, aumentar a dose até um máximo de 40mg por dia.
Duração do tratamento
O efeito antidepressivo geralmente inicia-se após 2-4 semanas. Tratamento com antidepressivos é sintomático e deve ser continuado por um período de tempo apropriado, geralmente até 6 meses após a recuperação, a fim de evitar uma recaída. Em pacientes com depressão recorrente (unipolar), a terapia de manutenção pode precisar ser continuada por vários anos para prevenir novos episódios.
Tratamento do transtorno de pânico
Uma dose oral única de 10mg é recomendada na primeira semana, antes de se aumentar a dose para 20mg por dia. Dependendo da resposta individual, aumentar a dose até um máximo de 40mg por dia.
Duração do tratamento
A efetividade máxima do Citalopram (substância ativa) no tratamento do pânico é alcançada após aproximadamente 3 meses e a resposta é mantida durante a continuação do tratamento.
Tratamento do transtorno obsessivo compulsivo
É recomendada a dose inicial de 20mg. Dependendo da resposta individual, aumentar a dose até um máximo de 40mg por dia.
Duração do tratamento
O início de ação no tratamento do TOC é de 2-4 semanas, com melhorias contínuas ao longo do tempo.
Posologia
Pacientes idosos (> 65 anos de idade)
Para pacientes idosos, a dose precisa ser reduzida para a metade da dose recomendada, por ex.: 10-20mg/dia. A dose máxima recomendada para idosos é 20mg/dia.
Crianças e adolescentes
Bromidrato de Citalopram (substância ativa) não deve ser usado para tratamento de crianças e adolescentes com menos de 18 anos de idade.
Pacientes com função renal reduzida
Não é necessário ajuste da posologia em pacientes com comprometimento renal leve ou moderado. Não está disponível nenhuma informação sobre o tratamento de pacientes com função renal gravemente reduzida (clearance de creatinina < 30mL/min).
Pacientes com função hepática reduzida
Uma dose diária inicial de 10mg nas primeiras duas semanas de tratamento é recomendada em pacientes com comprometimento hepático leve a moderado.
Dependendo da resposta individual, a dose pode ser aumentada para um máximo de 20mg diários. Cuidados e uma cuidadosa titulação da dose são aconselháveis em pacientes com comprometimento hepático grave.
Metabolizadores pobres CYP2C19
Para pacientes que são metabolizadores pobres da enzima CYP2C19, recomenda-se uma dose inicial de 10mg durante as duas primeiras semanas de tratamento. A dose poderá ser aumentada até no máximo 20mg/dia, dependendo da resposta individual.
Descontinuação
A descontinuação abrupta precisa ser evitada. Ao interromper o tratamento com Bromidrato de Citalopram (substância ativa), reduzir gradualmente a dose durante um período de uma ou duas semanas, para evitar possíveis sintomas de descontinuação. Se sintomas intoleráveis ocorrerem após redução da dose ou descontinuação do tratamento, retornar à dose anteriormente prescrita e reiniciar abredução da dose de forma mais gradual.
Esquecimento da dose
A meia-vida do Bromidrato de Citalopram (substância ativa) é de aproximadamente 1 ½ dia, o que permite que o esquecimento da ingestão da dose diária possa ser contornado com a simples supressão daquela dose. Retomar a prescrição usual. Não dobrar a dose.
Precauções
As seguintes advertências e precauções aplicam-se à classe terapêutica dos ISRSs (Inibidores Seletivos da Recaptação de Serotonina).
Crianças e adolescentes (< 18 anos de idade)
Não usar o Bromidrato de Citalopram (substância ativa) para tratar crianças ou adolescentes menores de 18 anos, ao menos que a necessidade clínica seja clara e o paciente seja cuidadosamente monitorado pelo médico quanto ao aparecimento de sintomas suicidas. Em estudos clínicos realizados com crianças e adolescentes tratados com antidepressivos, comparados com o placebo, foi observado aumento da hostilidade e do comportamento suicida (tentativas de suicídio e pensamentos suicidas).
Não existem dados de longo-prazo pela utilização por crianças e adolescentes no que se refere a crescimento, maturação e desenvolvimento cognitivo e comportamental.
Ansiedade paradoxal
Alguns pacientes com transtorno de pânico podem apresentar sintomas de ansiedade intensificados no início do tratamento com antidepressivos. Esta reação paradoxal geralmente desaparece dentro de 02 semanas durante o tratamento contínuo. Recomenda-se uma dose inicial baixa para reduzir a probabilidade de um efeito ansiogênico paradoxal.
Hiponatremia
Hiponatremia, provavelmente relacionada à secreção inapropriada de hormônio antidiurético (SIADH), foi relatada como efeito adverso raro com o uso de ISRS e geralmente se resolve com a descontinuação do tratamento. Pacientes idosos (especialmente mulheres) parecem ter o risco aumentado.
Suicídio/pensamentos suicidas ou piora clínica
A depressão está associada com um aumento dos pensamentos suicidas, atos de autoflagelação e suicídio (eventos relacionados ao suicídio). Este risco persiste até que ocorra uma remissão significativa da doença.
Como não há uma melhora expressiva nas primeiras semanas de tratamento, os pacientes devem ser cuidadosamente monitorados até que uma melhora significativa ocorra. É observado na prática clínica um aumento do risco de suicídio no início do tratamento, quando há uma pequena melhora parcial.
Outras doenças psiquiátricas para as quais o Citalopram (substância ativa) é indicado também podem estar associadas a um aumento do risco de suicídio ou eventos a ele relacionados. Estas doenças podem ser comórbidas à depressão. As mesmas precauções indicadas nos casos de tratamento dos pacientes com depressão devem ser aplicadas quando são tratados pacientes com outros transtornos psiquiátricos.
Os pacientes com histórias de tentativas de suicídio e/ou com ideação suicida, ambas prévias ao início do tratamento, apresentam um risco maior para tentativas de suicídio e devem ser monitorados cuidadosamente durante o tratamento antidepressivo.
Uma meta-análise de estudos clínicos placebo-controlados de drogas antidepressivas em pacientes adultos com distúrbios psiquiátricos mostrou um risco aumentado de comportamento suicida com o uso de antidepressivos comparado ao placebo em pacientes com menos de 25 anos de idade.
Uma supervisão dos pacientes, em especial estes de alto risco, deve ter a terapia medicamentosa acompanhada especialmente no início do tratamento e na mudança de doses. Pacientes (e cuidadores) precisam ser alertados sobre a necessidade de monitorar qualquer agravamento da situação clínica, comportamento suicida ou pensamentos ou mudanças não-usuais no comportamento e devem procurar aconselhamento médico imediatamente caso estes sintomas se façam presentes.
Acatisia/agitação psicomotora
O uso de ISRSs e IRSNs tem sido associado ao desenvolvimento de acatisia, caracterizada por uma inquietude desagradável ou desconfortável e necessidade de se movimentar, associada à incapacidade de ficar sentado ou em pé, parado.
Quando ocorre é mais comum nas primeiras semanas de tratamento. Os pacientes que desenvolverem estes sintomas podem piorar dos mesmos com o aumento da dose.
Mania
Em pacientes com doença maníaco-depressiva, uma mudança de fase maníaca pode ocorrer. Deve-se descontinuar os ISRSs em qualquer paciente que entre em fase maníaca.
Convulsões
Convulsões são riscos potenciais com as drogas antidepressivas. O Citalopram (substância ativa) deve ser descontinuado em qualquer paciente que apresente convulsões.
Deve-se evitar o uso dos ISRSs em pacientes com epilepsia instável e pacientes com epilepsia controlada. Estes pacientes precisam ser cuidadosamente monitorados por um médico.
Descontinuar o uso dos ISRSs caso haja um aumento da frequência de convulsões.
Diabetes
Em pacientes diabéticos, o tratamento com ISRSs poderá alterar o controle glicêmico. Pode ser necessário um ajuste na dose de insulina e/ou hipoglicemiantes orais em uso.
Síndrome serotoninérgica
Em raros casos foi relatada síndrome serotoninérgica em pacientes utilizando ISRSs. A combinação de sintomas como agitação, tremor, mioclonia e hipertermia podem indicar o desenvolvimento desta condição. O tratamento com Citalopram (substância ativa) precisa ser descontinuado imediatamente e tratamento sintomático deve ser iniciado.
Medicamentos serotoninérgicos
O Citalopram (substância ativa) não deve ser usado concomitantemente com medicamentos de efeitos serotoninérgicos tais como sumatriptano ou outros triptanos, tramadol, oxitriptano e triptofano.
Hemorragia
Há relatos de sangramentos cutâneos com tempo e/ou características anormais, tais como equimoses, hemorragias ginecológicas, sangramentos gastrointestinais e outros sangramentos cutâneos ou das mucosas com o uso dos ISRSs.
Recomenda-se cautela no caso de pacientes em tratamento com ISRSs, especialmente em uso concomitantemente com medicamentos conhecidos por afetar a função de plaquetas ou outros medicamentos que possam aumentar o risco de hemorragia, bem como em pacientes com conhecida tendência a sangramentos.
Eletroconvulsoterapia (ECT)
A experiência clínica no uso combinado de ISRSs e ECT é limitada e, portanto, recomenda-se cautela.
Erva de são joão
Efeitos indesejáveis podem ser mais comuns durante a utilização concomitante de Citalopram (substância ativa) e produtos fitoterápicos contendo Erva de São João (Hypericum perforatum). Sendo assim, o Citalopram (substância ativa) e produtos fitoterápicos à base de Erva de São João (Hypericum perforatum) não devem ser utilizados concomitantemente.
Sintomas de descontinuação
Sintomas de descontinuação são comuns ao interromper o tratamento, particularmente se a descontinuação for abrupta. Em um estudo clínico de prevenção das recorrências com o Citalopram (substância ativa), os eventos adversos após a descontinuação do tratamento com Citalopram (substância ativa) foram observados em 40% dos pacientes versus 20% dos pacientes que continuavam o uso de Citalopram (substância ativa).
O risco de sintomas de descontinuação podem ser dependentes de diversos fatores incluindo a duração e a dose do tratamento e a taxa de redução da dose.
Tonturas, distúrbios sensoriais (incluindo parestesia), distúrbios do sono (incluindo insônia e sonhos intensos), agitação ou ansiedade, náusea e ou vômitos, tremor, confusão, sudorese, dor de cabeça, diarreia, palpitações, instabilidade emocional, irritabilidade e distúrbios visuais são as reações mais comumente relatadas. Geralmente estes sintomas são leves a moderados, entretanto, em alguns pacientes, podem ser severos na intensidade.
Ocorrem geralmente nos primeiros dias de descontinuação do tratamento, mas há relatos muito raros destes sintomas em pacientes que inadvertidamente esqueceram uma dose.
Geralmente esses sintomas são autolimitados e usualmente desaparecem em 2 semanas, embora em alguns pacientes possam ser prolongados (2-3 meses ou mais). Sendo assim, é recomendado que a concentração do Citalopram (substância ativa) seja gradualmente diminuída quando o tratamento for descontinuado durante algumas semanas ou meses, de acordo com as necessidades do paciente.
Psicose
O tratamento de pacientes psicóticos com depressão pode aumentar os sintomas psicóticos.
Prolongamento do intervalo QT
Citalopram (substância ativa) mostrou causar um aumento do prolongamento do intervalo QT dose-dependente. Casos de prolongamento do intervalo QT e arritmia ventricular, incluindo Torsade de Pointes foram relatados durante o período de pós-comercialização do produto, predominantemente em pacientes do sexo feminino, com hipocalemia, ou com prolongamento QT ou outras doenças cardíacas pré-existentes.
Recomenda-se precaução nos pacientes que apresentam bradicardia significativa ou em pacientes que sofreram infarto agudo do miocárdio recentemente ou insuficiência cardíaca descompensada.
Distúrbios eletrolíticos como hipocalemia e hipomagnesemia aumentam o risco de arritmias malignas e devem ser tratadas antes do início do tratamento com Citalopram (substância ativa).
Uma revisão do ECG deve ser considerada antes do início do tratamento com Citalopram (substância ativa) nos pacientes que apresentam doença cardíaca estável.
Se ocorrerem sinais de arritmia cardíaca durante o tratamento com Citalopram (substância ativa), o tratamento deve ser descontinuado e deve ser realizado um ECG.
Glaucoma
Como ocorre com outros ISRSs, Citalopram (substância ativa) pode causar midríase e deve ser usado com precaução em pacientes com aumento da pressão intraocular ou naqueles com glaucoma de ângulo estreito.
Efeitos na capacidade de dirigir ou operar máquinas
O Citalopram (substância ativa) tem influência menor ou moderada na habilidade de dirigir ou operar máquinas. Medicamentos psicoativos podem reduzir a capacidade de julgamento e de reagir à emergências.
Os pacientes devem ser informados sobre esses efeitos e alertados quanto ao risco de interferência na sua capacidade de dirigir automóveis e de operar máquinas.
Geralmente, Bromidrato de Citalopram (substância ativa) não afeta a habilidade de suas atividades diárias normais. Entretanto, você precisa ter cautela quando dirigir veículos, operar máquinas ou realizar atividades que requeiram sua atenção.
Uso em idosos, crianças e outros grupos de risco
Para o uso em idosos, crianças e outros grupos de risco, ver “Como usar o Bromidrato de Citalopram (substância ativa)”.
Este medicamento contém lactose.
Os comprimidos contém lactose. Pacientes com problemas hereditários raros de intolerância à galactose, deficiência de lactase ou mal absorção de glucosegalactose não devem tomar este medicamento.
Reações Adversas
As reações adversas observadas com Citalopram (substância ativa) são em geral moderadas e transitórias.
As reações adversas são mais frequentes durante a primeira ou segunda semana de tratamento e, geralmente, diminuem de intensidade e frequência com a continuação do tratamento.
Para as reações após uma dose-resposta foi descoberto:
Aumento da sudorese, boca seca, insônia, sonolência, diarreia, náuseas e fadiga.
A tabela mostra o percentual de reações adversas associadas com ISRSs e/ou Citalopram (substância ativa) visto em ?1% dos pacientes em estudos duplo-cego placebo-controlados ou no período pós comercialização. As frequências foram definidas como:
- Muito comum (>1/10);
- Comum (>1/100 a ?1/10);
- Incomum (>1/1000 a <1/100);
- Raro (>1/10000 a <1/1000);
- Muito raro (<1/10000);
- Desconhecido (não pode ser estimado com os dados atuais).
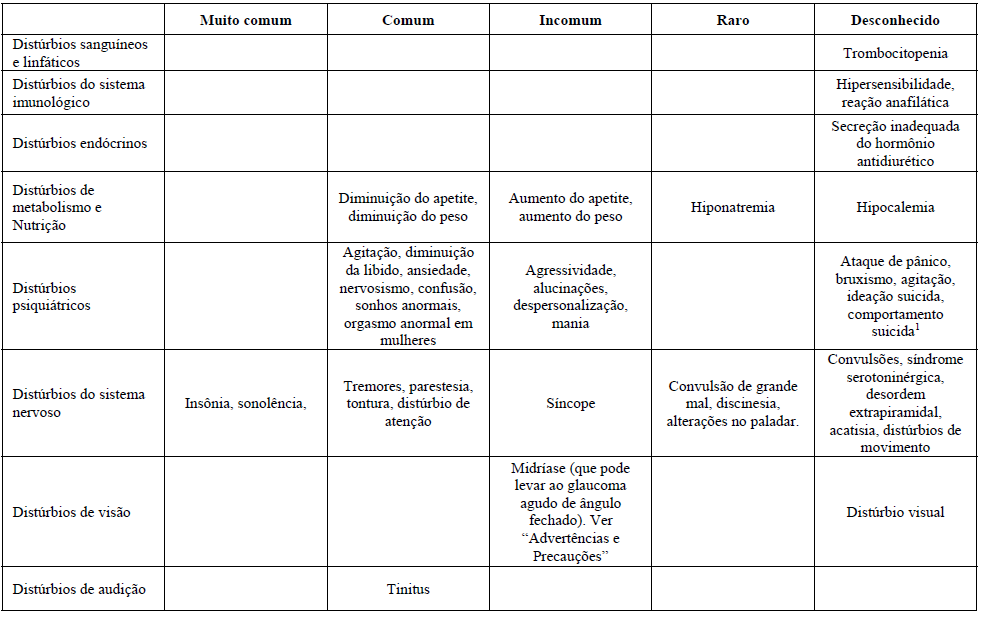
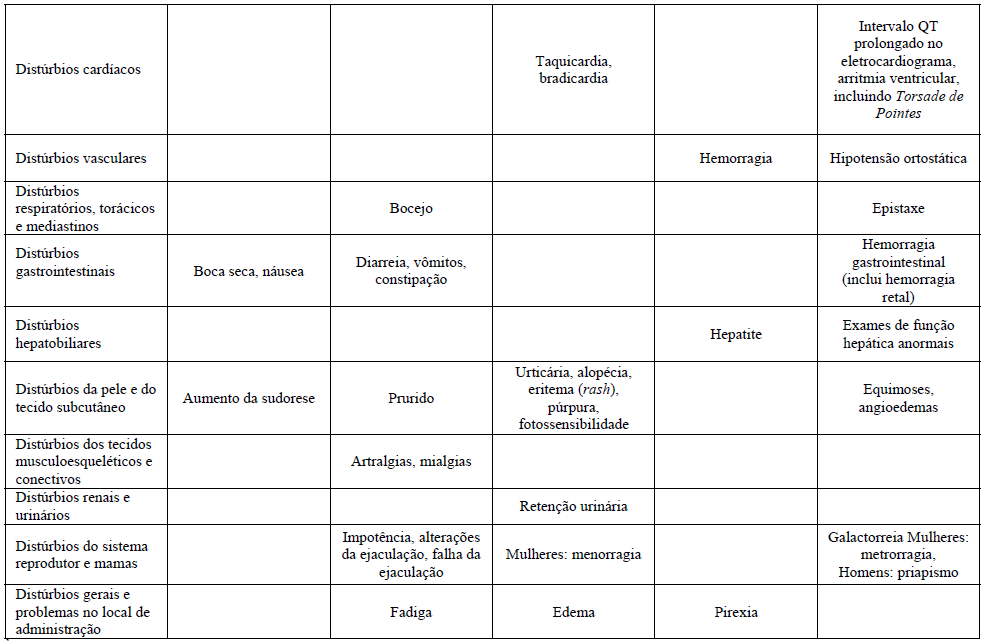
1Casos de ideação suicida e comportamentos suicidas foram relatados durante a terapia do Citalopram (substância ativa) ou logo após a descontinuação do tratamento.
Fraturas Ósseas
Estudos epidemiológicos, conduzidos principalmente em pacientes com 50 anos de idade e mais velhos, mostram um aumento do risco de fraturas ósseas em doentes tratados com ISRS e antidepressivos tricíclicos. O mecanismo que leva a este risco é desconhecido.
Prolongamento do Intervalo QT
Casos de Prolongamento do intervalo QT e arritmia ventricular incluindo Torsade de Pointes foram relatados durante o período de comercialização, predominantemente em pacientes do sexo feminino, com hipocalemia ou com prolongamento do intervalo QT pré-existente causado por outras doenças cardíacas.
As seguintes reações adversas a medicamentos também foram reportadas para a classe terapêutica dos ISRS: inquietude psicomotora/acatisia e anorexia.
Sintomas observados na descontinuação do tratamento com ISRSs
A descontinuação do Citalopram (substância ativa) (particularmente quando abrupta) causa sintomas de descontinuação.
Tonturas, alterações da senso-percepção (inclui parestesias), alterações do sono (inclui insônia e sonhos vividos), agitação ou ansiedade, náusea e/ou vômitos, tremores, confusão, sudorese, cefaleia, diarreia, palpitações, instabilidade emocional, irritabilidade e alterações visuais são as reações mais comumente reportadas.
Geralmente, esses eventos são de intensidade leve a moderada e autolimitados, porém em alguns pacientes podem ser graves e/ou prolongados.
Os eventos geralmente se resolvem dentro de 2 semanas, embora em alguns indivíduos este tempo possa se prolongar (2-3 meses ou mais). Logo, quando o tratamento com o Citalopram (substância ativa) não for mais necessário, recomenda-se fazer uma descontinuação gradual, com diminuição progressiva da dose.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
Interações farmacodinâmicas
Em um nível farmacodinâmico, casos de síndrome serotoninérgica de Citalopram (substância ativa) com moclobemida e buspirona já foram relatados.
Combinações medicamentosas contraindicadas
Inibidores da MAO
Não administrar o Citalopram (substância ativa) em combinação com IMAOs.
O uso concomitante do Citalopram (substância ativa) e IMAOs pode causar graves efeitos adversos, incluindo síndrome serotoninérgica. Casos de reações graves e algumas vezes fatais foram relatados em pacientes recebendo um ISRS em combinação com um inibidor da monoaminoxidase (IMAO), incluindo o IMAO irreversível selegilina, os IMAOs reversíveis moclobemida e linezolida e em pacientes que tenham descontinuado recentemente ISRS e iniciaram com um IMAO.
Em alguns casos os pacientes apresentaram sintomas semelhantes à síndrome serotoninérgica. Sintomas de uma interação medicamentosa com um IMAO incluem: hipertermia, rigidez, mioclonia, instabilidade autonômica com possíveis flutuações rápidas dos sinais vitais, alterações do estado mental que incluem confusão, irritabilidade e agitação extrema progredindo para delírio e coma.
Pimozida
A coadministração de uma dose única de pimozida 2mg em indivíduos tratados com o Citalopram (substância ativa) racêmico 40mg/dia durante 11 dias causou um aumento da ASC e da Cmáx da pimozida, embora não consistentemente em todo o estudo. A coadministração de pimozida e Citalopram (substância ativa) resultou num aumento médio do intervalo QTc de aproximadamente 10ms. Devido a interação observada com uma baixa dose de pimozida, a administração concomitante de Citalopram (substância ativa) e pimozida é contraindicada.
Combinações medicamentosas que requerem precaução
Selegilina (inibidor seletivo MAO B)
Um estudo de interação farmacocinética/farmacodinâmica com a administração concomitante de Citalopram (substância ativa) (20mg/dia) e selegilina (10mg/dia) não demonstrou interações clinicamente relevantes. O uso concomitante de Citalopram (substância ativa) e selegilina (em doses acima de 10mg/dia) é contraindicado.
Medicamentos serotoninérgicos
Lítio e triptofano
Nenhuma interação farmacodinâmica foi encontrada em estudos clínicos nos quais o Citalopram (substância ativa) tenha sido administrado concomitantemente ao lítio.
Entretanto, houve relatos de aumento de reações quando foram administrados ISRSs concomitantemente com lítio ou triptofano; como tal, o uso concomitante de ISRSs com essas drogas deve ser feito com cautela. Monitoramento de rotina dos níveis de lítio deve ser continuado como usual.
Coadministração com produtos serotoninérgicos (ex.: tramadol, sumatriptano) pode levar ao aumento de eventos adversos associados ao 5-HT. Até mais informação ser disponibilizada, o uso simultâneo de Citalopram (substância ativa) e agonistas da 5-HT, tais como sumatriptano e outros triptanos não é recomendado.
Erva de são joão
Interações dinâmicas entre ISRSs e produtos fitoterápicos que contenham a Erva de São João (Hypericum perforatum) podem ocorrer, resultando num aumento da incidência de reações adversas. Interações farmacocinéticas não foram investigadas.
Hemorragia
Recomenda-se precaução em pacientes que estejam em tratamento simultâneo com anticoagulantes ou medicamentos que afetam a função plaquetária, como anti-inflamatórios não esteroidais (AINEs), ácido acetilsalicílico, dipiramol e ticlopidina e outros medicamentos (por ex.: antipsicóticos atípicos, fenotiazina, antidepressivos tricíclicos) que podem aumentar o risco de hemorragia.
Eletroconvulsoterapia (ECT)
Não existem estudos clínicos estabelecendo os riscos ou benefícios do uso combinado de eletroconvulsivoterapia (ECT) e Citalopram (substância ativa).
Medicamentos que diminuem o limiar convulsivo
Os ISRSs podem diminuir o limiar convulsivo. Aconselha-se precaução ao utilizar concomitantemente outros medicamentos capazes de diminuir o limiar de convulsão (por exemplo, os antidepressivos [tricíclicos, ISRSs], neurolépticos [fenotiazida, tioxanteno e butirofenonas], mefloquina, bupropiona e tramadol).
Neurolépticos
Experiência com Citalopram (substância ativa) não revelou quaisquer interações clinicamente relevantes com neurolépticos. No entanto, assim como com outros ISRS, a possibilidade de uma interação farmacodinâmica não pode ser excluída.
Prolongamento do intervalo QT
Não foram realizados estudos farmacodinâmicos e farmacocinéticos entre Citalopram (substância ativa) e outros medicamentos que prolongam o intervalo QT. Entretanto, não se pode descartar um efeito aditivo entre esses medicamentos e Citalopram (substância ativa).
Dessa forma, a coadministração de Citalopram (substância ativa) e medicamentos que prolongam o intervalo QT, como antiarrítmicos Classes IA e III, antipsicóticos (ex.: derivados de fentiazina, pimozida e haloperidol), antidepressivos tricíclicos, alguns agentes antimicrobianos (ex.: esparfloxacina, moxifloxacina, eritromicina IV, pentamidina e anti-maláricos particularmente halofantrina), alguns antihistamínicos (astemozol e mizolastina) e etc., somente devem ser prescritos após uma avaliação criteriosa.
Interações farmacocinéticas
Biotransformação do Citalopram (substância ativa) para desmetilCitalopram (substância ativa) é mediada pelas isoenzimas do sistema do citocromo P450: CYP2C19 (aproximadamente 38%), CYP3A4 (aproximadamente 31%) e CYP2D6 (aproximadamente 31%). O fato de que o Citalopram (substância ativa) é metabolizado por mais de um CYP significa que a inibição de sua biotransformação é menos provável como a inibição de uma enzima pode ser compensada por outra. Portanto, a coadministração de Citalopram (substância ativa) com outros medicamentos na prática clínica tem probabilidade muito baixa de produzir interações farmacocinéticas.
Efeito de outros medicamentos na farmacocinética do Citalopram (substância ativa)
Coadministração de cetoconazol (potente inibidor da CYP3A4) não alterou a farmacocinética do Citalopram (substância ativa).
Um estudo de interação farmacocinética de lítio e Citalopram (substância ativa) não revelou qualquer interação farmacocinética.
Cimetidina (potente inibidor de CYP2D6, 3A4 e 1A2) causou um aumento moderado nos níveis de Citalopram (substância ativa).
Recomenda-se cautela na administração de Citalopram (substância ativa) combinado à cimetidina. Pode ser necessário um ajuste de dose.
Efeitos do Citalopram (substância ativa) sobre outros medicamentos
Um estudo de interação farmacocinética/farmacodinâmica com a administração concomitante de Citalopram (substância ativa) e metoprolol (um substrato da CYP2D6) mostrou um duplo aumento das concentrações de metoprolol, mas não teve aumento estatisticamente significante no efeito do metoprolol sobre a pressão sanguínea e a frequência cardíaca de voluntários saudáveis.
Recomenda-se precaução quando metoprolol e Citalopram (substância ativa) são administrados concomitantemente. Um ajuste de dose pode ser necessário.
Citalopram (substância ativa) e desmetilCitalopram (substância ativa) são insignificantes inibidores da CYP2C9, CYP2E1 E CYP3A4, e inibidores fracos da CYP1A2, CYP2C19 e CYP2D6 quando em comparação com outros ISRS estabelecidos como significantes inibidores.
Levomepromazina, digoxina, carbamazepina
Nenhuma mudança ou apenas mudanças muito pequenas de pouca importância clínica foram observadas quando o Citalopram (substância ativa) foi dado com substratos CYP1A2 (clozapina e teofilina), CYP2C9 (varfarina), CYP2C19 (imipramina e mefenitoína), CYP2D6 (esparteína, imipramina, amitriptilina e risperidona) e CYP3A4 (varfarina, carbamazepina (e seu metabólito carbamazepina epóxido) e triazolam). Nenhuma interação farmacocinética foi observada entre Citalopram (substância ativa) e levomepromazina, ou digoxina (indicando que o Citalopram (substância ativa) nem induz nem inibe a glicoproteína-P).
Imipramina, desipramina
Em um estudo farmacocinético, nenhum efeito foi demonstrado nos níveis de Citalopram (substância ativa) ou imipramina, embora o nível de desipramina, o metabólito primário da imipramina, foi aumentado.
Quando desipramina é combinada com Citalopram (substância ativa), um aumento da concentração plasmática de desipramina tem sido observado. A redução da dose de desipramina pode ser necessária
Interação Alimentícia
A absorção e outras propriedades farmacocinéticas do Citalopram (substância ativa) não é afetada pelos alimentos.
Álcool
Nenhuma interação farmacodinâmica ou farmacocinética é esperada entre o Citalopram (substância ativa) e o álcool. Entretanto, a combinação com álcool não é recomendada.
Ação da Substância
Resultados de eficácia
Dados de segurança pré-clínica
Toxicidade aguda
O Citalopram (substância ativa) tem baixa toxicidade aguda.
Toxicidade crônica
Em estudos de toxicidade crônica não foram observadas restrições para o uso terapêutico do Citalopram (substância ativa).
Estudos reprodutivos
Baseado nos dados dos estudos de toxicidade reprodutiva (segmentos I, II e III) não há razão para preocupações especiais com o uso do Citalopram (substância ativa) em mulheres com potencial para engravidar.
Estudos embriotóxicos em ratos com doses de 56 mg/kg/dia, que causam toxicidade materna, mostraram anomalias ósseas na região da coluna vertebral e costelas. Os níveis plasmáticos maternos foram de 2 a 3 vezes maiores do que a concentração terapêutica em humanos. Em ratos o Citalopram (substância ativa) não teve nenhum efeito na fertilidade, gravidez e desenvolvimento pós-natal, mas diminui o peso dos filhotes nascidos. O Citalopram (substância ativa) e seus metabólitos atingem concentrações fetais, que são 10 a 15 vezes maiores que os níveis plasmáticos maternos.
Dados de estudos em animais demonstraram que o Citalopram (substância ativa) induz a redução dos índices de fertilidade e de gravidez, a redução no número de implantações e a anormalidades no esperma em níveis de exposição bem acima dos níveis de exposição humana.
Potencial mutagênico e carcinogênico
O Citalopram (substância ativa) não tem potencial mutagênico ou carcinogênico.
Estudos em humanos
Depressão
Estudos placebo-controlados de curto-prazo
Um estudo de dose fixa em depressão maior (moderada a grave) (critérios do DSM-III-R) incluiu pacientes (n=650) que receberam diariamente placebo ou Citalopram (substância ativa) nas doses de 10mg, 20mg, 40mg ou 60mg. Todos os grupos que receberam o Citalopram (substância ativa) demonstraram melhora significativa das pontuações do item humor deprimido da Escala de Depressão de Hamilton (HAM-D) (p < 0,01), na Subescala de Melancolia da HAM-D, na Escala de Impressão Clínica Global (CGI) e na Escala de Depressão de Montgomery-Asberg (MADRS) (resposta; p < 0,05).
Ao final do estudo (semana 6), os grupos de 10 e 20 mg/dia apresentaram vantagem estatística em comparação ao placebo na CGI, no item humor deprimido da HAM-D e na MADRS, e os grupos que receberam doses de 40 e 60 mg/dia apresentaram superioridade estatística na CGI, na MADRS, no item humor depressivo da HAM-D e na pontuação total da HAM-D.
Em outro estudo de dose flexível (Citalopram (substância ativa) de 20 a 80 mg/dia), multicêntrico, placebo-controlado, de curto prazo (4 semanas), em pacientes com depressão maior leve a moderada (critérios do DSM-III-R), os pacientes do grupo Citalopram (substância ativa) apresentaram melhora significativa em relação ao início na HAM-D (p < 0,05), na CGI (p < 0,05) e na Escala de Auto avaliação da Depressão de ZUNG (ZUNG) (p < 0,05).
Depressão - prevenção de recaída e recorrência
Estudos de longo prazo, placebo-controlados.
Em dois estudos placebo-controlados (n=207 e n=226) os pacientes que preencheram os critérios para resposta clínica (pontuação total na Escala de Depressão de Montgomery-Asberg - MADRS < 12) após 6- 8 semanas de tratamento, oriundos de um estudo placebo-controlado (20 ou 40mg/dia de Citalopram (substância ativa)) e de um estudo aberto com Citalopram (substância ativa) (20-60mg/dia), foram randomizados para uma nova fase de 24 semanas de tratamento sem alteração das doses do Citalopram (substância ativa) ou do placebo1,2. Nos dois estudos demonstrou-se uma vantagem significativa do Citalopram (substância ativa) sobre o placebo (p<0,05).
O percentual de recaída para os pacientes em tratamento com Citalopram (substância ativa) foi de 10,5% e 13,8% respectivamente, nos dois estudos, comparados com 31% e 24,3% para os pacientes que receberam placebo.
Citalopram (substância ativa) nas doses de 20, 40 ou 60mg/dia é efetivo na prevenção da recaída da depressão em pacientes que inicialmente responderam a terapia antidepressiva.
Transtorno do pânico
Um estudo multicêntrico, randomizado, duplo-cego, placebo-controlado, de 8 semanas, incluiu 475 pacientes com transtorno do pânico (com ou sem agorafobia), e comparou o Citalopram (substância ativa) ao placebo e à clomipramina. A resposta foi definida como pontuação de 0 ou 1 para o item ataque de pânico na Escala de Ansiedade Clínica (CAS). Os melhores resultados foram obtidos com o Citalopram (substância ativa), em doses entre 20 e 30mg/dia.
Em uma extensão cega deste estudo, de longa duração (12 meses), os grupos que receberam Citalopram (substância ativa) 20- 30 ou 40-60mg/dia apresentaram resposta significativamente superior ao grupo placebo (p=0,001 e p=0,003, respectivamente). O grupo clomipramina (60 ou 90mg/dia) não apresentou diferenças em relação ao grupo placebo. Os percentuais de resposta em todo o período de tratamento indicaram que Citalopram (substância ativa) 20-60mg/dia é efetivo no tratamento do transtorno de pânico.
Transtorno obsessivo compulsivo (toc)
Um estudo multicêntrico, duplo-cego, randomizado, placebo-controlado, de 12 semanas, com 400 pacientes com TOC, incluiu, além do grupo placebo, grupos com Citalopram (substância ativa) nas doses de 20, 40 e 60mg/dia. Neste estudo, os três grupos de droga ativa apresentaram superioridade estatística comparados ao placebo na Escala de Obsessão-Compulsão de Yale-Brown –(Y-BOCS;p<0,01 para 20mg/dia e p<0,001 para 40 e 60mg/dia).
Características farmacológicas
Farmacodinâmica
Mecanismo de ação
Estudos bioquímicos e comportamentais mostraram que o Citalopram (substância ativa) é um potente inibidor da recaptação da serotonina (5-HT). A tolerância para a inibição da recaptação de 5-HT não é induzida pelo tratamento prolongado com o Citalopram (substância ativa). O Citalopram (substância ativa) é um dos inibidores seletivos da recaptação de serotonina (ISRS) de maior seletividade descritos até o momento, com nenhum ou mínimo efeito sobre a recaptação da noradrenalina (NA), dopamina (DA) e ácido gamaminobutírico (GABA).
Ao contrário dos antidepressivos tricíclicos e de alguns dos mais novos inibidores da recaptação da serotonina, o Citalopram (substância ativa) não apresenta afinidade, ou esta é muito baixa, aos receptores 5-HT1A, 5-HT2, DA, D1 e D2, aos adrenoreceptores ?1-, ?2-, ß, aos receptores histamínicos H1 aos receptores colinérgicos, benzodiazepínicos e opióides.
Uma série de testes funcionais- in vitro em órgãos isolados, bem como testes funcionais in vivo, confirmaram a falta de afinidade por esses receptores. Essa ausência de efeitos sobre receptores poderia explicar porque o Citalopram (substância ativa) produz uma quantidade menor de efeitos colaterais tradicionalmente relacionados aos antidepressivos como boca seca, distúrbios vesicais e intestinais, visão turva, sonolência, cardiotoxicidade e hipotensão ortostática.
Os principais metabólitos do Citalopram (substância ativa) são também ISRSs, embora as relações de potência e seletividade deles sejam menores que as do Citalopram (substância ativa). No entanto, as relações de seletividade dos metabólitos são maiores que as de vários dos ISRSs mais novos. Os metabólitos não contribuem para o efeito antidepressivo total.
Propriedades farmacodinâmicas
A supressão do sono durante o estágio REM (rapid eyes moviment - movimento rápido dos olhos) é considerada um fator preditivo da atividade antidepressiva. Como os ADT, outros ISRSs e os inibidores da monoaminoxidase (IMAO), o Citalopram (substância ativa) suprime o sono REM e aumenta o sono profundo de ondas lentas.
Embora não se ligue a receptores opióides, o Citalopram (substância ativa) potencializa o efeito antinociceptivo de analgésicos opióides comumente utilizados.
Em humanos o Citalopram (substância ativa) não compromete os desempenhos cognitivo e psicomotor e apresenta pouca ou nenhuma propriedade sedativa, seja sozinho ou em associação com álcool.
O Citalopram (substância ativa) não reduziu o fluxo de saliva em um estudo de dose única em voluntários humanos e não teve nenhuma influência significativa sobre parâmetros cardiovasculares em nenhum dos estudos com voluntários sadios. Citalopram (substância ativa) não altera níveis séricos de hormônio do crescimento. Citalopram (substância ativa) como outros ISRSs pode aumentar a prolactina no plasma, um efeito secundário sobre a prolactina estimulando a serotonina e sem importância clínica.
Propriedades farmacocinéticas
Absorção
A absorção do Citalopram (substância ativa) é quase completa e independe da ingestão de alimentos (Tmáx. médio de 3 horas).
A biodisponibilidade absoluta é aproximadamente 80%.
Distribuição
O volume de distribuição aparente (Vd)? é cerca de 12 a 17 l/kg, após administração oral. A ligação às proteínas plasmáticas é menor que 80% para o Citalopram (substância ativa) e seus principais metabólitos.
Biotransformação
O Citalopram (substância ativa) é metabolizado nos derivados ativos desmetilcitalopram, didesmetilcitalopram e Citalopram (substância ativa)N-óxido, e em um derivado inativo, o ácido propiônico deaminado. Todos os metabólitos ativos também são inibidores seletivos da recaptação da serotonina (ISRSs), porém mais fracos que o composto original. O Citalopram (substância ativa) inalterado é o composto predominante no plasma. As concentrações de desmetilcitalopram e didesmetilcitalopram geralmente correspondem a 30% - 50% e 5% – 10% da concentração de Citalopram (substância ativa), respectivamente.
A biotransformação do Citalopram (substância ativa) em desmetilCitalopram (substância ativa) é mediada pela isoenzima CYP2C19 (aproximadamente 38%), CYP3A4 (aproximadamente 31%) e CYP2D6 (aproximadamente 31%).
Eliminação
A meia-vida de eliminação (T1/2?) é de cerca de um dia e meio, o clearance plasmático do Citalopram (substância ativa) sistêmico (Cls) é de aproximadamente 0,3 a 0,4 l/min e a o clearance plasmático do Citalopram (substância ativa) oral é de aproximadamente 0,4 l/min. O Citalopram (substância ativa) é excretado principalmente através do fígado (85%) e o restante (15%) através dos rins; 12% a 23% da dose diária são excretados através da urina na forma de Citalopram (substância ativa) inalterado. A depuração hepática (residual) é de aproximadamente 0,3 l/min e a depuração renal é de aproximadamente 0,05 a 0,08 l/min.
Linearidade
A cinética é linear. Os níveis plasmáticos são alcançados em uma a duas semanas. Concentrações médias de 300 nmol/l (165 a 405 nmol/l) são alcançadas com uma dose diária de 40 mg.
Pacientes idosos (> 65 anos)
As meias-vidas mais longas (1,5 a 3,75 dias) e os valores de depuração diminuídos (0,08 a 0,3 l/min), decorrentes de uma redução da velocidade de metabolização, foram demonstrados em pacientes idosos. O tempo da concentração de estado de equilíbrio em idosos foi cerca de duas vezes maior que em pacientes mais jovens tratados com a mesma dose.
Função hepática reduzida
O Citalopram (substância ativa) é eliminado mais lentamente em pacientes com função hepática reduzida. A meia-vida do Citalopram (substância ativa), nesses casos, foi aproximadamente duas vezes mais longa e as concentrações de Citalopram (substância ativa) em equilíbrio, em uma determinada dose, serão duas vezes maiores que em pacientes com função hepática normal.
Função renal reduzida
O Citalopram (substância ativa) é eliminado mais lentamente em pacientes com redução leve a moderada da função renal, sem nenhum impacto maior em sua farmacocinética. No momento, não há nenhuma informação disponível para o tratamento de pacientes com função renal gravemente reduzida (clearance de creatinina < 30 ml/min).
Polimorfismo
Pesquisas in vivo mostraram que a metabolização do Citalopram (substância ativa) não exibe nenhum polimorfismo clinicamente importante na oxidação da esparteína/debrisoquina (CYP2D6). Como precaução, no caso de metabolizadores pobres da enzima CYP2C19, deve ser considerada uma dose inicial de 10 mg/dia.
Relação farmacocinética/farmacodinâmica
Não há relação clara entre níveis plasmáticos de Citalopram (substância ativa) e resposta terapêutica ou eventos adversos. Os metabólitos não contribuem para o efeito antidepressivo geral.