Comparamos o preço de Flixotide - Diskus 250Mcg 60Doses, veja o menor preço

RReferência
Para que serve
Flixotide Diskus é indicado na prevenção da asma em adultos e crianças e no tratamento dos sintomas da doença pulmonar obstrutiva crônica (DPOC).
Como Flixotide Diskus funciona?
Flixotide Diskus contém uma substância chamada propionato de fluticasona, que nas doses recomendadas tem potente ação anti-inflamatória, ou seja, age contra a inflamação dos pulmões. Isso resulta na redução dos sintomas e das crises de asma, na diminuição dos sintomas de DPOC e no aumento da função pulmonar. Esses benefícios proporcionam melhora significativa da sua qualidade de vida.
No tratamento da asma você deverá perceber os resultados de Flixotide Diskus em quatro a sete dias após o início do tratamento. Caso nunca tenha utilizado este tipo de medicamento (corticoide inalatório), é possível que você sinta algum benefício já nas primeiras 24 horas.
Contraindicação
Flixotide Diskus é contraindicado para pacientes com alergia ao propionato de fluticasona ou a qualquer outro componente da formulação (ver o item Composição).
Como usar
Antes de usar seu Flixotide Diskus, leia atentamente as instruções abaixo.
O dispositivo Diskus está lacrado em um invólucro laminado metálico. O invólucro fornece proteção contra a umidade e deve ser aberto apenas quando você estiver pronto para usá-lo pela primeira vez. Depois de aberto, o invólucro laminado deve ser descartado.
Fechado

Quando você retirar seu inalador Diskus do cartucho e remover o invólucro, ele estará na posição “fechado”.
Aberto

Um inalador Diskus novo contém 60 doses cuidadosamente medidas, na forma de pó, e higienicamente protegidas. Não requer manutenção nem troca de refil. O indicador de doses, localizado na parte superior do dispositivo, informa quantas ainda restam. Os números de 5 a 0 vão aparecer em vermelho para alertar você de que restam apenas algumas doses.
- Para abrir seu inalador Diskus, segure a tampa com uma das mãos e ponha o polegar da outra mão na depressão do inalador, como indica a figura. Gire a peça com o dedo polegar até ouvir um clique.
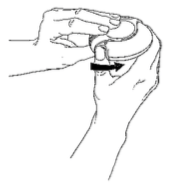
- Segure o inalador Diskus com o bocal voltado para você. Empurre a alavanca na posição indicada na figura até ouvir um segundo clique. Seu Diskus está pronto para ser usado. Toda vez que você empurrar a alavanca, uma nova dose estará disponível para inalação, e o contador de doses vai mostrar isso. Não empurre a alavanca sem necessidade para não desperdiçar novas doses.

- Antes de inalar o medicamento, leia atentamente estas instruções:
- Mantenha seu inalador Diskus distante da boca. Expire (solte o ar dos pulmões) o máximo que você puder. Lembre-se: nunca expire dentro do Diskus;
- Coloque o bocal do inalador Diskus nos lábios. Inale (puxe o ar para os pulmões) o mais lenta e profundamente possível, sempre através do Diskus, nunca pelo nariz;
- Retire o inalador Diskus da boca;
- Prenda a respiração por cerca de 10 segundos ou enquanto você se sentir confortável;
- Expire lentamente.

- Para fechar o inalador Diskus, coloque o dedo polegar na depressão do aparelho e gire a peça na direção indicada. Ao fechar o Diskus, você ouvirá um clique e a alavanca voltará à posição inicial. Seu inalador estará pronto para ser utilizado novamente.

- Depois, lavar a boca com água e não engolir.
Caso seu médico tenha receitado duas inalações seguidas, você deve fechar o Diskus e repetir todas as etapas descritas acima.
Lembre-se:
- Mantenha sempre seco seu inalador Diskus;
- Deixe-o fechado enquanto não precisar usá-lo e mantenha-o fora do alcance das crianças;
- Nunca expire dentro do inalador Diskus;
- Não empurre a alavanca sem necessidade para não desperdiçar novas doses;
- Não ultrapasse a dose indicada por seu médico.
Flixotide Diskus só deve ser usado por inalação oral (pela boca).
Não use este medicamento para tratar um ataque repentino de falta de ar porque isso não vai ajudá-lo. Você vai precisar de outro tipo de tratamento. Caso tome mais de um medicamento, tenha cuidado para não confundir seu uso.
Avise seu médico caso diminua o alívio proporcionado pelos outros medicamentos que você toma para tratar a asma ou se for necessário usar um número de inalações maior do que o indicado na receita.
Seu médico deverá recomendar a administração de pelo menos duas inalações por dose.
Posologia
Prevenção da asma
Adultos e adolescentes maiores de 16 anos
100 a 1.000 mcg duas vezes por dia.
Crianças e adolescentes de 4 a 16 anos
50 a 200 mcg duas vezes por dia.
Crianças menores de 4 anos
Esse dispositivo não é recomendado para os pacientes dessa faixa etária.
Tratamento dos sintomas da DPOC
Adultos
500 mcg duas vezes por dia.
Pacientes especiais
Não há necessidade de ajuste de dose para pacientes idosos nem para os que têm alguma doença nos rins ou no fígado.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento de seu médico.
O que devo fazer quando eu esquecer de usar Flixotide Diskus?
Caso você se esqueça de usar Flixotide Diskus, basta tomar a dose seguinte no horário previsto.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico.
Precauções
Se você responder sim a alguma das perguntas seguintes, converse com seu médico antes de usar Flixotide Diskus.
- Você está grávida ou pretende engravidar em breve?
- Você está amamentando?
- Já lhe disseram que você é alérgico a Flixotide Diskus, ao propionato de fluticasona ou qualquer outro ingrediente da formulação?
- Você já teve aftas na boca?
- Você está (ou já esteve) em tratamento para tuberculose?
- Já lhe disseram que você é alérgico a lactose ou a proteínas do leite?
Este medicamento contém lactose.
Informe seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para sua saúde.
Reações Adversas
Reação muito comum (ocorre em 10% dos pacientes que utilizam este medicamento)
Candidíase da boca e da garganta (sapinho).
Alguns pacientes apresentaram essa reação. Você pode obter alívio lavando a boca com água após o uso do produto, ou seu médico pode indicar uma forma de tratar essa reação para que você não precise parar de usar Flixotide Diskus.
Reações comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento)
Pneumonia (em pacientes com DPOC); rouquidão (alguns pacientes apresentam essa reação, controlada com a lavagem da boca com água imediatamente após a inalação); hematomas.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
Reações alérgicas na pele.
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
Candidíase no esôfago.
Reações muito raras (ocorrem em menos de 0,01% dos pacientes que utilizam este medicamento)
Inchaço da face e da garganta (angioedema); falta de ar ou dificuldade para respirar (dispneia ou broncoespasmos); manifestações alérgicas graves (reações anafiláticas); arredondamento da face; supressão dos hormônios produzidos pela glândula adrenal; desaceleração do crescimento (em crianças); redução da densidade mineral óssea (descalcificação dos ossos); problemas nos olhos, como catarata e glaucoma; aumento dos níveis de glicose (açúcar) do sangue (se você tem diabetes, seu médico pode indicar exames mais frequentes para verificar os níveis de açúcar do seu sangue e ajustar a dose do tratamento do diabetes); ansiedade; distúrbios do sono; mudanças de comportamento, inclusive hiperatividade e irritabilidade (principalmente em crianças).
Informe ao seu médico ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
População Especial
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
É improvável que Flixotide Diskus provoque algum efeito sobre a capacidade de dirigir veículos ou de operar máquinas.
Gravidez e lactação
Deve-se considerar a administração de propionato de fluticasona durante a gravidez somente se o benefício esperado para a mãe for maior do que qualquer possibilidade de risco para o feto. A administração durante a lactação deve ser considerada somente se o benefício esperado para a mãe justificar o possível risco para a criança.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento de seu médico. Pode ser perigoso para sua saúde.
Composição
Cada dose de Flixotide Diskus 50mcg contém:
Popionato de fluticasona 50 mcg.
Excipiente: lactose* q.s.p.
* Contém proteína de leite.
Cada dose de Flixotide Diskus 250mcg contém:
Popionato de fluticasona 250 mcg.
Excipiente: lactose* q.s.p.
* Contém proteína de leite.
Superdosagem
Superdose aguda
A inalação do medicamento em doses muito maiores que as recomendadas pode levar à supressão temporária do eixo hipotalâmico-hipofisário-adrenal. Isso geralmente não requer ação de emergência porque a função da glândula adrenal costuma recuperar-se em poucos dias.
Superdose crônica
Se você usar o propionato de fluticasona em doses diárias maiores que as indicadas por seu médico e durante períodos prolongados, possivelmente vai ocorrer uma diminuição significativa da função adrenal. Foram muito raros os casos de crise adrenal aguda em crianças que tomaram doses maiores que as recomendáveis (geralmente 1.000 mcg por dia ou mais) durante muitos meses ou até anos. Os sintomas são hipoglicemia (redução dos níveis de açúcar do sangue) e diminuição da consciência e/ou convulsões. Há algumas situações que podem acelerar a crise adrenal aguda, como traumas, cirurgias, infecções ou uma redução brusca de dose. Se seu médico precisar receitar doses superiores às recomendadas, ele vai também acompanhar cuidadosamente o tratamento e reduzir a dose aos poucos.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Em caso de intoxicação ligue para 0800 722 6001 se você precisar de mais orientações sobre como proceder.
Interação Medicamentosa
Em circunstâncias normais, as baixas concentrações plasmáticas do propionato de fluticasona são alcançadas, após a inalação, por causa do grande efeito do metabolismo de primeira passagem e do alto clearance sistêmico mediado pela CYP3A4 no intestino e no fígado.
Portanto, é improvável a ocorrência de interações medicamentosas clinicamente significativas.
Um estudo sobre interação medicamentosa em voluntários sadios mostrou que o ritonavir (um potente inibidor da CYP3A4) pode aumentar significativamente a concentração plasmática do propionato de fluticasona, gerando-se concentrações séricas de cortisol bastante reduzidas.
Houve relatos de interações medicamentosas clinicamente significativas em pacientes que receberam propionato de fluticasona intranasal ou inalatório e ritonavir, o que resultou em efeitos corticosteroides sistêmicos, como síndrome de Cushing e supressão adrenal. Por isso, o uso concomitante de propionato de fluticasona e ritonavir deve ser evitado, a menos que os benefícios potenciais para o paciente sejam maiores que o risco de efeitos colaterais sistêmicos.
Estudos demonstraram que outros inibidores da CYP3A4 (eritromicina e cetoconazol) produzem discreto aumento da exposição sistêmica ao propionato de fluticasona sem reduções séricas notáveis da concentração de cortisol.
Não obstante, ainda é necessário cuidado ao coadministrar inibidores potentes da CYP3A4 (como o cetoconazol), já que há potencial de aumento da exposição sistêmica ao propionato de fluticasona.
Ação da Substância
Resultados da eficácia
Em um estudo randomizado com 395 pacientes foi comparada a eficácia do propionato de fluticasona 2000 mcg versus budesonida 2000 mcg na melhora da função pulmonar e das exacerbações.
A fluticasona foi superior a budesonida no que se refere ao percentual de dias livres de sintomas, gravidade das exacerbações, utilização de medicação de resgate e melhora do VEF1.
A duração das exacerbações foi menor no grupo tratado com fluticasona quando comparado ao grupo tratado com budesonida (18,5 vs 23,6 dias, respectivamente). A fluticasona foi mais efetiva do que a budesonida com melhora clínica significativa da função pulmonar e redução do escore dos sintomas diurnos da asma em pacientes com asma grave.
Estudos clínicos
DPOC
Há uma redução significativa dos sintomas de DPOC e uma melhoria da função pulmonar, independente da idade do paciente, sexo, da função pulmonar, tabagismo ou atopia.
Isto pode resultar numa significativa melhoria na qualidade de vida.
Medicamentos contendo propionato de fluticasona na asma durante a gravidez
Um estudo epidemiológico retrospectivo observacional de coorte utilizando registros eletrônicos de saúde do Reino Unido foi utilizado para avaliar o risco de malformações congênitas maiores (MFCs) após a exposição ao propionato de fluticasona por via inalatória no primeiro trimestre e propionato de fluticasona + salmeterol em relação ao corticosteroide inalatório sem propionato de fluticasona.
Nenhum comparador placebo foi incluído neste estudo.
Dentro do grupo de asma de 5362 grávidas expostas a corticosteroides inalatórios no primeiro trimestre, foram encontrados 131 MFCs; 1612 (30%) foram expostas ao propionato de fluticasona ou salmeterol + propionato de fluticasona, das quais foram encontrados 42 MFCs diagnosticados.
A odds ratio ajustada para MFCs diagnosticadas por 1 um ano foi 1,1 (95% IC: 0,5 – 2.3) para mulheres com asma moderada expostas ao propionato de fluticasona versus mulheres expostas a corticoides inalatórios sem propionato de fluticasona e 1,2 (95% IC: 0,7 – 2,0) para mulheres com asma importante a grave.
Não foi encontrada diferença no risco de MFCs após a exposição no primeiro trimestre ao propionato de fluticasona isolado versus salmeterol + propionato de fluticasona.
Riscos absolutos de MFMs ao longo de todos os estratos de gravidade variaram de 2,0 a 2,9 a cada 100 grávidas expostas ao propionato de fluticasona o que é comparável aos resultados de um estudo com 15.840 grávidas não expostas às terapias de asma na General Practice Research Database. (2,8 eventos de MFCs a cada 100 grávidas).
Características farmacológicas
Propriedades farmacodinâmicas
O propionato de fluticasona, quando inalado nas doses recomendadas, apresenta potente ação anti-inflamatória glicocorticosteroide sobre os pulmões, o que resulta na redução dos sintomas e da exacerbação da asma.
Há também redução significativa dos sintomas da DPOC e melhora da função pulmonar independente da idade, do sexo, da função pulmonar basal, da condição tabágica e do estado atópico.
Esses benefícios proporcionam melhora significativa da qualidade de vida do paciente.
No tratamento da asma, o início do efeito terapêutico do medicamento é de quatro a sete dias após o início do tratamento, embora alguns benefícios possam ser aparentes já nas primeiras 24 horas para os pacientes que não tenham recebido corticoides inalatórios anteriormente.
Propriedades farmacocinéticas
Absorção
A biodisponibilidade absoluta do propionato de fluticasona após administração com cada um dos inaladores disponíveis foi estimada com base nos estudos de dados farmacocinéticos inalatórios e intravenosos e na comparação desses dados.
Nos indivíduos adultos e sadios, estimou-se a biodisponibilidade absoluta do propionato de fluticasona na versão diskus em 7,8% e a do propionato de fluticasona na versão spray em 10,9%. Nos pacientes com asma ou DPOC, observou-se um pequeno grau de exposição sistêmica ao propionato de fluticasona.
A absorção sistêmica do propionato de fluticasona ocorre sobretudo através dos pulmões e é inicialmente rápida e posteriormente prolongada.
O restante da dose inalada pode ser ingerido, mas sua contribuição com a exposição sistêmica é mínima em virtude da baixa solubilidade em água e do metabolismo de primeira passagem, o que resulta em disponibilidade oral menor que 1%. Há aumento linear da exposição sistêmica quando se eleva a dose administrada por via inalatória.
Distribuição
O propionato de fluticasona tem grande volume de distribuição no estado de equilíbrio (aproximadamente 300 litros). A ligação às proteínas plasmáticas é moderadamente alta (91%).
Metabolismo
O propionato de fluticasona é removido com rapidez da circulação sistêmica, principalmente pelo metabolismo a um ácido carboxílico inativo pela enzima 3A4 do citocromo P450 (CYP3A4).
Deve-se tomar cuidado na administração concomitante de inibidores conhecidos da CYP3A4, já que existe risco potencial de aumentar a exposição sistêmica ao propionato de fluticasona.
Eliminação
A disposição do propionato de fluticasona caracteriza-se pelo elevado clearance plasmático (1.150 mL/min) e pela meia-vida terminal de aproximadamente 8 horas. O clearance renal do propionato de fluticasona é desprezível (<0,2%) e não atinge 5% como metabólito.
Cuidados de Armazenamento
Mantenha o medicamento na embalagem original em local seco e em temperatura ambiente (entre 15ºC e 30ºC). O Diskus está lacrado em um invólucro laminado metálico que deve ser aberto apenas quando o medicamento for usado pela primeira vez. Depois de aberto, o invólucro laminado deve ser descartado.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com prazo de validade vencido.
Para sua segurança, mantenha o medicamento na embalagem original.
Todo medicamento deve ser mantido fora do alcance das crianças.?
Aspecto físico/características organolépticas
O dispositivo apresenta dois tons de laranja, é circular, de plástico moldado, tem aproximadamente 8,5 cm de diâmetro por 3 cm de altura e vem com um contador que indica o número de doses.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais
MS: 1.0107.0197
Farm. Resp.:
Edinilson da Silva Oliveira
CRF-RJ No 18875
Fabricado por:
Glaxo Wellcome Production
23, rue Lavoisier, Zone Industrielle n° 2 - 27000
Evreux - França
Registrado e Importado por:
GlaxoSmithKline Brasil Ltda.
Estrada dos Bandeirantes no 8464
Rio de Janeiro RJ
CNPJ: 33.247.743/0001-10
Venda sob prescrição médica.