Comparamos o preço de Lamotrigina 50Mg Com 30 Comprimidos Lamotrigina 50Mg Com 30 Comprimidos - Torrent Genérico, veja o menor preço

R$ 25,99
GGenérico
2
ofertasMelhores preços a partir de R$ 25,99 até R$ 25,99
Oferta patrocinada
vendido por Drogaria São Paulo
R$ 25,99
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Oferta patrocinada
vendido por Drogarias Pacheco
R$ 25,99
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Para que serve
A lamotrigina é uma droga antiepilética indicada como adjuvante ou em monoterapia para o tratamento de crises convulsivas parciais e crises generalizadas, incluindo crises tônico-clônicas.
Após o controle epiléptico ter sido alcançado durante terapia combinada, drogas antiepiléticas (DAEs) concomitantes geralmente podem ser retiradas, substituindo-as pela monoterapia com lamotrigina.
Contraindicação
Este medicamento é contraindicado em indivíduos com conhecida hipersensibilidade a lamotrigina ou a qualquer outro componente da formulação.
Este medicamento é contraindicado para menores de 12 anos.
Como usar
A lamotrigina deve ser engolida inteira, com o auxílio de um copo de água.
Os comprimidos não devem ser mastigados nem partidos. Se uma dose calculada de lamotrigina (por exemplo: para uso em crianças e pacientes com insuficiência hepática) não puder ser dividida em doses menores, a dose a ser administrada será igual à menor dose equivalente a um comprimido inteiro.
Este medicamento não deve ser partido ou mastigado.
Reintrodução da terapia
Os médicos devem avaliar a necessidade de escalonamento de dose ao reintroduzir a terapia com lamotrigina, em pacientes que descontinuaram seu uso por alguma razão, uma vez que há sérios riscos de exantema associados a altas doses iniciais e ao exceder a dose recomendada para o escalonamento de lamotrigina. Quanto maior o intervalo entre o uso prévio e a reintrodução, maior o cuidado que se deve tomar no escalonamento da dose de manutenção. Quando este intervalo exceder cinco meias-vidas, lamotrigina deve ser escalonada à dose de manutenção de acordo com um programa apropriado.
Recomenda-se que lamotrigina não seja reiniciada em pacientes que tenham descontinuado seu uso por causa de exantema associado ao tratamento prévio com lamotrigina, a menos que o potencial benefício ultrapasse os possíveis riscos.
Epilepsia
Quando drogas antiepilépticas de uso concomitante são retiradas para monoterapia com lamotrigina ou quando outra droga antiepilética (DAE) é adicionada ao regime de tratamento contendo lamotrigina, deve-se considerar os efeitos sobre a farmacocinética da lamotrigina.
Dose em monoterapia
Adultos e crianças acima de 12 anos de idade:
A dose inicial de lamotrigna em monoterapia é de 25mg, uma vez ao dia, por duas semanas, seguida por 50mg, uma vez ao dia, por duas semanas. A partir daí, a dose deve ser aumentada em até um máximo de 50-100mg, a cada uma a duas semanas, até que uma resposta ótima seja alcançada. A dose usual de manutenção para se alcançar uma resposta ideal é de 100-200mg/dia, administrados uma vez ao dia ou em duas doses fracionadas. Alguns pacientes podem necessitar de até 500mg/dia de lamotrigna para alcançar a resposta desejada.
Por conta do risco de exantema rash, a dose inicial e o escalonamento de doses subsequentes não deve ser excedido.
Dose em terapia combinada
Adultos e crianças acima de 12 anos:
Nos pacientes recebendo valproato, com ou sem outra droga antiepilética (DAE), a dose inicial de lamotrigna deve ser de 25mg, em dias alternados, por duas semanas, seguida por 25mg, uma vez ao dia, por duas semanas. Em seguida, a dose deve ser aumentada até um máximo de 25-50mg, a cada uma ou duas semanas, até que uma resposta adequada seja alcançada. A dose usual de manutenção para se obter uma resposta ótima é de 100-200mg/dia, administrados uma vez ao dia ou fracionados em duas tomadas.
Nos pacientes tomando DAEs concomitantes ou outras medicações que induzam a glicuronidação da lamotrigina, com ou sem outras DAEs (exceto valproato), a dose inicial de lamotrigna é de 50mg, uma vez ao dia, por duas semanas, seguidos por 100mg/dia, administrados em duas doses fracionadas, por duas semanas.
A partir daí, a dose deve ser aumentada até um máximo de 100mg a cada uma ou duas semanas, até que uma resposta adequada seja alcançada. A dose usual de manutenção para se obter uma resposta ótima é de 200-400mg/dia, administrados em duas doses fracionadas.
Alguns pacientes podem necessitar de até 700mg/dia de lamotrigna para alcançar a resposta desejada.
Em pacientes usando outras drogas que não induzem ou inibem significativamente a glicuronidação da lamotrigina, a dose inicial de lamotrigna é 25mg uma vez ao dia por duas semanas, seguidos por 50mg, uma vez ao dia, por duas semanas. A partir daí, a dose deve ser aumentada até um máximo de 50 a 100mg a cada uma ou duas semanas, até que uma resposta adequada seja alcançada. A dose usual de manutenção para se obter uma resposta ótima é de 100 a 200mg/dia, administrados uma vez ao dia ou em duas doses fracionadas.
Tabela 2 – Regime de tratamento recomendado em epilepsia para adultos e maiores de 12 anos
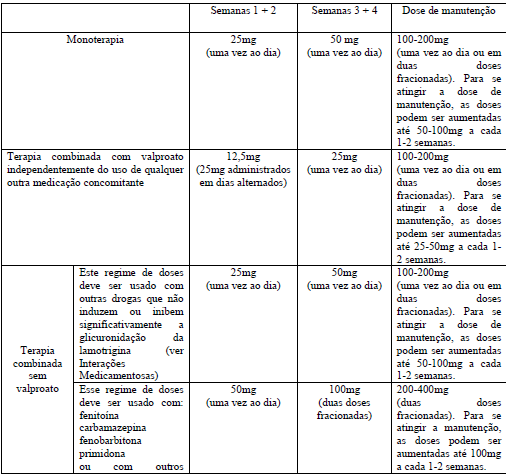

Face ao risco de exantema rash, a dose inicial e o escalonamento de doses subsequentes não devem ser excedidos.
Recomendações posológicas gerais para populações de pacientes especiais
Mulheres tomando contraceptivos hormonais
Iniciando o tratamento com lamotrigina em pacientes que já estejam tomando contraceptivos hormonais:
Embora haja evidências de que os contraceptivos hormonais aumentam o clearance da lamotrigina, nenhum ajuste no escalonamento de dose de lamotrigina deve ser necessário com base somente no uso de contraceptivos hormonais. O escalonamento das doses deve seguir as diretrizes recomendadas, baseando-se no fato de a lamotrigina ser adicionada a valproato (um inibidor da glicuronidação da lamotrigina) ou a um indutor da glicuronidação da lamotrigina, ou de lamotrigina ser adicionada na ausência de valproato ou de um indutor da glicuronidação da lamotrigina.
Iniciando o uso de contraceptivos hormonais em pacientes que já estejam tomando doses de manutenção de lamotrigina e não estejam tomando substâncias indutoras da glicuronidação da lamotrigina:
Na maioria dos casos, será necessário aumentar a dose de manutenção de lamotrigina para valores duas vezes maiores. É recomendado que, a partir do momento em que seja iniciado o uso de contraceptivos hormonais, a dose de lamotrigina seja aumentada para até 50 a 100mg/dia a cada semana, de acordo com a resposta clínica individual. Os aumentos de dose não devem exceder esse valor, a menos que a resposta clínica indique a necessidade de acréscimos maiores.
Interrompendo o uso de contraceptivos hormonais em pacientes que já estejam tomando doses de manutenção de lamotrigina e não estejam tomando substâncias indutoras da glicuronidação da lamotrigina:
Na maioria dos casos, será necessário reduzir a dose de manutenção de lamotrigina para valores até 50% menores. É recomendado que seja feita a redução gradual da dose diária de lamotrigina de até 50 a 100mg a cada semana (não excedendo 25% da dose diária total semanal) pelo período de três semanas, a menos que a resposta clínica indique o contrário.
Administração com atazanavir/ritonavir
Apesar de atazanavir/ritonavir ter mostrado reduzir a concentração plasmática de lamotrigina, nenhum ajuste no escalonamento de dose de lamotrigina deve ser necessário com base somente no uso de atazanavir/ritonavir. O escalonamento das doses deve seguir as diretrizes recomendadas, baseando-se no fato de a lamotrigina ser adicionada ao valproato (um inibidor da glicuronidação da lamotrigina) ou a um indutor da glicuronidação da lamotrigina, ou de lamotrigina ser adicionada na ausência de valproato ou de um indutor da glicuronidação da lamotrigina.
Em pacientes que já tomam doses de manutenção de lamotrigina e que não utilizam indutores de glicuronidação, pode ser necessário aumentar a dose de lamotrigina se atazanavir/ritonavir forem utilizados ou diminuir a dose se atazanavir/ritonavir forem descontinuados.
Idosos (acima de 65 anos de idade)
Nenhum ajuste de dose é necessário. A farmacocinética da lamotrigina nesta faixa etária não difere significativamente da população de adultos não idosos.
Insuficiência hepática
As doses iniciais de escalonamento e manutenção devem ser geralmente reduzidas em aproximadamente 50% em pacientes com insuficiência hepática moderada (Child-Pugh grau B) e em 75% na insuficiência hepática grave (Child Pugh grau C). As doses de escalonamento e manutenção devem ser ajustadas de acordo com a resposta clínica.
Insuficiência renal
Deve-se ter cautela ao administrar lamotrigina a pacientes com insuficiência renal. Em pacientes em estágio terminal de insuficiência renal, as doses iniciais de lamotrigina devem ser baseadas no regime de DAEs dos pacientes. Doses de manutenção reduzidas podem ser eficazes para pacientes com insuficiência renal significativa. Para informações farmacocinéticas mais detalhadas, ver Propriedades farmacocinéticas, em Características Farmacológicas.
Precauções
Exantema
Existem relatos de reações adversas dermatológicas que geralmente têm ocorrido nas primeiras oito semanas após o início do tratamento com a lamotrigina. A maioria dos exantemas rash é leve e autolimitada, entretanto, exantemas de pele graves, que requerem hospitalização e descontinuação de lamotrigina, foram relatados. Esses casos são potencialmente ameaçadores à vida e incluem a Síndrome de Stevens-Johnson (SJS) e a necrólise epidérmica tóxica (NET, Síndrome de Lyell).
Nos adultos participantes dos estudos, utilizando as doses recomendadas, a incidência de exantema de pele grave foi de aproximadamente 1:500 em pacientes epilépticos.
Aproximadamente metade desses casos foi relatada como SJS (1:1000).
O risco de exantema grave em crianças é maior do que nos adultos.
Dados disponíveis sugerem que a incidência de exantemas associados à hospitalização de crianças é de 1:300 a 1:100.
Em crianças, a presença inicial de exantema pode ser confundida com uma infecção. Os médicos devem considerar a possibilidade de reação medicamentosa em crianças que desenvolvem sintomas de exantema e febre durante as primeiras oito semanas de tratamento com lamotrigina.
Além disso, o risco global de aparecimento de exantema pode estar fortemente associado a:
- Altas doses iniciais de lamotrigina;
- Doses que excedam o escalonamento de doses recomendado;
- Uso concomitante de valproato.
Deve-se ter cuidado ao tratar pacientes com história de alergia ou rash cutâneo a outras drogas antiepiléticas, já que a frequência de rash não grave após tratamento com lamotrigina foi aproximadamente três vezes maior nestes pacientes do que nos que não apresentavam história de alergia e/ou rash.
Todos os pacientes (adultos e crianças) que desenvolverem exantema devem ser rapidamente avaliados, e o uso da lamotrigina, descontinuado, a menos que o exantema se mostre claramente não relacionado à droga. É recomendado que lamotrigina não seja reiniciado em pacientes que tiveram a terapia suspensa por ter apresentado exantema no tratamento anterior com lamotrigina, a menos que o benefício se sobreponha ao risco.
Exantema também tem sido relatado como parte de uma síndrome de hipersensibilidade associada a um padrão variável de sintomas sistêmicos – incluindo febre, linfadenopatia, edema facial, anormalidades hematológicas e hepáticas e meningite asséptica. A síndrome exibe um largo espectro de gravidade clínica e pode, raramente, levar à coagulação intravascular disseminada (CID) e à insuficiência de múltiplos órgãos.
É importante notar que manifestações de hipersensibilidade precoce (por exemplo: febre, linfadenopatia) podem estar presentes mesmo que não ocorra exantema. Se tais sinais e sintomas estiverem presentes, o paciente deve ser avaliado imediatamente, e o uso de lamotrigina deve ser descontinuado, a menos que possa ser estabelecida uma etiologia alternativa.
A meningite asséptica foi reversível com a retirada da droga na maioria dos casos, mas reapareceu em alguns casos de re-exposição à lamotrigina. A re-exposição resultou em um retorno rápido dos sintomas, que eram frequentemente mais graves. A lamotrigina não deve ser reiniciada em pacientes que tenham interrompido devido à meningite relacionada a tratamento prévio com lamotrigina.
Risco de suicídio
Sintomas de depressão e/ou transtorno bipolar podem ocorrer em pacientes com epilepsia, e existem evidências de que os pacientes com epilepsia e transtorno bipolar apresentam risco elevado para suicidalidade.
De 25% a 50% dos pacientes com transtorno bipolar tentam suicidar-se pelo menos uma vez e podem apresentar piora dos sintomas depressivos e/ou aparecimento de ideias e comportamentos suicidas (suicidalidade), estejam eles tomando ou não medicações para o transtorno bipolar, incluindo lamotrigina.
Ideação e comportamento suicidas foram relatados em pacientes tratados com DAEs em diversas indicações, inclusive epilepsia e transtorno bipolar. Uma meta-análise de estudos randomizados com DAEs (inclusive lamotrigina) controlados com placebo também demonstrou pequeno aumento no risco de ideação e comportamento suicidas. O mecanismo desse risco não é conhecido, e os dados disponíveis não descartam a possibilidade de risco aumentado para lamotrigina.
Portanto, os pacientes devem ser monitorados para detecção de sinais de ideação e comportamentos suicidas.
Os pacientes (e os cuidadores deles) devem ser aconselhados a buscar auxílio médico caso apareçam sinais de ideação ou comportamento suicidas.
Contraceptivos hormonais
Efeito dos contraceptivos hormonais na eficácia de lamotrigina:
Foi demonstrado que a associação de etinilestradiol/levonorgestrel (30mcg/150mcg) aumenta o clearance da lamotrigina em aproximadamente duas vezes, resultando em redução dos níveis de lamotrigina.
Após a titulação, doses de manutenção mais elevadas de lamotrigina podem ser necessárias (em até duas vezes ou mais) para atingir a resposta terapêutica máxima. Em mulheres que não estejam usando substâncias indutoras de glicuronidação da lamotrigina e em uso de contraceptivos hormonais que incluam uma semana de medicação inativa (por exemplo, uma semana sem pílula), aumentos graduais transitórios nos níveis de lamotrigina ocorrerão durante a semana de medicação inativa.
Esses aumentos devem ser maiores quando o aumento da dose de lamotrigina se der nos dias que antecedem ou durante a semana de medicação inativa. Para instruções de dose, ver Posologia e Modo de Usar.
Os médicos devem fazer acompanhamento clínico apropriado da mulher que comece ou pare de tomar contraceptivos hormonais durante o tratamento com lamotrigina, uma vez que ajustes na dosagem de lamotrigina serão necessários na maioria dos casos.
Outros contraceptivos orais e tratamentos de Terapia de Reposição Hormonal não foram estudados.
Entretanto, eles podem, de forma similar, afetar os parâmetros farmacocinéticos da lamotrigina.
Efeito da lamotrigina na eficácia de contraceptivos hormonais:
Em um estudo de interação com 16 voluntárias saudáveis demonstrou-se que quando a lamotrigina e o contraceptivo hormonal (associação de etinilestradiol/levonorgestrel) são administrados em associação há um modesto aumento no clearance do levonorgestrel e alterações nos níveis de FSH e LH séricos. O impacto dessas alterações na atividade ovulatória é desconhecido.
Entretanto, não pode ser excluída a possibilidade dessas alterações resultarem numa diminuição da eficácia contraceptiva em algumas pacientes que estejam tomando medicações hormonais e lamotrigina. Assim, as pacientes devem ser instruídas a relatar imediatamente ao médico qualquer alteração em seu ciclo menstrual, como sangramentos entre os períodos.
Efeito da lamotrigina nos substratos do transportador catiônico orgânico 2 (OCT2).
A lamotrigina é um inibidor da secreção tubular renal via proteínas OCT 2.
Isso pode resultar em aumento dos níveis plasmáticos de certas drogas que são substancialmente excretadas por esta via. A coadministração de lamotrigina com os substratos OCT 2s com um índice terapêutico estreito, por exemplo a dofetilida não é recomendado.
Diidrofolato redutase
A lamotrigina é um fraco inibidor da diidrofolato redutase. Portanto, há possibilidade de interferência com o metabolismo do folato durante tratamentos prolongados. Entretanto, em períodos de até um ano, a lamotrigina não provocou alterações significativas na concentração da hemoglobina, no volume corpuscular médio e nas concentrações de folato em nível sérico ou das hemácias. Em períodos de tratamento de até cinco anos não houve alterações significativas na concentração de folato das hemácias.
Insuficiência renal
Em estudos com dose única em pacientes com insuficiência renal terminal as concentrações plasmáticas de lamotrigina não foram significativamente alteradas. No entanto, como é esperado que haja acúmulo do metabólito glicuronato, deve se ter cuidado ao tratar pacientes com insuficiência renal.
Pacientes sendo tratados com outras formulações contendo lamotrigina
Este medicamento não deve ser administrada a pacientes que estejam sendo tratados com outras formulações contendo lamotrigina sem recomendação médica.
Epilepsia
Como ocorre com outras drogas antiepiléticas, a suspensão abrupta de lamotrigina pode provocar crises de rebote. A menos que seja necessária a interrupção abrupta (em casos de exantema, por exemplo), a dose de lamotrigina deve sofrer redução gradual ao longo de duas semanas.
Há relatos na literatura de que crises convulsivas graves, incluindo estado de mal epiléptico, podem levar à rabdomiólise, disfunção de múltiplos órgãos e coagulação intravascular disseminada, algumas vezes levando à morte.
Casos semelhantes ocorreram em associação ao uso de lamotrigina.
Testes de laboratório
A lamotrigina tem demonstrado interferir em testes rápidos de urina usados para detecção de drogas, podendo resultar em falsos positivos, particularmente para fenciclidina. Um método químico alternativo mais específico deve ser utilizado para confirmar um resultado positivo.
Gravidez e lactação
A administração de lamotrigina não prejudicou a fertilidade de animais, em estudos de reprodução. Não há experiência do efeito do lamotrigina sobre a fertilidade humana.
Dados pós-comercialização, resultantes de diversos registros prospectivos de gravidezes, documentaram resultados de cerca de 8.700 mulheres expostas a lamotrigina usada em monoterapia durante o primeiro trimestre de gravidez.
Globalmente, estes dados não são sugestivos de aumento substancial do risco de malformações congênitas maiores.
Embora os dados de um número limitado de registros apresentem relatos de aumento do risco de fendas orais, um estudo caso-controle completo não demonstrou maior risco de fendas orais em comparação a outras malformações maiores após a exposição à lamotrigina. Os dados relacionados ao uso de lamotrigina em associação a outros fármacos são insuficientes para avaliar se o risco de malformações associado a outros agentes é afetado pelo uso concomitante de lamotrigina.
Como a maioria das drogas, lamotrigina não deve ser usado na gravidez, a menos que, a critério clínico, o benefício potencial para a mãe justifique qualquer risco possível ao desenvolvimento fetal.
As alterações fisiológicas relacionadas à gravidez podem afetar os níveis e/ou efeitos terapêuticos da lamotrigina. Há relatos de diminuição dos níveis de lamotrigina durante a gravidez. Deve-se assegurar o adequado acompanhamento clínico à mulher grávida que esteja em tratamento com lamotrigina.
Houve relatos de que lamotrigina passa para o leite materno em concentrações altamente variáveis, resultando em níveis totais de lamotrigina em bebês de até cerca de 50% dos níveis observados nas mães. Portanto, em alguns bebês amamentados, as concentrações séricas de lamotrigina podem atingir níveis nos quais ocorrem efeitos farmacológicos.
O benefício potencial da amamentação deve ser considerado frente ao risco potencial de efeitos adversos aos bebês.
Categoria C de risco na gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Efeitos na capacidade de dirigir veículos e operar máquinas
Dois estudos com voluntários demonstraram que o efeito da lamotrigina sobre a coordenação motora visual, movimentos dos olhos, movimentos corporais e de sedação não diferiram do placebo. Em estudos clínicos com lamotrigna, eventos adversos de características neurológicas, como vertigem e diplopia, têm sido reportados. Desta forma, os pacientes devem avaliar como serão afetados pela terapia com lamotrigina antes de dirigir e operar máquinas.
Como existe uma variação individual em resposta a todas as terapias com drogas antiepilépticas, o paciente deve consultar seu médico especificamente sobre a questão e dirigir e a epilepsia.
Reações Adversas
As reações adversas identificadas a partir de dados de estudos clínicos de epilepsia estão descritas abaixo.
Reações adversas adicionais identificadas a partir de dados de vigilância pós-comercialização estão incluídas na seção Dados Pós-Comercialização.
Todas as seções devem ser consultadas ao considerar o perfil de segurança global de lamotrigina. Utilizou-se a seguinte convenção para classificar as reações adversas:
- Muito comuns (>1/10);
- Comuns (>1/100 e <1/10);
- Incomuns (>1/1.000 e <1/100);
- Raras (> 1/10.000 e <1/1.000);
- Muito raras (<1/10.000).
Epilepsia
As reações adversas a seguir foram identificadas durante estudos clínicos para epilepsia e devem ser consideradas junto às observadas nos dados de pós-comercialização para um perfil de segurança global de lamotrigina:
Reações muito comuns (>1/10)
Dor de cabeça, exantema cutâneo1.
Reações comuns (>1/100 e <1/10)
Agressividade, irritabilidade, fadiga, sonolência, insônia, tontura, tremor, náusea, vômito, diarreia.
Reações incomuns (>1/1.000 e <1/100)
Ataxia, diplopia, visão turva.
Reações raras (> 1/10.000 e <1.000)
Síndrome de Stevens-Johnson1, nistagmo.
Reações muito raras (<1/10.000)
- Necrólise epidérmica tóxica1;
- Anormalidades hematológicas2 (incluindo neutropenia, leucopenia, anemia, trombocitopenia, pancitopenia, anemia aplástica, agranulocitose), linfadenopatia associada ou não à síndrome de hipersensibilidade3;
- Síndrome de hipersensibilidade3 (incluindo sintomas como febre, linfadenopatia, edema facial, anormalidades sanguíneas e do fígado, coagulação intravascular disseminada (CID), insuficiência múltipla de órgãos);
- Tiques, alucinações, confusão;
- Testes de função hepática aumentados, disfunção hepática4, insuficiência hepática;
- Reações semelhantes ao lúpus.
1Em estudos clínicos duplo-cegos em adultos, ocorreram exantemas cutâneos (rashs cutâneos) em até 10% dos pacientes que tomavam lamotrigina e em 5% dos pacientes que tomavam placebo. Os exantemas cutâneos levaram à suspensão do tratamento com lamotrigina em 2% dos pacientes. O exantema, normalmente de aparência máculopapular, geralmente aparece dentro de oito semanas após o início do tratamento, ocorrendo regressão com a suspensão da droga.
Raramente, foram observados exantemas cutâneos graves, incluindo Síndrome de Stevens-Johnson e necrólise epidérmica tóxica (NET, Síndrome de Lyell). Embora na maioria dos casos ocorra pronta recuperação com a suspensão da droga, alguns pacientes experimentam déficit de cicatrização irreversível e, em alguns raros casos, evoluem para o óbito.
O risco de exantema global parece estar associado com:
- Altas doses iniciais de lamotrigina;
- Doses que excedam o escalonamento de doses recomendado na terapia com lamotrigina;
- Uso concomitante de valproato.
Exantema tem sido relatado como parte de uma síndrome de hipersensibilidade associada a um padrão variável de sintomas sistêmicos3.
2Anormalidades hematológicas e linfadenopatia pode ou não ser associadas a síndrome de hipersensibilidade3.
3Além disso, exantema também foi relatado como parte da síndrome de hipersensibilidade associado a um padrão variável de sintomas sistêmicos como febre, linfadenopatia, edema facial e anormalidades do sangue e fígado. A síndrome mostra um amplo espectro de gravidade clínica e pode, raramente, levar à síndrome de coagulação intravascular disseminada (CID) e insuficiência múltipla de órgãos.
É importante notar que manifestações de hipersensibilidade prematuras (por exemplo, febre e linfadenopatia) podem estar presentes sem que o exantema seja evidente. Se tais sinais e sintomas estiverem presentes, o paciente deverá ser avaliado imediatamente, e a lamotrigina, descontinuada, caso uma etiologia alternativa não seja estabelecida.
4A disfunção hepática ocorre geralmente associada a reações de hipersensibilidade, mas foram relatados casos isolados sem sinais claros de hipersensibilidade.
Dados pós-comercialização
Esta seção inclui as reações adversas identificadas durante vigilância póscomercialização.
Estas devem ser consideradas junto às observadas nos estudos clínicos para um perfil de segurança global de lamotrigina.
Reações muito comuns (>1/10)
Sonolência, ataxia, vertigem, dor de cabeça, diplopia, visão turva, náusea, vômito.
Reações comuns (>1/100 e <1/10)
Nistagmo, tremor, insônia, diarreia.
Reações raras (> 1/10.000 e <1/1000)
Alopecia, meningite asséptica, conjuntivite.
Reações muito raras (<1/10.000)
Agitação, inconstância, distúrbios do movimento, piora da doença de Parkinson5, efeitos extrapiramidais5, coreoatetose, aumento na frequência das convulsões, pesadelos.
5Foi relatado que a lamotrigina pode piorar os sintomas parkinsonianos em pacientes com doença de Parkinson pré existente. Há relatos isolados de efeitos extrapiramidais e coreoatetose em pacientes sem esta predisposição.
Em casos de eventos adversos, notifique-os ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA ou à Vigilância Sanitária Estadual ou Municipal.
Interação Medicamentosa
A UDP-glicuronil transferase foi identificada como sendo a enzima responsável pelo metabolismo da lamotrigina. Não há evidências de que a lamotrigina cause indução ou inibição clinicamente relevante de enzimas hepáticas de metabolização oxidativa de drogas, e as interações entre a lamotrigina e drogas metabolizadas pelas enzimas do citocromo P450 são improváveis.
A lamotrigina pode induzir seu próprio metabolismo, mas o efeito é modesto e, provavelmente, não apresenta consequências clínicas significativas.
Tabela 1: Efeito de outras drogas na glicuronidação da lamotrigina
| Drogas que inibem significativamente a glicuronidação da lamotrigina | Drogas que induzem significativamente a glicuronidação da lamotr | Drogas que não inibem nem induzem significativamente a glicuronidação da lamotrigina |
| Valproato |
Carbamazepina, fenitoína, primidona, fenobarbitona, rifampicina, lopinavir/ritonavir, atazanavir/ritonavir* Associação de | Lítio, bupropiona, olanzapina, oxcarbazepina, felbamato, gapabentina, levetiracetam, pregabalina, topiramato, zonisamida, aripripazol |
*Para orientações de dosagem, ver Posologia e modo de Usar – Recomendações gerais para populações de pacientes especiais.
**Outros contraceptivos orais e terapias de reposição hormonal não foram estudados, embora possam afetar os parâmetros farmacocinéticos de forma similar.
Interações envolvendo drogas antiepilépticas - DAEs
O valproato, que inibe a glicuronidação da lamotrigina, reduz o metabolismo e aumenta a meia-vida média da lamotrigina em cerca de duas vezes.
Alguns agentes antiepiléticos (como fenitoína, carbamazepina, fenobarbital e primidona), que induzem as enzimas hepáticas de metabolização de drogas, induzem a glicuronidação da lamotrigina, aumentando seu metabolismo.
Há relatos de eventos em nível do sistema nervoso central - incluindo vertigem, ataxia, diplopia, visão turva e náuseas - em pacientes recebendo carbamazepina após a introdução de lamotrigina. Esses eventos são normalmente resolvidos quando a dose de carbamazepina é reduzida. Efeito similar foi observado durante estudo com oxcarbazepina e lamotrigina em voluntários adultos saudáveis, mas a redução da dose não foi investigada.
Em estudo com voluntários adultos saudáveis, utilizando doses de 200mg de lamotrigina e 1.200mg de oxcarbazepina, observou-se que a oxcarbazepina não altera o metabolismo da lamotrigina e a lamotrigina não altera o metabolismo da oxcarbazepina.
Em estudo com voluntários sadios, a coadministração de felbamato (1.200mg, duas vezes ao dia) e lamotrigina (100mg, duas vezes ao dia, por 10 dias) não demonstrou ter efeitos clínicos relevantes na farmacocinética da lamotrigina.
Baseado nas análises retrospectivas dos níveis plasmáticos em pacientes que recebiam lamotrigina isolada ou juntamente com gabapentina, o clearance da lamotrigina não pareceu ser alterado pela gabapentina.
Interações potenciais entre levetiracetam e lamotrigina foram pesquisadas avaliando-se as concentrações séricas de ambos agentes durante estudo clínico placebo-controlado.
Os dados indicaram que a lamotrigina não influencia a farmacocinética do levetiracetam, e o levetiracetam não afeta a farmacocinética da lamotrigina.
O estado de equilíbrio das concentrações plasmáticas de lamotrigina não foi afetado pela administração concomitante com pregabalina (200mg, três vezes ao dia). Não existem interações farmacocinéticas entre lamotrigina e pregabalina.
O topiramato não alterou as concentrações plasmáticas de lamotrigina, enquanto foi observado aumento de 15% nas concentrações de topiramato.
Em estudo com pacientes com epilepsia, a coadministração de zonisamida (200 a 400mg/dia) com lamotrigina (150 a 500mg/dia) durante 35 dias não teve efeito significativo na farmacocinética da lamotrigina.
Apesar de terem sido reportadas alterações nas concentrações plasmáticas com outras drogas antiepiléticas, estudos controlados não demonstraram evidências de que a lamotrigina afete as concentrações plasmáticas de drogas antiepiléticas quando administradas concomitantemente. Evidências de estudos in vitro indicaram que a lamotrigina não altera a ligação de outras drogas antiepiléticas às proteínas.
Interações envolvendo outros agentes psicoativos
A farmacocinética do lítio, após a administração de 2g de gliconato de lítio anidro, duas vezes ao dia, durante seis dias, a 20 indivíduos saudáveis, não foi alterada pela administração concomitante de 100mg/dia de lamotrigina.
Múltiplas doses orais de bupropiona não tiveram efeitos estatisticamente significativos na farmacocinética de dose única de lamotrigina em 12 indivíduos e houve somente um leve aumento na área sob a curva (AUC) do metabólito glicuronídeo de lamotrigina.
Em estudo com voluntários adultos saudáveis, 15mg de olanzapina reduziu a área sob a curva (AUC) e a concentração máxima (Cmáx) da lamotrigina numa média de 24% e 20%, respectivamente. Em geral, espera-se que um efeito dessa magnitude não seja clinicamente relevante. A lamotrigina, em doses de 200mg, não afetou a farmacocinética da olanzapina.
Doses múltiplas orais de lamotrigina (400mg/dia) não tiveram efeito clínico significativo na farmacocinética de uma única dose de 2mg de risperidona em 14 voluntários adultos saudáveis. Após a coadministração de risperidona 2mg com lamotrigina, 12 dos 14 voluntários apresentaram sonolência, comparado a 1(um) de 20, quando tomaram risperidona isoladamente, e nenhum, quando lamotrigina foi administrado isoladamente.
Em um estudo com 18 pacientes adultos com transtorno bipolar I, que receberam um esquema estabelecido de lamotrigina (> / = 100mg / dia), doses de aripiprazol foram aumentadas de 10mg / dia para uma dose alvo de 30mg / dia ao longo de um período de 7 dias e continuadas uma vez ao dia por mais 7 dias. Uma redução média de cerca de 10% na Cmáx e AUC da lamotrigina foi observada. Não se espera que um efeito dessa magnitude tenha alguma consequência clínica.
Experimentos de inibição in vitro indicaram que a formação do metabólito primário da lamotrigina, o 2-N-glicuronídeo, foi minimamente afetada pela coincubação com amitriptilina, bupropiona, clonazepam, fluoxetina, haloperidol ou lorazepam.
Dados sobre o metabolismo do bufuralol, obtidos de microssoma hepático humano, sugeriram que a lamotrigina não reduz o clearance das drogas eliminadas predominantemente pelo CYP2D6. Resultados de experimentos in vitro também sugerem que é improvável que o clearance da lamotrigina seja afetado pela clozapina, fenelzina, risperidona, sertralina ou trazodona.
Interações com contraceptivos hormonais
Efeito de contraceptivos hormonais na famacocinética da lamotrigina:
Em um estudo com 16 voluntárias, verificou-se que o uso de contraceptivo contendo 30mcg de etinilestradiol e 150mcg de levonorgestrel associados causou aumento no clearance oral da lamotrigina em aproximadamente duas vezes resultando numa redução média de 52% e 39% na área sob a curva (AUC) e Cmáx, respectivamente. As concentrações séricas da lamotrigina aumentaram gradualmente durante o curso de uma semana de medicação inativa (por exemplo, uma semana sem contraceptivo), com concentrações pré-dose ao final da semana de medicação inativa sendo, em média, aproximadamente duas vezes mais altas que durante a coterapia.
Efeito da lamotrigina na farmacocinética dos contraceptivos hormonais:
Em um estudo com 16 voluntárias, a dose de equilíbrio de 300mg de lamotrigina não afetou a farmacocinética do componente etinilestradiol na medicação associada. Um modesto aumento no clearance oral do componente levonorgestrel foi observado, resultando numa redução média de 19% e 12% na área sob a curva (AUC) e Cmáx do levonorgestrel, respectivamente.
Medidas das concentrações séricas de FSH, LH e estradiol durante o estudo indicaram certa perda da supressão da atividade hormonal ovariana em algumas mulheres, embora a medida da progesterona sérica tenha indicado que não houve evidência hormonal de ovulação em nenhuma das 16 voluntárias. O impacto do modesto aumento do clearance do levonorgestrel e das alterações das concentrações séricas de FSH e LH na atividade ovulatória é desconhecido. O efeito de doses diferentes de 300mg/dia de lamotrigina não foi estudado, e estudos com outras formulações hormonais femininas não foram conduzidos.
Interações envolvendo outras medicações
Em um estudo com 10 voluntários do sexo masculino, verificou-se que a rifampicina aumentou o clearance e diminuiu a meia-vida da lamotrigina pela indução das enzimas hepáticas responsáveis pela glicuronidação.
Em pacientes recebendo terapia concomitante com rifampicina, deve-se empregar o regime de tratamento recomendado para a lamotrigina e indutores de glicuronidação competitivos.
Em estudo com voluntários saudáveis, lopinavir/ritonavir reduziu aproximadamente pela metade as concentrações plasmáticas de lamotrigina, provavelmente pela indução da glicuronidação. Em pacientes recebendo terapia concomitante com lopinavir/ritonavir, o regime de tratamento recomendado para lamotrigina e indutores da glicuronidação deve ser considerado.
Em um estudo com voluntários adultos sadios, atazanavir/ritonavir (300mg/100mg) reduziu a área sob a curva (AUC) e a Cmáx de lamotrigina (dose única de 100mg) em uma média de 32% e 6%, respectivamente.
Os dados da avaliação in vitro do efeito da lamotrigina no OCT 2 demonstram que lamotrigina, mas não o metabótito N (2)-glucuronídeo, é um inibidor de OCT 2 em concentrações potencialmente relevantes clinicamente. Estes dados demonstram que a lamotrigina é um inibidor de OCT 2, com valor IC50 de 53,8?M.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados de eficácia
Três estudos com nível de evidência A avaliaram a eficácia e tolerabilidade da lamotrigina em pacientes diagnosticados com epilepsia generalizada e parcial. O primeiro destes estudos avaliou 260 pacientes que foram randomizados para receber lamotrigina ou carbamazepina. O resultado obtido para epilepsia parcial, considerando pacientes livres de crises convulsivas no período de 24 semanas após a titulação do tratamento, foi de 48% dos pacientes tratados com lamotrigina e 51% daqueles tratados com carbamazepina.
No grupo com epilepsia generalizada os resultados foram respectivamente, 78% e 76%. O segundo destes estudos utilizou desenho semelhante, porém entre pacientes idosos e, à semelhança do estudo anterior, não reportou diferenças de eficácia significativas entre lamotrigina e carbamazepina.
O terceiro estudo comparativo entre lamotrigina e fenitoína com desenho semelhante aos anteriores também não demonstrou diferença significativa entre os grupos com relação ao controle das crises, com 43% dos pacientes no grupo lamotrigina e 36% no grupo fenitoína permanecendo livres de crises nas 24 semanas de acompanhamento.
Características farmacológicas
Propriedades farmacodinâmicas:
Modo de ação
Os resultados de estudos farmacológicos sugerem que a lamotrigina age nos canais de sódio sensíveis à diferença de potencial (ddp), estabilizando as membranas neuronais e inibindo a liberação de neurotransmissores, principalmente de glutamato, um aminoácido excitatório que desempenha papel-chave no desencadeamento de crises epiléticas.
Farmacodinâmica
Em testes destinados a avaliar os efeitos de drogas sobre o sistema nervoso central, usando-se doses de 240mg de lamotrigina administradas a voluntários adultos sadios, os resultados não diferiram daqueles obtidos com o placebo, ao passo que 1.000mg de fenitoína e 10mg de diazepam comprometeram significativamente a boa coordenação motora visual e os movimentos oculares, aumentaram a instabilidade corporal e produziram efeitos sedativos subjetivos.
Em outro estudo, doses orais únicas de 600mg de carbamazepina comprometeram significativamente a boa coordenação motora visual e os movimentos oculares, ao mesmo tempo em que aumentaram a instabilidade corporal e a frequência cardíaca, enquanto os resultados com a lamotrigina, em doses de 150mg e 300mg, não diferiram daqueles com o placebo.
Propriedades farmacocinéticas:
Absorção
A lamotrigina é rapidamente e completamente absorvida pelo intestino, sem metabolismo significativo de primeira passagem. O pico de concentração plasmática ocorre aproximadamente 2,5 horas após a administração oral da droga. O tempo necessário para que se atinja a concentração máxima é discretamente retardado após alimentação, porém a extensão da absorção não é afetada. O perfil farmacocinético é linear até 450mg, a mais alta dose única testada. Há variação considerável das concentrações máximas no estado de equilíbrio entre indivíduos, mas, em um mesmo indivíduo, esta concentração raramente varia.
Distribuição
A lamotrigina apresenta ligação de 55% às proteínas plasmáticas, e é muito improvável que seu deslocamento das proteínas resulte em toxicidade. Seu volume de distribuição é de 0,92 a 1,22L/kg.0
Metabolismo
UDP-glicuronil transferases têm sido identificadas como as enzimas responsáveis pelo metabolismo da lamotrigina.
A lamotrigina induz discretamente seu próprio metabolismo, dependendo da dose. Entretanto, não existem evidências de que a lamotrigina afete a farmacocinética de outras drogas antiepiléticas, e os dados sugerem que são pouco prováveis as interações entre a lamotrigina e as drogas metabolizadas pelas enzimas do citocromo P450.
Eliminação
O clearance (depuração) médio em adultos saudáveis, no estado de equilíbrio, é de 39 ± 14mL/min. O clearance da lamotrigina é primariamente metabólico, com eliminação subsequente na urina do material conjugado com glicuronídeo.
Menos de 10% da lamotrigina são excretados pela urina na forma inalterada. Apenas 2% de substâncias relacionadas à droga são excretados nas fezes. O clearance e a meia-vida são independentes da dose. A meia-vida de eliminação média em adultos saudáveis é de 24 a 35 horas.
Em um estudo com indivíduos afetados pela Síndrome de Gilbert, o clearance médio aparente foi reduzido em 32% quando comparado com os controles normais. Porém, os valores estão dentro da faixa da população em geral.
A meia-vida da lamotrigina é significativamente afetada por medicação concomitante.
A meia-vida média é reduzida para aproximadamente 14 horas quando a lamotrigina é administrada com drogas indutoras de glicuronidação, tais como carbamazepina e fenitoína, e é aumentada para uma média de aproximadamente 70 horas quando coadministrada com valproato.
Populações de pacientes especiais
Crianças
O clearance ajustado ao peso corporal é maior em crianças do que em adultos, com valores mais altos em crianças abaixo de 5 anos. A meia-vida da lamotrigina é, geralmente, menor em crianças do que em adultos, com um valor médio de aproximadamente 7 horas, quando administrada juntamente com drogas indutoras enzimáticas, tais como carbamazepina e fenitoína. A meia-vida da lamotrigina é aumentada para um valor médio de 45 a 50 horas quando coadministrada com valproato.
Idosos
Resultados da análise farmacocinética de uma população, incluindo pacientes jovens e idosos com epilepsia envolvidos nos mesmos testes, indicaram que o clearance da lamotrigina não se altera de modo clinicamente relevante. Após a administração de doses únicas isoladas, o clearance aparente decresceu em 12%, de 35mL/min em pacientes com 20 anos para 31mL/min em pacientes com 70 anos. O decréscimo após 48 semanas de tratamento foi de 10%, de 41 para 37mL/min entre grupos jovens e idosos.
Adicionalmente, a farmacocinética da lamotrigina foi estudada em 12 indivíduos idosos saudáveis, após dose única de 150mg. O clearance médio nestes idosos (0,39mL/min/kg) encontrou-se dentro da faixa dos valores médios de clearance (0,31 a 0,65mL/min/kg) obtidos em nove estudos com adultos não idosos depois de dose única de 30 a 450mg.
Pacientes com insuficiência renal
Em estudo com 12 voluntários com insuficiência renal crônica e outros seis indivíduos passando por hemodiálise em que cada um fez uso de dose única de lamotrigina de 100mg, a média do CL/F foi de 0,42mL/min/kg (insuficiência renal crônica), 0,33mL/min/kg (entre as sessões de hemodiálise), e 1,57mL/min/kg (durante a hemodiálise) comparada a 0,58mL/min/kg em voluntários sadios.
A média de meia-vida plasmática foi de 42,9 h (insuficiência renal crônica), 57,4 h (entre as sessões de hemodiálise) e 13 h (durante a hemodiálise), comparada a 26,2h em voluntários sadios. Considerando a média, aproximadamente 20% (entre 5,6% e 35,1%) da quantidade de lamotrigina presente no corpo foram eliminados durante quatro horas de hemodiálise.
Para esta população, doses iniciais de lamotrigina devem ser baseadas em pacientes em uso de drogas antiepiléticas.
Doses reduzidas de manutenção podem ser efetivas para pacientes com significativa falha da função renal.
Pacientes com insuficiência hepática
Um estudo farmacocinético com dose única envolveu 24 pacientes com diferentes graus de insuficiência hepática e 12 indivíduos saudáveis como controle. O clearance mediano aparente da lamotrigina foi 0,31; 0,24 ou 0,10mL/min/kg em pacientes com insuficiência hepática de grau A, B ou C (Classificação Child-Pugh), respectivamente, comparado a 0,34mL/min/kg nos indivíduos-controle saudáveis. As doses iniciais, de escalonamento e manutenção geralmente devem ser reduzidos em 50% em pacientes com insuficiência hepática moderada (Child-Pugh B) e 75% na insuficiência hepática grave (Child Pugh C). O escalonamento e a manutenção da dose devem ser ajustados de acordo com a resposta clínica do paciente.