Comparamos o preço de Onbrize - 150Mcg C 30 Comprimidos E Inalador, veja o menor preço

R$ 152,28
RReferência
12
ofertasMelhores preços a partir de R$ 152,28 até R$ 193,17
Oferta patrocinada
vendido por Drogaria Nova Esperança
economize
21.17%
R$ 152,28
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
Oferta patrocinada
vendido por Drogaria São Paulo
economize
4.96%
R$ 183,59
Oferta patrocinada
vendido por Drogarias Pacheco
economize
0.30%
R$ 192,59
vendido por Farma Prime
economize
20.33%
R$ 153,90
vendido por Farmácia Preço Popular
economize
20.11%
R$ 154,32
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogaria Droganita
economize
18.72%
R$ 157,00
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Promofarma
economize
12.88%
R$ 168,29
vendido por Pague Menos
economize
5.79%
R$ 181,99
vendido por Drogaria Araújo
economize
3.45%
R$ 186,51
vendido por Farmácia Online Farmagora
economize
1.20%
R$ 190,85
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Drogaria Catarinense
economize
1.20%
R$ 190,85
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmanita Drogaria
R$ 193,17
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Onbrize é indicado para facilitar a respiração em pessoas que apresentam dificuldade de respirar devido à doenças pulmonares chamadas doença pulmonar obstrutiva crônica (DPOC) moderada a grave.?
O uso regular de Onbrize, uma vez ao dia, irá ajudar a minimizar os efeitos da doença em todos os dias da sua vida.
Como Onbrize funciona?
Onbrize contém uma substância ativa chamada indacaterol. Este medicamento pertence ao grupo de medicamentos chamados broncodilatadores. Quando você inala Onbrize, ele ajuda você a respirar mais facilmente.?
Você deve utilizá-lo com um aparelho chamado de inalador (utilize Onbrize apenas com o inalador contido nesta embalagem).
Nesta embalagem, você encontrará um inalador e as cápsulas (em blíster) que contém o medicamento em pó inalatório. O inalador de Onbrize permite que você inale o medicamento contido em uma cápsula.
Onbrize relaxa os músculos das paredes das pequenas passagens de ar do pulmão. Isto ajuda abrir as vias aéreas, facilitando a entrada e saída do ar.?
Se você tiver qualquer dúvida sobre como Onbrize funciona ou porque foi indicado para você, converse com seu médico.
O indacaterol administrado uma vez ao dia no mesmo horário todos os dias, tanto pela manhã ou à noite, tem um rápido início de ação dentro de 5 minutos.
Contraindicação
Hipersensibilidade ao princípio ativo ou a qualquer um dos excipientes.
Não use Onbrize:
- Se você já teve uma reação incomum ou uma reação alérgica ao indacaterol ou a qualquer um dos componentes deste produto, listados no início desta bula. ?
- Onbrize é contraindicado para pacientes asmáticos.
Se algum destes se aplicar a você, avise seu médico antes de utilizar Onbrize.
Se você acha que pode ser alérgico, converse com seu médico.
Este medicamento é contraindicado para menores de 18 anos.
Como usar
Siga as orientações do seu médico cuidadosamente. Não exceda a dose recomendada.
Como inalar Onbrize?
Utilize apenas o inalador fornecido nesta embalagem (inalador do Onbrize). Não engula as cápsulas.
Instruções para utilizar o inalador do Onbrize
Este item explica como usar e cuidar do seu inalador do Onbrize. Leia atentamente e siga estas instruções. Vide também “Como inalar Onbrize”. Se você tiver alguma dúvida, converse com seu médico.
Sua embalagem de Onbrize:
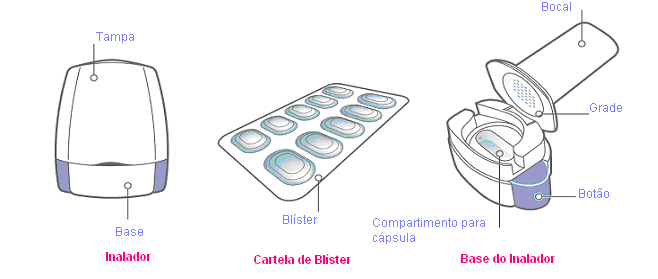
Cada embalagem de Onbrize contém:
- Um inalador
- Blíster contendo as cápsulas de Onbrize para serem usadas com o inalador
Não engolir as cápsulas de Onbrize:
O inalador do Onbrize permite que você inale o medicamento contido nas cápsulas.
Use apenas o inalador de Onbrize fornecido nesta embalagem.
Não use as cápsulas de Onbrize com nenhum outro inalador, e não use o inalador de Onbrize para outros medicamentos em cápsulas.
Como utilizar o seu inalador
1) Retire a tampa
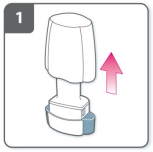
2) Abra o inalador
- Segure a base do inalador firmemente e incline o bocal para abrir o inalador.
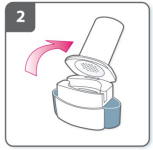
3) Prepare a cápsula
- ?Imediatamente antes do uso, com as mãos secas, remova uma cápsula do blíster.
4) Insira a cápsula
- Coloque a cápsula dentro do compartimento para cápsulas.
- Nunca coloque uma cápsula diretamente dentro do bocal.
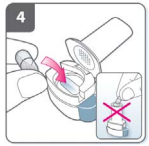
5) Feche o inalador?
- Feche completamente o inalador. Você deve ouvir um “click” quando estiver completamente fechado.
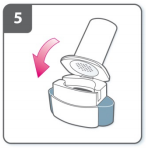
6) Perfure a cápsula
- Segure o inalador para cima, com o bocal apontado para cima.
- Aperte ambos os botões completamente uma única vez. Você deve ouvir um “click” quando a cápsula estiver sendo perfurada.
- Não aperte os botões de perfuração mais de uma vez.
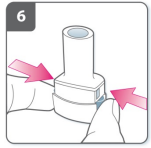
7) Libere os botões completamente
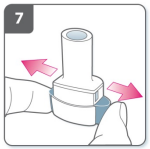
8) Expire
- Antes de colocar o bocal em sua boca, expire completamente.
- Nunca assopre dentro do bocal.
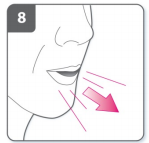
9) Inale o medicamento
- Antes de inspirar, coloque o bocal em sua boca e feche seus lábios firmemente em volta do bocal.
- Segure o inalador com os botões virados para esquerda e direita (não para cima e para baixo).
- Inspire rapidamente, mas constantemente, o mais profundo que puder.
- Não aperte os botões de perfuração.
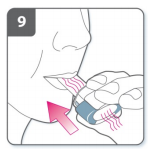
10) Observação
- Enquanto você inspira pelo inalador, a cápsula gira no compartimento e você deve ouvir um som de vibração. Você sentirá um sabor doce enquanto o medicamento segue para o seu pulmão.
- Se você não ouvir o som de vibração, a cápsula pode estar presa dentro do compartimento. Se isso ocorrer, abra o inalador e cuidadosamente desprenda a cápsula batendo levemente na base do aparelho. Não aperte os botões de perfuração para desprender a cápsula. Repita as etapas 8 e 9 se necessário.
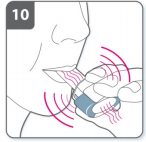
11) Segure a respiração
- ?- Continue segurando a sua respiração por pelo menos 5-10 segundos ou pelo maior tempo que você confortavelmente conseguir enquanto remove o inalador da sua boca. Então, expire.
- Abra o inalador para ver se ficou algum pó na cápsula. Se houver resíduo de pó na cápsula, feche o inalador e repita as etapas de 8 a 11. A maioria das pessoas é capaz de esvaziar a cápsula com uma ou duas inalações.
- Algumas pessoas ocasionalmente tossem logo após a inalação do medicamento. Se você tossir não se preocupe, pois se a cápsula estiver vazia, você recebeu a dose completa.
12) Remova a cápsula
- Após você ter terminado de tomar sua dose diária de Onbrize, abra o bocal novamente, remova a cápsula vazia batendo levemente e descarte-a. Feche o inalador e recoloque a tampa.
- Não armazene as cápsulas de Onbrize no inalador.
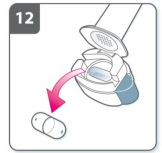
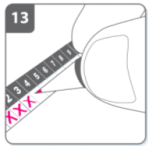
13) Marque na tabela de acompanhamento de dose diária
- Dentro da embalagem há uma tabela de acompanhamento da dose diária. Assinalar no quadradinho da tabela a data correspondente, ajudará a lembrar-se quando será a próxima dose.
 ?
?
Lembre-se:
- Não engula as cápsulas de Onbrize;?
- Use apenas o inalador do Onbrize que acompanha esta embalagem;
- As cápsulas de Onbrize devem sempre ser mantidas no blíster, e apenas removidas imediatamente antes do uso; ?
- Nunca coloque uma cápsula de Onbrize diretamente no bocal do inalador de Onbrize; ?
- Não aperte os botões de perfuração mais de uma vez; ?
- Nunca assopre dentro do bocal do inalador de Onbrize; ?
- Sempre desarme os botões apertados antes da inalação; ?
- Nunca lave o inalador de Onbrize com água. Mantenha-o seco;
- Nunca adquira o inalador de Onbrize separadamente;
- Sempre use o inalador de Onbrize novo que acompanha a sua embalagem nova do medicamento Onbrize;
- Não armazene as cápsulas no inalador de Onbrize; ?
- Sempre mantenha o inalador de Onbrize e as cápsulas de Onbrize em lugar seco.
Informações adicionais
?Ocasionalmente, pedaços muito pequenos da cápsula podem passar pela grade e entrar na sua boca. Se acontecer, você pode sentir estes pedaços em sua língua. Não é prejudicial se estes pedaços são engolidos ou inalados. As chances de a cápsula despedaçar serão aumentadas se a cápsula for perfurada mais de uma vez (etapa 6).
?Como limpar seu inalador?
?Limpe seu inalador uma vez por semana. Limpe o bocal dentro e fora com um pano sem fibras, limpo e seco para remover qualquer resíduo de pó. Nunca lave seu inalador com água. Mantenha-o sempre seco.
Quanto inalar de Onbrize??
A dose usual é a inalação do conteúdo de uma cápsula uma vez ao dia, todos os dias. A dose máxima diária é de 300 mcg em adultos. ?
Quando inalar Onbrize?
Você precisa inalar apenas uma vez ao dia porque os efeitos de Onbrize perduram por 24 horas.?Inalar Onbrize no mesmo horário todo dia irá ajudar a minimizar seus sintomas durante todo o dia e noite. Irá também ajudar a se lembrar de usar seu medicamento. ?
Por quanto tempo Onbrize deve ser administrado?
Continue seu tratamento com Onbrize pelo tempo que seu médico determinar.?A DPOC é uma doença crônica e por isso você deve usar Onbrize todos os dias e não apenas quando você apresentar problemas de respiração ou outros sintomas da DPOC.?Se você tiver dúvidas sobre por quanto tempo continuar o seu tratamento com Onbrize, converse com seu médico ou farmacêutico
População especial
Nenhum ajuste de dose é necessário para pacientes idosos, com disfunção hepática leve e moderada ou disfunção renal. Não há dado disponível para pacientes com disfunção hepática grave. Onbrize™ não deve ser utilizado por pacientes abaixo de 18 anos de idade.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar este medicamento?
Se você esquecer uma dose, inale a próxima dose no dia seguinte no horário usual. Não administre duas doses para compensar a dose esquecida. Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Antes de usar Onbrize
Siga todas as instruções médicas cuidadosamente. Elas podem divergir da informação geral descrita nesta bula. ?
Tenha atenção especial com Onbrize:
Antes de utilizar Onbrize, informe seu médico se alguma destas situações se aplica a você:
- Se você é asmático (neste caso você não deve ser tratado com Onbrize); ?
- Se você tiver problemas do coração; ?
- Se você sofre de epilepsia; ?
- Se você tem problemas da glândula da tireoide; ?
- Se você sofre de diabetes; ?
- Se você está tomando medicamentos similares para a sua doença pulmonar.
Durante o tratamento com Onbrize, informe seu médico imediatamente se você sentir qualquer um dos sintomas abaixo:
- Se você sentir um aperto no peito, tosse, chiado ou falta de ar imediatamente após a inalação da medicação (sinais de broncoespasmo); ?
- Se você apresentar dificuldade para respirar ou engolir, inchaço da língua, lábios e face, urticária (erupção cutânea, coceira, ardência), (sinais de reação alérgica); ?
- Se seus sintomas da DPOC (falta de ar, chiado, tosse) não melhorarem ou se piorarem durante o seu tratamento. ?
Reações Adversas
Assim como com todos os medicamentos, pacientes utilizando Onbrize podem apresentar reações adversas embora nem todos os apresentem.
Algumas reações adversas podem ser graves (frequência incomum: ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Você pode apresentar sintomas de reações de hipersensibilidade, tais como dificuldade para respirar ou engolir, inchaço da língua, lábios e face, urticária, erupção cutânea; ?
- Você pode apresentar sintomas de broncoespasmo paradoxal, como dificuldade para respirar com chiado ou tosse.
Se você apresentar alguma destas, avise seu médico imediatamente.
Algumas reações adversas são muito comuns (ocorrem em 10% dos pacientes que utilizam este medicamento): ?
- Combinação de garganta inflamada, nariz escorrendo, nariz entupido, espirros, tosse e dor de cabeça com ou sem febre.
Se alguma destas reações te afetarem gravemente, avise seu médico.
Algumas reações adversas são comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento):
- Dor de cabeça; ?
- Tontura; ?
- Tosse; ?
- Espasmo muscular; ?
- Dor de garganta; ?
- Sensação de pressão ou dor nas bochechas ou testa (sinusite); ?
- Dor muscular;
- Inchaço das mãos, tornozelos e pés; ?
- Aperto no peito (problemas cardíacos); ?
- Palpitações; ?
- Sede excessiva, aumento da quantidade de urina, aumento do apetite com perda de peso, cansaço, alto nível ?de açúcar no sangue (que são sinais de uma doença chamada diabetes); ?
- Nariz escorrendo; ?
- Dor nos ossos e juntas; ?
- Dor no peito; ?
- Coceira / Erupção cutânea.
?Se qualquer um destes efeitos afetarem você gravemente, informe seu médico.
Algumas reações adversas são incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Batimento cardíaco irregular; ?
- Batimento cardíaco acelerado; ?
- Dor nos músculos;?
- Formigamento ou dormência.
Se qualquer uma destas reações afetarem você gravemente, informe ao seu médico.
?Algumas pessoas ocasionalmente tossem logo após a inalação do medicamento. A tosse é um sintoma comum em pacientes com DPOC. Se você apresentar uma breve tosse após inalar o medicamento, não se preocupe, uma vez que a cápsula esteja vazia, você recebeu a dose completa. ?
Caso alguma dessas reações adversas se torne grave ou se você notar alguma reação adversa não listada nesta bula, informe ao seu médico. ?
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista. ?
População Especial
Pacientes idosos (65 anos de idade ou mais) ?
Se você tiver 65 anos de idade ou mais, pode usar Onbrize na mesma dose indicada para adultos.
?Crianças e adolescentes (menores de 18 anos de idade)
?Onbrize não deve ser administrado para crianças ou adolescentes. ?
Gravidez e lactação ?
Se você estiver grávida ou acha que está grávida, ou se você está amamentando, converse com seu médico que avaliará se você pode usar Onbrize.?Peça orientações ao seu médico ou farmacêutico antes de utilizar qualquer medicamento. ?Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
?Efeitos sobre a habilidade de dirigir veículos e/ou operar máquinas
?Onbrize não tem influência, ou tem influência desprezível, sobre a capacidade de dirigir e operar máquinas. ?
Composição
Onbrize 150 mcg - cada cápsula de Onbrize contém:
194 mcg de maleato de indacaterol que equivale a 150 mcg de indacaterol.?
A dose disponibilizada (dose medida a partir do bocal do inalador de Onbrize) é de 120 mcg de indacaterol.
Onbrize 300 mcg - cada cápsula de Onbrize contém:
389 mcg de maleato de indacaterol que equivale a 300 mcg de indacaterol.
A dose disponibilizada (dose medida a partir do bocal do inalador de Onbrize) é de 240 mcg de indacaterol.
Excipientes:
Lactose monoidratada e gelatina (componente da cápsula).
Superdosagem
Se você inalar Onbrize em excesso ou se alguém acidentalmente inalou seu medicamento, você pode apresentar alguns dos seguintes eventos adversos:
- Batimento cardíaco rápido ou irregular; ?
- Respiração rápida, confusão, cansaço (sinais de acidose metabólica); ?
- Fraqueza muscular, espasmos musculares, batimento cardíaco anormal (sinais de baixo nível de potássio no ?sangue); ?
- Tremor; ?
- Dor de cabeça; ?
- Náuseas, vômitos; ?
- Sonolência;
- Alto nível de açúcar no sangue.
?Se você acha que está enfrentando algum destes eventos adversos, interrompa o uso do Onbrize e procure um médico ou hospital para obter orientação imediatamente. Mostre a embalagem do medicamento. Cuidados médicos podem ser necessários.
Interação Medicamentosa
Medicamentos que conhecidamente prolongam o intervalo QTc
Maleato de Indacaterol (substância ativa), como outros agonistas beta2-adrenérgicos, deve ser administrado com precaução para pacientes que estão sendo tratados com inibidores de monoamino oxidase, antidepressivos tricíclicos ou medicamentos que sabidamente prolongam o intervalo QT, pois qualquer efeito desses medicamentos no intervalo QT pode ser potencializado. Os medicamentos conhecidos por prolongar o intervalo QT podem aumentar o risco de arritmia ventricular.
Agentes simpatomiméticos
A administração concomitante de agentes simpatomiméticos (isolados ou como parte de uma terapia combinada) pode potencializar os efeitos adversos de Maleato de Indacaterol (substância ativa).
Hipocalemia
Tratamento concomitante com derivados de metilxantinas, esteroides ou diuréticos não poupadores de potássio podem potencializar o possível efeito de hipocalemia dos agonistas beta2-adrenérgicos.
Bloqueadores beta-adrenérgicos
Os bloqueadores beta-adrenérgicos podem enfraquecer ou antagonizar o efeito dos agonistas beta2-adrenérgicos. Portanto, Maleato de Indacaterol (substância ativa) não deve ser administrado junto com bloqueadores beta-adrenérgicos (incluindo colírios) a menos que haja razões fortes para seu uso. Quando necessário, os bloqueadores beta-adrenérgicos cardiosseletivos devem ser os de preferência, embora devam ser administrados com precaução.
Interação medicamentosa metabólica e baseada em transportadores
A inibição dos principais mecanismos de clearance (depuração) do indacaterol, CYP3A4 e P-gp, não tem impacto na segurança das doses terapêuticas de Maleato de Indacaterol (substância ativa).
Estudos de interação medicamentosa foram realizados utilizando inibidores potentes e específicos de CYP3A4 e P-gp (por ex., cetoconazol, eritromicina, verapamil e ritonavir). O verapamil foi usado como o inibidor prototípico de P-gp e resultou no aumento de ASC de 1,4 a 2 vezes e aumento de 1,5 vezes em Cmáx. A coadministração de eritromicina com Maleato de Indacaterol (substância ativa) resultou em um aumento de ASC de 1,4 a 1,6 vezes e 1,2 vezes para Cmáx. A inibição combinada de P-gp e CYP3A4 pelo inibidor duplo muito forte cetoconazol, causou um aumento de 2 e 1,4 vezes em ASC e Cmáx, respectivamente. O tratamento concomitante com ritonavir, outro inibidor duplo da CYP3A4 e P-gp, resultou em um aumento de 1,6 a 1,8 na ASC e a Cmáx não foi afetada. Tomados juntos, os dados sugerem que o clearance (depuração) sistêmico é influenciado pela modulação das atividades de P-gp e CYP3A4 e que o aumento de 2 vezes em ASC causado pelo inibidor duplo muito forte cetoconazol, reflete o impacto da inibição máxima combinada. A magnitude do aumento da exposição devido às interações medicamentosas não levanta nenhuma preocupação de segurança dada a experiência de segurança do tratamento com Maleato de Indacaterol (substância ativa) em estudos clínicos de até um ano em doses de 2 a 4 vezes maiores que as doses terapêuticas recomendadas.
Maleato de Indacaterol (substância ativa) não causou interações medicamentosas com comedicação. As investigações in vitro indicaram que o indacaterol tem potencial negligenciável de causar interações metabólicas com medicamentos nos níveis de exposição sistêmica alcançados em prática clínica.
Ação da Substância
Resultados da eficácia
O programa de desenvolvimento do estudo clínico de fase III de Maleato de Indacaterol (substância ativa) consistiu de 16 estudos-chaves e envolveu mais de 9.000 pacientes com diagnóstico clínico de DPOC moderada a grave, com 40 anos de idade ou mais, que tinham histórico de tabagismo de pelo menos 20 maços-ano, VEF1 pós-broncodilatador < 80% e ? 30% do valor normal esperado e uma razão VEF1/CVF pós-broncodilatador menor que 70%.
Nestes estudos, o indacaterol administrado uma vez ao dia, nas doses de 150 mcg e 300 mcg, mostrou melhora clinicamente significativa na função pulmonar (medidas pelo volume expiratório forçado em um segundo, VEF1) por 24 horas. No primeiro ponto de avaliação na semana 12 (VEF1 no nadir em 24 horas), a dose de 150 mcg resultou em um aumento de 0,13-0,18 L comparado ao placebo (p < 0,001) e um aumento de 0,06 L comparado ao salmeterol 50 mcg duas vezes ao dia (p < 0,001). A dose de 300 mcg resultou em um aumento de 0,17-0,18 L comparado ao placebo (p < 0,001) e um aumento de 0,1 L comparado ao formoterol 12 mcg duas vezes ao dia (p < 0,001). Ambas as doses resultaram em um aumento de 0,04-0,05 L sobre tiotrópio open-label 18 mcg uma vez ao dia (150 mcg, p = 0,004; 300 mcg, p = 0,01).
O indacaterol administrado uma vez ao dia no mesmo horário todos os dias, tanto pela manhã ou à noite, teve um rápido início de ação dentro de 5 minutos similar ao do salbutamol 200 mcg e, foi significativa e estatisticamente mais rápido quando comparado com salmeterol/fluticasona 50/500 mcg [6], e as melhoras média do pico em VEF1 em relação ao nível basal de 0,25-0,33 L no estado de equilíbrio ocorrendo entre 2-4 horas após a dose. O efeito broncodilatador de 24 horas de Maleato de Indacaterol (substância ativa) foi mantido a partir da primeira dose por todo um período de um ano com nenhuma evidência de perda de eficácia (taquifilaxia).
Em um estudo de 26 semanas, controlado com placebo e ativo (tiotrópio open-label) em 2.059 pacientes, a melhora média em relação ao nível basal de VEF1 em 5 minutos foi 0,12 L e 0,13 L para Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg, uma vez ao dia, respectivamente; a melhora média do pico, em relação ao nível basal, após a primeira dose (Dia 1) foi 0,19 L e 0,24 L, respectivamente e melhorou para 0,23 L e 0,26 L, respectivamente, quando o estado de equilíbrio farmacodinâmico foi alcançado (Dia 14). No primeiro ponto de avaliação (Semana 12), ambos os grupos de tratamento com Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg uma vez ao dia mostraram um valor de VEF1, no nadir, significativamente maior quando comparado ao placebo (ambas as concentrações 0,18 L, p < 0,001) e ao tiotrópio (0,05 L, p = 0,004, e 0,04 L, p = 0,01, respectivamente).
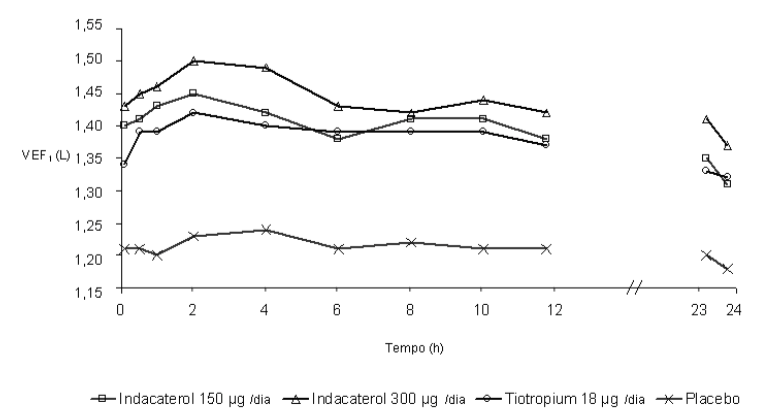
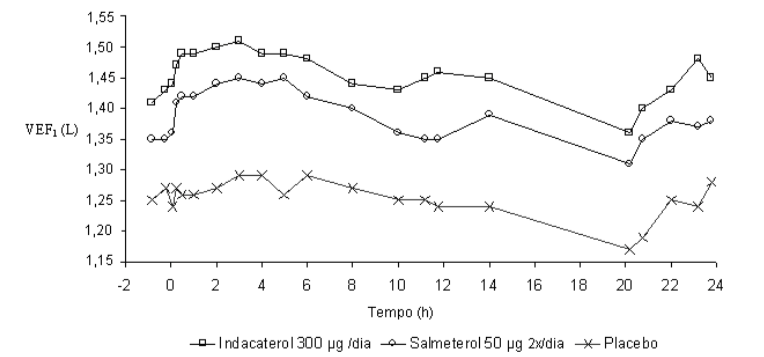
Neste estudo, medidas espirométricas sequenciais de 12-horas foram realizadas em um subgrupo de pacientes durante as horas diurnas (12 horas). Os valores de VEF1 sequenciais de 12 horas do Dia 1 e os valores de VEF1 no nadir, do Dia 2 são mostrados na Figura 1, e do Dia 182/183 na Figura 2, respectivamente. A melhora na função pulmonar perdurou 24 horas após a primeira dose e foi mantida, consistentemente, pelo período de tratamento de 26 semanas sem qualquer evidência de tolerância.
Figura 1 A menor média quadrática de VEF1 sequenciada durante 12 horas no Dia 1 e VEF1 no nadir, no Dia 2 (subconjunto por intenção de tratamento com 12 horas de espirometria sequencial)
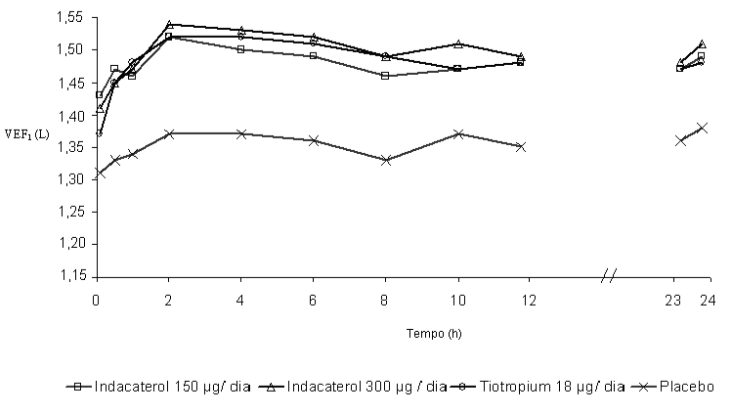
Figura 2 A menor média quadrática de VEF1 sequenciada durante 12 horas no Dia 182 e de VEF1 no nadir, no Dia 183 (subconjunto por intenção de tratamento com 12 horas de espirometria sequencial)
Em uma extensão de segurança deste estudo de 26 semanas, placebo-controlado em 414 pacientes, a eficácia não foi o primeiro ponto de avaliação, entretanto no segundo ponto de avaliação (Semana 52) de VEF1 no nadir, o tratamento tanto com Maleato de Indacaterol (substância ativa) 150 mcg como com 300 mcg uma vez ao dia resultou num valor de VEF1 no nadir significativamente maior comparado ao placebo (0,17 L, p < 0,001 e 0,18 L, p < 0,001, respectivamente).
Os resultados de um estudo de 12 semanas, placebo-controlado com 416 pacientes que avaliou a dose de 150 mcg uma vez ao dia, foram similares aos resultados do estudo de 26 semanas para esta dose. A melhora média do pico de VEF1, em relação ao nível basal, foi de 0,23 L após um dia de tratamento uma vez ao dia. No primeiro parâmetro de avaliação (Semana 12), o tratamento com Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia resultou em um valor de VEF1 no nadir, significativamente maior quando comparado com placebo (0,13 L, p < 0,001).
Em um estudo de 26 semanas, placebo e ativo-(salmeterol cego) controlado em 1.002 pacientes, os quais avaliaram Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia, a melhora média de VEF1, em relação ao basal, nos 5 minutos foi 0,11 L com uma melhora no pico de 0,25 L em relação ao basal após a primeira dose (Dia 1). No primeiro ponto de avaliação (Semana 12), o tratamento com Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia mostrou um valor de VEF1 no nadir significativamente maior comparado tanto ao placebo (0,17 L, p < 0,001) quanto ao salmeterol (0,06 L, p < 0,001).
Em um estudo de 52 semanas, controlado com placebo e ativo (formoterol), com 1.732 pacientes, que avaliou a dose de Maleato de Indacaterol (substância ativa) 300 mcg uma vez ao dia e uma dose maior, a melhora média de VEF1, em relação ao nível basal, em 5 minutos, foram 0,14 L com uma melhora no pico de 0,20 L em relação ao nível basal após a primeira dose (Dia 1). No primeiro parâmetro de avaliação (Semana 12), o tratamento com Maleato de Indacaterol (substância ativa) 300 mcg uma vez ao dia resultou em um valor de VEF1 no nadir, significativamente maior quando comparado ao placebo (0,17 L, p < 0,001) e ao formoterol (0,1 L, p < 0,001). Esta melhora na função pulmonar foi mantida durante o tratamento de 52 semanas, sem nenhuma evidência de perda de eficácia durante este período. Maleato de Indacaterol (substância ativa) foi superior ao formoterol em relação ao VEF1 no nadir, em todas as avaliações.
Em um estudo cruzado de 2 semanas, controlado com placebo e ativo (salmeterol open-label), a espirometria por 24 horas foi avaliada em 68 pacientes. Os valores espirométricos sequenciais durante 24 horas são demonstradas na Figura 3. Após 14 dias de tratamento uma vez ao dia, a melhora na função pulmonar quando comparada ao placebo foi mantida por 24 horas, além disso, o valor de VEF1 no nadir foi significativa e estatisticamente maior quando comparado ao salmeterol (0,09 L, p = 0,011). Resultados similares da espirometria sequencial de 24 horas foram observados após 26 semanas em um subgrupo de pacientes (n = 236) do estudo de 26 semanas. Ambos os estudos embasam ainda a melhora de VEF1 em relação ao placebo com a administração de Maleato de Indacaterol (substância ativa) uma vez ao dia, e que a broncodilatação foi mantida durante o intervalo da dose de 24 horas, em comparação ao placebo.
Figura 3 Perfil de 24h da menor média quadrática de VEF1 (L) após 14 dias de tratamento (população por intenção de tratamento modificada)
Os seguintes resultados de impacto na qualidade de vida foram demonstrados nos estudos de longa duração de 12, 26 e 52 semanas de tratamento:
Maleato de Indacaterol (substância ativa) melhorou significativamente a dispneia quando comparado com o nível basal nos estudo de 26 semanas (avaliado usando o Transitional Dyspnea Index, TDI) para a primeira avaliação (dia 29), e este foi mantido por todas as 26 semanas nos tratamento de 150 mcg e 300 mcg uma vez ao dia quando comparado com o placebo. Maleato de Indacaterol (substância ativa) 300 mcg uma vez ao dia foi também estatisticamente superior ao tiotrópio open-label em todos os intervalos de tempo (p ? 0,01). A proporção de pacientes que alcançaram a pontuação ? 1,0 (correspondendo a uma diferença clinicamente importante) na pontuação focal de TDI foi significativamente maior no grupo de indacaterol em todos os 4 momentos de avaliação comparados ao grupo placebo (p ? 0,001). Na semana 26, as proporções foram 62,4% e 70,8% com Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia e 300 mcg uma vez ao dia, respectivamente, comparados a 57,3% e 46,6% com tiotrópio e com placebo, respectivamente. No estudo de 26 semanas, placebo e ativo-(salmeterol cego) controlado, Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia também melhorou significativamente a dispneia durante todo o período de tratamento da semana 26. A proporção de pacientes que atingiram um valor focal de TDI ? 1,0 (correspondendo a uma diferença clinicamente importante) foi significativamente maior no grupo de indacaterol em todos os quatro pontos de avaliação (Dia 29, Dia 57, Dia 84 e Dia 182), do que no grupo placebo (p ? 0,005).
Neste estudo, diferenças estatisticamente significativas entre o tratamento ativo e o placebo foram vistas para a mudança a partir do basal na média do número de puffs de medicação de resgate diários, dia e noite, em determinados intervalos de 4 semanas do período de 26 semanas de tratamento. Os pacientes tratados com Maleato de Indacaterol (substância ativa) necessitaram numericamente de menos puffs de medicação de resgate diários, dia e noite, comparado com os pacientes tratados com salmeterol em determinados intervalos de 4 semanas, mas as diferenças entre os tratamentos ativos não foram significativas estatisticamente. No estudo de 52 semanas, houve uma redução estatisticamente significativa no número de puffs de resgate com agonista beta2-adrenérgicos de curta ação com Maleato de Indacaterol (substância ativa) 300 mcg uma vez ao dia comparado ao formoterol e placebo (1,69; 1,35 e 0,02 menos puffs, respectivamente) [8]. Do mesmo modo, no estudo de 26 semanas, reduções no uso de medicamentos de resgate nos grupos Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia e 300 mcg uma vez ao dia foram estatisticamente significativas quando comparados ao tiotrópio open-label e placebo (1,45 e 1,56 comparados a 0,99 e 0,39 menos puffs, respectivamente). No estudo de 12 semanas (que não teve comparador ativo), um padrão similar foi observado com Maleato de Indacaterol (substância ativa) 150 mcg uma vez ao dia.
Os pacientes tratados com Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg uma vez ao dia tiveram, numericamente, menor risco de exacerbação da DPOC comparados ao grupo placebo em estudos de longa duração de 12, 26 e 52 semanas de tratamento. Quando comparados ao placebo, o tempo até a primeira exacerbação da DPOC foi significativamente maior no estudo de 26 semanas sob tratamento com 150 mcg uma vez ao dia e no estudo de 52 semanas sob tratamento com 300 mcg uma vez ao dia (p = 0,019 e p = 0,03, respectivamente). Análises conjuntas mostraram que os pacientes tratados com Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg uma vez ao dia tiveram, estatisticamente, riscos menores de exacerbação da DPOC comparado ao placebo em ambas as amostragens populacionais de 6 meses e 12 meses.
O tempo até a primeira exacerbação da DPOC, comparado ao placebo, foi significativamente maior na população de 6 meses sob o tratamento de doses de 150 mcg e 300 mcg uma vez ao dia (p = 0,005 e p = 0,006, respectivamente) e na população de 12 meses sob o tratamento de 300 mcg uma vez ao dia (p = 0,022). Análises conjuntas de eficácia de 6 e 12 meses de tratamento demostraram que a taxa de exacerbação de DPOC foi estatística e significativamente menor que a taxa do placebo. Comparações de tratamento de 6 meses em relação ao placebo mostraram uma razão da taxa de 0,70 (IC de 95%; p-value 0,014) e 0,74 (IC de 95%; p-value 0,024) para Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg, respectivamente e para 12 meses, a razão da taxa foi 0,78 (IC de 95%; p-value 0,034) para o tratamento com 300 mcg uma vez ao dia.
Maleato de Indacaterol (substância ativa) também melhorou significativamente a saúde relacionada à qualidade de vida (medida pelo Questionário Respiratório de Saint George – SGRQ: St. George ?s Respiratory Questionnaire) em estudos de longa duração de 12, 26 e 52 semanas de tratamento.
Ambas as doses de 150 mcg e 300 mcg uma vez ao dia demonstraram uma redução média da pontuação total significativa no SGRQ (melhora), bem como em cada componente da pontuação, em comparação ao placebo: uma melhora comparada ao placebo, excedendo a diferença mínima clinicamente importante de 4 unidades, foi mostrada nas semanas 8 e 12 no estudo de 12 semanas e no estudo de 52 semanas, foi demonstrada para o tratamento com 300 mcg uma vez ao dia nas semanas 8, 24, 44 e 52. No estudo de 26 semanas, os pacientes tratados com 150 mcg uma vez ao dia tiveram redução significativa da pontuação média total no SGRQ comparado ao tiotrópio (p ? 0,05) e no final da extensão deste estudo de segurança placebo-controlado de 26 semanas, a principal mudança na pontuação total no SGRQ foi uma redução (melhora) de 3,2 unidades para Maleato de Indacaterol (substância ativa) 150 mcg versus placebo após 52 semanas de tratamento. Em outro estudo de 26 semanas, o tratamento tanto com Maleato de Indacaterol (substância ativa) 150 mcg quanto com salmeterol resultou em uma redução significativa da pontuação média total no SGRQ comparado com placebo com diferenças médias de 6,3 unidades (p < 0,001) e 4,2 unidades (p < 0,001), respectivamente, excedendo a diferença mínima clinicamente importante de 4 unidades após 12 semanas e, portanto, também foram clinicamente relevantes. Maleato de Indacaterol (substância ativa) também alcançou superioridade estatística sobre o salmeterol em 2,1 unidades (p = 0,033).
O tratamento com Maleato de Indacaterol (substância ativa) 150 mcg e 300 mcg uma vez ao dia durante 26 semanas melhorou significativamente a porcentagem de dias sem sintomas (p < 0,02) e a porcentagem de dias que os pacientes foram capazes de realizar suas atividades normais diárias quando comparado ao placebo (p < 0,001).
Características Farmacológicas
Mecanismo de ação
O indacaterol é um agonista beta2-adrenérgico de “ultra” longa duração para administração uma vez ao dia. Os efeitos farmacológicos dos agonistas beta2-adrenérgicos, incluindo indacaterol, são pelo menos em parte atribuídos ao estímulo da adenilciclase intracelular, a enzima que catalisa a conversão do trifosfato de adenosina (ATP) para 3, 5-monofosfato cíclico de adenosina (monofosfato cíclico). O aumento dos níveis de AMP cíclico causou o relaxamento do músculo liso brônquico. Os estudos in vitro mostraram que o indacaterol tem atividade agonista nos receptores beta2 24 vezes maior que nos receptores beta1 e 20 vezes maior que nos receptores beta3. Este perfil seletivo é similar ao do formoterol.
Quando inalado, o indacaterol age localmente nos pulmões como um broncodilatador. O indacaterol é um agonista quase completo dos receptores humanos beta2-adrenérgicos com potência nanomolar. Em brônquios humanos isolados, o indacaterol tem um rápido início de ação e de longa duração.
Embora os receptores beta2-adrenérgicos sejam os predominantes no músculo liso brônquico e os receptores beta1-adrenérgicos sejam os predominantes no coração humano, há também receptores beta2-adrenérgicos no coração humano que correspondem de 10% a 50% do total dos receptores adrenérgicos. A função exata dos receptores beta2- adrenérgicos no coração é desconhecida, mas sua presença aumenta a possibilidade de, até mesmo os agonistas beta2- adrenérgicos altamente seletivos, apresentarem efeitos cardíacos.
Propriedades Farmacodinâmicas
Efeitos farmacodinâmicos primários
Maleato de Indacaterol (substância ativa) proporcionou melhoras significativas e consistentes na função pulmonar (conforme medido pelo volume expiratório forçado em um segundo, VEF1) durante 24 horas em vários estudos clínicos farmacodinâmicos e de eficácia. Maleato de Indacaterol (substância ativa) teve um rápido início de ação, dentro de 5 minutos após a inalação, comparável ao efeito do beta2-agonista de ação rápida salbutamol, com efeito de pico ocorrendo entre 2-4 horas após a dose. Não houve evidência de taquifilaxia no efeito broncodilatador após doses repetidas por até 52 semanas. O efeito broncodilatador não dependeu do horário da dose inalada (pela manhã ou à noite).
Maleato de Indacaterol (substância ativa) reduziu tanto a hiperinsuflação dinâmica quanto a estática em pacientes com DPOC moderada a grave. A capacidade inspiratória durante o exercício constante, submáximo aumentou em 317 mL comparada ao placebo após administração de 300 mcg uma vez ao dia durante 14 dias. Foi também demonstrado um aumento estatisticamente significativo na capacidade inspiratória no repouso, na resistência ao exercício e no VEF1 bem como uma melhora significativa dos parâmetros de dispneia.
Efeitos farmacodinâmicos secundários
O efeito adverso característico dos agonistas beta2-adrenérgicos inalatórios decorrem da ativação dos receptores beta-adrenérgicos sistêmicos.
Os mais comuns efeitos adversos incluem tremor músculo esquelético e câimbras, insônia, taquicardia, redução do potássio sérico e aumento da glicose plasmática.
Efeitos na eletrofisiologia cardíaca
O efeito de Maleato de Indacaterol (substância ativa) no intervalo QT foi avaliado em um estudo duplo-cego, placebo- e ativo (moxifloxacino)- controlado, após doses múltiplas de indacaterol 150 mcg, 300 mcg ou 600 mcg uma vez ao dia por duas semanas em 404 voluntários sadios. O método de Fridericia para a correção da frequência cardíaca foi empregado para derivar o intervalo QT corrigido (QTcF). O prolongamento máximo médio do intervalo de QTcF foi < 5 ms, e o limite superior do intervalo de confiança de 90% foi abaixo de 10 ms para todas as comparações de combinações de tempo versus placebo. Isso mostra que não há preocupações quanto ao potencial pró-arrítmico relacionado ao prolongamento do intervalo QT nas doses terapêuticas recomendadas. Não houve evidência de relação entre a concentração e o delta QTc na faixa das doses avaliadas.
Monitoramento de eletrocardiograma em pacientes com DPOC
O efeito de Maleato de Indacaterol (substância ativa) na frequência e no ritmo cardíaco foi avaliado usando um gravador ECG contínuo de 24 horas (monitoramento Holter) num subconjunto de 605 pacientes com DPOC de um estudo de Fase III de 26 semanas, duplo- cego, placebo-controlado. O monitoramento Holter ocorreu uma vez no período basal e até 3 vezes durante o período de tratamento de 26 semanas (nas semanas 2, 12 e 26).
A comparação da frequência cardíaca média durante 24 horas não mostrou aumento em relação ao nível basal para ambas as doses avaliadas, 150 mcg uma vez ao dia e 300 mcg uma vez ao dia. A análise da frequência cardíaca por hora foi similar para ambas as doses quando comparada ao placebo e ao tiotrópio. O padrão da variação diurna durante 24 horas foi mantido e foi similar ao placebo.
Em relação ao placebo ou tiotrópio, não houve diferença na taxa de fibrilação atrial, no tempo gasto na fibrilação atrial e nem na frequência ventricular máxima da fibrilação atrial.
Não se observou durante as visitas, nenhum padrão claro nas taxas de ocorrência de batimentos cardíacos ectópicos únicos, duplos ou aumento da frequencia cardíaca.
Como o compilado dos dados das frequências dos batimentos ectópicos ventriculares pode ser difícil de interpretar, foram analisados critérios pró-arrítmicos específicos. Nesta análise, a ocorrência basal dos batimentos ectópicos ventriculares foi comparada à mudança em relação ao nível basal, determinando certos parâmetros para a mudança que descreve a resposta pró-arrítmica. O número de pacientes com resposta pró-arrítmica documentada foi muito similar dentre ambas as doses de indacaterol quando comparado ao placebo e ao tiotrópio.
Em resumo, não houve diferença clinicamente relevante no desenvolvimento de eventos arrítmicos nos pacientes que receberam o tratamento com indacaterol, comparados àqueles que receberam placebo ou tratamento com tiotrópio.
Efeitos no potássio sérico e na glicose plasmática
Alterações no potássio sérico e na glicose plasmática foram avaliadas em um estudo de Fase III, duplo-cego, placebo- controlado. Uma hora após a dose na semana 12, alterações desprezíveis foram observadas no potássio sérico variando de 0,03 a 0,05 mmol/L e na glicose plasmática média variando de 0,25 a 0,31 mmol/L quando comparados com o placebo.
Farmacocinética
Absorção
O tempo médio para alcançar as concentrações do pico sérico do indacaterol foi aproximadamente 15 minutos após inalação de doses únicas ou repetidas. A exposição sistêmica ao indacaterol aumentou com o aumento da dose (150 mcg a 600 mcg) de maneira proporcional à dose. A biodisponibilidade absoluta de indacaterol após uma inalação foi em média de 43 a 45%. A exposição sistêmica resulta de uma composição da absorção pulmonar e intestinal.
A concentração sérica de indacaterol aumentou com a administração de doses repetidas uma vez ao dia. O estado de equilíbrio foi atingido dentro de 12 a 15 dias. A razão do acúmulo médio de indacaterol, isto é, a ASC durante o intervalo de dose de 24 horas no Dia 14 ou Dia 15 comparado ao Dia 1, foi de 2,9 a 3,8 para as doses entre 75 mcg e 600 mcg inaladas uma vez ao dia.
Distribuição
Após infusão intravenosa, o volume de distribuição (Vz) de indacaterol foi de 2,361 L a 2,557 L indicando uma distribuição extensa. In vitro, a ligação às proteínas do soro e do plasma humanos foi de 94,1 a 95,3% e 95,1 a 96,2%, respectivamente.
Biotransformação/metabolismo
Após administração oral de indacaterol marcado radioativamente em um estudo ADME (absorção, distribuição, metabolismo e excreção) em humanos, o indacaterol inalterado foi o principal componente no soro, responsável por aproximadamente um terço da ASC total relacionado ao medicamento, durante 24 horas. Um derivado hidroxilado foi o metabólito mais proeminente no soro. Um O-glucoronídio fenólico de indacaterol e o indacaterol hidroxilado foram os outros metabólitos proeminentes. Um diástero isômero do derivado hidroxilado, um N-glucoronídeo de indacaterol e os produtos C- e N-dialquilados foram os outros metabólitos identificados.
As investigações in vitro indicaram que a UGT1A1 é a única isoforma da UGT que metabolizou o indacaterol para O- glucoronídeo fenólico. Os metabólitos oxidativos foram encontrados em incubações com os CYP1A1, CYP2D6 e CYP3A4 recombinantes.
Concluiu-se que a CYP3A4 foi a isoenzima predominante responsável pela hidroxilação do indacaterol. As investigações in vitro indicaram também que o indacaterol é um substrato de baixa afinidade para a bomba de fluxo de P-gp.
Eliminação
Nos estudos clínicos que incluíram coleta de urina, a quantidade de indacaterol inalterado excretada pela urina foi geralmente menor que 2% da dose. O clearance (depuração) renal de indacaterol foi, em média, entre 0,46 e 1,20 L/h. Quando comparado ao clearance (depuração) sérico de indacaterol de 18,8 a 23,3 L/h, é evidente que o clearance (depuração) renal tem um papel menor (aproximadamente 2 a 6% do clearance - depuração - sistêmico) na eliminação do indacaterol disponível sistemicamente.
Em um estudo humano ADME, no qual o indacaterol foi administrado oralmente, a via fecal de excreção foi dominante sobre a via urinária. O indacaterol foi excretado nas fezes humanas principalmente como fármaco inalterado (54% da dose) e, de uma forma menor, os metabólitos hidroxilados do indacaterol (23% da dose). A contabilização foi completa com ? 90% da dose recuperada nas excreções.
As concentrações séricas de indacaterol decaíram de uma maneira multifásica com uma meia-vida média terminal entre 45,5 a 126 horas. A meia-vida efetiva, calculada a partir da acumulação do indacaterol após doses repetidas foi de 40 a 56 horas, que são consistentes com o tempo do estado de equilíbrio observado aproximadamente de 12 a 15 dias.
População especial
Uma análise populacional do efeito da idade, sexo e peso na exposição sistêmica em pacientes com DPOC após inalação indicou que Maleato de Indacaterol (substância ativa) pode ser usado seguramente em todos os grupos de idade e de peso e independente do sexo. Não foi sugerida qualquer diferença entre subgrupos étnicos nesta população. Experiências de tratamento limitadas estão disponíveis na população negra.
A farmacocinética de indacaterol foi investigada em dois genótipos UGT1A1 diferentes – o genótipo [(TA)6, (TA)6] completamente funcional e o genótipo [(TA)7, (TA)7] de baixa atividade (síndrome de Gilbert genotípica). O estudo demonstrou que os estados de equilíbrio de ASC e Cmáx do indacaterol foram 1,2 vezes maior no genótipo [(TA)7, (TA)7], indicando que a exposição sistêmica do indacaterol é afetado de forma insignificante apenas por esta variação do genótipo UGT1A1.
Os pacientes com disfunção hepática leve a moderada não apresentaram mudança relevante no Cmáx ou ASC do indacaterol, bem como nenhuma diferença na ligação proteica entre os pacientes com disfunção hepática leve e moderada e seus controles saudáveis. Estudos em pacientes com disfunção hepática grave não foram realizados.
Devido à baixa contribuição da via urinária na eliminação corpórea total, não foi realizado um estudo em pacientes com deficiência renal.
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram risco especial para humanos baseado nos estudos convencionais de segurança farmacológica, toxicidade de dose repetida, genotoxicidade, potencial carcinogênico e toxicidade na reprodução. Os efeitos do indacaterol observados nos estudos de toxicidade em cães ocorreram principalmente no sistema cardiovascular e foram constituídos por taquicardia, arritmias e lesões miocárdicas.
Estes são efeitos farmacológicos conhecidos e poderiam ser explicados pelas propriedades beta2-agonistas do indacaterol. Outros efeitos relevantes notados em estudos de toxicidade de dose repetida foram leve irritação do trato respiratório superior em ratos, compatível com rinite e alterações epiteliais da cavidade nasal e laringe. Todos estes achados foram observados apenas com exposições consideradas suficientemente superiores em relação à exposição máxima humana indicando pequena relevância para o uso clínico.
Os efeitos adversos em relação à fertilidade, gravidez, desenvolvimento embrionário/fetal, desenvolvimento pré e pós- natal só puderam ser demonstrados em doses 195 vezes maiores que a dose inalatória máxima recomendada diariamente de 300 mcg em humanos (em uma base de mg/m2). Esses efeitos, especificamente o aumento da incidência de uma variação esquelética, foram observados em coelhos. O indacaterol não foi teratogênico em ratos e coelhos após administração subcutânea. Os estudos de genotoxicidade não revelaram nenhum potencial mutagênico ou clastogênico. O potencial carcinogênico de indacaterol foi avaliado em um estudo de inalação de 2 anos em ratos e um estudo oral de 26 semanas em camundongos transgênicos. O tratamento vitalício de ratos resultou num aumento da incidência de leiomioma ovariano benigno e hiperplasia focal dos músculos lisos ovarianos em fêmeas, nas doses aproximadamente 68 vezes maiores que a dose máxima recomendada de 300 mcg uma vez ao dia para humanos (em uma base de mg/m2).
Os aumentos em leiomiomas do trato genital de ratas foram similarmente demonstrados com outros medicamentos agonistas beta2-adrenérgicos. Um estudo oral de 26 semanas (por sonda) em camundongos CB6F1/TgrasH2 hemizigóticos com indacaterol não mostrou nenhuma evidência de tumorigenicidade nas doses de aproximadamente 9.800 vezes maiores que a dose máxima recomendada de 300 mcg uma vez ao dia para humanos (em uma base de mg/m2).
Embora o indacaterol não tenha afetado a capacidade reprodutiva geral em um estudo de fertilidade com ratos, verificou-se uma diminuição do número de gravidezes na geração F1 em estudo de pré e pós-desenvolvimento em ratos, com uma exposição 14 vezes superior à de humanos tratados com Maleato de Indacaterol (substância ativa).
Cuidados de Armazenamento
Não use após a data de validade impressa na caixa.Conservar o produto em temperatura ambiente (entre 15 e 30°C) e proteger da umidade.
Mantenha o produto na embalagem original.
Armazene em um lugar seco, protegido do calor e da umidade.
Mantenha o produto fora do alcance e da visão das crianças. ?Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
?Aspectos físicos
- ?- Onbrize 150 mcg – código do produto (IDL 150) e logo da empresa impressos em preto sobre a cápsula transparente e incolor.?
- Onbrize 300 mcg – código do produto (IDL 300) e logo da empresa impressos em azul sob a cápsula transparente e incolor.
?Antes de usar, observe o aspecto do medicamento.
Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo. ?
Mensagens de Alerta
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use este medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde. ?
Dizeres Legais
MS – 1.0068.1073
?Farm. Resp.: Flavia Regina Pegorer - CRF-SP 18.150 ?
Importado por:
Novartis Biociências S.A.?
Av. Professor Vicente Rao, 90 ?São Paulo – SP?
CNPJ: 56.994.502/0001-30
Indústria Brasileira ?
Fabricado por:
Novartis Pharma Stein AG, Stein, Suíça ?
Embalado por:
Novartis Farmacéutica S.A., Barberà Del Vallès