Comparamos o preço de Pristiq - 100Mg 28 Comprimidos, veja o menor preço

R$ 221,52
RReferência
9
ofertasMelhores preços a partir de R$ 218,78 até R$ 252,32
Oferta patrocinada
vendido por Drogarias Pacheco
economize
12.21%
R$ 221,52
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Oferta patrocinada
vendido por Drogaria São Paulo
economize
12.21%
R$ 221,52
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Preço Popular
economize
13.29%
R$ 218,78
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Pague Menos
economize
11.23%
R$ 223,99
vendido por Drogão Net
economize
9.82%
R$ 227,53
vendido por Panvel Farmácias
economize
9.58%
R$ 228,16
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farmácia Online Farmagora
economize
8.89%
R$ 229,90
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Drogaria Catarinense
economize
5.84%
R$ 237,59
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Promofarma
R$ 252,32
Para que serve
Pristiq (succinato de desvenlafaxina monoidratado) é indicado para tratamento do transtorno depressivo maior (TDM, estado de profunda e persistente infelicidade ou tristeza acompanhado de uma perda completa do interesse pelas atividades diárias normais).
Como Pristiq funciona?
O princípio ativo de Pristiq age aumentando a disponibilidade de dois neurotransmissores (serotonina e noradrenalina, substâncias encontradas no cérebro). A falta desta substância pode causar a depressão.
O uso de Pristiq ajuda a corrigir o desequilíbrio químico da serotonina e da noradrenalina no cérebro que é a causa bioquímica da depressão.
O tempo estimado para o início da ação do medicamento é de até 7 dias.
Contraindicação
Pristiq não deve ser usado em caso de hipersensibilidade (alergia) ao succinato de desvenlafaxina monoidratado, ao cloridrato de venlafaxina ou a qualquer componente da fórmula.
Pristiq não deve ser utilizado simultaneamente com inibidores da monoaminoxidase (outra classe de antidepressivo) e outros medicamentos que contenham venlafaxina e/ou desvenlafaxina.
Se você estiver usando um inibidor da monoaminoxidase o intervalo recomendado entre a suspensão desta classe de medicação e a introdução deve ser de pelo menos 14 dias.
Este medicamento é contraindicado para uso por população pediátrica.
Como usar
Pristiq deve ser usado apenas por via oral. Engula inteiro o comprimido de Pristiq, diretamente com um pouco de líquido.
Tome sempre o medicamento exatamente como orientado por seu médico. Só o médico deve definir a duração do tratamento.
Posologia
A dose recomendada de Pristiq é de 50 mg uma vez por dia, com ou sem alimentos.
Para alguns pacientes o médico pode indicar aumento gradativo da dosagem, o que deve acontecer em intervalos de 7 dias. A dose máxima não pode ser maior do que 200 mg/dia.
Pacientes com Insuficiência Renal (prejuízo na função dos rins):
A dose inicial recomendada em pacientes com insuficiência renal grave ou doença renal em estágio terminal (DRET) é de 50 mg em dias alternados.
Pacientes com Insuficiência Hepática (prejuízo na função do fígado):
O uso de doses acima de 100 mg/dia não é recomendado.
Pacientes Idosos:
Não é necessário ajuste de dose exclusivamente com base na idade.
Descontinuação de Pristiq:
Recomenda-se que seja feita gradativamente, sempre sob orientação médica. A interrupção repentina deve ser evitada sempre que possível, pois pode ser acompanhada de: alteração do humor para a euforia ou tristeza, irritabilidade, agitação, tontura, ansiedade, confusão, dores de cabeça, letargia (sensação de lentidão), labilidade emocional (falta de controle das emoções), insônia, tinido (escuta de um chiado inexistente) e convulsões.
Embora esses eventos sejam, geralmente, autolimitados, houve relatos de sintomas sérios de descontinuação.
Este medicamento não deve ser partido, aberto ou mastigado.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Pristiq?
O esquecimento da dose pode comprometer a eficácia do tratamento.
Tome-o assim que lembrar se já estiver perto do horário de tomar a próxima dose, pule a dose esquecida e tome a próxima, continuando esquema conforme recomendado pelo seu médico.
Não tome o medicamento 2 vezes para compensar doses esquecidas.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Pristiq deve ser usado com cautela em pacientes:
- Com história prévia ou familiar de mania ou hipomania (estado de humor alterado onde há reações de euforia desproporcionais aos acontecimentos);
- Portadores de glaucoma de ângulo fechado (aumento da pressão dentro do olho);
- Portadores de hipertensão arterial prévia (aumento da pressão arterial) a quem se recomenda monitorização frequente;
- Predispostos a sangramentos (por exemplo, os que usam medicações para inibir a agregação das plaquetas – células sanguíneas responsáveis pelo início da coagulação – como o ácido acetilsalicílico e/ou aqueles que usam medicação anticoagulante, como a varfarina).
Os antidepressivos podem (geralmente no início do tratamento e nas alterações de dosagem) levar a alteração do comportamento, piora da depressão e ideação suicida. É importante que você, paciente, e seus familiares fiquem alertas para o aparecimento de ansiedade, agitação, insônia, irritabilidade, hostilidade, impulsividade, acatisia (agitação psicomotora, ou seja, dos pensamentos e movimentos), mania, hipomania (exacerbação do humor, euforia) e qualquer outra alteração do comportamento.
No caso do aparecimento desses sintomas o médico deve ser imediatamente consultado.
Pristiq pode induzir o aparecimento de hipertensão arterial em paciente sem história anterior, recomenda-se a monitorização constante da pressão arterial durante o tratamento.
Em alguns estudos observou-se o aumento da quantidade de colesterol no sangue, também é recomendada a realização de exames periódicos para acompanhar os níveis do colesterol no sangue. Pacientes com angina instável não foram avaliados.
Grávidez e Lactação
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgiãodentista.
Não há estudos que garantam a segurança do feto à exposição a esta medicação.
Ele só deve ser indicado se os benefícios superarem este risco. Portanto, durante toda a gravidez e o parto, este medicamento não deve ser utilizado sem orientação médica ou do cirurgião-dentista; informe-os em caso de gravidez.
Se você está amamentando ou pretende amamentar, não é recomendado usar Pristiq, já que ele é excretado pelo leite e a segurança deste medicamento para as mulheres e crianças não é conhecida.
Capacidade de dirigir e operar máquinas
Pristiq pode prejudicar o julgamento, o raciocínio ou as habilidades motoras. Até que você saiba como Pristiq te afeta, tenha cuidado ao realizar atividades que requeiram concentração, tais como dirigir ou operar máquinas.
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Sempre avise ao seu médico todas as medicações que você toma quando ele for prescrever uma medicação nova.
Interação medicamentosa
O médico precisa avaliar se as medicações reagem entre si alterando a sua ação, ou da outra; isso se chama interação medicamentosa.
O uso concomitante (no mesmo período de tempo) de Pristiq com medicamentos que aumentam a predisposição ao sangramento (veja no primeiro parágrafo) pode aumentar o risco de sangramentos espontâneos.
O uso de Pristiq com outros medicamentos que podem aumentar a quantidade de serotonina no organismo (outros antidepressivos, antipsicóticos, anfetaminas, antagonistas da dopamina e anestésicos de uso hospitalar) pode aumentar o risco de aparecimento da Síndrome Serotoninérgica (reação do corpo ao excesso de serotonina que cursa com inquietação, alteração do comportamento, rigidez muscular, aumento da temperatura, aumento da velocidade dos reflexos e tremores; que pode ser fatal).
Pristiq age no sistema nervoso central, portanto, não é recomendado seu uso concomitante (ao mesmo tempo) ao álcool.
O uso de Pristiq pode alterar o resultado de alguns exames laboratoriais como o de urina para fenciclidina e anfetamina, de transaminases séricas (enzimas do fígado), lipídios e proteinúria (proteína aumentada na urina/eliminação de proteínas pela urina).
Este medicamento pode causar doping.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Reação Muito Comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
- Insônia;
- Dor de cabeça;
- Tontura;
- Sonolência;
- Náusea;
- Boca seca;
- Hiper-hidrose (suor excessivo).
Reação Comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Redução do apetite;
- Síndrome de abstinência;
- Ansiedade;
- Nervosismo;
- Sonhos anormais;
- Irritabilidade;
- Redução da libido;
- Anorgasmia (falta de prazer sexual ou orgasmo);
- Tremor;
- Parestesia (dormência e formigamento);
- Distúrbios de atenção;
- Disgeusia (alteração do paladar);
- Visão borrada;
- Midríase (pupila dilatada);
- Vertigem (tontura);
- Tinido (zumbido no ouvido);
- Taquicardia (aceleração dos batimentos cardíacos);
- Palpitação;
- Aumento da pressão sanguínea;
- Fogachos;
- Bocejos;
- Constipação;
- Diarreia;
- Vômitos;
- Rash;
- Rigidez musculoesquelética;
- Disfunção erétil;
- Ejaculação tardia;
- Fadiga;
- Astenia (fraqueza);
- Calafrios;
- Sensação de nervosismo;
- Teste de função anormal do fígado;
- Aumento de peso;
- Redução de peso.
Reação Incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Hipersensibilidade (alergia);
- Despersonalização;
- Orgasmo anormal;
- Síncope (desmaio);
- Discinesia (movimentos involuntários, principalmente dos músculos da boca, língua e face, ocorrendo exteriorização da língua e movimentos de um canto a outro da boca);
- Hipotensão ortostática (diminuição da pressão arterial ao levantar);
- Extremidades frias;
- Epistaxe (sangramento nasal);
- Alopecia (perda de cabelo);
- Retenção urinária;
- Hesitação urinária;
- Proteinúria (proteína aumentada na urina / eliminação de proteínas pela urina);
- Distúrbio de ejaculação;
- Falha na ejaculação;
- Disfunção sexual;
- Aumento do colesterol sanguíneo;
- Aumento do triglicéride sanguíneo;
- Aumento da prolactina sanguínea.
Reação Rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Hiponatremia (redução da concentração de sódio no sangue);
- Mania;
- Hipomania;
- Alucinação;
- Síndrome serotoninérgica (alterações do estado mental, dos movimentos entre outras);
- Convulsão;
- Distonia (contração involuntária da musculatura, lenta e repetitiva);
- Síndrome de Stevens-Johnson (reação alérgica grave com bolhas na pele e mucosas);
- Angioedema (inchaço das partes mais profundas da pele ou da mucosa, geralmente de origem alérgica);
- Reação de fotossensibilidade (sensibilidade exagerada da pele à luz).
Após a ingestão de Pristiq, você pode encontrar restos de substâncias inertes (sem efeito) do comprimido em suas fezes. Isso não afeta a eficácia do produto uma vez que o ingrediente ativo de Pristiq já foi previamente absorvido.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe também à empresa através do seu serviço de atendimento.
Composição
Cada comprimido de Pristiq 50 mg contém:
75,87 mg de succinato de desvenlafaxina monoidratado equivalente a 50 mg de desvenlafaxina.
Cada comprimido de Pristiq 100 mg contém:
151,77 mg de succinato de desvenlafaxina monoidratado equivalente a 100 mg de desvenlafaxina.
Excipientes: hipromelose; celulose microcristalina; talco; estearato de magnésio; Opadry contendo álcool polivinílico, dióxido de titânio, macrogol, talco, óxido de ferro vermelho, óxido de ferro amarelo (apenas Pristiq 50 mg) e corante amarelo FD&C n° 6 (apenas Pristiq 100 mg).
Superdosagem
Se uma grande quantidade de Pristiq for ingerida de uma só vez, o médico deve ser contatado imediatamente.
O tratamento é composto de:
- Manter as vias aéreas livres e a respiração normal;
- Lavagem gástrica através de sonda colocada a partir da boca até o estômago;
- Uso de carvão ativado.
Não se conhece nenhum antídoto (substância que impeça a ação) específico para a desvenlafaxina. A indução de vômitos não é recomendada.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Interação Medicamentosa
Inibidores da monoaminoxidase (IMAOs)
As reações adversas, algumas das quais foram sérias, foram relatadas em pacientes que recentemente descontinuaram um inibidor da monoaminoxidase (incluindo IMAOs reversíveis, como a linezolida e o azul de metileno intravenoso) e iniciaram o tratamento com antidepressivos com propriedades farmacológicas semelhantes às da desvenlafaxina (IRSNs ou ISRSs) ou que recentemente descontinuaram a terapia com IRSN ou ISRS antes do início de um IMAO. O uso concomitante da desvenlafaxina em pacientes tomando inibidores da monoaminoxidase (IMAOs) é contraindicado.
Pelo menos 14 dias devem se passar entre a descontinuação de um IMAO e a introdução da terapia com Succinato de Desvenlafaxina. Além disso, deve haver pelo menos 7 dias de intervalo após a interrupção de Succinato de Desvenlafaxina antes do início de um IMAO.
Agentes Ativos do Sistema Nervoso Central (SNC)
O risco de usar a desvenlafaxina em combinação com outros medicamentos ativos do SNC não foi avaliado sistematicamente. Deve-se ter cautela quando a desvenlafaxina for tomada em associação a outros medicamentos ativos do SNC.
Síndrome Serotoninérgica
Como ocorre com outros agentes serotoninérgicos, a síndrome serotoninérgica, uma condição potencialmente fatal, pode ocorrer com o tratamento com a desvenlafaxina, particularmente com o uso concomitante de outros agentes que podem afetar o sistema neurotransmissor serotonérgico (incluindo triptanos, ISRSs, outros IRSNs, lítio, sibutramina, fentanila e seus análogos, tramadol, dextrometorfano, tapentadol, meperidina, metadona, pentazocina ou erva de São João [Hypericum perforatum]), com medicamentos que prejudicam o metabolismo da serotonina (como os IMAOs, incluindo a linezolida [um antibiótico que é um IMAO não seletivo reversível] e o azul de metileno) ou com precursores da serotonina (como suplementos de triptofano).
Se o tratamento concomitante com a desvenlafaxina e um ISRS, um IRSN ou um agonista do receptor de 5-hidroxitriptamina [triptano] for clinicamente justificado, recomenda-se a observação rigorosa do paciente, especialmente durante o início do tratamento e os aumentos da dose. O uso concomitante da desvenlafaxina com precursores da serotonina (como suplementos de triptofano) não é recomendado.
Drogas que Interferem na Hemostase (por ex., anti-inflamatórios não esteroidais, ácido acetilsalicílico e varfarina)
A liberação de serotonina pelas plaquetas desempenha um importante papel na hemostase. Estudos epidemiológicos de controle de caso e desenho de coorte demostraram uma associação entre o uso de drogas psicotrópicas que interferem na reabsorção de serotonina e a ocorrência de sangramento gastrintestinal superior. Esses estudos demonstraram, ainda, que o uso concomitante de anti-inflamatórios não esteroidais ou ácido acetilsalicílico pode potencializar esse risco de sangramento. Efeitos anticoagulantes alterados, incluindo o aumento de sangramento, foram relatados quando IRSNs e ISRSs são coadministrados com varfarina. Os pacientes recebendo terapia com varfarina devem ser cuidadosamente monitorados quando a terapia com Succinato de Desvenlafaxina é iniciada ou descontinuada.
Etanol
Um estudo clínico demonstrou que a desvenlafaxina não aumenta o comprometimento das habilidades mentais e motoras causadas pelo etanol. No entanto, como ocorre com todos os medicamentos ativos do SNC, os pacientes devem ser aconselhados a evitar o consumo de álcool enquanto estiverem tomando a desvenlafaxina.
Potencial de Outros Medicamentos Afetarem a desvenlafaxina
Inibidores da CYP3A4
A CYP3A4 está minimamente envolvida na eliminação da desvenlafaxina. Em um estudo clínico, o cetoconazol (200 mg, 2x/dia) aumentou a área sob a curva de concentração vs. tempo (AUC) da desvenlafaxina (dose única de 400 mg) em cerca de 43%, uma interação fraca, e a Cmáx em aproximadamente 8%. O uso concomitante da desvenlafaxina com inibidores potentes da CYP3A4 pode resultar em concentrações maiores da desvenlafaxina.
Inibidores de Outras Enzimas CYP
Com base em dados in vitro, não se espera que os medicamentos que inibem as isoenzimas CYP 1A1, 1A2, 2A6, 2D6, 2C8, 2C9, 2C19 e 2E1 tenham impacto significativo sobre o perfil farmacocinético da desvenlafaxina.
Potencial da desvenlafaxina de Afetar Outros Medicamentos
Medicamentos Metabolizados pela CYP2D6
Estudos clínicos demonstram que a desvenlafaxina não tem efeito clinicamente relevante sobre o metabolismo pela CYP2D6 na dose de 100 mg diariamente. Quando o succinato de desvenlafaxina monoidratado foi administrado na dose de 100 mg diariamente em associação a uma dose única de 50 mg de desipramina, um substrato da CYP2D6, a AUC da desipramina aumentou aproximadamente 17%. Quando a dose de 400 mg foi administrada, a AUC da desipramina aumentou aproximadamente 90%. Quando o succinato de desvenlafaxina monoidratado foi administrado na dose de 100 mg diariamente em associação a uma dose única de 60 mg de codeína, um substrato da CYP2D6 metabolizado em morfina, a AUC da morfina diminuiu aproximadamente 8%. O uso concomitante da desvenlafaxina com um medicamento metabolizado pela CYP2D6 pode resultar em concentrações maiores desse medicamento e concentrações menores de seus metabólitos da CYP2D6.
Medicamentos Metabolizados pela CYP3A4
In vitro, a desvenlafaxina não inibe nem induz as isoenzimas CYP3A4. Em um estudo clínico, a desvenlafaxina (400 mg diariamente) diminuiu a AUC do midazolam (dose única de 4 mg), um substrato da CYP3A4, em aproximadamente 31%. Em um segundo estudo, Succinato de Desvenlafaxina 50 mg foi coadministrado diariamente com uma dose única de 4 mg de midazolam. A AUC e Cmáx do midazolam diminuíram em aproximadamente 29% e 14%, respectivamente. O uso concomitante da desvenlafaxina com um medicamento metabolizado pela CYP3A4 pode resultar em exposições menores a esse medicamento.
Medicamentos Metabolizados pela Combinação de CYP2D6 e CYP3A4 (tamoxifeno e aripiprazol)
Estudos clínicos demonstraram que a desvenlafaxina (100 mg diariamente) não tem um efeito clinicamente relevante sobre os medicamentos metabolizados pela combinação das enzimas CYP2D6 e CYP3A4.
Uma dose única de 40 mg de tamoxifeno, que é metabolizado nos metabólitos ativos 4-hidróxi-tamoxifeno e endoxifeno principalmente pela CYP2D6 com contribuições menores para o metabolismo pela CYP3A4, foi administrada em associação com o succinato de desvenlafaxina monoidratado (100 mg diariamente). A AUC aumentou 3% com a administração concomitante do succinato de desvenlafaxina monoidratado. A AUC do 4-hidróxi-tamoxifeno aumentou 9%. A AUC do endoxifeno foi reduzida em 12%.
O succinato de desvenlafaxina monoidratado foi administrado na dose de 100 mg diariamente em associação com uma dose única de 5 mg de aripiprazol, um substrato da CYP2D6 e CYP3A4 metabolizado no metabólito ativo deidro-aripiprazol. A AUC de aripiprazol aumentou 6% com a administração concomitante do succinato de desvenlafaxina monoidratado. A AUC do deidro-aripiprazol aumentou 3% com a administração concomitante.
Medicamentos Metabolizados pela CYP1A2, 2A6, 2C8, 2C9 e 2C19
In vitro, a desvenlafaxina não inibe as isoenzimas CYP1A2, 2A6, 2C8, 2C9 e 2C19 e não seria de se esperar que afetasse a farmacocinética dos medicamentos que são metabolizados por essas isoenzimas do CYP.
Transportador da Glicoproteína P
In vitro, a desvenlafaxina não é substrato nem inibidor do transportador da glicoproteína P.
Interações Medicamentosas com Exames Laboratoriais
Testes de triagem de imunoensaio de urina falso-positivos para fenciclidina (PCP) e anfetamina foram relatados em pacientes que tomam a desvenlafaxina. Isto é devido à falta de especificidade dos testes de triagem. Resultados falso-positivos podem ser esperados por vários dias após a descontinuação da terapia com a desvenlafaxina. Testes confirmatórios, tais como espectrometria de massa / cromatografia gasosa, distinguirão a desvenlafaxina da PCP e anfetamina.
Terapia Eletroconvulsiva
Não há dados clínicos que estabeleçam os riscos e/ou benefícios da terapia eletroconvulsiva combinada ao tratamento do TDM com a desvenlafaxina.
Possíveis Alterações Laboratoriais
Houve relatos incomuns (? 0,1% e < 1%) de aumentos discretos aos níveis das transaminases séricas, alguns dos quais foram clinicamente significativos, sem aumentos concomitantes dos níveis de bilirrubina, em alguns pacientes tratados com Succinato de Desvenlafaxina.
Lipídios
Elevações no colesterol sérico total em jejum, colesterol LDL (lipoproteína de baixa densidade) e triglicérides ocorreram nos estudos controlados. Algumas dessas anormalidades foram consideradas potencial e clinicamente significativas.
A porcentagem de pacientes que excedeu o valor limítrofe pré-determinado consta na Tabela 1.
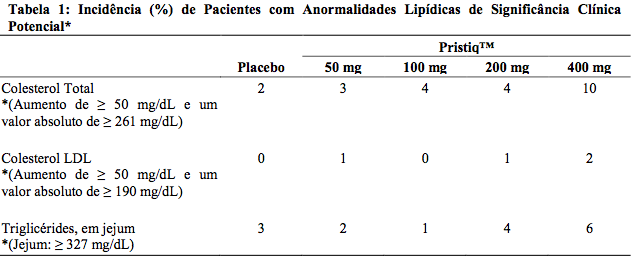
Proteinúria
Proteinúria maior que ou igual a traços foi observada nos estudos controlados de dose fixa (vide Tabela 2). Essa proteinúria não foi associada a aumentos no BUN ou na creatinina e, em geral, foi transitória.

Terapia Eletroconvulsiva
Não há dados clínicos que estabeleçam os riscos e/ou benefícios da terapia eletroconvulsiva combinada ao tratamento do TDM com a desvenlafaxina.
Interação Alimentícia
Não há relatos até o momento.
Ação da Substância
Resultados da eficácia
A eficácia da desvenlafaxina como tratamento da depressão foi estabelecida em quatro estudos de dose fixa, controlados por placebo, duplo-cegos e randomizados de 8 semanas e dois estudos de prevenção de recaídas em pacientes ambulatoriais adultos que atenderam aos critérios de transtorno depressivo maior do Manual Diagnóstico e Estatístico de Transtornos Mentais (DSM-IV). No primeiro estudo, os pacientes receberam 100 mg (n = 114), 200 mg (n = 116) ou 400 mg (n = 113) de desvenlafaxina uma vez por dia ou placebo (n = 118). Em um segundo estudo, os pacientes receberam 200 mg (n = 121) ou 400 mg (n = 124) de desvenlafaxina uma vez por dia ou placebo (n = 124). Em outros dois estudos, os pacientes receberam 50 mg (n = 150 e n = 164) ou 100 mg (n = 147 e n = 158) de desvenlafaxinauma vez por dia ou placebo (n = 150 e n = 161).
A desvenlafaxina mostrou superioridade em relação ao placebo medida pela melhora na pontuação total na Escala de Classificação de Depressão de Hamilton de 17 itens (HAM-D17) em quatro estudos, e com base na Escala de Impressões Clínicas Globais – Melhora (CGI-I) em três dos quatro estudos.
Em um estudo de longo prazo, pacientes ambulatoriais adultos atendendo aos critérios de transtorno depressivo maior do DSM-IV, que responderam a 8 semanas de um tratamento agudo aberto com 50 mg/dia de desvenlafaxina e, subsequentemente, se mantiveram estáveis por 12 semanas com a desvenlafaxina, foram randomizados de maneira duplo-cega para permanecerem no tratamento ativo ou mudarem para placebo por até 26 semanas de observação para recidiva. A resposta durante a fase aberta foi definida como pontuação total na HAM-D17 ? 11 e na CGI-I ? 2 na avaliação do Dia 56; a estabilidade foi definida como não tendo pontuação total na HAM-D17 ? 16 em qualquer visita ao consultório. A recidiva durante a fase duplo-cega foi definida da seguinte maneira:
- Pontuação total na HAM-D17 ? 16 em qualquer visita ao consultório;
- Descontinuação por resposta de eficácia insatisfatória;
- Hospitalização por depressão;
- Tentativa de suicídio;
- Suicídio.
Pacientes que receberam tratamento contínuo de desvenlafaxina apresentaram, estatisticamente, tempo significativamente mais longo para a recidiva quando comparado com placebo. Em 26 semanas, a probabilidade estimada de recidiva de Kaplan-Meier foi 14% com o tratamento com a desvenlafaxina versus 30% com placebo.
Em um segundo estudo de longo prazo, os pacientes ambulatoriais adultos que atenderam aos critérios de transtorno depressivo maior do DSM-IV e que responderam a 12 semanas de tratamento agudo com a desvenlafaxina foram randomizados para a mesma dose (200 ou 400 mg/dia) que receberam durante o tratamento agudo ou para o placebo por até 26 semanas de observação para recidiva. A resposta durante a fase aberta foi definida como pontuação total na HAM-D17 < 11 na avaliação do Dia 84. A recorrência durante a fase duplo-cega foi definida da seguinte maneira:
- Pontuação total na HAM-D17 ? 16 em qualquer visita ao consultório;
- Pontuação na CGI-I ? 6 (versus Dia 84) em qualquer visita ao consultório;
- Descontinuação do estudo devido à resposta insatisfatória.
Os pacientes que receberam o tratamento contínuo com a desvenlafaxina apresentaram taxas de recidiva significativamente menores em relação às 26 semanas subsequentes em comparação aos que receberam placebo.
As análises da relação entre o resultado do tratamento e a idade e o sexo não sugeriram nenhum diferencial de responsividade com base nessas características dos pacientes. Não havia informações suficientes para determinar o efeito da raça sobre o resultado nesses estudos.
Características Farmacológicas
Estudos pré-clínicos demonstraram que a desvenlafaxina é um inibidor seletivo da recaptação da serotonina e da noradrenalina (IRSN). A eficácia clínica da desvenlafaxina está relacionada ao aumento de ação desses neurotransmissores no sistema nervoso central.
A desvenlafaxina não possui afinidade significativa por vários receptores, incluindo receptores muscarínico-colinérgicos, histaminérgicos H1 ou ?1-adrenérgicos in vitro. Foi sugerido que a atividade farmacológica nesses receptores está associada a vários efeitos anticolinérgicos, sedativos e cardiovasculares observados com outros medicamentos psicotrópicos. No mesmo ensaio abrangente de perfil de ligação, a desvenlafaxina também não apresentou afinidade significativa por vários canais iônicos, incluindo canais de íon cálcio, cloreto, potássio e sódio. Também não apresentou atividade inibitória na monoaminoxidase (MAO). A desvenlafaxina não apresentou atividade significativa no estudo do canal de potássio cardíaco (hERG) in vitro.
Em modelos pré-clínicos com roedores, a desvenlafaxina demonstrou atividade preditiva de ações antidepressivas, ansiolíticas, termorreguladoras e propriedades inibitórias da dor.
Propriedades Farmacocinéticas
A farmacocinética de dose única da desvenlafaxina é linear e proporcional à dose em um intervalo de dose de 50 a 600 mg/dia. A meia-vida terminal média (t1/2) é de aproximadamente 11 horas. Com a administração uma vez por dia, as concentrações plasmáticas no estado de equilíbrio são atingidas em, aproximadamente, 4 a 5 dias. No estado de equilíbrio, o acúmulo de doses múltiplas da desvenlafaxina é linear e previsível a partir do perfil farmacocinético de dose única.
A farmacocinética da desvenlafaxina foi completamente avaliada em mulheres e homens. Houve diferenças mínimas com base no sexo; os dados de todos os indivíduos são apresentados a seguir.
Absorção e Distribuição
O succinato de desvenlafaxina monoidratado é bem absorvido, com uma biodisponibilidade oral absoluta de 80%. O tempo médio para a concentração plasmática máxima (Tmáx) é de cerca de 7,5 horas após a administração oral. A AUC e a Cmáx de 6.747 ng.h/mL e 376 ng/mL, respectivamente, são observadas após doses múltiplas de 100 mg.
Efeitos dos Alimentos
Um estudo do efeito da presença de alimentos envolvendo a administração da desvenlafaxina a indivíduos saudáveis em jejum e na presença de alimentos (refeição com alto teor de gordura) indicou que a Cmáx aumentou cerca de 16% na presença de alimentos, enquanto as AUCs foram semelhantes. Essa diferença não é clinicamente significativa; portanto, a desvenlafaxina pode ser tomada independentemente das refeições.
A ligação a proteínas plasmáticas da desvenlafaxina é baixa (30%) e independente da concentração do medicamento. O volume de distribuição da desvenlafaxina em estado de equilíbrio após a administração intravenosa é de 3,4 L/kg, indicando a distribuição em compartimentos não vasculares.
Metabolismo e Eliminação
Aproximadamente 45% da desvenlafaxina é excretada inalterada na urina. A desvenlafaxina é metabolizada principalmente por conjugação (mediada por isoformas da UGT, incluindo UGT1A1, UGT1A3, UGT2B4, UGT2B15 e UGT2B17) e, em menor grau, através do metabolismo oxidativo.
Aproximadamente 19% da dose administrada é excretada como o metabólito glicuronídeo e < 5% como o metabólito oxidativo (N, O-didesmetilvenlafaxina) na urina. A CYP3A4 é a isoenzima do citocromo P450 predominante que age como mediador do metabolismo oxidativo (N-desmetilação) da desvenlafaxina.
Uso Geriátrico
Em um estudo conduzido com indivíduos saudáveis que receberam doses de até 300 mg, houve uma redução dependente da idade do clearance da desvenlafaxina, resultando em um aumento de 32% da Cmáx e um aumento de 55% dos valores da AUC dos indivíduos com mais de 75 anos em comparação aos indivíduos entre 18 e 45 anos. Não foram observadas diferenças em relação à segurança ou eficácia entre pacientes mais idosos (? 65 anos de idade) e pacientes mais jovens, mas não se pode desconsiderar a maior sensibilidade de alguns pacientes mais idosos. Não houve necessidade de ajuste de dose exclusivamente com base na idade; entretanto, uma possível redução da depuração renal da desvenlafaxina deve ser considerada ao determinar a dose a ser utilizada.
Uso Pediátrico
A segurança e a eficácia nos pacientes com menos de 18 anos de idade não foram estabelecidas.
Pacientes com Insuficiência Renal
A farmacocinética do succinato de desvenlafaxina monoidratado 100 mg foi estudada em indivíduos com insuficiência renal leve (n = 9), moderada (n = 8) e grave (n = 7) e doença renal em estágio terminal (DRET) com necessidade de diálise (n = 9) e em indivíduos controle saudáveis pareados por idade (n = 8). A eliminação foi significativamente correlacionada com a depuração de creatinina. A depuração corpórea total foi reduzida em 29% na insuficiência renal leve, 39% na moderada, 51% na grave e 58% na DRET em comparação a indivíduos saudáveis. Esse clearance reduzido resultou em aumentos das AUCs de 42% nos indivíduos com insuficiência renal leve (CrCl de 24 h = 50-80 mL/min), 56% em moderada (CrCl de 24 h = 30-50 mL/min), 108% em grave (CrCl de 24 h < 30 mL/min) e 116% nos indivíduos com DRET.
A meia-vida terminal média (t1/2) foi prolongada de 11,1 horas nos indivíduos saudáveis para 13,5; 15,5; 17,6 e 22,8 horas em indivíduos com insuficiência renal leve, moderada, grave e com DRET, respectivamente.
Menos de 5% do medicamento no organismo foi depurado durante um procedimento de hemodiálise padrão de 4 horas. Portanto, doses complementares não devem ser administradas a pacientes após a diálise. O ajuste de dose é recomendado em pacientes com insuficiência da função renal significativa.
Pacientes com Insuficiência Hepática
A farmacocinética do succinato de desvenlafaxina monoidratado 100 mg foi estudada em indivíduos com insuficiência hepática leve (Child-Pugh A, n = 8), moderada (Child-Pugh B, n = 8), grave (Child-Pugh C, n = 8) e em indivíduos saudáveis (n = 12).
A AUC média foi aumentada em aproximadamente 31% e 35% nos pacientes com insuficiência hepática moderada e grave, respectivamente, em comparação aos indivíduos saudáveis. Os valores médios de AUC foram equivalentes em indivíduos com insuficiência hepática leve e em indivíduos saudáveis (diferença < 5%).
O clearance sistêmico (CL/F) foi diminuído em aproximadamente 20% e 36% em pacientes com insuficiência hepática moderada e grave, respectivamente, em comparação a indivíduos saudáveis. Os valores de CL/F foram equivalentes em indivíduos com insuficiência hepática leve e em indivíduos saudáveis (diferença < 5%).
A t1/2 média mudou de aproximadamente 10 horas em indivíduos saudáveis e em indivíduos com insuficiência hepática leve para 13 e 14 horas em insuficiência hepática moderada e grave, respectivamente.
Estudo Minucioso do Intervalo QTc
Em um estudo minucioso do intervalo QTc com critérios determinados de maneira prospectiva, em mulheres saudáveis, a desvenlafaxina não causou prolongamento do intervalo QT. Além disso, nenhum efeito sobre o intervalo QRS foi observado.
Dados Pré-Clínicos de Segurança
Carcinogenicidade
O succinato de desvenlafaxina monoidratado administrado por sonda oral a camundongos e ratos por 2 anos não aumentou a incidência de tumores em qualquer estudo.
Os camundongos receberam desvenlafaxina em doses até 500/300 mg/kg/dia (dose reduzida após 45 semanas de administração). A dose de 300 mg/kg/dia é 90 vezes (em mg/kg) a dose humana máxima recomendada (DHMR) de 200 mg/dia, e 7 vezes (em mg/m2) a DHMR.
Os ratos receberam desvenlafaxina em doses até 300 mg/kg/dia (machos) ou 500 mg/kg/dia (fêmeas). A dose mais elevada foi de 90 (machos) ou 150 (fêmeas) vezes (em mg/kg) a DHMR de 200 mg/dia, e de 15 (machos) ou 24 (fêmeas) vezes (em mg/m2) o DHMR de 200 mg/dia.
Mutagenicidade
A desvenlafaxina não foi mutagênica no ensaio in vitro de mutação bacteriana (teste de Ames) e não foi clastogênica em um ensaio in vitro de aberração cromossômica em culturas de células CHO, um ensaio in vivo de micronúcleo de camundongo, ou um ensaio in vivo de aberração cromossômica em ratos. Além disso, a desvenlafaxina não foi genotóxica no ensaio in vitro de mutação de progressão de células CHO de mamíferos e foi negativa no ensaio in vitro de transformação celular de embriões de camundongos BALB/c-3T3.
Comprometimento da Fertilidade
Fertilidade reduzida foi observada em estudo pré-clínico, no qual ratos e ratas receberam succinato de desvenlafaxina monoidratado.
Este efeito foi notado em doses orais de aproximadamente 30 vezes (em mg/kg) e 5 vezes (em mg/m2) a dose humana máxima (DHMR) de 200 mg/dia.2Não houve efeito na fertilidade para doses orais de aproximadamente 9 vezes (em mg/kg) e 1,5 vezes (em mg/m ) a DHMR. A relevância deste achado em humanos é desconhecida.
Teratogenicidade
Quando a desvenlafaxina foi administrada por via oral a ratas e coelhas prenhas durante o período de organogênese, não houve evidência de teratogenicidade em ratos com quaisquer doses testadas, até 30 vezes (em mg/kg) e até 5 vezes (em mg/m2) a dose humana máxima recomendada (DHMR) de 200 mg/dia em ratos. Em coelhos, não houve evidência de teratogenicidade em doses até 23 vezes (em mg/kg) a DHMR de 200 mg/dia, ou 7 vezes (em mg/m2) a DHMR. No entanto, os pesos fetais foram reduzidos em ratos com uma dose sem efeito de 30 vezes (em mg/kg) e 5 vezes (em mg/m2) a DHMR.
Quando o succinato de desvenlafaxina monoidratado foi administrado por via oral a ratas prenhas durante a gestação e lactação, houve uma diminuição no peso das crias e aumento do número de mortes das crias durante os primeiros quatro dias de lactação. A causa dessas mortes não é conhecida. A dose sem efeito para a mortalidade das crias foi de 30 vezes (em mg/kg) e 5 vezes (em mg/m2) a DHMR de 200 mg/dia. O crescimento e desempenho reprodutivo pós-desmame da cria não foram afetados pelo tratamento materno com desvenlafaxina na dose de 90 vezes (em mg/kg) e 15 vezes (em mg/m2) a DHMR.
O tempo médio estimado para o início da ação terapêutica de Succinato de Desvenlafaxina é de até 7 dias.
Cuidados de Armazenamento
Pristiq deve ser conservado em temperatura ambiente (entre 15 e 30ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use o medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características do Produto:
Pristiq 50 mg:
Comprimido revestido rosa claro, quadrado (piramidal em um dos lados), gravado com “W” sobre “50” na face plana.
Pristiq 100 mg:
Comprimido revestido laranja avermelhado, quadrado (piramidal em um dos lados), gravado com “W” sobre “100” na face plana.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
MS – 1.2110.0273
Farmacêutica Responsável:
Edina S. M. Nakamura
CRF-SP nº 9258
Registrado por:
Wyeth Indústria Farmacêutica Ltda.
Rua Alexandre Dumas, 1.860
CEP 04717-904 – São Paulo – SP
CNPJ nº. 61.072.393/0001-33
Fabricado por:
Pfizer Ireland Pharmaceuticals
Newbridge – Irlanda
Importado e Embalado por:
Wyeth Indústria Farmacêutica Ltda.
Rodovia Castelo Branco, km 32,5
Itapevi – SP – Brasil
CNPJ nº. 61.072.393/0039-06
Indústria Brasileira
ou
Embalado por:
Pfizer Pharmaceuticals LLC
Vega Baja – Porto Rico
Importado por:
Wyeth Indústria Farmacêutica Ltda.
Rodovia Castelo Branco, km 32,5
CEP 06696-270 – Itapevi – SP
CNPJ nº 61.072.393/0039-06
Sac: 0800- 7701575
Venda sob prescrição médica. Só pode ser vendido com retenção de receita.